Способ получения 3-гидрокси-3-метилмасляной кислоты из ацетона и ацетил-соа
Иллюстрации
Показать всеИзобретение относится к области химического синтеза и микробиологии. Предложен способ получения 3-гидрокси-3-метилмаслянной кислоты из ацетона и соединения, которое обеспечивает активированную ацетильную группу. Также предложены соответствующие рекомбинантный организм, его применение, композиция, применение фермента с активностью HMG CoA синтазы и применение ацетона для получения 3-гидрокси-3-метилмаслянной кислоты. 7 н. и 6 з. п. ф-лы, 9 ил., 4 табл., 7 пр.
Реферат
Изобретение относится к способу получения 3-гидрокси-3-метилмаслянной кислота (также упоминаемая как бета-гидроксиизовалерат или ГИВ) из ацетона и соединения, которое обеспечивает активированную ацетильную группу, включающему ферментное превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, в 3-гидрокси-3-метилмаслянную кислоту. Превращение использует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть, С=0) ацетона и метильной группой соединения, которое обеспечивает активированную ацетильную группу. Предпочтительно, фермент, используемый в процессе, является ферментом с активностью HMG СоА синтазы (ЕС 2.3.3.10) и/или PksG протеин и/или фермент с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4). Представленное изобретение также относится к организмам способным продуцировать 3-гидрокси-3-метилмаслянную кислоту из ацетона и соединения, которое обеспечивает активированную ацетильную группу, и использованию вышеупомянутых ферментов и организмов для продуцирования 3-гидрокси-3-метилмаслянной кислоты. В заключение, представленное изобретение относится к использованию ацетона для получения 3-гидрокси-3-метилмаслянной кислоты.
3-Гидрокси-3-метилмаслянная кислота (также упоминаемая как бета-гидроксиизовалерат или ГИВ; смотри Фигуру 1) является метаболитом незаменимой аминокислоты лейцина и синтезируется в организме человека. Она может быть найдена в малых количествах в грейпфруте, люцерне и соме. Известно, что она также встречается при некоторых метаболических расстройствах катаболизма лейцина, то есть гиповалериановая ацидемия. Показано, что 3-гидрокси-3-метилмаслянная кислота может оказывать действие на увеличение мышечной массы и силы (Nissen et al., J. Appl. Physiol. 81 (1996), 2095-2104). Wilson et al. (Nutrition & Metabolism 5 (2008)) предлагает, как механизм действия, следующее:
- повышение сарколеммальной целостности путем превращения HMG СоА рекуктазой
- увеличение синтеза белка посредством mTOR пути
- снижение разрушения белка вследствие ингибирования убиквитинного пути. Предполагается, что 3-гидрокси-3-метилмаслянная кислота содействует сопротивлению мышц расщеплению белка, способствует восстановлению мышц и поддерживает повышение выносливости. Описано, что она помогает пациентам с хроническим обструктивным заболеванием легких в отделениях интенсивной терапии в больницах, с истощением мышц, связанным с ВИЧ и раком, и пострадавшим от травмы с тяжелыми повреждениями. Таким образом, она представляет коммерческий интерес из-за ее применения как мышечного усилителя для бодибилдинга и как лекарственного средства для избегания истощения мышц.
Патент Соединенных Штатов 7026507 описывает процесс изготовления твердых композиций натрия 3-гидрокси-3-метилбутирата, в котором на первой стадии процесса, 4,4-диметилоксетан-2-он подвергают взаимодействию с водным раствором натрия гидроксида для образования раствора натрия 3-гидрокси-3-метилбутирата, и потом, если необходимо, после концентрации раствор используют на следующей стадии процесса синтетического диоксида кремния, на которой полученный в результате продукт, если необходимо, сушат.
Желательно обеспечить процесса получения 3-гидрокси-3-метилбутирата, который не зависел бы от неорганических стадий производства и который мог бы быть осуществлен в живых организмах, в связи с этим, был бы экологически безопасным и недорогим. В этом контексте, Lee и др. (Appl. Environ. Microbiol. 63 (1997), 4191-4195) описывают способ получения 3-гидрокси-3-метилбутирата путем превращения 3-метилмаслянной кислоты в 3-гидрокси-3-метилмаслянную кислоту, используя микроорганизм Galactomyces reessii. Однако, хотя этот процесс позволил получение 3-гидрокси-3-метилбутирата, существует необходимость обеспечить альтернативные эффективные и экономически эффективные пути получения 3-гидрокси-3-метилбутирата, в особенности, посредством биологических процессов.
Представленное изобретение соответствует данному требованию для альтернативного процесса получения 3-гидрокси-3-метилбутирата и предусматривает способ, который основывается на биологических источниках и позволяет получать 3-гидрокси-3-метилбутират in vitro или in vivo в микроорганизме или других видах.
В частности, представленное изобретение относится к способу получения 3-гидрокси-3-метилмаслянной кислоты (также упоминаемой как бета-гидроксиизовалерат или ГИВ) из ацетона и соединения, которое обеспечивает активированную ацетильную группу, включающему ферментное превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, в 3-гидрокси-3-метилмаслянную кислоту.
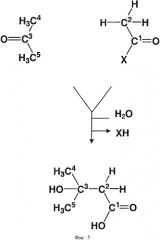
Ацетон представляют следующей формулой: СН3-(С=О)-СНз. В предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, изображают следующей формулой (I):
в которой X выбран из группы, состоящей из: S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-CH2-O-PO2H-C10H13N5O7P (кофермент A), S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-CH2-О-PO2H-полипептид (ацильный носитель протеина), S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-ОН (пантетеин), S-CH2-CH2-NH-CO-CH3 (N-ацетилцистамин), S-CH3 (метантиол), S-CH2-CH(NH2)-CО2H (цистеин), S-CH2-CH2-CH(NH2)-CО2H (гомоцистеин), S-CH2-CH(NH-C5H8N03)-CO-NH-CH2-C02H (глутатион), S-CH2-CH2-SO3H (кофермент М) и ОН (уксусная кислота).
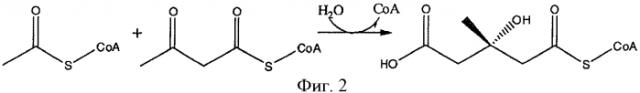
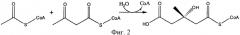
Превращение использует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, в соответствии с формулой (I). В соответствии с данной схемой реакции оксо-группа ацетона реагирует, как электрофил, а метильная группа соединения, которое обеспечивает активированную ацетильную группу в соответствии с формулой (I) реагирует, как нуклеофил. Общая реакция превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу в соответствии с формулой (I), показана на фигуре 5.
Реакция может происходить в одну стадию, то есть 3-гидрокси-3-метилбутират может быть напрямую получен реакцией, катализированной описанным выше ферментом. Альтернативно, реакция может включать две стадии, в особенности в случае, когда используют ацетил СоА как соединение, которое обеспечивает активированную ацетильную группу, в смысле, что сначала получают аддукт 3-гидрокси-3-метилбутирата и соединения, которое обеспечивает активированную ацетильную группу, например, 3-гидрокси-3-метилбутират-СоА, который впоследствии гидролизуют, например, до 3-гидрокси-3-метилбутирата и СоА. Таким образом, в первом альтернативном случае, фермент катализирует полную реакцию как показано на фигуре 5. Во втором альтернативном случае, фермент катализирует образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, но X остается в молекуле. Затем, X удаляют в последствии из молекулы гидролизом. Представленное изобретение впервые демонстрирует, что существует возможность получить 3-гидрокси-3-метилбутират, используя фермент, который может переносить активированную ацетильную группу к ацетону. В уровне техники описывается получение 3-гидрокси-3-метилбутирата из изовалериановой кислоты путем биопревращения, используя грибок Galactomyces reessii. Однако принимая во внимание, что изовалериановую кислоту получают из лейцина путем декарбоксилирования, и что лейцин сам получается при метаболизме из полной конденсации двух молекул пирувата и одной молекулы ацетила СоА, этот процесс получения является энергетически невыгодным. Процесс представленного изобретения лишен этого недостатка. В общем, в контексте представленного изобретения мог бы быть использован какой-либо фермент, который связывает соединение, обеспечивающее активированную ацетильную группу, как определено выше, как один субстрат, а также субстрат, который содержит как компонент группу ацетона. В одном предпочтительном варианте осуществления ферментом является фермент, который связывает ацетил СоА как субстрат.Примерами таких ферментов являются HMG СоА синтаза, HMG СоА лиаза или другие лиазы расщепления/конденсации С-С связи. Однако, как будет также объяснено ниже, ферменты, которые обычно используют в реакции, которую они катализируют в природе, ацетил-донор отличный от ацетила СоА, могут использовать ацетил СоА или ему аналогичный, например, PksG протеин.
В другом предпочтительном варианте осуществления ферментом является фермент, который связывает как субстрат соединение, которое обеспечивает активированную ацетильную группу, в соответствии с формулой (I), в которой X является протеином ацил-носителем, таким как ацетил-S-AcpK протеин, кодированный pksX клатсром генов для продуцирования бациллина в Bacillus subtilis. Примером такого фермента является PksG протеин. PksG протеин является одним из протеинов, кодированных pksX кластером генов из Bacillus subtilis. PksG протеин способен катализировать перенос карбоксиметильной группы -СН2-СО2Н от ацетил-S-AcpK к сложному р-кетотиоэфиру поликетидного промежуточного вещества, соединенного с одним из тиолированных доменов PksL протеина, в реакции, которая аналогична той, что катализирована HMG СоА синтазой. Однако, в контексте представленного изобретения показано, что PksG протеин также может использовать ацетил СоА вместо ацетил-S-AcpK протеина как донора активированной ацетильной группы.
В одном предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, является ацетилом СоА. Ацетил СоА (также известный как ацетил кофермента А) по химической структуре является сложным тиоэфиром кофермента А (тиол) и уксусной кислоты.
В другом предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, имеет формулу (I), в которой X является протеином ацил-носителем, таким как ацетил-S-AcpK протеин, кодированный pksX кластером генов для продуцирования бациллина в Bacillus subtilis.
Предпочтительно, фермент, использованный в процессе, является ферментом с активностью HMG СоА синтазы (ЕС 2.3.3.10) и/или PksG протеином, и/или ферментом с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4).
В одном предпочтительном варианте осуществления способ в соответствии с представленным изобретением включает ферментное превращение ацетона и ацетил СоА в 3-гидрокси-3-метилбутират с ферментом, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода С2 ацетил СоА в соответствии с формулой (I).
В предпочтительном варианте осуществления фермент, использованный в процессе в соответствии с изобретением, является ферментом, который имеет активность HMG СоА синтазы (ЕС 2.3.3.10), или ферментом, который имеет активность PksG протеина, или ферментом, который имеет активность лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4).
В частности, в контексте представленного изобретения показано, что HMG СоА синтаза может связывать ацетон вместо обычного ацетоацетил-СоА субстрата, в связи с этим, позволяет превращение ацетил-СоА (или соединения в соответствии с формулой (I)) и ацетона в 3-гидрокси-3-метилбутират.Более того, в контексте представленного изобретения показано, что PksG протеин может использовать ацетил СоА как субстрат вместо Ac-S-AcpK протеина, и может катализировать реакцию, которая обычно катализируется HMG СоА синтазой. Таким образом, предполагается, что также PksG протеин, который катализирует реакцию аналогичную реакции HMG СоА синтазы, будет способен катализировать превращение ацетона и соединения формулы (I) в 3-гидрокси-3-метилбутират.Более того, предполагается, что лиазы расщепления/конденсации С-С связи, такие как HMG СоА лиаза, могут катализировать превращение ацетил-СоА и ацетона в 3-гидрокси-3-метилбутирил-СоА, который, в свою очередь, может быть гидролизован до 3-гидрокси-3-метилбутирата и СоА.
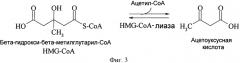
В контексте представленной заявки термин "HMG СоА синтаза" или "протеин/фермент, имеющий активность HMG СоА синтазы" относится к какому-либо ферменту, который классифицируется в ЕС нумерации ЕС 2.3.3.10 (ранее, HMG-CoA синтаза классифицировалась как ЕС 4.1.3.5, но была переведена в ЕС 2.3.3.10), в частности, он относится к какому-либо ферменту, который способен катализировать реакцию, в которой ацетил-СоА конденсируется с ацетоацетил-СоА, чтобы образовать 3-гидрокси-3-метилглутарил-СоА (HMG-СоА) (смотри фигуру 2) и термин также относится к какому-либо ферменту, который получен из такой HMG СоА синтазы и, которая способна катализировать превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил СоА, в 3-гидрокси-3-метилбутират.
Ферментная активность конденсирующей ацетил-СоА с ацетоацетил-СоА для образования 3-гидрокси-3-метилглутарил-СоА (HMG-CoA) может быть измерена способом, хорошо известным с уровня техники. Одно возможное и предпочтительно используемое исследование описано, например, в Clinkenbeard et al. (J. Biol. Chem. 250 (1975), 3108-3116). В этом исследовании активность синтазы HMG-CoA измеряют путем мониторинга понижения абсорбции при 303 нм, которое сопровождает исчезновение ацетил-СоА-зависимой енолятной формы ацетоацетил-СоА. Прпедпочтительно активность HMG СоА синтазы исследовали как описано в примнрн 3.
HMG СоА синтаза является частью мевалонатного пути. Два пути определены для синтеза изопентилпирофосфата (IПФ), то есть мевалонатный путь и глицеральдегид 3-фосфат-пируватный путь. HMG СоА синтаза катализирует биологическую конденсацию Кляйзена (Claisen) ацетил-СоА с ацетоацетил-СоА и является представимелем суперсемейства ацил-конденсирующих ферментов, которое включает бета-кетотиолазы, синтазы жирных кислот (синтаза протеина бета-кетоацильного носителя) и синтазы поликетида. HMG СоА синтаза описана для различных организмов. К тому же, доступны аминокислотные последовательности и последовательности нуклеиновых кислот, кодирующие HMG СоА синтазы, из многочисленных источников. Обычно, последовательности совместно используют только небольшую степень из полной идентичности последовательностей. Например, ферменты из Staphylococcus или Streptococcus демонстрируют только около 20% идентичности к тем, что у человека и птичьей HMG СоА синтазе. В некоторых источниках описано, что бактериальные HMG СоА синтазы и их животные аналоги демонстрируют только около 10% всеобщей идентичности последовательностей (Sutherlin et al., J. Bacteriol. 184 (2002), 4065-4070). Однако, аминокислотные остатки, участвующие в реакциях ацетилирования и конденсации, сохраняются среди бактериальных и эукариотических HMG СоА синтаз (Campobasso et al., J. Biol. Chem. 279 (2004), 44883-44888). Определяли трехмерную структуру ферментов HMG СоА синтазы, и ключевые аминокислоты для ферментной реакции, в принципе, являются хорошо описанными (Campobasso et al., loc. cit.; Chun et al., J. Biol.Chem. 275 (2000), 17946-17953; Nagegowda et al., Biochem. J. 383 (2004), 517-527; Hegardt, Biochem. J. 338 (1999), 569-582). У эукариотов существует две формы HMG СоА синтазы, то есть цитозольная и митохондральная форма. Цитозольная форма играет ключевую роль в продуцировании холестерина и других изопреноидов, и митохондральная форма вовлечена в продуцирование кетоновых тел.
В принцепе, какой-либо фермент HMG СоА синтазы может быть использован в контексте представленного изобретения, в частности из прокариотических или эукариотических организмов.
Описаны прокариотические HMG СоА синтазы, например, из Staphylococcus aureus (Campobasso et al., loc. cit.; Uniprot номер доступа Q9FD87), Staphylococcus epidermidis (Uniprot номер доступа Q9FD76), Staphylococcus haemolyticus (Uniprot номер доступа Q9FD82), Enterococcus faecalis (Sutherlin et al., loc. cit.; Unirprot номер доступа Q9FD7), Enterococcus faecium (Uniprot номер доступа Q9FD66), Streptococcus pneumonia (Uniprot номер доступа Q9FD56), Streptococcus pyogenes (Uniprot номер доступа Q9FD61) и Methanobacterium thermoautotrophicum (номер доступа AE000857), Borrelia burgdorferi (NCBI номер доступа BB0683).
Более того, в следующей таблице А перечислено некоторые известные HMG СоА синтазы от прокариотов:
| Таблица А | |
| Swissprot/TrEmbl номер доступа | Организм |
| Q9YAS0 | Aeropyrum pernix |
| A7Z4Y2 | Bacillus amyloliquefaciens |
| Р40830|2874037340 | Bacillus subtilis |
| B8G795 | Chloroflexus aggregans |
| A5EUV4 | Dichelobacter nodosus |
| A5FM54 | Flavobacterium johnsoniae |
| Q18GC4 | Haloquadratum walsbyi |
| B9LS15 | Halorubrum lacusprofundi |
| A9B8F0 | Herpetosiphon aurantiacus |
| A2BMY8 | Hyperthermus butylicus |
| Q5FLB7 | Lactobacillus Kucnomaophilus |
| Q03QR0 | Lactobacillus brevis |
| Q1GAH5 | Lactobacillus delbrueckii |
| B2GBL1 | Lactobacillus fermentum |
| B1MZ51 | Leuconostoc citreum |
| Q03WZ0 | Leuconostoc mesenteroides |
| A4YH99 | Metallosphaera sedula |
| A5UNI8 | Methanobrevibacter smithii |
| Q58941 | Methanocaldococcus jannaschii |
| Q12UR3 | Methanococcoides burtonii |
| A6USZ1 | Methanococcus aeolicus |
| Swissprot/TrEmbl номер доступа | Организм |
| A4FWW6 | Methanococcus maripaludis |
| A6UPL1 | Methanosarcina mazei |
| A2STY2 | Methanocorpusculum labreanum |
| Q8TVL0 | Methanopyrus_ andleri |
| Q8PYJ0 | Methanosarcina mazei |
| Q2NHU7 | Methanosphaera stadtmanae |
| Q2FPH4 | Methanospirillum hungatei |
| B2HGT6 | Mycobacterium marinum |
| Q3IMZ7 | Natronomonas pharaonis |
| Q8EP69 | Oceanobacillus iheyensis |
| Q04F95 | Oenococcus oeni |
| Q03FU5 | Pediococcus pentosaceus |
| Q6L233 | Picrophilus torridus |
| A6G7N7 | Plesiocystis pacifica |
| A4WJ12 | Pyrobaculum arsenaticum |
| A7NHZ7 | Roseiflexus castenholzii |
| Q8CN06 | Staphylococcus epidermidis |
| Q4L958 | Staphylococcus haemolyticus |
| Q4A0D6 | Staphylococcus saprophytics |
| B4U364 | Streptococcus equi |
| Q8DUI5 | Streptococcus mutans |
| Q4J933 | Sulfolobus Kucnomaocaldarius |
| Q971K8 | Sulfolobus tokodaii |
| Q9HI87 | Thermoplasma Kucnomaophilum |
| Q31EW2 | Thiomicrospira crunogena |
| Q51798 | Pyrococcus furiosus |
| A5VJB7 | Lactobacillus reuteri |
| Q7CF79 | Streptococcus pyogenes |
| Q9UWU0 | Sulfolobus solfataricus |
Описаны эукариотические HMG СоА синтазы, например, из грибов, таких как Schizosaccharomyces pombe (номера доступа U32187 и Р54874), Saccharomyces cerevisiae (номер доступа Р54839), растений, таких как резуховидная таля (Arabidopsis thaliana) (номера доступа Х83882 и Р54873), сосна обыкновенная (Pinus sylvestris) (номер доступа Х96386) и животных, таких как Caenorhabditis elegans (номер доступа Р54871), домовая мышь (Mus musculus) (митохондральная; номер доступа Р54869 и Hegardt, Biochem. J. 338 (1999), 569-582), серая крыса (Rattus norvegicus) (митохондральная: номер доступа Р22791 и Hegardt, Biochem. J. 338 (1999); цитозольная: номер доступа Р17425), 569-582), китайский хомячок (Chinese hamster) (Cricetulus griseus: номер доступа Р13704), домашняя свинья (Sus scrofa) (митохондральная; номер доступа U90884 и Hegardt, Biochem. J. 338 (1999), 569-582), человек разумный {Homo sapiens) (митохондральная: номер доступа Р54868 и Hegardt, Biochem. J. 338 (1999), 569-582; цитозольная: номер доступа Q01581), рыжий таракан (Blattella germanica) (цитозольная форма 1; номер доступа Р54961), рыжий таракан (Blattella germanica) (цитозольная форма 2; номер доступа Р54870) и банкивская джунглевая курица (Gallus gallus) (цитозольная; номер доступа Р23228).
Примеры HMG СоА синтаз из различных организмов даны в SEQ ID NO: 1 до 14. SEQ ID NO: 1 показывает последовательность цитоплазматической HMG СоА синтазы Caenorhabditis elegans (Р54871, банк генов F25B4.6), SEQ ID NO: 2 показывает последовательность цитоплазматической HMG СоА синтазы of Schizosaccharomyces pombe (делящиеся дрожжи; Р54874), SEQ ID NO: 3 показывает последовательность цитоплазматической HMG СоА синтазы Saccharomyces cerevisiae (пекарские дрожжи; Р54839, банк генов САА65437.1), SEQ ID NO: 4 показывает последовательность цитоплазматической HMG СоА синтазы резуховидной тали (Arabidopsis thaliana) (кресс «мышиное-ухо»; Р54873), SEQ ID NO: 5 показывает последовательность цитоплазматической HMG СоА синтаза Dictyostelium discoideum (слизевой гриб; Р54872, банк генов L2114), SEQ ID NO: 6 показывает последовательность цитоплазматической HMG СоА синтаза Blattella germanica (рыжий таракан; Р54961, банк генов Х73679), SEQ ID NO: 7 показывает последовательность цитоплазматической HMG СоА синтазы Gallus gallus (курица; Р23228, банк генов CHKHMGCOAS), SEQ ID NO: 8 показывает последовательность цитоплазматической HMG СоА синтазы Homo sapiens (человек; Q01581, банк генов Х66435), SEQ ID NO: 9 показывает последовательность митохондральной HMG СоА синтазы Homo sapiens (человек; Р54868, банк генов Х83618), SEQ ID NO: 10 показывает последовательность митохондральной HMG СоА синтазы Dictyostelium discoideum (слизевой гриб; Q86HL5, банк генов ХМ_638984), SEQ ID NO: 11 показывает последовательность HMG СоА синтазы Staphylococcus epidermidis (Q9FD76), SEQ ID NO: 12 показывает последовательность HMG СоА синтазы Lactobacillus fermentum (B2GBL1), SEQ ID NO: 13 показывает последовательность HMG СоА синтазы Hyperthermus butylicus (A2BMY8), SEQ ID NO: 14 показывает последовательность HMG СоА синтазы Chloroflexus aggregans (B8G795), SEQ ID NO: 24 показывает последовательность HMG СоА синтазы Lactobacillus delbrueckii (Q1GAH5) и SEQ ID NO: 25 показывает последовательность HMG СоА синтазы Staphylococcus haemolyticus Q4L958 (I98>V различие по сравнению с протеином дикого типа).
В предпочтительном варианте осуществления представленного изобретения HMG СоА синтаза является ферментом, содержащем аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: от 1 до 14 или последовательность, которая является, по меньшей мере, на п % идентичной к какой-либо из SEQ ID NO: от 1 до 14 и, которая имеет активность HMG СоА синтазы с n, которое является целым числом между 10 и 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99.
Предпочтительно, степень идентичности определяют сравнением соответствующей последовательности с аминокислотной прследовательностью какой-либо одной из вышеупомянутых SEQ ID NO. Когда последовательности, которые сравнивают, не имеют одинаковую длину, степень идентичности, предпочтительно, или относится к процентному содержанию аминокислотных остатков в более короткой последовательности, которая является идентичной аминокислотным остаткам в более длинной последовательности, или к процентному содержанию аминокислотных остатков в более длинной последовательности, которая является идентичной аминокислотным остаткам в более короткой последовательности. Степень идентичности последовательности может быть определена в соответствии со способами, хорошо известными с уровня техники, используя, предпочтительно, приемлемые компьютерные алгоритмы, такой как CLUSTAL. Когда, используя способ анализу Clustal для определения одной конкретной последовательности из двух является, например, на 80% идентичной контрольной последовательности, параметры, установленные по умолчанию могут быть использованы или исходные параметры являются предпочтительно следующими: матрица: blosum 30; открытый штраф за пропуск в последовательности: 10,0; штраф за продолжение делеции: 0,05; дивергентное запаздывание: 40; пространственная изоляция разрыва: 8 для сравнений аминокислотных последовательностей. Для сравнений нуклеотидных последовательностей штраф за продолжение делеции предпочтительно составляет до 5,0.
Предпочтительно, степень идентичности рассчитывают сверх полной длины последовательности.
HMG СоА синтаза, использованная в прцессе в соответствии с изобретением, может быть встечающейся в природе HMG СоА синтазой или она может быть HMG СоА синтазой, которую получают из встречающейся в природе HMG СоА синтазы, например, введением мутаций или других альтераций которые, например, изменяют или улучшают ферментную активность, стабильность, и т.д.
Термин "HMG СоА синтаза" или "протеин/фермент, имеющий активность HMG СоА синтазы" в контексте представленной заявки также охватывает ферменты, которые получают из HMG СоА синтазы, которая способна к продуцированию 3-гидрокси-3-метилбутирата путем ферментного превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил-СоА, но, который только имеет низкую аффинность к ацетоацетил-СоА, как субстрату, или делает уже не приемлемым ацетоацетил-СоА, как субстрат.Такая модификация предпочтительного субстрата HMG СоА синтазы позволяет улучшить превращение ацетона в 3-гидрокси-3-метилбутират и понизить продуцирование побочного продукта, например, HMG-CoA. Способы модифицирования и/или улучшения ожидаемых ферментных активностей протеинов хорошо известны квалифицированному специалисту с уровня техники и включает, например, неспецифический мутагенез или сайт-направленный мутагенез, и является результатом отбора ферментов, имеющих ожидаемые свойства или подходы так-называемого "направленного развития".
Например, для генной инженерии в прокариотических клетках, молекула нуклеиновой кислоты, кодирующая HMG СоА синтазу, может быть введена в плазмиды, которые разрешают мутагенез или модификацию последовательности рекомбинацией последовательностей ДНК. Стандартные способы (смотри Sambrook and Russell (2001), Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA) позволяют основные обмены, для осуществления или природных, или синтетических последовательностей, которые будут добавлены. ДНК фрагменты могут быть связаны друг с другом путем использования адаптеров и линкеров к фрагментам. Более того, могут быть использованы инженерно-технические мероприятия, которые обеспечивают приемлемые сайты рестрикции или удаление остатка ДНК или сайтов рестрикции. В тех случаях, в которых внедрения, удаления или замещения являются возможными, могут быть использованы in vitro мутагенез, "первичная репарация", рестрикция или сшивание. В основном, анализ последовательности, анализ рестрикции и другие способы биохимии и молекулярной биологии выполняются как способы анализа. Полученные в результате варианты HMG СоА синтазы далее исследуют на их ферментную активность и, в частности, на их способность предпочитать как субстрат ацетон, больше чем ацетоацетил-СоА. Исследование для измерения способности HMG СоА синтазы для использования ацетона как субстрата описано в примере 5. Образование 3-гидрокси-3-метилбутирата может быть обнаружено путем сравнения со стандартным соединением, например, после разделения тонкослойной хроматографией, ЖХ/МС и колориметрическим анализом после его дериватизации или масс-спектрометрией.
В частности, реакция происходит в реакционной смеси, содержащей 40 мМ Трис-HCI рН 8, от 5 до 50 мМ ацетил-СоА, от 100 до 500 мМ ацетона, 1 MgCI2 (за исключением митохондрия HMG-CoA синтазы), 0,5 мМ DTT и фермент, варирующий в диапазоне от 0,2 до 8 мг/мл. Контрольные реакции проводили в отсутствии фермента и одного из субстратов.
Прохождение синтеза сопровождается анализом аликвот, взятых после увеличения периода инкубации при 30 или 37°C. Как правило, аликвоту 50 мкл отбирают после 48 часов инкубации, нагревают в течение 1 минуты при 100°C, чтобы удалить протеины, центрифугируют и супернатант переносят в чистую виалу для определения ГИВ посредством масс-спектрометрии. Раствор 3-гидрокси-3-метилбутирата получают в 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 0,5 мМ DTT, нагревают, как описано выше, и используют как стандартный образец.
Образцы анализируют на РЕ SCIEX API 2000 тройном квадрупольном масс-спектрометре в режиме отрицательных ионов с раствором Н20/ацетонитрил=60/40, содержащей 0,1% триэтиламина в качестве подвижной фазы, скорость потока составляла 40 мкл/мин. 10 мкл каждого супернатанта смешивают с равным количеством подвижной фазы и напрямую впрыскивают в массспектрометр. Контролируют присутствие [3-гидрокси-3-метилбутират-Н]" иона. Синтез 3-гидрокси-3-метилбутирата также могут проводить в присутствии меченного радиоизотопом [2-14С] ацетона. Образование продукта анализируют после разделения реакционной смеси путем ТСХ или ВЭЖХ.
В предпочтительном вариант осуществления HMG СоА синтаза, использованная в представленном изобретении, является ферментом, которая имеет Км значение для ацетона 300 мМ или ниже, предпочтительно 250 мМ или ниже, даже более предпочтительно 200 мМ или ниже и особенно предпочтительно 150 мМ или ниже. Предпочтительно Км значение определяют при условиях, описанных в примере 7. В другом предпочтительном варианте осуществления HMG СоА синтаза, использованная в представленном изобретение, имеет kcat значение для описанной реакции, по меньшей мере, 0,1×10-4 сек-1, предпочтительно, по меньшей мере, 0,2×10-4 сек-1, даже более предпочтительно, по меньшей мере, 0,5×10-4 сек-1 и особенно предпочтительно, по меньшей мере, 1×10-4 сек-1, по меньшей мере, 2×10-4 сек-1, по меньшей мере, 3×10-4 сек-1 или, по меньшей мере, 5×10-4 сек-1. Предпочтительно, kcat значение определяют при условиях, описанных в примере 7.
С уровня техники известно, что His264 птичей HMG СоА синтазы играет роль во взаимодействии фермента с ацетоацетил-СоА и, что Ala264 разновидность испытывает недостаток взаимодействия с кислородом остатка сложного тиоэфира ацетоацетил-СоА (Misraa et al., Biochem. 35 (1996), 9610-9616). Таким образом, в целях разработки вариантов предположим, что HMG СоА синтаза, которая демонстрирует более низкую восприимчивость ацетоацетил-СоА как субстрата, но которая принимает ацетон как субстрат, систематически мутирует в HMG СоА синтазу гистидинового остатка, который соответствует His264 птичьей HMG СоА синтазы, описанной в Misraa et al. (цит.месте), для того чтобы уменьшить или блокировать восприятие ацетоацетил-СоА как субстрата. В дополнение, варианты HMG СоА синтазы могут предусматривать те, которые демонстрируют повышенную активность. Steussy et al. (Biochemistry 45 (2006), 14407-14414), например, описали мутанта Enterococcus faecalis HMG СоА синтазы, в котором А1а110 изменился до Gly110 и, который демонстрирует повышение 140-изгибов всей скорости реакции.
Способы определения вариантов с улучшенными ферментными свойствами, поскольку это касается получения 3-гидрокси-3-метилбутирата, также могут осуществлять в присутствии кофактора, который позволяет стерическую и/или электронную комплементацию в каталитическом сайте ферменте/ферментов вследствие того, что субстратный ацетон короче, чем природный субстратный ацетоацетил-СоА HMG СоА синтазы. Одним примером такого кофактора был бы кофермент А или структурно близкородственная молекула, такая как S-нитрозо-СоА.
Модифицированная версия HMG СоА синтазы, воспринимающая ацетон как субстрат, но, имеющая низкую аффинность к ацетоацетил-СоА как субстрату или не длинее, воспринимающей ацетоацетил-СоА как субстрат, может быть получен из встречающейся в природе HMG СоА синтазы или из уже модифицированной, оптимизированной или синтетически синтезированной HMG СоА синтазы.
Другим примером протеина, который может быть использован в способе в соответствии с изобретением, является PksG протеин. В контексте представленной заявки термин "PksG протеин" или "протеин/фермент, имеющий активность PksG протеина" относится к какому-либо ферменту, который способен катализировать реакцию, которая в природе катализируется посредством PksG протеина, то есть перенос -СН2СОО- от ацетил-S-AcpK (Ас-S-AcpK) до сложного р-кетотиоэфирного поликетидного промежуточного соединения, присоединенного к одному из тиолированных доменов PksL протеина. Это - реакция, которая является аналогичной к той, что катализирована HMG СоА синтазой с тем отличием, что ацетил-сложный тиоэфир фосфопантетеильного остатка присоединяется к протеину-носителю вместо того, чтобы к части кофермента А. Хотя PksG протеин в реакции, которую он катализирует в природе, переносит ацетильную группу от ацетил-S-АсрК к акцептору, в контексте представленного изобретения показано, что PksG протеин, кроме того, может осуществлять реакцию, которая обычно катализируется HMG СоА синтазой, то есть синтез HMG СоА, начинающийся с ацетоацетила СоА и ацетила СоА (смотри пример 3, в котором в таблице 1 показано, что фермент из Mycobacterium marinum (B2HGT6) может действовать на ацетоацетил СоА и ацетил СоА).
Ферментная активность PksG протеина может быть измерена способами, известными с уровня техники. Одно возможное и предпочтительно использованное исследование описано, например, в Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982). В этом иисследовании ацетоацетил (Acac)-S-PksL-T2 используют как модельный субстракт и инкубируют вместе с Ac-S-AcpK и PksG протеином. Образование HMG-S-PksL-T2 демонстрирует, что PksG протеин способен переносить карбоксиметильную группу -СН2-CO2H от Ac-S-AcpK к (Acac)-S-PksL-T2. Образование HMG-S-PksL-T2 может быть определено или путем электроспрей ионизации (ESI)-FTMS или путем авторадиографии. В предпочтительном варианте осуществления соответствующие исследования выполняют, как описано на странице 8982 Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982). PksG протеин является частью pksX пути в Bacillus subtilis, который кодирует ферменты, несущие ответственность за биосинтез бациллина (Butcher et al., Proc. Natl. Acad. Sci. USA 104 (2007), 1506-1509). Кодированными протеинами являются AcpK, PksC, PksL, PksF, PksG, PksH и Pksl. В соответствии с Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982) эти ферменты действуют, чтобы ввести ацетатное производное р-метильной ветки на ацетоацетил-8-носитель протеина.
В предпочтительном варианте осуществления представленного изобретения PksG протеин является ферментос, содержащим аминокислотную последовательность, как показано в SEQ ID NO: 15 или 16, или последовательность, которая является, по меньшей мере, на п % идентичной к SEQ ID NO: 15 или 16 и, имеющая активность PksG протеина с п, которое является целым числом между 10 и 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99. SEQ ID NO: 15 показывает аминокислотную последовательность PksG протеина Bacillus subtilis (Р40830) и SEQ ID NO: 16 показывает аминокислотную последовательность PksG протеина Mycobacterium marinum (B2HGT6).
Поскольку это касается определения степени идентичности последовательности, то используется такое же, как изложено выше применительно к HMG СоА синтазе.
PksG протеин, использованный в процессе в соответствии с изобретением, может быть встречающимся в природе PksG протеином или он может быть PksG протеином, который получают из встречающегося в природе PksG протеина, например, путем введения мутаций или других альтераций, которые, например, изменяют или улучшают ферментную активность, стабильность и т.д.
Термин "PksG протеин" или "протеин/фермент, имеющий активность PksG протеина" в контексте представленной заявки, кроме того, предусматривает феременты, которые получены из PksG протеина, который способен продуцировать 3-гидрокси-3-метилбутират путем ферментного превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил-СоА, но который имеет только низкую аффинность к их природному субстрату или делает больше не восприимчивым к их природному субстрату. Такая модификация предпочтительного субстрата PksG потеина позволяет улучшить превращение ацетона в 3-гидрокси-3-метилбутират и понизить выход нежелательных побочных продуктов. Способы модификации и/или улучшения желаемых ферментных активностей протеинов хорошо известны квалифицированному специалисту с уровня техники и описаны выше. Полученные в результате варианты PksG протеина далее исследовали на их ферментную активность и в особенности на их способность отдавать предпочтение ацетону как субстрату. Исследование измерения способности PksG протеина использовать ацетон как субстрат описано в примере 5 для HMG-CoA синтазы. Образование 3-гидрокси-3-метилбутирата может быть обнаружено, как описано выше. Такие способы идентификации вариантов с улучшенными ферментными свойствами с точки зрения получения 3-гидрокси-3-метилбутирата могут также быть осуществлены в присутствии кофактора, который позволяет стерическую и/или электронную комплементацию в каталитическом сайте фермента/ферментов в связи с тем фактом, что субстрат ацетона короче чем природный субстрат PksG протеина.
Модифицированная версия PksG протеина, воспринимающая ацетон как субстрат, но имеющая низкую аффинность к или не длинее, природно воспринимающего субстрата, может быть получена из встречающегося в природе PksG протеина или из уже модифицированного, оптимизированного или синтетически синтезированного PksG протеина.
В контексте представленного изобретения термин "лиаза расщепления/конденсации С-С связи" или "протеин/фермент, имеющий активность лиазы расщепления/конденсации С-С связи" относится к ферменту, который способен к расщеплению или образованию путем конденсации С-С связи и который содержит так называемый TIM (триозофосфат изомераза) цилиндровый домен. Этот TIM цилиндровый домен находят в ряде пируват связанных ферментов и ацетил-СоА зависимых ферментах (Forouhar et al. J. Biol. Chem. 281 (2006), 7533-7545). TIM цилиндровый домен имеет классификационную ли