Содержащие нуклеиновые кислоты липидные частицы и относящиеся к ним способы
Иллюстрации
Показать всеГруппа изобретений относится к биохимии. Предложена липидная частица для доставки нуклеиновой кислоты (варианты), способ введения нуклеиновой кислоты в клетку, способ изготовления липидных частиц, включающих нуклеиновую кислоту. Липидная частица содержит ядро, состоящее из нуклеиновой кислоты и катионного липида, и вторичные липиды, окружающие указанное ядро. В другом варианте липидная частица содержит ядро, состоящее из нуклеиновой кислоты, катионного липида и вторичных липидов, и вторичные липиды, окружающие указанное ядро. Способ введения нуклеиновой кислоты в клетку включает приведение клетки в контакт с вышеуказанными липидными частицами. Способ изготовления липидных частиц, содержащих нуклеиновую кислоту, включает введение первого потока, содержащего нуклеиновую кислоту, и введение второго потока, содержащего образующие липидную частицу вещества, в устройство для обеспечения протекания первого и второго потоков, протекание первого и второго потоков из первого отдела устройства во второй отдел устройства, смешивание потоков во втором отделе устройства для обеспечения третьего потока, содержащего липидные частицы. Изобретения обеспечивают усовершенствование липидных частиц, содержащих терапевтическое средство, повышение эффективности инкапсулирования нуклеиновых кислот в липидную частицу. 4 н. и 14 з.п. ф-лы, 33 ил., 1 табл., 5 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет на основании предварительной заявки на патент США No. 61/280510, поданной 4 ноября 2009 г., полное содержание которой включено в настоящий документ во всей полноте путем ссылки.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Липидные наночастицы (LNP) являются наиболее клинически усовершенствованными системами доставки лекарственного средства, при этом семь основанных на LNP лекарственных средств получили разрешение регуляторного органа. Эти одобренные лекарственные средства содержат малые молекулы, такие как противораковые лекарственные средства и демонстрируют повышенную эффективность и/или уменьшенную токсичность по сравнению со "свободным" лекарственным средством. Технология LNP носителя также была применена для доставки "генетических" лекарственных средств, таких как плазмиды для экспрессии терапевтических белков или олигонуклеотидов (OGN) малых интерферирующих РНК (миРНК) для сайленсинга генов, способствующих развитию заболевания. Разработка способов для эффективной in vivo доставки OGN миРНК и других генетических лекарственных средств является главной проблемой, препятствующей революционной возможности этих веществ в качестве терапевтических средств.
Современные достижения в LNP технологии и разработке катионных липидов, необходимых для инкапсуляции и доставки генетических лекарственных средств, подчеркивают возможности LNP систем для решения задачи in vivo доставки. Было продемонстрировано, что LNP-миРНК системы индуцируют сайленсинг терапевтически значимых целевых генов в животных моделях, включая приматов, кроме человека, после внутривенной (i.v.) инъекции, и они в настоящее время проходят различные клинические испытания.
Было разработано множество способов приготовления LNP систем, содержащих генетические лекарственные средства. Эти способы включают смешивание заранее приготовленных LNP с OGN в присутствии этанола или смешивание липида, растворенного в этаноле, с водными средами, содержащими OGN, и результатом являются LNP диаметрами 100 нм или менее и эффективность инкапсуляции OGN 65-95%. Оба этих способа основаны на наличии катионных липидов для достижения инкапсуляции OGN и поли(этиленгликолевых) (PEG) липидов для замедления агрегирования и формирования крупных струтур. Свойства произведенных LNP систем, включая размер и эффективность OGN инкапсуляции, чувствительны к ряду параметров приготовления, таких как ионная сила, концентрация липида и этанола, pH, концентрация OGN и скорости перемешивания. В целом, параметры, такие как относительные концентрации липида и OGN во время смешивания, а также скорости смешивания тяжело контролировать с использованием существующих процедур приготовления, что приводит к изменяемости характеристик произведенных LNP, как в пределах одного, так и между разными препаратами.
Микрожидкостные устройства обеспечивают возможность контролируемо и быстро смешивать жидкости в нанолитровом масштабе с точным контролем температуры, времени контакта и концентраций растворов. Контролируемое и быстрое микрожидкостное смешивание применяли ранее в синтезе неорганических наночастиц и микрочастиц, и оно может превосходить крупномасштабные системы в крупномасштабном производстве наночастиц. Микрожидкостные двухфазные капельные технологии были применены для производства монодисперсных полимерных микрочастиц для доставки лекарственного средства или для производства крупных везикул для инкапсуляции клеток, белков или других биомолекул. Было продемонстрировано применение гидродинамической фокусировки потока, распространенной микрожидкостной технологии для обеспечения быстрого смешивания реагентов для формирования монодисперсных липосом контролируемого размера. Также было доказано, что эта технология пригодна для производства полимерных наночастиц, при этом были получены более мелкие, более монодисперсные частицы с более высокой инкапсуляцией малых молекул по сравнению со способами массового производства.
Несмотря на прогресс в развитии способов LNP систем, содержащих генетические лекарственные средства, существует необходимость в устройствах и способах приготовления липидных наночастиц, содержащих терапевтические вещества, а также в усовершенствованных липидных наночастицах, содержащих терапевтические вещества. Настоящее изобретение направлено на удовлетворение необходимости и предоставляет дополнительные связанные с этим преимущества.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение предоставляет липидные частицы, содержащие нуклеиновые кислоты.
В одном варианте осуществления липидная частица содержит (a) один или более катионных липидов, (b) один или более вторичных липидов и (c) одну или более нуклеиновых кислот, где липидная частица содержит практически твердое ядро, как указано в данном документе.
В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В некоторых вариантах осуществления частица содержит от приблизительно 30 до приблизительно 95 мольных процентов катионного липида.
В одном варианте осуществления вторичным липидом является PEG-c-DMA. В одном варианте осуществления вторичным липидом является 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC). В некоторых вариантах осуществления частица содержит от приблизительно 1 до приблизительно 10 мольных процентов вторичного липида.
Нуклеиновыми кислотами могут быть ДНК, РНК, замкнутая нуклеиновая кислота, аналог нуклеиновых кислот или плазмида, допускающая экспрессирование ДНК или РНК.
В другом варианте осуществления липидная частица содержит (a) один или более катионных липидов, (b) один или более нейтральных липидов, (c) один или более PEG-липидов, (d) один или более стеролов и (e) одну или более нуклеиновых кислот, где липидная частица содержит практически твердое ядро, как указано в данном документе. В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В одном варианте осуществления PEG-липидом является PEG-c-DMA. В одном варианте осуществления нейтральным липидом является 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC). В одном варианте осуществления стерин является холестерином. В одном варианте осуществления нуклеиновой кислотой является миРНК.
В дополнительном варианте осуществления липидная частица состоит из одного или более катионных липидов и одной или более нуклеиновых кислот. В одном варианте осуществления липидная частица содержит практически твердое ядро, как указано в данном документе. В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В одном варианте осуществления нуклеиновой кислотой является миРНК.
В других аспектах изобретение предоставляет способы использования липидных частиц.
В одном варианте осуществления изобретение предоставляет способ введения нуклеиновой кислоты в субъект, содержащий введение липидной частицы по изобретению в субъект, нуждающийся в этом.
В одном варианте осуществления изобретение предоставляет способ введения нуклеиновой кислоты в клетку, содержащий приведение клетки в контакт с липидной частицей по изобретению.
В одном варианте осуществления изобретение предоставляет способ модуляции экспрессии целевого полинуклеотида или полипептида, содержащий приведение клетки в контакт с липидной частицей по изобретению, где нуклеиновая кислота способна к модуляции экспрессии целевого полинуклеотида или полипептида.
В одном варианте осуществления изобретение предоставляет способ лечения заболевания или расстройства, характеризуемого сверхэкспрессией полипептида в субъекте, содержащий введение в субъект липидной частицы изобретения, где нуклеиновая кислота способна к сайленсингу или снижению экспрессии полипептида.
В другом аспекте изобретение предоставляет способ создания липидных частиц.
В одном варианте осуществления изобретение предоставляет способ создания липидных частиц, включающих нуклеиновую кислоту, содержащий:
введение первого потока, содержащего нуклеиновую кислоту в первом растворителе, в микрожидкостное устройство; где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в устройство, и второй отдел для смешивания содержимого одного или более потоков микрожидкостным смесителем;
введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе, в устройство для обеспечения протекания первого и второго потоков в условиях ламинарного протекания, где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в микроканал, и второй отдел для смешивания содержимых одного или более потоков, где образующие липидную частицу вещества содержат катионный липид, и где первый и второй растворители не являются одинаковыми;
протекание одного или более первых потоков и одного или более вторых потоков из первого отдела устройства во второй отдел устройства и
смешивание содержимых одного или более первых потоков и одного или более вторых потоков, протекающих в условиях ламинарного протекания, во втором отделе устройства для обеспечения третьего потока, содержащего липидные наночастицы с инкапсулированной нуклеиновой кислотой.
В другом варианте осуществления изобретение предоставляет способ приготовления липидных частиц, включающих нуклеиновую кислоту, содержащий:
введение первого потока, содержащего нуклеиновую кислоту в первом растворителе в канал; где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в канал, и второй отдел для смешивания содержимых одного или более потоков;
введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе; где канал имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в канал, и второй отдел для смешивания содержимых одного или более потоков;
протекание одного или более первых потоков и одного или более вторых потоков из первого отдела канала во второй отдел канала с сохранением при этом физического разделения двух потоков, где один или более первых потоков и один или более вторых потоков не смешиваются, пока они не попадают во второй отдел канала и
смешивание содержимых одного или более первых потоков и одного или более вторых потоков, протекающих в условиях ламинарного протекания, во втором отделе микроканала, для обеспечения третьего потока, содержащего липидные наночастицы с инкапсулированной нуклеиновой кислотой.
В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых одного или более первых потоков и одного или более вторых потоков содержит варьирование концентрации или относительных скоростей смешивания одного или более первых потоков и одного или более вторых потоков.
В некоторых вариантах осуществления вышеупомянутых способов способы дополнительно содержат разбавление третьего потока водным буфером. В некоторых вариантах осуществления разбавление третьего потока содержит протекание третьего потока и водного буфера во второе смешивающее устройство.
В некоторых вариантах осуществления вышеупомянутых способов способы дополнительно содержат диализирование водного буфера, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой для снижения количества второго растворителя.
В некоторых вариантах осуществления вышеупомянутых способов первый растворитель представляет собой водный буфер. В некоторых вариантах осуществления вышеупомянутых способов второй растворитель представляет собой водный спирт.
В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых первого и второго потоков содержит беспорядочную адвекцию. В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых первого и второго потоков содержит смешивание с помощью микросмесителя.
В некоторых вариантах осуществления вышеупомянутых способов эффективность инкапсуляции нуклеиновой кислоты составляет от приблизительно 90 до приблизительно 100%.
В некоторых вариантах осуществления вышеупомянутых способов смешивание одного или более первых потоков и одного или более вторых потоков предотвращено в первом отделе посредством перегородки. В некоторых вариантах осуществления перегородка представляет собой стенку канала, проточную жидкость или концентрическую трубку.
В другом аспекте изобретения предоставлены устройства для изготовления липидных частиц. В одном варианте осуществления изобретение предоставляет устройство для производства липидной частицы с инкапсулированной нуклеиновой кислотой, содержащее:
первое впускное отверстие для приема первого раствора, содержащего нуклеиновую кислоту в первом растворителе;
микроканал первого впускного отверстия в жидкостном сообщении с первым впускным отверстием для обеспечения первого потока, содержащего нуклеиновую кислоту в первом растворителе;
второе впускное отверстие для приема второго раствора, содержащего образующие липидную частицу вещества во втором растворителе;
микроканал второго впускного отверстия в жидкостном сообщении со вторым впускным отверстием для обеспечения второго потока, содержащего образующие липидную частицу вещества во втором растворителе и
третий микроканал для приема первого и второго потоков, где третий микроканал имеет первый отдел, приспособленный для протекания первого и второго потоков, введенных в микроканал в условиях ламинарного протекания, и второй отдел, приспособленный для смешивания содержимых первого и второго потоков, для обеспечения третьего потока, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой.
В одном варианте осуществления устройство дополнительно содержит средство для разбавления третьего потока для обеспечения разбавленного потока, содержащего стабилизированные липидные частицы с инкапсулированной нуклеиновой кислотой. В некоторых вариантах осуществления средство для разбавления третьего потока содержит микросмеситель.
В одном варианте осуществления микроканал имеет гидродинамический диаметр от приблизительно 20 до приблизительно 300 мкм.
В одном варианте осуществления второй отдел микроканала содержит рельефные конструкции. В одном варианте осуществления второй отдел микроканала имеет главное направление потока, и при этом одна или более поверхностей имеет по меньшей мере одну выемку или выступ, расположенные на них, при этом выемка или выступ имеют ориентацию, которая образует угол с главным направлением. В одном варианте осуществления второй отдел содержит микросмеситель.
В некоторых вариантах осуществления устройство дополнительно содержит средство для варьирования скоростей потока первого и второго потоков.
В некоторых вариантах осуществления устройство дополнительно содержит перегородку, эффективную для физического разделения одного или более первых потоков от одного или более вторых потоков в первом отделе.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Предшествующие аспекты и многие сопутствующие преимущества этого изобретения станут в большей степени оценены по достоинству, после того как они станут более понятны на основе следующего подробного описания вместе с сопутствующими чертежами.
Фиг. 1 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения.
Фиг. 2 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое является усовершенствованием устройства изображенного на Фиг. 1.
Фиг. 3 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое представляет собой усовершенствование устройства, изображенного на Фиг. 2.
Фиг. 4 представляет собой схематическое изображение иллюстративного жидкостного устройства и способа изобретения.
Фиг. 5 представляет собой схематическое изображение иллюстративной компоновки изобретения, содержащей десять жидкостных устройств, проиллюстрированных на Фиг. 4.
Фиг. 6 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения.
Фиг. 7 представляет собой схематическое изображение иллюстративной компоновки изобретения, содержащей десять иллюстративных жидкостных устройств, проиллюстрированных на Фиг.6.
Фиг. 8 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего три впускных отверстия и одно выпускное отверстие (устройство 800 включает в себя смешивающий канал 810).
Фиг. 9 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего два впускных отверстия и одно выпускное отверстие (устройство 900 включает в себя смешивающий канал 910).
Фиг. 10 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего несколько (n) последовательных впускных отверстий и одно выпускное отверстие (устройство 1000 включает в себя смешивающие каналы 1010a, 1010b, 1010c и 1010d).
Фиг. 11 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего три впускных отверстия и одно выпускное отверстие (устройство 1100 включает в себя смешивающие каналы 1110a, 1110b и 1110c).
Фиг. 12 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего семь впускных отверстий и одно выпускное отверстие (устройство 1200 включает в себя смешивающие каналы 1210a, 1210b, 1210c и 1210d).
Фиг. 13 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего многопластинчатый смеситель (устройство 1300 включает в себя смешивающий канал 1310).
Фиг. 14 представляет собой крупный план многопластинчатого смесителя, изображенного на Фиг. 14.
Фиг. 15A представляет собой схематическое изображение иллюстративного микрожидкостного (MF) способа изготовления липидных наночастиц (LNP) по изобретению: липид-этанольный и миРНК-водный растворы подаются во впускные отверстия микрожидкостного смешивающего устройства; елочные структуры в устройстве индуцируют беспорядочную адвекцию ламинарного потока и приводят к быстрому смешиванию липидных групп с водным потоком и образованию липидных наночастиц. Смешивающий канал имеет размеры 200 мкм в ширину и 79 мкм в высоту. Елочные структуры имеют размеры 31 мкм в высоту и 50 мкм в толщину.
Фиг. 15B представляет собой схематическое изображение способа изготовления липидных наночастиц (LNP) с предварительно сформированной везикулой (PFV): (a) липид-этанольный раствор добавляется в водный раствор, pH 4,0, что приводит в результате к образованию частиц везикулярного типа; (b) экструзия через 80 нм поликарбонатую мембрану (Nuclepore) при комнатной температуре с использованием Lipex Extruder обеспечивает более равномерное распределение частиц; и (c) добавление раствора миРНК при взбалтывании и инкубировании при 35°C в течение 30 минут способствует инкапсуляции миРНК.
Фиг. 16A-16C иллюстрируют влияние скорости потока в микрожидкостном устройстве на смешивание и размер LNP частиц. Два 10 мкМ раствора флюоресцеина (флюоресцирующий при pH 8,8, нефлюоресцирующий при pH 5,15) смешивают для получения полностью флюоресцирующего раствора. Фиг. 16A сравнивает степени смешивания (%), установленные по средней интенсивности флюоресценции вдоль ширины канала в качестве функции от времени смешивания (мс), рассчитанного из средней скорости жидкости и длины перемещения (0,2, 0,8, 1,4 и 2 мл/мин). Фиг. 16B и 16C сравнивают средний диаметр частиц LNP, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид 0,06 масс./масс., с 10 мМ липид-этанольной фазой, смешанной с 25 мМ ацетатным буфером, pH4, содержащим миРНК. Фиг. 16B сравнивает средний диаметр частиц (нм) LNP в качестве функции от скорости потока (мл/мин). Фиг. 16C сравнивает средний диаметр частиц (нм) LNP в качестве функции от соотношения скоростей этанольного и водного потоков. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 17 иллюстрирует влияние липидной концентрации на размер LNP частицы посредством сравнения среднего диаметра частиц (нм) в качестве функции от концентрации липида в этаноле (мМ). Повышение концентрации липида приводит к увеличению среднего диаметра частицы. Общее липидное содержание в этанольной фазе, которое подвергалось смешиванию в микрожидкостном чипе, варьировалось от 10 мМ до 50 мМ. LNP была составлена из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид 0,06 масс./масс. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного при помощи динамического рассеяния света.
Фиг. 18A и 18B иллюстрируют влияние PEG-липида и катионного липида на системы LNP. Фиг. 18A сравнивает средний диаметр частиц (нм) в качестве функции от PEG-c-DMA содержания (мол.% в LNP) для LNP, приготовленных PFV и MF способами. Содержание PEG-липида варьировалось от 1 мол.% до 10 мол.% в LNP композиции. Изменение содержания PEG-липида компенсировалось корректировкой содержания холестерина. LNP были составлены из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1 (-x):l (+x), (где x=1-9), соотношение миРНК/общий липид составляло 0,06 масс./масс. Фиг. 18B сравнивает средний диаметр частиц (нм) как функцию DLin-KC2-DMA содержания (мол.%) для LNP, приготовленных посредством PFV и MF способов. Содержание катионного липида варьировалось от 40 мол.% до 70 мол.%. PEG-c-DMA поддержилось постоянным при 1 мол.% и поддерживалось молярное соотношение 0,25 для DSPC-холестерина. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. 10 мМ липид-этанольный фазы смешивали с 25 мМ ацетатным буфером, pH 4, включающим миРНК. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 19 иллюстрирует влияние соотношения миРНК/липид на размер частиц и инкапсуляцию посредством сравнения среднего диаметра частиц (нм) и инкапсуляции (%) в зависимости от соотношения миРНК/липид (масс./масс.) (также выраженного как нуклеотид/фосфат (N/P)). Инкапсуляцию определяли посредством отделения LNP суспензии от свободной миРНК с использованием анион-обменной спин колонки. LNP была составлена из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид составляло 0,06 масс./масс. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. 10 мМ липид-этанольной фазы смешивали с 25 мМ ацетатным буфером, pH 4, включающим миРНК. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 20A и 20B иллюстрируют морфологию PEG-липидных и катионных липидных LNP систем, приготовленных посредством микрожидкостного смесителя с использованием крио-трансмиссионной электронной микроскопии (ТЕМ). LNP были отображены с увеличением 29K с помощью Крио-ТЭМ. Фиг. 20A представляет собой изображение пустых LNP, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1. Фиг. 20B представляет собой изображение LNP, наполненных миРНК, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид составляло 0,06 масс./масс. Приготовление было выполнено с использованием микрожидкостного смесителя при 20 мМ липида в этанольной фазе. Наполненные LNP-миРНК и пустые частицы, включающие 1 мол.% PEG-c-DOMG, проявляли идентичную морфологию и весьма гомогенную по составу структуру. Длина масштабной полоски 100 нм.
Фиг. 21 иллюстрирует активность in vivo сайленсинга произведенной микрожидкостным способом LNP в модели Фактора VII мыши посредством сравнения относительного уровня протеина FVII (%) в зависимости от дозировки миРНК (мг/кг) с варьированием содержания DLin-KC2-DMA в LNP от 40 мол.% до 60 мол.%. Состав LNP, включающий 1 мол.% PEG-c-DOMG и 60 мол.% DLin-KC2-DMA, обеспечивает сайленсинг FVII, сходный с тем, о котором раннее сообщали при использовании альтернативных подходов. Генный сайленсинг постепенно повышается для LNP, включающих DLin-KC2-DMA в интервале от 40 мол.% до 60 мол.%. Системная инъекция LNP-миРНК мышам была выполнена инъекцией в хвостовую вену (n=3 на уровень дозы). Отбор крови был выполнен через 24 ч после инъекции и уровни фактора VII были определены посредством колориметрического анализа. В LNP поддерживалось соотношение DSPC/Холестерин при 0,2 масс./масс. и содержалось 1 мол.% PEG-c-DOMG. Соотношение миРНК/липид в LNP составляло 0,06 масс./масс.
Фиг. 22A-22C иллюстрируют крио-электронную микроскопию липидных наночастиц, приготовленных микрогидродинамическим способом. Пустые липидные наночастицы, приготовленные посредством микрогидродинамики (40% DLinKC2-DMA, 11,5% DSPC, 47,5% холестерина, 1% PEG-c-DMA) продемонстрировали электрон-плотную внутреннюю область, что указывает на структуру твердого ядра (Фиг. 22A). Образец, составленный из POPC, продемонстрировал менее плотную внутреннюю область, что соотносится с везикулами с водным ядром (Фиг. 22B). Системы, содержащие POPC/триолеин, который имеет гидрофобное ядро из триолеина, окруженного монослоем POPC, продемонстрировали электрон-плотную внутреннюю область, сходную с образцом (Фиг. 22C).
Фиг. 23 иллюстрирует LNP предельного размера, приготовленные с DLinKC2-DMA/PEG-липидной системой (90/10, мол.%/мол.%) с использованием микрожидкостного смешивания, посредством сравнения среднего диаметра частиц (нм) в зависимости от соотношения скорости этанол/водного потока для LNP, произведенных в присутствии миРНК (N/P=1) и в отсутствии миРНК (без миРНК). Приготовление было выполнено с использованием 10 мМ липид-этанольной фазы, смешанной с 25 мМ ацетатным буфером, pH 4. Размер частиц был определен при помощи динамического рассеяния света, и приведены средневзвешенные по размеру диаметры.
Фиг. 24A-24C иллюстрируют 31P ЯМР миРНК, инкапсулированной в 50% DLinKC2-DMA, 45% холестерин и 5% PEG-c-DMA с использованием микрожидкостного смешивания. DSPC не было включено для избежания противоречивого сигнала от фосфора, содержащегося в фосфолипиде. 31P сигнал от миРНК не может быть обнаружен для интактных LNP (Фиг. 24A) или после добавления 150 мМ ацетата аммония (Фиг. 24B). Сигнал может быть обнаружен только после добавления 1% SDS для солюбилизации частицы (Фиг. 24C).
Фиг. 25, представляющая собой электрофоретический гель, иллюстрирует результаты анализа защиты от РНКазы. миРНК была инкапсулирована с использованием или микрожидкостного способа (MF) или PFV подхода или была оставлена неинкапсулированной. Тритон Х-100 был добавлен для полной солюбилизации и лизирования липидных частиц. Гель-электрофорез был выполнен на 20% нативном полиакриламидном геле и миРНК визуализирована окрашиванием CYBR-Safe.
Фиг. 26 иллюстрирует результаты анализа слияния при липидном смешивании, представленные в виде процентного содержания липидного смешивания в зависимости от времени (секунды). Для определения величины доступного катионного липидного процентного содержания в крайнем слое LNP, были приготовлены три LNP системы: в отсутствии миРНК (без миРНК), при N/P=4 и N/P=1. Липидный анализ был выполнен при pH 5,5 для обеспечения почти полной ионизации катионного липида, и реакция была инициирована внесением LNP в кювету, содержащую крайне анионные везикулы DOPS/NBD-PE/Rh-PE (молярное соотношение 98:1:1).
Фиг. 27 представляет собой схематической отображение миРНК LNP системы с твердым ядром, образованной микрожидкостным смешиванием в соответствии со способом изобретения.
Фиг. 28A и 28B иллюстрируют средний диаметр частиц (нм) и дзета-потенциал (мВ), соответственно, в виде функции от последовательностный композиции липидной наночастицы, приготовленной с использованием микрожидкостного смесителя.
Фиг. 29 представляет собой схематическое изображение иллюстративного устройства и способа изобретения для последовательной сборки липидных наночастиц.
Фиг. 30 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 31 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 32 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 33 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет липидные частицы, включающие терапевтический реагент, способы и устройства для изготовления липидных частиц, включающих терапевтический реагент, и способы доставки терапевтического реагента с использованием липидных частиц.
Липидные частицы
В одном аспекте изобретение предоставляет липидные частицы, включающие терапевтический реагент. Липидные частицы включают в себя один или более катионных липидов, один или более вторичных липидов и одну или более нуклеиновых кислот.
Катионный липид. Липидные частицы включают катионный липид. В используемом в данном документе значении термин "катионный липид" относится к липиду, который является катионным или становится катионным (протонированным) по мере того, как рН понижается ниже рК ионизируемой группы липида, но становится постепенно более нейтральным при более высоких значениях рН. При значениях рН ниже рК липид способен ассоциироваться с отрицательно заряженной нуклеиновой кислотой (например, олигонуклеотидами). В используемом в данном документе значении термин "катионный липид" включает в себя цвиттеронные липиды, которые приобретают положительный заряд при снижении рН.
Термин "катионный липид" относится к любому набору разновидностей липидов, которые несут результирующий положительный заряд при выбранном рН, таком как физиологическое
pH. Такие липиды включают, но не ограничены ими, хлорид N,N-диолеил-N,N-диметиламмония (DODAC); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTMA); бромид N,N-дистеарил-N,N-диметиламмония (DDAB); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP); 3-(N-(N',N'-диметиламиноэтан)- карбамоил)холестерин (DC-Chol) и бромид N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтил аммония (DMRIE). Дополнительно в данном изобретении может быть использован ряд коммерчески доступных препаратов катионных липидов. Они включают, например, LIPOFECTIN® (коммерчески доступные катионные липосомы, содержащие DOTMA и 1,2-диолеил-sn-3-фосфоэтаноламин (DOPE), от GIBCO/BRL, Grand Island, NY); LIPOFECTAMIN® (коммерчески доступные катионные липосомы, содержащие трифторацетат N-(1-(2,3-диолеилокси)пропил)-N-(2-(сперминкарбоксамидо) этил)-N,N-диметиламмония (DOSPA) и (DOPE), от GIBCO/BRL) и TRANSFECTAM® (коммерчески доступные катионные липиды, содержащие диоктадециламидоглицил карбоксиспермин (DOGS) в этаноле от Promega Corp.,Madison, WI). Следующее липиды являются катионными и имеют положительный заряд при pH ниже физиологического: DODAP, DODMA, DMDMA, 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA).
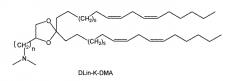
В одном варианте осуществления катионный липид представляет собой аминолипид. Подходящие аминолипиды, пригодные для изобретения включают описанные в WO 2009/096558, включенные в данный документ во всей полноте посредством ссылки. Иллюстративные аминолипиды включают в себя 1,2-дилинолейокси-3-(диметиламино) ацетоксипропан (DLin-DAC), 1,2-дилинолейокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), соль хлорида 1,2-дилинолеилокси-3-триметиламинопропана (DLin-TMA-Cl), соль хлорида 1,2-дилинолеоил-3-триметиламинопропана (DLin-TAP-Cl), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ), 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандиол (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан(DLin-EG-DMA) и 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA).
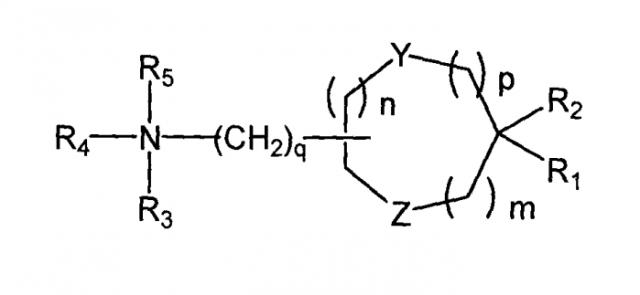
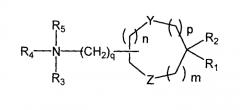
Пригодные аминолипиды включают в себя имеющие формулу:
где R1 и R2 являются или одинаковым или различным и необязательно независимо замещенным C10-C24 алкилом, необязательно замещенным C10-C24 алкенилом, необязательно замещенным C10-C24 алкинилом или необязательно замещенным C10-C24 ацилом;
R3 и R4 являются или одинаковым или различным и необязательно независимо замещенным C1-C6 алкилом, необязательно замещенным C2-C6 алкенилом или необязательно замещенным С2-С6 алкинилом, или R3 и R4 могут быть связаны с образованием необязательно замещенного гетероциклического кольца из от 4 до 6 атомов углерода и 1 или 2 гетероатомов, выбранных из азота и кислорода;
R5 или присутствует или отсутствует, когда присутствует, то является водородом или С1-С6 алкилом;
m, n и p являются или одинаковым, или различным и независимо или 0 или 1 при условии, что m, n и p не является одновременно 0;
q является 0, 1, 2, 3 или 4 и
Y и Z являются или одинаковым, или различным и независимо O, S или NH.
В одном варианте осуществления каждый из R1 и R2 являются линолеилом, и аминолипид представляет собой дилинолеил аминолипид. В одном варианте осуществления аминолипид представляет собой дилинолеил аминолипид.
Иллюстративный пригодный дилинолеил аминолипид имеет формулу:
где n представляет собой 0, 1, 2, 3 или 4.
В одном варианте осуществления катионный липид представляет собой DLin-K-DMA. В одном варианте осуществления катионный липид представляет собой DLin-KC2-DMA (вышеприведенный DLin-K-DMA, где n представляет собой 2).
Другие пригодные катионные липиды включают катионные липиды, которые несут суммарный положительный заряд при приблизительно физиологическом pH, в добавление к описанным выше, хлорид N,N-диолеил-N,N-диметиламмония (DODAC); хлорид N-(2,3-диолеилокси)пропил-N,N-N-триэтиламмония (DOTMA); бромид N,N-дистеарил-N,N-диметиламмония (DDAB); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP); соль хлорида 1,2-диолеилокси-3-триметиламинопропана (DOTAP-Cl); 3β-(N-(N',N'-диметиламиноэтан)карбамоил)холестерин (DC-Chol), трифторацетат N-(1-(2,3-диолеилокси)пропил)-N-2-(сперминкарбоксамидо)этил)-N,N-диметиламмония (DOSPA), диоктадециламидоглицил карбоксиспермин (DOGS), 1,2-диолеил-3-диметиламмоний пропан (DODAP), N,N-диметил-2,3-диолеилокси)пропиламин (DODMA) и бромид N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтил аммония (DMRIE). Дополнительно может быть использован ряд коммерчески доступных препаратов катионных липидов, таких как, например, LIPOFECTIN (содержащий DOTMA и DOPE, доступный от GIBCO/BRL) и LIPOFECTAMIN (содержащий DOSPA и DOPE, доступный от GIBCO/BRL).
Катионный липид представлен в липидной частице в количестве от приблизительно 30 до приблизительно 95 мольных процентов. В одном варианте осуществления катионный липид представлен в липидной частице в количестве от приблизительно 30 до приблизительно 70 мольных процентов. В одном варианте осуществления катионный липид представлен в липидной частице в количестве от приблизительно 40 до приблизительно 60 мольных процентов.
В одном варианте осуществления липидная частица включает в себя (состоит из) только один или более катионных липидов и одну или более нуклеиновых кислот. Приготовление и характеризация липидной частицы по изобретению, состоящей из катионного липида и нуклеиновой кислоты, описаны в примере 5.
Вторичные липиды. В некоторых вариантах осуществления липидные частицы включают один или более вторичных липидов. Пригодные вторичные липиды стабилизируют образование частиц во время их образования.
Термин "липид" относится к группе органических соединений, которые являются сложными эфирами жирных кислот и характеризуются тем, что они нерастворимы в воде, но растворимы во многих органических растворителях. Обычно выделяют три класса липидов: (1) "простые липиды", которые включают в себя жиры и масла, а также воски; (2) "сложные липиды", которые включают в себя фосфолипиды и гликолипиды; и (3) "производные липиды", таки