Способ выявления генов-мишеней для диагностики и терапии лейкозов человека
Иллюстрации
Показать всеГруппа изобретений относится к области молекулярной биологии. Сущность изобретения состоит в подавлении активности активированного онкогена AML-ETO методом РНК-интерференции в злокачественных кроветворных клетках, полученных от больных лейкозом, с использованием конструкции малой шпилечной РНК, встроенной в лентивирусный вектор pLSLP-AML-ETO-shRNA, кодируемой нуклеотидной последовательностью двухцепочечной ДНК, представляющей собой: 5′-р-gatccgCCTCGAAATCGTACTGAGActtcctgcaa
TCTCAGTACGATTTCGAGGtttttg-3′ (смысловая цепь), 5′-р-aattcaaaaaCCTCGAAATCGTACT
GAGAttgcaggaagTCTCAGTACGATTTCGAGGcg-3′ (антисмысловая цепь). Ингибирование активности конкретного онкогена посредством малой шпилечной РНК позволяет определить спектр изменения экспрессии генов, ответственных за рост и дифференцировку кроветворных клеток, и обнаружить те из них, изменение активности которых напрямую связано с активацией данного онкогена, и определить, в какой мере воздействие на такие гены - потенциальные мишени оказывает влияние на способность злокачественных клеток к неконтролируемому росту. 2 н.п. ф-лы, 7 ил., 2 табл. 2 пр.
Реферат
Изобретение относится к области молекулярной биологии и может быть использовано для выявления генов-мишеней для диагностики и терапии лейкозов человека.
Лейкозы занимают особое место среди злокачественных заболеваний человека и животных и характеризуются повышенным содержанием бластных клеток, которые, с одной стороны, не выполняют нормальные функции зрелых клеток крови, а с другой, за счет активной пролиферации, вытесняют нормальные ростки кроветворения.
Значительную часть лейкозов человека составляют острые миелоидные лейкозы (ОМЛ). Их возникновение связано с нарушением развития клеток-предшественников миелоидных, эритроидных, мегакариоцитарных и моноцитарных клеточных линий. Полагают, что лейкозы имеют клональную природу, т.е. злокачественные бластные клетки являются потомками одной единственной трансформированной клетки, возникающей в результате нескольких, а возможно, даже одной мутации. Считается, что процесс злокачественного перерождения является многостадийным - активация онкогенов в результате мутаций приводит к дальнейшей активации целого каскада генов и, как следствие, к дезорганизации строго слаженных механизмов, отвечающих за развитие кроветворных клеток и нормальное кроветворение. До сих пор не известно, в какой мере и какие именно гены активируются вследствие возникновения уже известных "ключевых" мутаций. Всё это существенно осложняет диагностику лейкозов и выбор эффективных схем лечения.
В настоящее время основными средствами терапии лейкозов являются химиотерапия, лучевая терапия и трансплантация костного мозга. Однако первые два способа сами по себе является довольно болезненными, далеко не всегда эффективными и нередко приводят к рецидивам заболевания, проявляющимся, как правило, в ещё более острой форме, а последний является крайне дорогим и сложным, что, прежде всего, связано с поиском донора костного мозга. Кроме всего трансплантация костного мозга также несёт целый ряд опасностей для здоровья пациента, к основным из которых относят случаи отторжения трансплантата. Именно поэтому поиск новых эффективных мишеней и подходов для диагностики и лечения лейкозов является крайне актуальным направлением исследований учёных всего мира.
Однако возможности поиска новых эффективных мишеней ограничены несовершенством существующих методов и их высокой стоимостью.
Проблема ещё больше обостряется тем, что до сих пор неизвестно какие ещё гены, ответственные за рост и дифференцировку кроветворных клеток, и в какой степени вовлечены в процесс злокачественного перерождения.
Для большинства видов опухолей установлены лишь некоторые из онкогенов, участвующих в канцерогенезе. Это затрудняет разработку и выбор терапевтических подходов, и в частности, терапевтических целей -генов-мишеней и их белковых продуктов.
В патенте RU 2161309 (международная публикация WO 95/25813) описан ген MTS, соматические мутации этого гена в зародышевой линии и способ выявления предрасположенности к злокачественным опухолям. Также описано применение выявленных мутаций для диагностики предрасположенности к -различным формам злокачественных заболеваний, в частности, лейкозам, и лечению заболеваний, при которых произошла мутация в гене MTS, включая генотерапию, заменяющую белковую терапию и использование белковых миметиков.
В патенте RU 2240125 в качестве гена-мишени для лечения Ph+ лейкозов описан онкоген BCR/ABL, и олигонуклеотидная генотерапия Ph+ лейкозов путем обработки суспендизооных культур Ph+ клеток антисмысловыми олигонуклеотидами, длиною 16-26 нуклеотидных звеньев, специфичными к мРНК онкогена BCR/ABL в сочетании с антисмысловыми олигонуклеотидами к мРНК других генов, блокирующих апоптоз Ph+ клеток, отличных от онкогена BCR/ABL.
В патенте RU 2286798 описан способ идентификации хромосомных транслокаций, приводящих к развитию злокачественных заболеваний крови с использованием олигонуклеотидного биологического микрочипа путем гибридизации с олигонуклеотидным микрочипом химерного амплифицированного флуоресцентно меченного продукта, состоящего из последовательностей генов, участвующих в определенной хромосомной транслокации, ассоциированной с лейкозом.
В евразийском патенте ЕА 003637 (международная публикация WO 00/05406) описаны новые способы идентификации биомолекул лигандов и мишеней путем включения случайных нуклеотидных последовательностей в
каркас, состоящий из модулятора активности фермента, трансформации существенно идентичных клеток, полученной таким образом конструкцией и скрининга трансформированных клеток для идентификации клеток, в которых был изменен предварительно выбранный фенотипический признак.
В евразийском патенте ЕА 006512 описаны способы определения генов, детерминирующих синтез диагностически важных белков, определения точечных мутаций, делеций, вставок, инверсий и транслокаций в нуклеиновых кислотах, определения уровня экспрессии генов; определения гомо- и гетерозиготного состояний мутаций основанные на применении методов гибридизации, ПЦР и ее модификаций на микрочипе.
В международной публикации WO 2004/067778 описано выявление дифференциально экспрессирумых генов при лимфогранулематозе, последовательностей этих генов и их применение в качестве маркеров для лимфогранулематоза. Генные последовательности, представленные в изобретении, дифференциально экспрессируются при лимфогранулематозе.
В международной публикации WO 2005/080601 описаны способы генетического анализа для классификации, диагностики и прогнозирования острого миелолейкоза.
В международной публикации WO 2010/111712 описан способ идентификации РНКи мишеней и применение РНКи для рациональной терапии лейкозов, резистентных к химиотерапии. Также представлена мышиная модель, используемая для определения эффективности shPHK in vivo для снижения выживаемости злокачественных клеток, резистентных к химиотерапии.
В международной публикации WO 2009/055907 описана активность не рецепторной тирозинкиназы онкобелков слитого гена Bcr/Abl, которая представляет собой ключевые факторы, ответственные за развитие и прогрессирование Ph+ хронического миелолейкоза и Ph+ острого лимфобластного лейкоза. Также описан пептидный ингибитор Bcr/Abl тирозинкиназы, который индуцирует апоптоз в различных трансформированных клетках и ингибирует Bcr/Abl киназу и, опосредованно, ряд нижележащих мишеней (CrkL, STATS, с-Мус).
В международной публикации WO 02/42482 описаны функциональные лентивирусные векторы на основе химерного гена вируса лейкоза мышей и
вируса иммунодефицита кошачьих, которые используются для генной терапии.
В международной публикации WO 2007/050706 описано применение дифференциального метилирования и гибридизации для идентификации новых маркеров метилирования и профилей метилирования для гематопоэтических злокачественных опухолей, лейкозов, лимфом и т.д., а также маркеров для диагностики, прогноза и мониторинга лечения.
Применение маркеров метилирования генома для идентификации новых генов-мишеней для диагностики и лечения острого миелолейкоза также описано в международной публикации WO 2007/016668.
Гены-мишени и продукты их экспрессии, идентифицированные на основании профиля их экспрессии до и после лечения острого лимфобластного лейкоза, описаны в международной заявке WO 03/087315, изучение профиля экспрессии генов для диагностики и подбора лечения больных лейкозом, описаны в WO 03/083140, способы генотипирования клеток при остром лейкозе ct(llq23)/MLL, и изучение профиля экспрессии генов, а также наборы и системы для их осуществления описаны в WO 2006/048266, при остром промиелоцитарном лейкозе - в WO 2006/048263.
Идентификация новой генной транслокации (3р21, 5q33) при миелолейкозе у людей описана в международной публикации WO 2007/075933, идентификация гена сdс2-зависимой киназы, ассоциированной с лейкозом у людей, описана в WO 00/12719; идентификация лейкоцит-специфичного гена Sp 140 и связанного с ним белка, и его применение в генной терапии для лечения злокачественных заболеваний, а также его применение в качестве диагностического и прогностического маркера, описано в WO 98/14569; идентификация гена MCL-1, ассоциированного с миелоидным лейкозом, а также способы диагностики и лечения с использованием нуклеотидных и полипептидных последовательностей mcl-1, описаны в WO 94/29330; ферментативная молекула РНК, которая специфически расщепляет мРНК, кодируемую геном mdr-1, описана в WO 93/23057; идентификация гена MTS и мутаций этого гена, а также применение в диагностике и прогнозировании, в частности, лейкозов, описано в WO 95/25429.
Перспективным современным подходом исследования функциональной активности генов, в том числе и активированных онкогенов, является РНК-интерференция, основанная на подавлении экспрессии генов
на посттранскрипционном уровне с помощью коротких дуплексов siPHK (small interfering RNA, малые интерферирующие РНК) длиной 21-23 нуклеотидов с выступающими 2-3 нуклеотидами на 3'-концах. Эффективным методом введения интерферирующих РНК в клетки является использование рекомбинантных ретро- и лентивирусных векторов, направляющих в трансдуцированных клетках синтез шпилечных РНК (shPHK) предшественников малых интерферирующих РНК. siPHK образуются из shPHK под действием клеточного белка Дайсера (Dicer), обладающего рибонуклеазной активностью. Шпилечные конструкции могут быть успешно применены для подавления экспрессии генов, принимающих участие в развитии вирусных инфекций, и некоторых активированных онкогенов. Представляется возможным применить этот подход для подавления экспрессии онкогенов, выявляемых при острых миелоидных лейкозах, которые с большой вероятностью могут являться ключевыми факторами развития ОМЛ.
Такие подходы и конструкции малых шпилечных РНК описаны, например, в публикациях китайских патентных заявок CN 102747083, CN 103320444 и в китайском патенте CN 20130925, и в непатентной литературе, например, у BantounasL, Phylactoul L.A., Uney J.B. 2004. RNA interference and the use of small interfering RNA to study gene function in mammalian systems J. Mol. Endocrinol. 33, 545-557, Agrawal N., Dasaradhi P.V., Mohmmed Α., Malhotra P., Bhatnagar R.K., Mukherjee S.K. 2003. RNA interference: biology, mechanism, and applications. Microbiol. Mol. Biol. Rev. 67, 657-685, в статье Вильгельма А.Э., Чумакова СП., Прасолова B.C. 2006 Интерференция РНК: биология и перспективы применения в биомедицине и биотехнологии. Мол биол. 40(3), 387-403.
Однако, несмотря на активное выявление новых генов-мишеней для диагностики и терапии лейкозов человека и создание конструкций малых шпилечных РНК для РНК-интерференции, проблема поиска новых эффективных мишеней для терапевтического воздействия и разработки новых способов диагностики и лечения лейкозов по-прежнему остается актуальной.
Предлагаемый способ основан на подавлении активности активированного онкогена AML-ETO методом РНК-интерференции в злокачественных кроветворных клетках, полученных от больных лейкозом с использованием конструкции малой шпилечной РНК, для встраивания в лентивирусный вектор, по сайтам рестрикции BamHI и EcoRI или Hpal и
Xhol, кодируемой нуклеотидной последовательностью двухцепочечной ДНК, представляющей собой:
для встраивания по сайтам рестрикции BamHI и EcoRI
shAEl SLP -смысловая
5'-р-
gatccgCCTCGAAATCGTACTGAGActtcctgcaaTCTCAGTACGATTTCGAGGttt ttg-3'
shAE 1 SLP-антисмысловая 5'-p-
aattcaaaaaCCTCGAAATCGTACTGAGAttgcaggaagTCTCAGTACGATTTCGA GGcg-3'
или для встраивания по сайтам рестрикции Hpal и Xhol
shAE 1 GO-смысловая
5'-р-
aacgCCTCGAAATCGTACTGAGActtcctgcaaTCTCAGTACGATTTCGAGGttttt с-3'
shAE 1 GO-антисмысловая 5'-р-
tcgagaaaaaCCTCGAAATCGTACTGAGAttgcaggaagTCTCAGTACGATTTCGA GGcgtt-3'
Этот способ позволяет путём ингибирования активности конкретного онкогена, определить спектр изменения экспрессии генов, ответственных за рост и дифференцировку кроветворных клеток, и обнаружить те из них, изменение активности которых напрямую связано с активацией данного онкогена. Кроме того, данный способ позволяет определить, в какой мере воздействие на такие гены-потенциальные мишени для диагностики и терапии лейкозов оказывает влияние на способность злокачественных клеток к неконтролируемому росту.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Структура препаратов экспрессирующих векторов, необходимых для конструирования препаратов лентивирусных частиц, направляющих синтез shPHK и подавление активированного онкогена AMLI-ETOB злокачественных кроветворных клетках.
Интеграцию последовательности, кодирующей shPHK, в геном клетки-хозяина, могут обеспечить лентивирусные векторы, долговременно подавляя экспрессию гена-мишени. Выбор лентивирусных векторов обусловлен также способностью рекомбинантных лентивирусов заражать широкий спектр клеток, в том числе клетки крови. Это может позволить использовать такие векторы для изучения влияния подавления экспрессии онкогенов на восстановление нормальной дифференцировки клеток крови, а также для исследования генов, экспрессия которых будет изменяться при подавлении активности активированных онкогенов AML1-ETO, которые могут быть перспективными терапевтическими и диагностическими мишенями в случае ОМЛ.
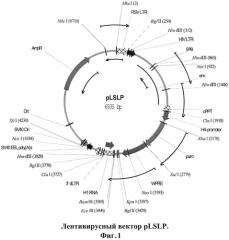
Такие векторы были созданы на базе вектора pLSLP, предназначенного для переноса и экспрессии малых шпилечных РНК в клетках млекопитающих. Вектор позволяет осуществлять встраивание последовательности, кодирующей шпилечную РНК по сайтам рестрикции BamHI и EcoRI. В данном случае экспрессия лентивирусной шпилечной конструкции находится под контролем промотора полимеразы III HI. Помимо этого в составе вектора имеется последовательность, гена устойчивости к пуромицину, наличие которого позволяет осуществлять селекцию клеток, трансдуцированных с помощью данной лентивирусной конструкции. Авторами изобретения был осуществлён дизайн последовательностей, кодирующих shPHK шпилечные структуры -предшественники siPHK:
AML1 -ЕТО-смысловая
5'-р-
gatccgCCTCGAAATCGTACTGAGActtcctgcaaTCTCAGTACGATTTCGAGGttt ttg-3'
AML 1 -ЕТО-антисмысловая
5'-р-
aattcaaaaaCCTCGAAATCGTACTGAGAttgcaggaagTCTCAGTACGATTTCGA GGcg-3'
Эти последовательности могут быть клонированы в лентивирусный вектор. Основой для таких генетических конструкций будет служить лентивирусный вектор pLSLP (Фигура 1).
Основные характеристики вектора pLSLP:
Вектор является самоинактивирующимся (SIN) за счет делеции в U3 области 3'концевого LTR.
Вектор содержит ген резистентности к пуромицину.
Вектор содержит генетические элементы сРРТ и WPRE.
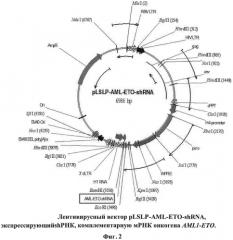
Клонирование проводили с помощью стандартных методов генной инженерии. На Фигуре 2 представлена карта рестрикции сконструированного лентивирусного вектора pLSLP-AML-ETO-shRNA, несущего шпилечную структуру, специфичную в отношении места слияния AML1-ETO. Аналогичным образом может быть сконструирован лентивирусный вектор pLSLP-SCR-shRNA, несущий последовательность, кодирующую shRNA-SCR, не имеющую гомологии с мРНК человека и мыши, используемый в качестве отрицательного контроля.
SCR - смысловая
5'-р-
gatccgCAAGTCTCGTATGTAGTGGcttcctgtcaCCACTACATACGAGACTTGtttt tg-3'
SCR- антисмысловая 5'-р-
aattcaaaaaCAAGTCTCGTATGTAGTGGtgacaggaagCCACTACATACGAGACT TGcg-3'
sh-PHK - экспрессионная кассета в U3 области 3'dLTR. (Экспрессионная кассета находится под контролем РНК-полимеразы Ill-зависимого промотора HI.). shPHK, экспрессирующая последовательность ДНК, клонируется в вектор по сайтам рестрикции BamHI и EcoRI.
ПРИМЕРЫ
ПРИМЕР 1
Анализ подавления экспрессии онкогенов, в перевиваемых кроветворных клетках, трансдуцированных лентивирусным вектором, направляющим синтез shPHK, который опосредует подавление одного из активированных онкогенов
Для анализа подавления экспрессии онкогенов, в перевиваемых кроветворных клетках, трансдуцированных лентивирусным вектором, направляющим синтез shPHK, который опосредует подавление активированных онкогенов AML1-ETO, гиперэкспрессия которого является одним из важнейших факторов, способствующих развитию лейкоза, используют метод ОТ-ПЦР (полимеразная ценная реакция, сопряжённая с обратной транскрипцией), модифицированный метод "гнёздной" ОТ-ПЦР и метод ПЦР в реальном времени (Real-timePCR).
Для этого сначала производят разморозку лабораторных образцов злокачественных перевиваемых клеток человека, полученных от больного лейкозом. Для этого ампулы с образцами клеток, извлекают из сосуда с жидким азотом и помещают в термостат 37°С на 3 минуты, после этого суспензию клеток переносят в полипропиленовые пробирки, содержащие 6 мл среды RPMI и 20% FCS, суспендируют и центрифугируют 6 мин со скоростью 800 об/мин. После этого супернатант отбирают, а осадок ресуспендируют в 2 мл среды RPMI 1640, содержащей 20% эмбриональной сыворотки, 4 мМ L-глутамина, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл, соответственно, рН 6,8-7,0, культивирование осуществляют при температуре 37°С в атмосфере 5% СО2. Культивирование клеток осуществляют в 6-ти луночных планшетах. Через три дня после размораживания к клетки в лунке ресуспендируют, после чего, добавляют 3 мл свежей среды RPMI 1640, после чего опять ресуспендируют и переносят в чашку Петри с площадью поверхности 6 см2. Ещё через 3-4 дня 5 мл суспензии клеток переносят в 10 см2чашку Петри и добавляют 7 мл свежей среды RPMI 1640. Через 4-5 дней осуществляют подсчёт количества клеток. Для расчёта количества клеток используют камеру Нойбауэра. Для этого 10 мкл клеточной суспензии вносят под покровное стекло камеры. Считают количество клеток в четырёх больших квадратах, после чего концентрацию клеток в суспензии определяют по формуле: C=N* 10000/4, где С-количество клеток в 1 мл суспензии, а N - количество клеток в четырёх квадратах.
Таким образом, осуществляют наращивание и подготовку к анализу перевиваемых клеток человека, в которых осуществляется синтез shPHK конструкций (shPHK AML1-ETO, shPHK AML5'), направляющих подавление экспрессии онкогена AML1-ETO, и один образец клеток, в которых происходит синтез неспецифической конструкции shSCR, не приводящей к подавлению какого-либо из генов.
Выделение тотальной РНК из культур клеток, в которых осуществляется синтез shPHK - предшественников siPHK, специфичных в отношении онкогена AML1-ЕТО, и в которых происходит синтез неспецифической конструкции shSCR, осуществляют с помощью тризола. Для этого около 5 млн клеток суспензионной культуры клеток суспендируют и переносят в пробирки. Пробирки с клетками центрифугируют 6 минут при 1000g. Затем удаляют супернатант и добавляют 1 мл lxPBS, суспендируют и снова центрифугируют при прежних условиях, после чего снова удаляют супернатант.
Для выделения используют следующие реактивы:
-Тризол (Invitrogen)
-Хлороформ (Applied Biosystems)
-Изопропиловый спирт
-75% этанол (в ДЭПК воде)
-3Мацетат Na (рН= 5,5) (Applied Biosystems)
-mQ вода
Выделение тотальной РНК осуществляют в следующей последовательности:
Рабочее место обрабатывают ингибиторами РНКаз. К клеткам добавляют тризол (необходимое количество рассчитывают, исходя из соотношения 1 мл тризола на 5-10 млн. клеток). Клетки инкубируют в тризоле в течение 5 минут при комнатной температуре. Лизат переносят в новые пробирки и добавляют хлороформ из расчета 0,2 мл на 1 мл тризола, плотно закрывают пробирку и встряхивают рукой 15 секунд, после чего инкубируют смесь 2-3 минуты при комнатной температуре. Далее пробы центрифугируют 15 минут при 12000g в центрифуге с охлаждением (4°С). В результате центрифугирования смесь разделяется на нижнюю хлороформ фенольную фазу красного цвета, интерфазу белого цвета и бесцветную водную фазу. РНК находится в верхней водной фазе. Водную фазу переносят в чистую пробирку. Добавляют изопропиловый спирт из расчета 0,5 мл на 1 мл тризола и инкубируют 10 минут при комнатной температуре. Затем пробы центрифугируют 10 минут при 12000g в центрифуге с охлаждением (4°С). На дне пробирки виден светлый гелеподобный осадок. Промывают осадок 1 мл 75% ледяного этанола, разбивая осадок на вортексе. После отмывки пробы центрифугируют 10 минут при 12000g в центрифуге с охлаждением (4°С). Промывку проводят дважды. После этого спирт удаляют и высушивают осадок на воздухе. Осадок растворяют в 50 мкл mQ (из расчета 1 мкг/мкл).
Количество и чистоту выделенной РНК определяют с помощью спектрофотометра NanoDrop, определяя поглощение при 230, 260, 280 нм. Количество РНК оценивают по значению А260, т.к. 1 А260=40 мкг РНК/мл. Чистоту образца оценивают по отношению А260/А280 (должно быть в пределах 1,8 - 2,0), степень загрязнения низкомолекулярными органическими соединениями - по А260/А230 (в пределах 1,5 - 2,0). Качество выделенной РНК определяют с помощью электрофореза в 1% агарозном геле. Оценивают присутствие двух полос, соответствующих 28S и 18S рибосомальных РНК, а также отсутствие неспецифических полос и ярко-выраженного "шмера".
Далее к раствору РНК добавляют натрия ацетат и этиловый спирт (1/10 и 2,5 объема раствора РНК соответственно). Смесь перемешивают на вортексе, и затем инкубируют в течение 30 минут при 20 °С. Далее смесь центрифугируют в течение 15 мин при 10°С, 12000 g. Супернатант удаляют, к осадку добавляют 1 мл охлажденного 75% этилового спирта. Полученную смесь перемешивают на вортексе, и затем центрифугируют в течение 15 мин при 10°С, 12000 g. Супернатант удаляют, осадок высушивают на воздухе в течение 10-15 минут. К сухому осадку добавляют mQ воду. Объем воды рассчитывают, исходя из исходного количества РНК (мкг) и желаемой итоговой концентрации. В дальнейшей работе используют растворы РНК с концентрацией 1 мкг/мкл.
ОТ-ПЦР - обратная транскрипция, сопряженная с полимеразной цепной реакцией.
Для синтеза кДНК использовали тотальную РНК клеток (полученную, как описано выше). Выделенную РНК переосаждают и растворяют в воде до концентрации 1 мкг/мл. Смешивают 1 мкл растворенной РНК, 1 мкл поли-Т праймеров (5 пкмоль/мкл), 4 мкл обработанной ДЭПК воды и инкубируют
смесь на водяной бане при 70°С в течение 5 минут. Далее, охлаждают смесь на льду в течение 10 минут. После однократного центрифугирования для осаждения капель конденсата в каждую пробу добавляют 4 мкл пятикратного буфера для обратной транскриптазы (Promega), 2 мкл смеси dNTP (10 мМ, Promega), 1 мкл Rnasine (Promega), 1 мкл обратной транскриптазы MLV (Promega) и 6 мкл воды, обработанной ДЭПК. Перемешивают на вортексе и инкубируют на водяной бане при 42°С в течение 1 часа. Далее пробы охлаждают, доводят водой mQ, до конечного объема 50 мкл. Пробы кДНК хранят при -20°С.
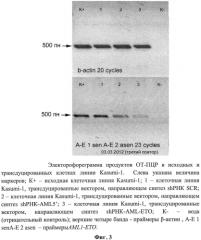
Анализ полученной кДНК методом модифицированной "гнездной" ОТ-ПЦР используют для идентификации в полученной из клеток Kasumi-1 тотальной кДНК онкогена AML-ETO, используя модифицированный метод гнездной ПЦР с двумя парами праймеров, специфичными к данному гену ("внешние" - для 1-й стадии, и "внутренние" - для 2-й стадии). Обе стадии гнездной ПЦР.
Амплификацию проводили в следующих условиях, 1 цикл: денатурация 94°С - 30 секунд, отжиг - 30 секунд, синтез - 72°С, 1 минута. Температуру отжига определяли для каждой пары праймеров.
Для определения уровня экспрессии мРНК гена AMLl-ЕТО на первой и второй стадиях соответственно оптимальное число циклов составляет 13 и 15 циклов.
Характеристики праймеров, использованных для анализа уровня: экспрессии интересующих генов, приведены в Таблице 1:
Было показано, что в клетках линии Kasumi-1, трансдуцированных лентивирусными векторами, направляющими синтез shPHK -предшественников siPHK, специфических в отношении активированного онкогена AML1-ETO осуществляется подавление экспрессии указанного онкогена, являющегося ключевым в злокачественном перерождении кроветворной ткани и ответственным за дифференцировку и в определённой степени рост клеток миелоидного ряда. На Фигуре 3 приведена электрофореграмма, иллюстрирующая значительное снижение количества мРНК AML1-ETO в клетках линии Kasumi-1, по сравнению с контрольными клетками, трансдуцированными лентивирусными векторами, направляющими синтез неспецифической в отношении какого либо из генов человека shPHK SCR.
На гистограмме (Фигура 4) представлены средние значения, полученные из трёх независимых экспериментов.
Синтез шпилечных конструкций shPHK-AMLl-ETO или shPHK-AML5' приводит к снижению уровня экспрессии AML1-ETO в 3 и 5 раз соответственно по сравнению с контролем. В качестве контроля были использованы клетки Kasumi-1, трансдуцированные лентивирусным вектором, направляющем синтез shPHK SCR, не имеющей гомологии с мРНК человека и мыши.
ПРИМЕР 2
Анализ экспрессии генов-мишеней, активность которых контролируется активированными онкогенами
Функциональный эффект, оказываемый подавлением экспрессии активированного онкогена AML1-ETO. В качестве оценочного критерия выбрана скорость роста клеток линии Kasumi-1. Было проведено сравнение скорости роста клеток, трансдуцированных лентивирусным вектором, направляющим специфические шпилечные конструкции, специфические в отношении исследуемого онкогена по сравнению с контрольным образцом клеток, трансдуцированных лентивирусным вектором, направляющем синтез неспецифической shPHK SCR.
Исходные клетки линии Kasumi-1, трансдуцированные shPHK SCR, shPHK AML5' или shPHK-AMLl-ETO, высевают в 96 луночные планшеты в концентрациях 4000, 2000, 1000, .500, 250 и 125 клеток на лунку в 100 мкл среды. Эксперимент осуществляют в трёх повторах. Клетки выращивают на
стандартной среде RPMI 1640, содержащей 20% эмбриональной сыворотки, 4 мМ L-глутамина, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл, соответственно, рН 6,8-7,0 при температуре 37°С в атмосфере 5% СО2. В течение 12 дней после посадки, каждые 2 дня, клетки в лунках ресуспендируют и отбирают по 5 мкл для подсчёта количества клеток в каждой лунке. На протяжении 12 дней контролируют количество среды в каждой лунке на уровне 100 мкл.
На Фигуре 5 приведена диаграмма, иллюстрирующая изменение количества клеток в лунках 96 луночного планшета в течение 10 дней при начальной плотности посадки 4000 клеток на лунку. Представленные результаты получены из трёх независимых экспериментов (р<0,05).
Видно, что скорость пролиферации клеток Kasumi-1, в которых экспрессия эндогенного AML1-ETO подавлена с помощью shPHK-AMLl-ЕТО, значительно ниже, по сравнению с исходными клетками Kasumi-1 или с клетками, в которых происходит синтез shPHK-SCR, не специфичной в отношении какой либо из мРНК человека или мыши.
На Фигуре 6 представлена гистограмма, иллюстрирующая изменение количества клеток в лунках на десятый день после посадки в зависимости от плотности посадки. Представленные результаты получены из трёх независимых экспериментов (р<0,05).
Видно, что при посадке по 4000 на лунку клеток Kasumi-1, в которых экспрессия AML1-ETO подавлена, их количество в 1,7 раз ниже, чем клеток, в которых уровень экспрессии онкогена не был изменён. При плотности посадки 2000 шт на лунку и 1000 шт на лунку эти соотношения составили 4,5 и 14 раз. Показано, что при плотности посадки клеток Kasumi-1 с подавленной экспрессией AML1-ETO ниже 1000 шт на лунку, их рост совсем не происходит, в то время как клетки с неизменённым уровнем экспрессии онкогена способны расти при относительно редкой плотности посадки в 500 шт. на лунку и даже 250 шт на лунку.
Приведённые результаты свидетельствуют о том, что подавление экспрессии онкогена AML1-ETO в клетках Kasumi-1 приводит к значительному снижению их скорости пролиферации, а также значительно снижает их способность давать клоны и расти при низких плотностях посадки относительно исходных клеток Kasumi-1 с неизменённым уровнем экспрессии онкогена AML1-ETO.
Для поиска генов-мишеней, находящихся под контролем активированного онкогена AML1-ETO, которые могут быть потенциальными генами-мишенями при разработке новых подходов для диагностики и терапии ОМЛ, был использован метод глубокого секвенирования на базе платформы Illumina. Для этого осуществляют выделение мРНК из клеток, трансдуцированных лентивирусными векторами, направляющими синтез shPHK, и синтез цепи кДНК, как описано выше. Анализ полученных образцов кДНК осуществляют с помощью метода глубокого секвенирования на базе платформы Illumina. Для каждого гена был выбран один наиболее представленный транскрипт. Для сортировки генов по уровню дифференциальной экспрессии использовали стандартное отклонение нормализованной экспрессии. Нормализация была осуществлена так, чтобы сумма попаданий для каждого образца была равна этой сумме в контрольном образце (кДНК из клеток, трансдуцированных лентивирусным вектором, направляющим синтез shPHK SCR). Гены были отсортированы по уровню дифференциальной экспрессии.
На Фигуре 7 (А,Б,В) приведены примеры гистограмм попарных сравнений некоторых из наиболее дифференциально экспрессируемых генов, экспрессия которых изменяется в результате подавления активированного онкогена AML1 -ЕТО.
В Таблице 2 представлен перечень всех генов, экспрессия которых меняется при подавлении активированного онкогена AML1-ETO в клетках линии Kasumi-1. В таблице представлено 5 столбцов, первый из которых содержит идентификационный номер гена, во втором столбце приведено краткое наименование гена, в третьем столбце приведено количество "ридов" для данного гена в клетках, трансдуцированных лентивирусным вектором, направляющем синтез shPHK SCR, в четвёртом столбце количество "ридов" для данного гена в клетках, трансдуцированных лентивирусным вектором, направляющем синтез shPHK AML1-ETO, в пятом столбце приведено отношение числа "ридов" из третьего столбца на число "ридов" из четвёртого столбца для данного гена. Это соотношение иллюстрирует снижение уровня экспрессии обнаруженного гена относительно контроля (клеток, трансдуцированных лентивирусным вектором, направляющем синтез shPHK SCR) при подавлении активированного онкогена AML1-ETO.
| Таблица 2 | ||||
| ID | ген | shSCR | shAE | shSCR/shAE |
| NM 144708 | ANKAR | 28 | 1 | 28,0 |
| NM 182689 | EFNA4 | 28 | 1 | 28,0 |
| NM 153631 | HOXA3 | 27 | 1 | 27,0 |
| NM 004981 | KCNJ4 | 21 | 1 | 21,0 |
| NM 000606 | C8G | 19 | 1 | 19,0 |
| NM 001171136 1 | ZBTB12 | 18 | 1 | 18,0 |
| NM 004943 | DMWD | 33 | 16,5 | |
| NR 039856 | MIR4707 | 16 | 1 | 16,0 |
| NM 003890 | FCGBP | 15 | 1 | 15,0 |
| NM 025211 | GKAP1 | 15 | 1 | 15,0 |
| NM 021135 | RPS6KA2 | 15 | 1 | 15,0 |
| NM 005775 | SP6 | 15 | 1 | 15,0 |
| NM 001166339 | SPDYE5 | 13 | 1 | 13,0 |
| NM 001023561 | ZNF774 | 13 | 1 | 13,0 |
| NM 001101426 | ISPD | 25 | 12,5 | |
| NM 001003674 | C18orf1 | 12 | 1 | 12,0 |
| NM 016210 | C3orf18 | 12 | 1 | 12,0 |
| NM 033510 | DISP2 | 24 | 12,0 | |
| NR 026771 | DKFZP434L187 | 12 | 1 | 12,0 |
| NM 001167857 | PPP1R12B | 12 | 1 | 12,0 |
| NM 130795 | RGS3 | 24 | 2 | 12,0 |
| NM 001636 | SLC26A1 | 24 | 2 | 12,0 |
| NM 017575 | SMPD3 | 12 | 1 | 12,0 |
| NM 033394 | TAP1 | 24 | 2 | 12,0 |
| NM 006297 | YAF2 | 36 | 3 | 12,0 |
| NM 001122962 | SIRPB2 | 22 | 2 | 11,0 |
| NM 198216 | SNTA1 | 43 | 4 | 10,8 |
| NM 001975 | EN02 | 10 | 1 | 10,0 |
| NR 027051 | FLJ39582 | 10 | 1 | 10,0 |
| NR 004390 | SNORD110 | 10 | 1 | 10,0 |
| NR 000021 | SNORD5 | 10 | 1 | 10,0 |
| NM 032786 | ZDHHC1 | 10 | 1 | 10,0 |
| NM 001010880 | ZNF782 | 31 | 3 | 10,3 |
| NM 001195605 | ZNRD1 | 10 | 1 | 10,0 |
| NM 005683 | GPR55 | 30 | 3 | 10,0 |
| NM 021184 4 | C6orf47 | 19 | 2 | 9,5 |
| NM 001142966 | GREB1L | 19 | 2 | 9,5 |
| NM 198850 | PHLDB3 | 19 | 2 | 9,5 |
| NR 037918 | PRH1-PRR4 | 19 | 2 | 9,5 |
| NM 001161440 | PTPRH | 19 | 2 | 9,5 |
| NM 017836 | SLC44A2 | 19 | 2 | 9,5 |
| NM 138448 | ACYP2 | 28 | 3 | 9,3 |
| NM 152240 | ZMAT5 | 46 | 5 | 9,2 |
| NM 033031 | CCNB3 | 63 | 7 | 9,0 |
| NR 024009 | CN5H6.4 | 9 | 1 | 9,0 |
| NM 000106 | CYP2D6 | 18 | 2 | 9,0 |
| NM 207305 | FOXD4 | 18 | 2 | 9,0 |
| NM 001004056 | GRK4 | 9 | 1 | 9,0 |
| NM 172193 | KLHDC1 | 9 | 1 | 9,0 |
| NM 203397 | MBLAC1 | 9 | 1 | 9,0 |
| NR 039901 | MIR4746 | 9 | 1 | 9,0 |
| NR 030368 | MIR638 | 9 | 1 | 9,0 |
| NM 024302 | MMP28 | 9 | 1 | 9,0 |
| NM 001204295 | MUC1 | 9 | 1 | 9,0 |
| NM 020904 | PLEKHA4 | 9 | 1 | 9,0 |
| NM 020780 | PTCHD2 | 18 | 2 | 9,0 |
| NM 000355 | TCTEX1D4 | 9 | 1 | 9,0 |
| NM 003969 | UBE2Q2P2 | 9 | 1 | 9,0 |
| NM 001001974 | PLEKHA1 | 34 | 4 | 8,5 |
| NR 037428 | MIR3655 | 25 | 3 | 8,3 |
| NM 001033082 | MYCL1 | 25 | 3 | 8,3 |
| NM 014686 | KIAA0355 | 42 | 5 | 8,4 |
| NM 022842 | CDCP1 | 16 | 2 | 8,0 |
| NM 032727 | INA | 33 | 4 | 8,3 |
| NR 031576 | MIR762 | 16 | 2 | 8,0 |
| NM_007162 | TFPI | 16 | 2 | 8,0 |
| NM 024807 | TRIM16L | 16 | 2 | 8,0 |
| NM 001199161 | USP6 | 33 | 4 | 8,3 |
| NM 017715 | ZNF319 | 66 | 8 | 8,3 |
| NM 145271 | ZNF701 | 16 | 2 | 8,0 |
| NM 024906 | SCD5 | 24 | 3 | 8,0 |
| NM 001197129 | SYS1-DBNDD2 | 24 | 3 | 8,0 |
| NM 000407 | GP1BB | 31 | 4 | 7,8 |
| NM 173201 | ATP2A1 | 15 | 2 | 7,5 |
| NR 027129 | C21orf67 | 15 | 2 | 7,5 |
| NM 001098808 | C9orf129 | 30 | 4 | 7,5 |
| NM 001242369 | C9orf7 | 15 | 2 | 7,5 |
| NM 015557 | CHD5 | 15 | 2 | 7,5 |
| NM 001166346 | MDFIC | 37 | 5 | 7,4 |
| NR 033851 | MGC39372 | 15 | 2 | 7,5 |
| NM 020201 | NT5M | 30 | 4 | 7,5 |
| NM 022463 | NXN | 15 | 2 | 7,5 |
| NM 006418 | OLFM4 | 15 | 2 | 7,5 |
| NM 017439 | PION | 15 | 2 | 7,5 |
| NM 002702 | POU6F1 | 60 | 8 | 7,5 |
| NM 153336 | PSTK | 22 | 3 | 7,3 |
| NM 134428 | RFX3 | 15 | 2 | 7,5 |
| NM 014496 | RPS6KA6 | 15 | 2 | 7,5 |
| NR 003010 | SCARNA12 | 15 | 2 | 7,5 |
| NR 002588 | SNORA51 | 15 | 2 | 7,5 |
| NM 016639 | TNFSF14 | 15 | 2 | 7,5 |
| NM 001173513 | TYMP | 22 | 3 | 7,3 |
| NM 001102664 | EPN2 | 81 | 11 | 7,4 |
| NM 033120 | NKD2 | 72 | 10 | 7,2 |
| NM 007122 | USP18 | 36 | 5 | 7,2 |
| NM 001141936 | C4orf48 | 28 | 4 | 7,0 |
| NM |