Конъюгированные молекулы фактора viii
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению молекулы Фактора VIII с укороченным В-доменом и ковалентно конъюгированной с гидрофильным полимером, имеющей измененное время полужизни в кровотоке, и может быть использовано в медицине для лечения гемофилии. Получают молекулу предшественника Фактора VIII с укороченным В-доменом, где В-домен соответствует аминокислотам 741-761 из SEQ ID NO 2. При этом указанная молекула ковалентно конъюгирована с ПЭГ или полисахаридом размером 10-80 кДа посредством О-связанного олигосахарида по сериновому остатку в укороченном В-домене, который соответствует аминокислоте 750 в SEQ ID NO 2. Изобретение позволяет увеличить время полужизни Фактора VIII в кровотоке. 5 н. и 3 з.п. ф-лы, 8 ил., 4 табл., 7 пр.
Реферат
Область техники
[0001] Настоящее изобретение относится к конъюгированным молекулам Фактора свертывания VIII. В частности, настоящее изобретение относится к конъюгированным молекулам Фактора свертывания VIII, имеющим измененное время полужизни в кровотоке.
Предшествующий уровень техники
[0002] Гемофилия А - это наследственная болезнь кровотечений, причиной которой является дефицит Фактора свертывания VIII (FVIII) или нарушение его активности. Клинические проявления затрагивают непервичный гемостаз - формирование кровяного сгустка протекает нормально, но сгусток нестабилен из-за того, что не происходит вторичное образование тромбина. Это заболевание лечат путем внутривенной инъекции Фактора свертывания FVIII, который либо выделяют из крови, либо получают рекомбинантным способом.
[0003] Современные рекомендации по лечению расходятся с традиционными способами лечения по возникновению жалобы и направлены на профилактику. Время полужизни в кровотоке эндогенного FVIII составляет 12-14 часов, и, таким образом, профилактическую терапию следует осуществлять несколько раз в неделю, чтобы у пациента фактически отсутствовали симптомы заболевания. Внутривенное введение для многих пациентов, особенно для детей и лиц молодого возраста, связано со значительными неудобствами и/или болью. Таким образом, в данной области техники существует необходимость в новых образцах Фактора VIII с активностью Фактора VIII, которые предпочтительно гомогенны по структуре, предпочтительно безопасны и предпочтительно имеют значительно увеличенное время полужизни в кровотоке, для того чтобы уменьшить число введений в неделю Фактора VIII. Кроме того, в данной области техники существует необходимость в сравнительно простых способах получения и производства таких молекул.
[0004] В данной области техники известно ПЭГилирование Фактора VIII, применяемое для увеличения времени его полужизни в кровотоке. Тем не менее получение безопасного продукта, обладающего гомогенной структурой, а также существенно улучшенным временем полужизни в кровотоке, является затруднительным. Имеющиеся способы получения конъюгированных молекул Фактора VIII являются часто трудоемкими и/или приводят к низкому выходу и/или получаемые продукты не гомогенны по структуре. В WO 2008011633 было предложено применение искусственным образом полученных сайтов О-сцепленного гликозилирования для получения терапевтических белков с длительным временем полужизни в кровотоке терапевтических белков, однако в этой заявке не были раскрыты конъюгированные молекулы Фактора VIII.
Сущность изобретения
[0005] В первом аспекте настоящее изобретение относится к молекуле Фактора VIII с укороченным В-доменом, имеющей измененное время полужизни в кровотоке, причем указанная молекула ковалентно конъюгирована с гидрофильным полимером за счет О-связанного олигосахарида в укороченном В-домене, где активация Фактора VIII приводит к удалению ковалентно связанной боковой группы.
[0006] В других аспектах настоящее изобретение относится, кроме того, к способам получения таких молекул, к применению таких молекул и к фармацевтическим композициям, включающим такие молекулы.
[0007] Таким образом, предлагается конъюгированная молекула Фактора VIII с измененным временем полужизни в кровотоке, где конъюгированная боковая группа (например, гидрофильный полимер) удаляется в ходе активации. Молекулы по изобретению предпочтительно имеют гомогенную структуру - по меньшей мере, с точки зрения положения гидрофильного полимера в укороченном В-домене - и предпочтительно имеют благоприятный профиль безопасности. Кроме того, здесь также представлены простые способы получения таких молекул. Предпочтительно, чтобы активированные молекулы Фактора VIII по изобретению были сходны с эндогенным активированным Фактором VIII.
Подробное описание изобретения
Определения:
[0008] Молекулы Фактора VIII: FVIII/Фактор VIII - это высокомолекулярный сложный гликопротеин, который изначально синтезируется гепатоцитами. FVIII состоит из 2351 аминокислот, включая сигнальный пептид, и содержит несколько отчетливо различимых доменов, определяемых гомологией. Имеется три А-домена, уникальный В-домен и два С-домена. Порядок доменов можно представить как NH2-A1-A2-B-A3-C1-C2-COOH. FVIII циркулирует в плазме в виде двух цепей, разделенных по границе В-А3. Цепи соединены связями, опосредованными ионами двухвалентного металла. Цепь А1-А2-В называют тяжелой цепью (НС), а А3-С1-С2 - легкой цепью (LC).
[0009] Эндогенные молекулы Фактора VIII циркулируют in vivo в виде пула молекул с В-доменами различного размера. По всей вероятности, in vivo происходит постепенное энзиматическое отщепление В-домена, что приводит к формированию пула молекул с В-доменами различного размера. Принято считать, что расщепление по положению 740, в ходе которого удаляется последний фрагмент В-домена, происходит в связи с тромбиновой активации. Однако нельзя исключить, что вариант Фактора VIII, в котором, например, был поврежден сайт расщепления в положении 740, может быть активным.
[0010] В данном тексте термин "Фактор VIII", или "FVIII", относится к человеческому плазменному гликопротеину, который является участником внутреннего пути свертывания и необходим для свертывания крови. "Нативный FVIII" является полноразмерной молекулой человеческого FVIII, показанной в SEQ ID NO 1 (аминокислоты 1-2332). В-домен включает аминокислоты 741-1648 в SEQ ID N01.
[ООН] SEQ ID N01:
ATRRYYLGAVELSWDYMQSDLGELPVDARFPPRVPKSFPFNTSWYKKTLFVEFTDHLFNIAKPRPPWMGLLGPTIQAEVYDTWITLKNMASHPVSLHAVGVSYWKASEGAEYDDQTSQREKEDDKVFPGGSHTYVWQVLKENGPMASDPLCLTYSYLSHVDLVKDLNSGLIGALLVCREGSLAKEKTQTLHKFILLFAVFDEGKSWHSETKNSLMQDRDAASARAWPKMHTVNGYVNRSLPGLIGCHRKSVYWHVIGMGTTPEVHSIFLEGHTFLVRNHRQASLEISPITFLTAQTLLMDLGQFLLFCHISSHQHDGMEAYVKVDSCPEEPQLRMKNNEEAEDYDDDLTDSEMDWRFDDDNSPSFIQIRSVAKKHPKTWVHYIAAEEEDWDYAPLVLAPDDRSYKSQYLNNGPQRIGRKYKKVRFMAYTDETFKTREAIQHESGILGPLLYGEVGDTLLIIFKNQASRPYNIYPHGITDVRPLYSRRLPKGVKHLKDFPILPGEIFKYKWTVTVEDGPTKSDPRCLTRYYSSFVNMERDLASGLIGPLLICYKESVDQRGNQIMSDKRNVILFSVFDENRSWYLTENIQRFLPNPAGVQLEDPEFQASNIMHSINGYVFDSLQLSVCLHEVAYWYILSIGAQTDFLSVFFSGYTFKHKMVYEDTLTLFPFSGETVFMSMENPGLWILGCHNSDFRNRGMTALLKVSSCDKNTGDYYEDSYEDISAYLLSKNNAIEPRSFSQNSRHPSTRQKQFNATTIPENDIEKTDPWFAHRTPMPKIQNVSSSDLLMLLRQSPTPHGLSLSDLQEAKYETFSDDPS PGAIDSNNSLSEMTHFRPQLHHSGDMVFTPESGLQLRLNEKLGTTAATELKKLDFKVSSTSNNLISTIPSDNLMGTDNTSSLGPPSMPVHYDSQLDTTLFGKKSSPLTESGGPLSLSEENNDSKLLESGLMNSQESSWGKNVSSTESGRLFKGKRAHGPALLTKDNALFKVSISLLKTNKTSNNSATNRKTHIDGPSLLIENSPSVWQNILESDTEFKKVTPLIHDRMLMDKNATALRLNHMSNKTTSSKNMEMVQQKKEGPIPPDAQNPDMSFFKMLFLPESARWIQRTHGKNSLNSGQGPSPKQLVSLGPEKSVEGQNFLSEKNKVWGKGEFTKDVGLKEMVFPSSRNLFLTNLDNLHENNTHNQEKKIQEEIEKKETLIQENWLPQIHTVTGTKNFMKNLFLLSTRQNVEGSYDGAYAPVLQDFRSLNDSTNRTKKHTAHFSKKGEEENLEGLGNQTKQIVEKYACTTRISPNTSQQNFVTQRSKRALKQFRLPLEETELEKRIIVDDTSTQWSKNMKHLTPSTLTQIDYNEKEKGAITQSPLSDCLTRSHSIPQANRSPLPIAKVSSFPSIRPIYLTRVLFQDNSSHLPAASYRKKDSGVQESSHFLQGAKKNNLSLAILTLEMTGDQREVGSLGTSATNSVTYKKVENTVLPKPDLPKTSGKVELLPKVHIYQKDLFPTETSNGSPGHLDLVEGSLLQGTEGAIKWNEANRPGKVPFLRVATESSAKTPSKLLDPLAWDNHYGTQIPKEEWKSQEKSPEKTAFKKKDTILSLNACESNHAIAAINEGQNKPEIEVTWAKQGRTERLCSQNPPVLKRHQREITRTTLQSDQEEIDYDDTISVEMKKEDFDIYDEDENQSPRSFQKKTRHYFIAAVERLWDYGMSSSPHVLRNRAQSGSVPQFKKWFQEFTDGSFTQPLYRGELNEHLGLLGPYIRAEVEDN1MVTFRNQASRPYSFYSSLISYEEDQRQGAEPRKNFVKPNETKTYFWKVQHHMAPTKDEFDCKAWAYFSDVDLEKDVHSGLIGPLLVCHTNTLNPAHGRQVTVQEFALFFTIFDETKSWYFTENMERNCRAPCNIQMEDPTFKENYRFHAINGYIMDTLPGLVMAQDQRIRWYLLSMGSNENIHSIHFSGHVFTVRKKEEYKMALYNLYPGVFETVEMLPSKAGIWRVECLIGEHLHAGMSTLFLVYSNKCQTPLGMASGHIRDFQITASGQYGQWAPKLARLHYSGSINAWSTKEPFSWIKVDLLAPMIIHGIKTQGARQKFSSLYISQFIIMYSLDGKKWQTYRGNSTGTLMVFFGNVDSSGIKHNIFNPPIIARYIRLHPTHYSIRSTLRMELMGCDLNSCSMPLGMESKAISDAQITASSYFTNMFATWSPSKARLHLQGRSNAWRPQVNNPKEWLQVDFQKTMKVTGVTTQGVKSLLTSMYVKEFLISSSQDGHQWTLFFQNGKVKVFQGNQDSFTPWNSLDPPLLTRYLRIHPQSWVHQIALRMEVLGCEAQDLY
[0012] Молекулы Фактора VIII по настоящему изобретению - это молекулы Фактора FVIII с укороченным В-доменом, где оставшиеся домены соответствуют последовательности, представленной аминокислотами 1-740 и 1649-2332 в SEQ ID NO 1. Следовательно, молекулы по изобретению являются рекомбинантными молекулами, полученными в трансформированных клетках хозяина, предпочтительно в клетках млекопитающих. Тем не менее оставшиеся домены (т.е. три А-домена и два С-домена) могут незначительно различаться, например примерно на 1%, 2%, 3%, 4% или 5% от аминокислотной последовательности, представленной в SEQ ID NO 1 (аминокислоты 1-740 и 1649-2332). В частности, возможно введение аминокислотных модификаций (замен, делеций и т.п.) в остальные домены, например, с целью изменения связывающей способности Фактора VIII по отношению к различным компонентам, таким как, например, фактор vW, LPR, различные рецепторы, другие Факторы свертывания, клеточные поверхности и т.п. Кроме того, молекулы Фактора VIII по изобретению могут включать другие посттрансляционные модификации - например, в укороченном В-домене и/или в одном или более из остальных доменов молекул. Эти другие посттрансляционные модификации могут быть в форме различных молекул, конъюгированных с молекулой Фактора VIII по изобретению, таких как, например, полимерные соединения, пептидные соединения, соединения-производные жирных кислот и т.п.
[0013] Все молекулы Фактора VIII по настоящему изобретению - независимо от того, модифицированы они вне В-домена или нет, содержат ли иную посттрансляционную модификацию или нет - обладают активностью Фактора VIII (что подразумевает способность участвовать в каскаде реакций свертывания, причем их действие в функциональном отношении сходно или идентично FVIII), индуцируют образование FXa за счет взаимодействия с FIXa на активированных тромбоцитах и способствуют образованию кровяного сгустка. Эту активность можно оценивать in vitro способами, хорошо известными в данной области техники, такими как, например, анализ свертывания, анализ эндогенного потенциала тромбина и т.п. Молекулы Фактора VIII по настоящему изобретению имеют активность FVIII, составляющую по меньшей мере около 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% и 100% или даже более 100% от активности нативного человеческого FVIII.
[0014] В-домен: В-домен Фактора VIII охватывает аминокислоты 741-1648 в SEQ ID NO 1. В-домен расщепляется по нескольким различным сайтам, что приводит к высокой гетерогенности циркулирующих в плазме молекул FVIII. Конкретная функция высоко гликозилированного В-домена не известна. Известно, что этот домен не существенен для активности FVIII в каскаде реакций свертывания. Это предположение о вероятном отсутствии функции подтверждается тем фактом, что FVIII с делецией/с укороченным В-доменом, оказывается, обладает in vivo свойствами, идентичными тем, которые наблюдаются для полноразмерного нативного FVIII. С другой стороны, имеются свидетельства тому, что В-домен может уменьшать связывание белка с клеточной мембраной, по меньшей мере, в условиях отсутствия сыворотки.
[0015] Молекула Фактора VIII с укороченным В-доменом/с делецией В-домена: Эндогенный полноразмерный FVIII синтезируется в виде одноцепочечной молекулы-предшественника. Перед секрецией молекула-предшественник расщепляется на тяжелую цепь и легкую цепь. Для получения рекомбинантного FVIII с делецией В-домена можно применить две различные стратегии. Либо синтезируют отдельно тяжелую цепь без В-домена и легкую цепь в виде двух различных полипептидных цепей (двухцепочечная стратегия), либо FVIII или FVIII с делецией В-домена синтезируют в виде единственной полипептидной цепи-предшественника (одноцепочечная стратегия), которая расщепляется на тяжелую и легкую цепи таким же образом, как и полноразмерный предшественник FVIII.
[0016] В полипептиде-предшественнике FVIII с делецией В-домена участки тяжелой и легкой цепи обычно разделены линкером. Чтобы минимизировать риск введения иммуногенных эпитопов в FVIII с делецией В-домена, последовательность линкера предпочтительно получают из В-домена FVIII. Линкер должен включать сайт узнавания для протеазы, которая расщепляет полипептид-предшественник FVIII с делецией В-домена на тяжелую и легкую цепь. В В-домене полноразмерного FVIII данный сайт узнавания составляют аминокислоты 1644-1648. Тромбиновый сайт, приводящий к удалению линкера при активации FVIII с делецией В-домена, расположен в тяжелой цепи. Таким образом, маловероятно, чтобы размер и аминокислотная последовательность линкера влияли на его удаление из остальной молекулы FVIII при активации тромбином. При производстве FVIII удобно осуществлять делецию В-домена. Тем не менее можно включать фрагменты В-домена в линкер без снижения продуктивности. Негативный эффект В-домена на продуктивность не связывают с каким-либо конкретным размером В-домена или конкретной его последовательностью.
[0017] Укороченный В-домен может содержать несколько сайтов O-гликозилирования. Тем не менее в предпочтительном воплощении молекула включает только один, как вариант два, три или четыре O-связанных олигосахарида в укороченном В-домене.
[0018] В предпочтительном воплощении укороченный В-домен включает только один сайт потенциального O-гликозилирования и гидрофильный полимер ковалентно конъюгирован по этому сайту O-гликозилирования.
[0019] O-связанные олигосахариды в молекулах по изобретению с укороченным В-доменом могут быть присоединены по сайтам O-гликозилирования, которые были искусственно получены рекомбинантным способом и/или за счет выведения на поверхность молекулы "скрытых" сайтов O-гликозилирования путем укорочения В-домена. В обоих случаях подобные молекулы можно создавать путем разработки аминокислотной последовательности Фактора VIII с укороченным В-доменом и последующего проведения in silico анализа данной аминокислотной последовательности, с помощью которого можно предсказать вероятность образования сайтов O-гликозилирования в укороченном В-домене. Молекулы со сравнительно высокой вероятностью присутствия таких сайтов гликозилирования можно синтезировать в подходящих клетках хозяина, с последующим анализом паттерна гликозилирования, а затем произвести отбор молекул с O-сцепленным гликозилированием в укороченном В-домене. Подходящие клетки хозяина для получения рекомбинантного белка Фактора VIII предпочтительно должны происходить от млекопитающих для того, чтобы можно было гарантировать гликозилирование молекулы. При осуществлении на практике настоящего изобретения эти клетки являются клетками млекопитающих, более предпочтительно - устойчивой клеточной линией, включая, без ограничения, линии клеток СНО (например, АТСС CCL 61), COS-1 (например, АТСС CRL 1650), фибробласты почки сирийского хомячка (ВНК) и НЕК293 (например, АТСС CRL 1573; Graham et al., J. Gen. Virol. 36:59-72, 1977). Предпочтительной линией клеток ВНК является клеточная линия tk-ts13 ВНК (Waechter and Baserga, Proc.Natl.Acad.Sci.USA 79:1106-1110, 1982), здесь и далее обозначенная как клетки ВНК 570. Линия клеток ВНК 570 доступна в Американской коллекции типовых культур (АТСС), 12301 Parklawn Dr., Rockville, MD 20852, с регистрационным номером в базе данных АТСС (accession number) CRL 10314. Линия клеток tk-ts13 ВНК доступна также в АТСС под регистрационным номером CRL 1632. Предпочтительной линией клеток СНО является линия клеток СНО К1, доступная в АТСС под регистрационным номером СС161, а также клеточные линии CHO-DXB11 и CHO-DG44.
[0020] Другие приемлемые клеточные линии включают, без ограничения, Rat Нер I (гепатома крысы; АТСС CRL 1600), Rat Hep II (гепатома крысы; АТСС CRL 1548), ТСМК (АТСС CCL 139), легкое человека (АТСС НВ 8065), NCTC 1469 (АТСС CCL 9.1); клетки DUKX (линия клеток СНО) (Uriaub and Chasin, Proc. Natl. Acad. Sci. USA 77:4216-4220, 1980) (клетки DUKX, обозначаемые также как клетки DXB11), а также DG44 (линия клеток СНО) (Cell, 33: 405, 1983; Somatic Cell and Molecular Genetics 12: 555, 1986). Можно применять также клетки ЗТЗ, клетки Namalwa, клетки миеломы и слияния миелом с другими клетками. В некоторых воплощениях такими клетками могут быть мутантные или рекомбинантные клетки, такие как, например, клетки, которые экспрессируют в количественном и качественной отношении иной спектр энзимов, катализирующих посттрансляционную модификацию белков (например, энзимов гликозилирования, таких как гликозилтрансферазы и/или гликозидазы, или ферментов процессинга, например пропептидов), чем тот тип клеток, от которого они произошли. Особенно предпочтительны клетки DUKX (линия клеток СНО).
[0021] На данный момент предпочтительны клетки НЕК293, COS, клетки яичника китайского хомячка (СНО), фибробласты почки сирийского хомячка (ВНК) и клетки миеломы, особенно клетки яичника китайского хомячка (СНО).
[0022] Таким образом, авторы настоящего изобретения показали, что существует возможность активировать "скрытые" сайты O-гликозилирования в В-домене Фактора VIII путем укорочения В-домена. Чтобы не привязываться к конкретной теории, это явление можно объяснить третичной структурой молекулы в укороченном В-домене, где происходят изменения. Таким образом, "скрытые" сайты O-гликозилирования становятся "доступными" для гликозилирования в укороченном В-домене. Одним из преимуществ такого подхода является обеспечение приемлемого профиля безопасности рекомбинантных молекул с точки зрения, например, аллергенности. Другим его преимуществом является то, что этот подход предоставляет более простой путь получения вариантов с укороченным В-доменом, содержащих O-связанные олигосахариды в В-домене, благодаря изначальному присутствию сайтов гликозилирования в В-домене, поскольку ранее было показано, что создавать искусственные сайты O-гликозилирования в рекомбинантных белках трудно.
[0023] Длина В-домена в молекуле FVIII дикого типа (wt) составляет около 907 аминокислот. Длина укороченного В-домена в молекулах по настоящему изобретению может варьироваться от примерно 10 аминокислот до примерно 700 остатков, например около 12-500 аминокислот, 12-400 аминокислот, 12-300 аминокислот, 12-200 аминокислот, 15-100 аминокислот, 15-75 аминокислот, 15-50 аминокислот, 15-45 аминокислот, 20-45 аминокислот, 20-40 аминокислот или 20-30 аминокислот. Укороченный В-домен может включать фрагменты тяжелой цепи и/или короткой цепи и/или искусственно введенной последовательности, которая не присутствует в молекуле wt FVIII. Термины "с укороченным В-доменом" или "с делецией В-домена" в данном описании можно употреблять равнозначно.
[0024] Измененное время полужизни в кровотоке: Молекулы по настоящему изобретению имеют измененное время полужизни в кровотоке0 по сравнению с молекулой Фактора VIII дикого типа, предпочтительно увеличенное время полужизни в кровотоке. Время полужизни в кровотоке предпочтительно увеличено по меньшей мере на 10%, предпочтительно по меньшей мере на 15%, предпочтительно по меньшей мере на 20%, предпочтительно по меньшей мере на 25%, предпочтительно по меньшей мере на 30%, предпочтительно по меньшей мере на 35%, предпочтительно по меньшей мере на 40%, предпочтительно по меньшей мере на 45%, предпочтительно по меньшей мере на 50%, предпочтительно по меньшей мере на 55%, предпочтительно по меньшей мере на 60%, предпочтительно по меньшей мере на 65%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, предпочтительно по меньшей мере на 100%, более предпочтительно по меньшей мере на 125%; более предпочтительно по меньшей мере на 150%, более предпочтительно по меньшей мере на 175%, более предпочтительно по меньшей мере на 200% и более предпочтительно по меньшей мере на 250% или 300%. И еще более предпочтительно, чтобы такие молекулы имели время полужизни в кровотоке, которое увеличено по меньшей мере на 400%, 500%, 600% или даже на 700% по отношению ко времени полужизни в кровотоке FVIII дикого типа.
[0025] Гидрофильный полимер: Модифицирующая группа/гидрофильный полимер по настоящему изобретению предпочтительно не должны быть природными. В одном примере "не встречающейся в природе модифицирующей группой" является полимерная модифицирующая группа, в которой по меньшей мере один полимерный фрагмент не является природным. В другом примере не встречающейся в природе модифицирующей группой является модифицированный углевод. Местоположение функционализации посредством модифицирующей группы выбирают таким образом, чтобы не происходило предотвращение энзиматического присоединения "модифицированного сахара" к полипептиду. Понятие "модифицированный сахар" относится также к любому остатку-миметику гликозила, который может быть функционализирован с помощью модифицирующей группы и который является субстратом для природного или модифицированного энзима, например для гликозилтрансферазы.
[0026] Полимерная модифицирующая группа, присоединяемая к полипептиду, может изменять свойства такого полипептида, например его биодоступность, биологическую активность или время полужизни в организме. Типичные полимеры по изобретению включают водорастворимые полимеры, которые могут быть линейными или разветвленными, могут содержать одну или более независимо выбранных полимерных частиц, таких как полиалкиленгликоль и его производные. Полимерная модифицирующая группа по изобретению может включать водорастворимый полимер, например полиэтиленгликоль - ПЭГ (PEG) - и его производные (m-PEG), полипропиленгликоль и его производные (PPG, m-PPG) и т.п.
[0027] Термин "водорастворимый" относится к молекулам, которые в некоторой степени растворимы в воде и их растворимость можно детектировать. Способы детектирования и/или оценки растворимости в воде хорошо известны в данной области техники. Приведенные в примерах водорастворимые полимеры по изобретению включают пептиды, сахариды, полиэфиры, полиамины, поликарбоновые кислоты и т.п. Пептиды могут иметь смешанные последовательности, а могут быть составлены из единственной аминокислоты - например полилизина. Примером полисахарида является полисиаловая кислота. В качестве примера полиэфира представлен полиэтиленгликоль, например m-PEG. Полиэтиленимин является примером полиамина, а полиакриловая кислота - примером поликарбоновой кислоты.
[0028] Полимерным скелетом водорастворимого полимера по изобретению может быть полиэтиленгликоль (т.е. ПЭГ). Термин "ПЭГ в связи с настоящим изобретением включает полиэтиленгликоль в любой из его форм, включая алкокси-ПЭГ, бифункциональный ПЭГ, многофункциональный (multiarmed) ПЭГ, вилообразный (forked) ПЭГ, разветвленный ПЭГ, ПЭГ с боковыми заместителями (pendent) (т.е. ПЭГ или родственные ему полимеры, содержащие одну или более функциональных групп, присоединенных к полимерному скелету), или же ПЭГ, содержащий внутри себя деградируемые связи.
[0029] Полимерный скелет может быть линейным или разветвленным. Разветвленные полимерные скелеты в общем виде известны в данной области техники. Как правило, разветвленный полимер содержит центральную сердцевинную структуру (central branch core moiety) и множество линейных полимерных цепей, присоединенных к центральной сердцевинной структуре. ПЭГ обычно применяется в его разветвленных формах, которые можно получить путем добавления оксида этилена к различным полиолам, таким как глицерин, пентаэритрит и сорбит. Центральную структуру можно также получить из некоторых аминокислот, таких как лизин или цистеин. В одном примере разветвленный полиэтиленгликоль можно представить общей формулой вида R(-ПЭГ-ОН)m, где R представляет собой ядро полимера, например глицерин или пентаэритрит, a m - число ветвей. Многофункциональные (multiarmed) молекулы ПЭГ, например, те, что описаны в патенте США №5932462, включенном в настоящее описание полностью посредством ссылки, также можно применять в качестве полимерного скелета.
[0030] На Фиг.8 показан пример разветвленного полимера ПЭГ, применяемый в воплощениях данного изобретения, обозначенный здесь как "SA-глицерин-ПЭГ." На Фиг.8А показан пример компонента SA-глицерин-ПЭГ полимеров CMP-SA-глицерин-ПЭГ или SA-глицерин-ПЭГ, присоединенного к гликану или к аминокислоте полипептида. На Фиг.8 В показан фрагмент SA-глицерин-ПЭГ, присоединенный гликану или полипептиду через остаток галактозы (Gal). На Фиг.8С показан фрагмент SA-глицерин-ПЭГ, присоединенный к гликану или полипептиду через остаток Gal-GalNAc. На Фиг.8D показан фрагмент SA-глицерин-ПЭГ, присоединенный к аминокислоте полипептида через группу Gal-GalNAc. В различных воплощениях АА - это треонин или серин. В одном примере воплощения АА превращается в сайт O-сцепленного гликозилирования путем делеции В-домена полипептида FVIII. Обсуждение в нижеследующем абзаце [0032], касающееся молекулярного веса этого полимера, в общем случае применимо к разветвленному ПЭГ, показанному на Фиг.8. На Фиг.8 индекс "n" может быть любым целым числом, которое соответствует линейному (или же разветвленному) полимеру m-PEG желаемого молекулярного веса, что обсуждено в абзаце [0032]. В различных воплощениях "n" выбирают таким образом, чтобы линейный фрагмент m-PEG составлял примерно от 20 кДа до 40 кДа, например, около 20 кДа, около 30 кДа или около 40 кДа. Целые числа, соответствующие этим молекулярным весам m-PEG, составляют от примерно 400 (например, около 455) до примерно 900 (например, около 910). Соответственно, "n" выбирают таким образом, чтобы получить разветвленный ПЭГ с молекулярным весом примерно от 40 кДа до 80 кДа, например, около 40 кДа, около 50 кДа, около 60 кДа, около 70 кДа или около 80 кДа.
[0031] Многие другие полимеры также можно применять в данном изобретении. Особенно применимы в данном изобретении полимерные скелеты, которые имеют непептидную природу и являются водорастворимыми. Примеры подходящих полимеров включают, без ограничения, другие полиалкиленгликоли, например полипропиленгликоль ("PPG"), сополимеры этиленгликоля и пропиленгликоля и им подобные, полиоксиэтилированный полиол, полиолефиновый спирт, поливинилпирролидон, полигидроксипропилметакриламид, поли([альфа]-гидроксикислота), поливиниловый спирт, полифосфазен, полиоксазолин, поли(М-акрилоилморфолин), такие как описанные в патенте США №5629384, который включен в настоящее описание полностью посредством ссылки, а также их сополимеры, терполимеры и их смеси.
[0032] Несмотря на то что молекулярный вес каждой цепи полимерного скелета может варьироваться, обычно он находится в пределах примерно от 100 Да до 160000 Да, например, приблизительно от 5000 Да до 100000 Да. Более конкретно, размер каждого конъюгированного гидрофильного полимера по настоящему изобретению может варьироваться примерно от 500 Да до 80000 Да, как, например, примерно от 1000 Да до 80000 Да; примерно от 2000 Да до 70000 Да; примерно от 5000 до 70000 Да; примерно от 5000 до 60000 Да; примерно от 10000 до 70000 Да; примерно от 20000 до 60000 Да; примерно от 30000 до 60000 Да; примерно от 30000 до 50000 Да; или примерно от 30000 до 40000 Да. Следует понимать, что эти размеры представляют собой скорее оценку, чем точные значения. В предпочтительном воплощении молекулы по изобретению конъюгированы с гетерогенной популяцией гидрофильных полимеров, таких как, например, ПЭГ размером, например, 10000, 40000 или 80000 Да ± примерно 5000, примерно 4000, примерно 3000, примерно 2000 или примерно 1000 Да.
[0033] O-связанный олигосахарид: Как N-гликаны, так и O-гликаны присоединяются к белкам клетками, продуцирующими данный белок. Клеточный аппарат N-гликозилирования распознает и гликозилирует сигнальные последовательности N-гликозилирования (мотивы N-X-S/T) в аминокислотной цепи, когда насцентный белок перемещается из рибосомы в эндоплазматический ретикулум (Kiely et al. 1976; Glabe et al. 1980).
[0034] Аналогично O-гликаны присоединяются по специфическим сайтам O-гликозилирования в аминокислотной цепи, но мотивы, запускающие O-гликозилирование, гораздо более гетерогенны, чем сигналы N-гликозилирования, и мы до сих пор не способны адекватным образом предсказывать сайты O-гликозилирования в аминокислотной последовательности (Julenius et al. 2004). Поэтому создание искусственных сайтов O-гликозилирования связано в некоторой мере с неопределенностью. Принято считать, что нативная молекула FVIII не содержит сайтов O-гликозилирования, и, таким образом, опытный специалист предположил бы, что следует создать по меньшей мере один искусственный сайт O-гликозилирования и вставить его в В-домен в связи с осуществлением на практике настоящего изобретения.
[0035] O-связанный олигосахарид в укороченном В-домене Фактора VIII можно, таким образом, присоединить к природной последовательности O-сцепленного гликозилирования или к последовательности O-сцепленного гликозилирования, которая была искусственно создана рекомбинантным способом.
[0036] В предпочтительном воплощении настоящего изобретения O-связанный олигосахарид присоединен к природной последовательности O-сцепленного гликозилирования, которая не подвержена гликозилированию в молекуле Фактора VIII дикого типа, но становится доступной для O-гликозилирования вследствие укорочения В-домена. Пример такой последовательности приведен в Примерах и в SEQ ID NO 2 (укороченный В-домен соответствует аминокислотам 742-763). Возможно, что "скрытый" сайт O-гликозилирования в SEQ ID NO 2 также будет гликозилирован, даже если укорочение В-домена произойдет где-то в другом месте, т.е. если укороченный В-домен будет несколько короче (например, на 1, 2, 3, 4 или 5 аминокислот короче, чем SEQ ID NO 2) или длиннее (например, на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот) по сравнению с SEQ ID NO 2. Такой подход, связанный с активацией "скрытого" сайта O-гликозилирования путем укорочения В-домена, а не с созданием искусственного сайта O-гликозилирования, имеет преимущество в том, что создается молекула с благоприятным профилем безопасности (т.е. со сниженной аллергенностью и т.д.). Могут быть аналогично активированы и другие сайты O-гликозилирования в В-домене Фактора VIII при укорочении молекул различным образом.
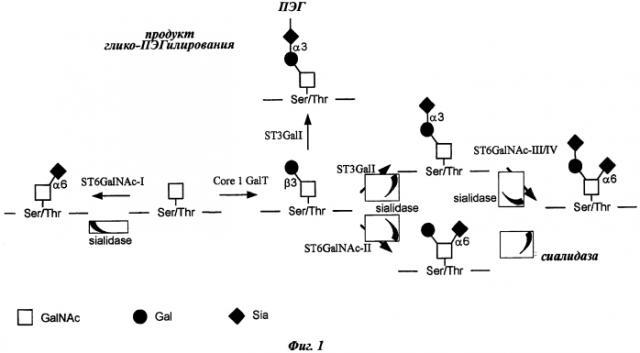
[0037] Глико-ПЭГилирование O-связанного олигосахарида: Биосинтез O-гликанов можно модифицировать и прерывать добавлением остатков сиаловой кислоты на сравнительно ранних этапах биосинтеза. Определенные энзимы - сиалилтрансферазы - способны воздействовать на GalNAca-Ser/Thr или же на подтипы структур (core subtypes) O-гликанов ранней стадии биосинтеза, после воздействия энзима Core 1 GalT. Термин «Т-антиген» (Т antigen) связан с присутствием дисахарида Galp1-3GalNAca-Ser7Thr. При синтезе таких структур возникает конкуренция между гликозилтрансферазами за один и тот же субстрат, и, таким образом, уровни экспрессии гликозилтрансфераз и их субклеточное распределение в аппарате Гольджи определяют структурный выход в биосинтезе O-гликанов и их разнообразие. Как показано на Фиг.1, глико-ПЭГилированию подвержен только дисахарид Galp1-3GalNAcα-Ser/Thr.
[0038] Тем не менее доступное количество этой структуры можно существенно увеличить путем обработки белка сиалидазой или ферментом Corel GalT, или же их комбинацией. Результатом процесса глико-ПЭГилирования является присоединение сиаловой кислоты-ПЭГ к нативной структуре за счет образования α3-связи с дисахаридом Galp1-3GalNAcα-Ser/Thr белка-мишени (Фиг.1).
[0039] Другие гидрофильные полимеры также можно присоединять к O-связанным олигосахаридам. Основным требованием для энзиматического конъюгирования других гидрофильных полимеров с FVIII посредством O-гликана является возможность их присоединения к производному глицил-сиаловой кислоты за счет свободной аминогруппы, что раскрыто в WO 03031464. Для достижения этой цели существует большое разнообразие химических способов конъюгирования, известных специалистам в данной области техники. Примеры активированного биосовместимого полимера включают оксиды полиалкилена, такие как, без ограничения, полимеры полиэтиленгликоль (ПЭГ) и 2-(метакрилоилокси)этил фосфорилхолин (mРС) (как описано в WO 03062290), декстраны, коломиновые кислоты (colominic acids) или другие полимеры углеводной природы, полимеры аминокислот или специфических пептидных последовательностей, производные биотина, поливиниловый спирт (PVA), поликарбоксилаты, поливинилпирролидон, полиэтилен-со-ангидрид малеиновой кислоты, полистирол-со-ангидрид малеиновой кислоты, полиозазолин, поли(акрилоилморфолин), гепарин, альбумин, целлюлозы, гидролизаты хитозана, крахмалы, например гидроксиэтилен-крахмалы и гидроксипропил-крахмалы, гликоген, агарозы и их производные, гуаровая смола, пуллулан, инулин, ксантановая смола, каррагинан, пектин, гидролизаты альгиновой кислоты, другие полимеры и любые их эквиваленты.
[0040] Фармацевтическая композиция: В данном описании подразумевается, что термин «фармацевтическая композиция» предпочтительно охватывает композиции, включающие молекулы Фактора VIII по настоящему изобретению, подходящие для парентерального введения, такие как, например, готовые к использованию стерильные водные композиции или сухие стерильные композиции, которые можно растворять, например, в воде или водном буфере. Композиции по изобретению могут включать различные фармацевтически приемлемые эксципиенты, стабилизаторы и т.д.
[0041] Дополнительные ингредиенты в таких композициях могут включать увлажняющие вещества, эмульгаторы, антиоксиданты, объемообразующие агенты, агенты, регулирующие тоничность, хелатирующие агенты, ионы металлов, маслянистые растворители, белки (например, человеческий сывороточный альбумин, желатин или белки) и цвиттер-ион (например, аминокислоту, такую как бетаин, таурин, аргинин, глицин, лизин и гистидин). Подобные дополнительные ингредиенты, разумеется, не должны оказывать негативный эффект на общую стабильность препарата по настоящему изобретению. Парентеральное введение можно осуществлять путем подкожной, внутримышечной, внутрибрюшинной или внутривенной инъекции с помощью шприца, возможно шприца-ручки. В другом варианте парентеральное введение можно проводить с помощью инфузионного насоса. Другим вариантом является композиция, которая может представлять собой раствор или суспензию для введения соединения FVIII в форме назального или пульмонального спрэя. В качестве еще одного варианта фармацевтические композиции, содержащие соединение FVIII по изобретению, могут быть также приспособлены для чрескожного введения, например, путем инъекции без применения иглы или в форме накладки, возможно накладки для ионтофореза, или же для трансмукозального, например трансбуккального введения.
[0042] Таким образом, в первом аспекте настоящее изобретение относится к молекуле Фактора VIII с укороченным В-доменом, имеющей измененное время полужизни в кровотоке, причем указанная молекула ковалентно конъюгирована с гидрофильным полимером посредством O-связанного олигосахарида в укороченном В-домене, при этом активация Фактора VIII (активация молекулы) приводит к удалению ковалентно конъюгированного полимера.
[0043] Согласно одному воплощению гидрофильным полимером является ПЭГ. Размер полимера ПЭГ может варьироваться примерно от 10000 до 160000 Да; например, от 10000 до 80000 Да, например, около 10000; 15000; 20000; 25000; 30000; 35000; 40000; 45000; 50000; 55000; 60000; 65000, 70000; 75000; или 80000 Да. Предпочтительно, чтобы O-связанный олигосахарид был присоединен по сайту O-гликозилирования, который был получен путем укорочения В-домена, а не путем вставки искусственного сайта O-гликозилирования, не присутствующего в молекуле wt FVIII.
[0044] Согласно особенно предпочтительному варианту осуществления, молекула по настоящему изобретению включает аминокислотную последовательность, представленную в SEQ ID NO 2. Такие молекулы имеют уникальную особенность в том, что активированная молекула FVIII идентична нативной активной молекуле FVIII. Эта особенность, по-видимому, дает более удачные характеристики в испытаниях на безопасность.
[0045] Настоящее изобретение относится также к фармацевтическим композициям, включающим молекулы по настоящему изобретению.
[0046] Настоящее изобретение, кроме того, относится к способу получения молекулы по настоящему изобретению, причем указанный способ включает конъюгацию молекулы Фактора VIII с укороченным В-доменом с гидрофильным полимером, таким как, например, группа ПЭГ, посредством O-связанного олигосахарида в укороченном В-домене. Следовательно, настоящее изобретение также относится к молекулам, которые получены или которые можно получить таким способом.
[0047] В другом аспекте настоящее изобретение относится к способу лечения гемофилии, включающему введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества молекул по изобретению.
[0048] В данном описании термин "лечение" относится к лекарственной терапии любого человека или животного, которые в этом лечении нуждаются. Предполагается, что указанный пациент прошел медицинский осмотр врачом-терапевтом, который поставил предварительный или окончательный диагноз, который указывал бы на то, что применение вышеупомянутого специального лечения будет благотворным для здоровья указанного пациента-человека или животного. Время проведения и цель указанной терапии может варьироваться от одного пациента к другому в соответствии с состоянием его здоровья. Таким образом, указанная терапия может быть профилактической, смягчающей, симптоматической и/или лечебной.
[0049] В еще одном аспекте настоящее изобретение относится к применению молекулы по изобретению в качестве лекарства, а также к применению молекулы по изобретению для изготовления лекарства для лечения гемофилии.
[0050] В последнем аспекте настоящее изобретение относится к способу разработки молекулы Фактора VIII с укороченным В-доменом по настоящему изобретению, который включает (i) укорочение В-домена и, возможно, проведение анализа аминокислотной последовательности этой укороченной молекулы Фактора VIII для выявления потенциальных сайтов О-сцепленного гликозилиро