Замещенные дипептиды с нейропсихотропной активностью
Иллюстрации
Показать всеИзобретение относится к области биологически активных соединений и относится к новым дипептидам формулы R1-C(O)-X-Trp-Y-Ile-R2, где X=L или D конфигурация, Y=L конфигурация; R1=C6H5-CH2-O, или C6H5-(CH2)5, или C6H5-CH2; R2=OH, или NH2, или NHCH3, обладающим нейропсихотропной активностью, в частности анксиолитической. 4 н. и 5 з.п. ф-лы, 10 табл., 7 пр.
Реферат
Область изобретения
Изобретение относится к новым биологически активным дипептидам общей формулы:
где X=L или D конфигурация, Y=L конфигурация;
R1=C6H5-CH2-O-, или C6H5-(СН2)5-, или C6H5-CH2-;
R2=OH, или OCH3, или NH2, или NHCH3.
Новые соединения являются лигандами транслокаторного протеина (18 kDa, TSPO) и обладают нейропсихотропными свойствами, в частности анксиолитическими.
Уровень техники
Периферические бензодиазепиновые рецепторы (PBR, или TSPO), открытые в 1977 году [Braestrup С, Squires R.F., Proc. Natl. Acad. Sci. USA. Sep 1977; 74(9):3805-3809.], расположены в большинстве периферических органов, включая почки, легкие, сердце, но в наибольшем количестве представлены в тканях, продуцирующих стероидные гормоны, таких как тестикулы, яичники, надпочечники, а также в небольшом количестве присутствует в глиальных клетках здорового головного мозга [Beurdeley-Thomas A., Miccoli L., Oudard S., Dutrillaux В., Poupon M.F., J. Neurooncol. 2000. V.46. №1 P.45-56]. TSPO представляет собой 18 kDa богатый триптофаном белок, образующий тройной белковый комплекс с вольт-зависимым анионным каналом массой 32 kDa (VDAC) и 30 kDa переносчиком адениннуклеотида (ANC), расположенный на внешней мембране митохондрий [Papadopoulos V., Boujrad N., Ikonomovic M.D., Ferrara P., Vidic В., Mol. Cell. Endocrinol. 1994. V.104. N1 P.R5]. Кроме того, с этим комплексом способен связываться TSPO-ассоциированный белок-1 (PRAX-1), который модулирует функцию TSPO. [McEnery M.W., Snowman A.M., Trifdetti R.R., Snyder S.H., Proc. Natl Acad. Sci. USA. 1992. V.89. N8. P.3170.].
Ранее предполагалось, что TSPO является подклассом центральных бензодиазепиновых рецепторов, так как, подобно им, они с высокой аффинностью связывались с диазепамом. Однако уникальное строение и расположение в клетке заставило считать TSPO новым типом рецепторов [V. Papadopoulos, М. Baraldi, Т.R. Guilarte, Т.В. Knudsen, J.-J. Lacapere, P. Lindemann, M.D. Norenberg, D. Nutt, A. Weizman, M.-R. Zhang, M. Gavis, TRENDS in Pharmacological Sciences Vol.27 No.8, P.402-409].
Существуют многочисленные свидетельства об участии TSPO в различных биологических процессах, однако его точная физиологическая роль остается неизвестной. В частности, TSPO участвует в модуляции иммунного ответа, транспорте порфирина и синтезе гема, регуляции пролиферации клеток, биосинтезе стероидных гормонов, а так же в программируемой смерти клеток [V. Papadopoulos, L. Lecanu, R.C. Brown, Z. Han, Z.-X. Yao, Neuroscience 138 (2006) 749-756]. Наиболее изученная функция TSPO заключается в транслокации холестерина от внешней к внутренней митохондриальной мембране, что является лимитирующей стадией в синтезе стероидов и нейростероидов [J.-J. Lacapere, V. Papadopoulos, Steroids 68 (2003) 569-585]. Хорошо известно, что нейростероиды играют ключевую роль в функционировании центральной нервной системы, формировании психического статуса, эмоций, поведения, обучения и памяти [Alkayed N.J., Murphy S.J., Traystman R.J., Hurn P.D. J. of the American Heart Asociation. 2000. V.31. P.161-168]. Таким образом, TSPO может увеличивать в мозгу концентрацию нейростероидов, которые усиливают нейромедиаторную функцию ГАМК и вызывают неседативные анксиолитические эффекты. [G. Primofiore, F. Da Settimo, S. Taliani, F. Simorini, M.P. Patrizi, E. Novellino, G. Greco, E. Abignente, B. Costa, B. Chelli, C. Martini, J.Med.Chem, 2004, v.47, p.1852-1855]. Есть указания на то, что лиганды TSPO могут быть полезны в лечении воспалительных и кардиоваскулярных заболеваний [Roseli С Farges, Sandra R Torresa, Pascual Ferrarab, Rosa M Ribeiro-do-Vallea, Life Sci., 2004, v.74, p.1387-1395].
TSPO может быть использован как мишень для создания лекарственных средств для лечения нейрональных заболеваний. Так, было показано, что лиганды TSPO обладают значительной эффективностью на различных in vivo моделях нейродегенерации [Girard, С.et al.Proc. Natl Acad. Sci. USA, 2008, 105, 20505-20510], тревоги [Da Settimo, F. et al. J. Med. Chem. 2008, 51, 5798-5806], депрессии [Kita A, et al. Br. J. Pharmacol. 2008, 142, 1059-1072]
В литературе в качестве лигандов TSPO рецепторов описано несколько классов химических соединений.
В качестве эндогенных лигандов-агонистов TSPO рассматриваются 11 kDa нейропептид DBI (ингибитор связывания диазепама), 16 kDa белок антралин (anthralin) [Michelle L. James, Silvia Selleri, Michael Kassiou, Curr. Med. Chem., 2006, 13, 1991-2001], StAR (steroidogenic acute regulatory protein) и некоторые порфирины, включая гем [John G. Pastorino, Gabriella Simbula, Ellen Gilfo, J.B. Hoek, and John L. Farber, J. of Biol. Chem., Vol.269, No.49, Issue of December 9, P.31041-31046].
Синтетическими лигандами TSPO долгое время считались диазепам, клоназепам и некоторые другие производные бензодиазепина, однако указанные вещества связываются как с TSPO, так и с центральным бензодиазепиновым рецептором.
Известным селективным антагонистом TSPO является бензодиазепин Ro 5-4864 (заявка US 20050090489)
Первыми не бензодиазепиновыми антагонистами TSPO были изохинолиновые карбоксамиды РК-1195 и VC-198M [J. Benavides et al, Brain Res. Bull., Vol.13, Iss.1, July 1984, P.69-77].
В 1991 году в патенте US 5032595 фирма Synthelabo (сейчас Sanofi-Aventis) рассмотрела известное лекарственное средство Alpidem как потенциальный лиганд TSPO. Ранее было известно, что данное вещество обладает анксиолитическим эффектом и не обладает седативным эффектом. Авторами патента было показано, что данное соединение вызывает стимуляцию стероидогенеза. Однако в 1995 году Alpidem был изъят из продаж из-за повышенной гепатотоксичности.
В 1999 году в патенте US 5891891 были описаны в качестве лигандов TSPO производные имидазопиридина. Авторами была показана их эффективность в лечение экстрапирамидных расстройств.
В статье [European Journal of Medicinal Chemistry Vol.32, Issue 3, 1997, Pages 241-251] авторы описывают в качестве лигандов TSPO бензоксазепины OXA-17f и OXA-17j
В 2007 году в заявке US 20100179133 в качестве лигандов TSPO раскрываются вещества общей формулы
Эти соединения вызывают внутри митохондрий генерацию активных форм кислорода, что приводит к уменьшению или предотвращению окислительного стресса при табакокурении.
В международной заявке WO 1999051594 были описаны производные имидазо[1,2-а]пиридинов общей формулы:
Авторами была показана эффективность в использовании заявляемых веществ как маркеры заболеваний центральной нервной системы, связанных с повышенной экспрессией TSPO.
В заявке PCT/US2007/086538 описаны призводные феноксифенил-ацетамида (DAA-1097, DAA-1106) в качестве биомаркеров молекулярной визуализации повышенной экспрессии TSPO.
В заявке EP 1036794 фирма Dainippon Pharmaceutical Co., Ltd в качестве лигандов TSPO описала серию производных 2-арил-8-оксодигидропуринов. Изучение этих соединений показало их активность на модели болезни Альцгеймера на мышах (патент US 6962921). Соединение XBD-173 (АС-5216, Emapunil) представляющее собой N-бензил-N-этил-2-(7-метил-8-оксо-2-фенилпурин-9-ил)-ацетамид, находится на второй стадии клинических испытаний в качестве анксиолитика (Novartis, NCT00108836).
В статье (Romeo, ЕА. et al. J. Pharmacol. Exp.Ther., 1992, 262, 971-978) описаны производные арилиндолацетамида, проявившие агонистическую активность к TSPO. Арилиндолацетамид SSR180575 находится на второй стадии клинических испытаний (Sanofi-Aventis, NCT00502515) для лечения диабетической нейропатии.
Однако соединения, описанные в вышеприведенных ссылках, не открывают и не предполагают новых структурных вариаций патентуемых соединений.
Сущность изобретения
Нашей целью явилось получение дипептидных аналогов лигандов TSPO с агонистической активностью. Мы нашли, что эта цель может быть достигнута с помощью соединений общей формулы
R1-C(O)-X-Trp-Y-Ile-R2
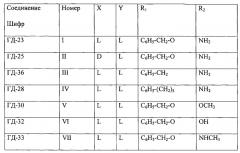
где X=L или D конфигурация, Y=L конфигурация; R1=C6H5-CH2-O-, C6H5-(CH2)5-, C6H5-CH2-; R2=OH, OCH3, NH2, NHCH3
Примерами осуществления изобретения могут служить следующие соединения:
I амид N-карбобензокси-L-триптофанил-L-изолейцина
II амид N-карбобензокси-D-триптофанил-L-изолейцина
III амид N-фенилгексаноил-L-триптофанил-L-изолейцина
IV амид N-фенилацетил-L-триптофанил-L-изолейцина
V метиловый эфир N-карбобензокси-L-триптофанил-L-изолейцина
VI N-карбобензокси-L-триптофанил-L-изолейцин
VII метиламид N-карбобензокси-L-триптофанил-L-изолейцина
Представляемые в изобретении соединения изобретения дополнительно иллюстрирует таблица 1.
Приведенные выше соединения были получены хорошо известными способами синтеза пептидов. Обычный процесс получения рассматриваемых соединений состоит в смешивании и конденсации требуемых аминокислот, как правило, в гомогенной фазе.
Конденсация в гомогенной фазе может быть выполнена следующим образом:
а) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционоспособные группы, в присутствии конденсирующего агента такого как карбодиимид;
б) конденсация аминокислоты, имеющей активированную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционноспособные группы;
в) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, имеющей активированную аминогруппу и защищенные другие реакционносособные группы.
Карбоксильная группа может быть активирована превращением ее в хлорагидридную, азидную, ангидридную группы или активированный эфир, такой как N-оксисукцинимидный, N-оксибензотриазольный, пентахлофениловый или паранитрофениловый эфиры. Аминогруппа может быть активирована превращением ее в фосфитамид или «фосфоразным» методом.
Наиболее общими для рассмотренных выше реакций конденсации являются: карбодиимидный метод; азидный метод; метод смешанных ангидридов; метод активированных эфиров. Эти методы описаны в "The Peptides". Vol.1. 1965 (Academic Press), E. Schroeder, K. Lubke, или в "The Peptides", Vol.1, 1979 (Academic Press) E. Cross, L. Meinhofen.
Предпочтительными методами конденсации при получении пептидов формулы 1 является метод активированных эфиров, который проводят преимущественно с применением сукцинимидных эфиров, защищенных по аминогруппе аминокислот. Лучшими растворителями являются смесь этилацетата с дихлорметаном, чистый этилацетат и тетрагидрофуран
Реакционноспособные группы, которые не должны участвовать в конденсации, могут быть защищены группами, которые легко удаляются, например, гидролизом или восстановлением. Так, карбоксильная группа может быть защищена этерфикацией метанолом, этанолом, трет-бутанолом, бензиловым спиртом.
Аминогруппу обычно эффективно защищают кислотными группами, например остатками алифатических, ароматических, гетероциклических карбоновых кислот, такими как ацетил, бензоил, пиридинкарбоксил, кислотными группами, производными угольной кислоты, такими как этоксикарбонил, бензилоксикарбонил, трет-бутилоксикарбонил; или кислотными группами, производными сульфокислоты, такой как пара-толуосульфониловая.
При синтезе заявляемых соединений N-алканоилзамещенных дипептидов N-ацильные производные получали используя бензилхлорформиат, фенилуксусную и 6-фенилгексановую кислоты. Эти ацильные группы функционировали также в качестве N-защитных групп в дальнейшем ходе синтеза.
Защитные группы удаляли в соответствии с природой этих групп. Карбобензокси-группу удаляли гидрогенолизом в токе водорода в метаноле с добавкой 10%-ного палладия на угле в качестве катализатора; трет-бутилоксикарбонильную группу удаляли в присутствии безводной трифторуксусной кислоты.
Амиды дипептидов по формуле 1 могут быть получены введением амидной группы в соответствующий дипептид каким-либо подходящим способом, например обработкой дипептида аммиаком в присутствии конденсирующего агента. Алкиламиды пептидов получают аминолизом алкилэфира соответствующего дипептида или реакцией с аминокислотой в виде желаемого алкиламида. Более предпочтительны незамещенные амиды, монометил- и диметиламиды.
Эфиры пептидов согласно формуле 1 получают предпочтительно путем использования аминокислоты в форме желаемого эфира. Они могут быть получены также соответствующей этерификацией полученного пептида. Предпочтительны метиловые и этиловые эфиры.
Примеры осуществления изобретения
В дальнейшем используются следующие сокращения:
Boc - трет-бутилоксикарбонил
DIPEA - диизопропилэтиламин
DMF - диметилформамид
DMSO - диметилсульфоксид
OSu - оксисукцинил
Ile - изолейцил
Me - метил
Ph - фенил
Phhex - фенилгексаноил
TFA - трифторуксусная кислота
THF - тетрагидрофуран
Trp - триптофанил
Pd/C - наночастицы палладия на поверхности активированного угля
Z - бензилоксикарбонил
TCX - тонкослойная хроматография
ЯМР - ядерный магнитный резонанс
Для определения физико-химических характеристик полученных веществ была использована следующая аппаратура:
точки плавления определяли на приборе Optimelt МРА100 (Stanford Research Systems, Англия) в открытых капиллярах без корректировки;
удельное вращение плоскости поляризации света регистрировали на автоматическом поляриметре ADP 440 Polarimeter (Bellingham+Stanley Ltd., Англия);
1H-ЯМР-спектры регистрировали в шкале δ, м.д., на спектрометре Bruker АС-250 (Германия) в растворах DMSO-d6, используя в качестве внутреннего стандарта тетраметилсилан.
Для обозначения резонансных сигналов использовали следующие сокращения: с - синглет, д - дублет, т - триплет, к - квадруплет, м - мультиплет;
Тонкослойную хроматографию (TCX) выполняли на силикагелевых пластинах DC Kieselgel 60 G/F254 (Merck, Германия) в системах растворителей хлороформ: метанол, 9:1 (А) или бутанол: уксусная: кислота: вода 4:1:1 (Б), с проявлением в парах йода или ультрафиолетовых лучах.
ПРИМЕР 1. Получение амида N-карбобензокси-L-триптофанил-L-изолейцина (I), Z-L-Trp-L-Ile-NH2.
а) N-третбутилоксикарбонил-L-изолейцин, N-Boc-L-Ile.
К раствору 15,00 г (114,5 ммоль) L-изолейцина в 50 мл 1N NaOH добавляли раствор 10,00 г NaHCO3 в 50 мл воды, 30 мл изопропилового спирта и 30,00 г (137,4 ммоль, 20% избыток) ди-трет-бутилпирокарбоната. Смесь перемешивали 2 ч при комнатной температуре, затем разбавляли водой до объема 300 мл. Избыток ди-трет-бутилпирокарбоната экстрагировали диэтиловым эфиром (2×100 мл). Водный раствор подкисляли 5% раствором H2SO4 до pH 4-5, продукт экстрагировали этилацетатом (3×100). Органические фракции объединяли, промывали насыщенном раствором NaCl, высушивали над безводным MgSO4, осушитель отфильтровывали, этилацетат упаривали, получали 21,71 г (82%) чистого продукта в виде бесцветного прозрачного масла. Соединение было описано только методом TCX (Rf=0.62 в системе А) и не было описано методом ЯМР, так как дополнительное подтверждение структуры не требовалось.
б) Сукцинимидный эфир N-третбутилоксикарбонил-L-изолейцина, N-Boc-L-Ile-OSu.
К раствору 5,00 г (21,6 ммоль) Boc-L-изолейцина в 50 мл THF добавляли 2,73 г (23,8 ммоль, 10% избыток) N-гидроксисукцинимида, раствор охлаждали до 0°C и в течение 30 мин, прикапывали раствор 4,90 г (23,8 ммоль, 10% избыток) дицилогексилкарбодиимида в 20 мл THF, следя за тем, чтобы температура не превышала +5°C. Затем реакционную массу перемешивали 30 мин при 0-+5°C и 5 ч при комнатной температуре. Осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное вязкое масло растворяли в 30 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°C, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Получали чистый продукт в количестве 5,31 г (75%) в виде светло-желтого порошка с t° плав. 91,4-93°C.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.86 (3 H, т, СδН3 Ile), 0.95 (3 H, д, Cγ°H3 Ile), 1.29 и 1.47 (2 H, два м, CγH2 Ile), 1.38 (9 H, c, -OC(CH3)3), 1,86 (1 H, м, CβН Ile), 2,79 (4 H, м, OSu), 4.23 (1 H, д. д., CαН Ile), 7.57 (1 H, д, NH Ile).
в) Амид N-третбутиоксикарбонил-L-изолейцина, N-Boc-L-Ile-NH2.
К раствору 3 г (9 ммоль) Boc-L-Ile-OSu в 5 мл DMF приливали 20 мл водного раствора аммиака, сразу выпадал белый творожистый осадок. Полученную суспензию перемешивали 30 мин до полного прохождения реакции, затем упаривали до половины объема, приливали 20 мл охлажденной дистиллированной воды. Через 2 часа сформировавшийся осадок отфильтровывали на стеклянном фильтре, промывали 20 мл 3% H2SO4, 30 мл дистиллированной воды, сушили на воздухе. Получали 1,94 г (93%) Boc-Phe-NH2 в виде белого порошка с t° плав. 167,4- 68,2°C.
Спектр 1H-ЯМР (DMSO-d6) δ, м.д.: 0.81 (3 H, т, CδН3 Ile), 0,82 (3 H, д, Сγ°Н3 Ile), 1,06 и 1,36 (2 H, два м, CγH2 Ile), 1.36 (9 H, c, -OC(CH3)3), 1.61 (1 H, м, СβН Ile), 2,79 (4 H, м, OSu), 3.74 (1 H, д.д, CαH Ile), 6.53 (1 H, д, NH Ile), 6.97 и 7.25 (2 H, два с, NH2 амид).
г) Трифторацетат амида L-изолейцина, TFA*Ile-NH2
К суспензии 1,30 г (4,9 ммоль) Boc-Ile-NH2 в 7 мл дихлорметана приливали 3 мл TFA и перемешивали до прекращения выделения газа. Раствор упаривали с диэтиловым эфиром (3×10 мл). Полученное белое масло затирали под диэтиловым эфиром. Осадку давали сформироваться в течение 12 часов на воздухе при комнатной температуре. Кристаллы отфильтровывали, сушили в вакуумированном эксикаторе над CaCl2. Получали 1,17 г (99%) TFA*H-Ile-NH2 в виде белого порошка с t° плав 135-137°C.
Спектр 1H-ЯМР (DMSO-d6) δ, м.д.: 0.83 (3 H, т, CδH3 Ile), 0.91 (3 H, д, Сγ°Н3 Ile), 1.13 и 1.45 (2 H, два м, CγН2 Ilе), 1.80 (1 H, м, СβН Ile), 3.56 (1 H, д.д., CαН Ile), 7.55 и 7.82 (2 H, два с, NH2 амид), 8.08 (3 H, уш. с, N+Н3 Ile).
д) N-Карбобензокси -L-триптофан (Z-L-TrpOH).
Растворяли 10,00 г (48,9 ммоль) L-триптофана в 200 мл 0,1 N раствора NaOH. При охлаждении из двух капельных воронок прикапывали 50% раствор карбобензоксихлорида в толуоле (10 мл, 10% избыток) и 100 мл 1N раствора NaOH. Реакционной массе давали нагреться до комнатной температуры, перемешивали 12 ч. По окончании реакции (TCX-контроль в системе Б) щелочной раствор промывали диэтиловым эфиром, водную фракцию нейтрализовывали 1N раствором HCl. Выпавший осадок отфильтровывали, промывали 0,1N HCl, дистиллированной водой, высушивали в вакууме в эксикаторе над CaCl2. Получали 15, 41 г (93%) продукта в виде серого порошка с t° плав. 125-127°C.
Спектр 1N-ЯМР (DMSO-d6) δ, м.д.: 2.98 и 3.18 (2 H, два д.д., CβН Trp), 4.21 (1 H, м, CαН Trp), 5.96 (2 H, с, -OCH2C6H5), 6.87-7,76 (10 Н, м, -OCH2C6H5, индол), 7.45 (1 H, д, NH Тrp), 10.80 (1 H, с, NH индол).
е) Сукцинимидный эфир N-карбобензокси-L-триптофана, Z-L-Trp-OSu.
К раствору 2,00 г (5,9 ммоль) Z-L-TrpOH в 15 мл этилацетата (безводного, нейтрального) добавляли 0,79 г (6,9 ммоль, 17% избыток) N-гидроксисукцинимида, раствор охлаждали до 0°C и в течение 10 мин, затем присыпали 1,44 г (7,0 ммоль, 19% избыток) дицилогексилкарбодиимида, следя за тем, чтобы температура не превышала +5°C. Реакционную массу перемешивали 30 мин при температуре 0-+5°C и затем 12 ч при комнатной температуре. Осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное вязкое масло растворяли в 10 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°C, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное масло промывали гексаном, гексан декантировали, масло упаривали досуха. Получали чистый продукт в количестве 2,33 г (92%) в виде белой пены.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 2.78 (4 H, м, OSu), 3.01 и 3.25 (2 H, два д.д., CβН Тrр), 3.98 (1 H, м, СαН Тrр), 4.97 (2 H, с, -OCH2C6H5), 6.73-7.62 (10 Н, м, -OCH2C6H5, индол), 8.56 (1 H, д, NH Trp), 10.78 (1 Н, с, NH индол).
ж) Амид N-карбобензокси-L-триптофанил-L-изолейцина, Z-L-Trp-L-Ile-NH2 (I).
Растворяли 1,00 г (4 ммоль) TFA*L-IleNH2 в 50 мл смеси дихлорэтана и этилацетата (1:1) с добавлением 0,8 мл (4 ммоль) DIPEA. При перемешивании прибавляли раствор 1,96 г (4,4 ммоль 10% избыток) Z-L-TrpONSu в 20 мл дихлорэтана. Перемешивали 12 ч при комнатной температуре. По окончании реакции (TCX контроль в системе А) раствор экстрагировали 50 мл 5% раствором NaHCO3 и дистиллированной водой (2×50 мл), органическую фазу упаривали. По мере упаривания образовывался белый осадок. Осадок отделяли на бумажном фильтре, промывали малым количеством хлористого метилена, высушивали на воздухе. Выход составил 0, 73 г (40%) чистого продукта с t° плав. 214-216°C, [ α ] 27 D = − 23 ∘ , c=1, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.80 (3 H, т, СδН3 Ile), 0.83 (3 H, д, Cγ°Н3 Ile), 1.07 и 1.44 (2 H, два м, CγH2 Ile), 1.72 (1 H, м, CβН Ile), 2.92 и 3.11 (2 H, два д.д., СβН Тrр), 4.17 (1 H, д.д., СαН Ile), 4.34 (1 H, м, CαН Trp), 4.93 и 4.98 (2 H, 2 д, -OCH2C6H5), 6.95-7.28 (10 H, м, -OCH2C6H5, индол), 7.46 (1 H, д, NH Trp), 7.77 (1 H, д, NH Ile), 7.41 и 7.13 (2 H, два с, NH2 амид),, 10.80 (1 H, с, NH индол).
ПРИМЕР 2. Получение амида N-карбобензокси-D-триптофанил-L-изолейцина, Z-L-Trp-L-Ile-NH2 (II)
а) Сукцинимидный эфир N-карбобензокси-D-триптофана, Z-D-Trp-OSu.
Получали аналогично Iд и Iе с использованием D-триптофана.
б) Амид N-карбобензокси-D-триптофанил-L-изолейцина, Z-D-Trp-L-Ile-NH2 (II).
Растворяли 0,50 г (2 ммоль) TFA*L-IleNH2 в 50 мл смеси дихлорметана и этилацетата (1:1) с добавлением 0,4 мл (2 ммоль) DIPEA. При перемешивании прибавляли раствор 0,98 г (2,2 ммоль 10% избыток) Z-D-TrpOSu в 20 мл дихлорэтана. Перемешивали 12 ч при комнатной температуре. По окончании реакции (TCX контроль в системе А) раствор экстрагировали 50 мл 5% раствором NaHCO3 и дистиллированной водой (2×50 мл), органическую фазу упаривали. По мере упаривания образовывался белый осадок. Осадок отделяли на бумажном фильтре, промывали малым количеством хлористого метилена, высушивали на воздухе. Выход составил 0,80 г (90%) продукта с t° плав. 195-198°С, [ α ] 27 D = + 30 ∘ , с=1, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.80 (3 H, т, CδН3 Ile), 0.83 (3 H, д, CδН3 Ile), 1.07 и 1.44 (2 H, два м, CγH2 Ilе), 1.72 (1 H, м, CβН Ile), 2.92 и 3.11 (2 H, два д.д., CβН Trp), 4.17 (1 H, д.д., CαН Ile), 4.34 (1 H, м, CαН Trp), 4.93 и 4.98 (2 H, 2 д, -OCH2C6H5), 6.95-7.28 (10 H, м, -ОСН2С6Н5, индол), 7.46 (1 Н, д, NH Trp), 7.77 (1 H, д, NH Ile), 7.41 и 7.13 (2 H, два с, NH2 амид),, 10.80 (1 H, с, NH индол).
ПРИМЕР 3. Амид N-фенилацетил-L-триптофанил-L-изолейцина, PhCH2C(O)-L-Trp-L-Ile-NH2 (III).
а) Синтез сукцинимидного эфира фенилуксусной кислоты.
К раствору 5,00 г (37,0 ммоль) фенилуксусной кислоты в 50 мл тетрагидрофурана добавляли 5,07 г (44,0 ммоль, 20% избыток) N-гидроксисукцинимида, раствор охлаждали до 0°C, после чего в течение 5 мин прибавляли 9,08 г (44,0 ммоль, 20% избыток) дицилогексилкарбодиимида, следя за тем, чтобы температура не превышала +5°C. Затем реакционную массу перемешивали 30 мин при температуре 0-+5°C и 5 ч при комнатной температуре. Осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали на роторном испарителе. Полученное вязкое масло растворяли в 50 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°С, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали, масло промывали гексаном, гексан декантировали, остаток упаривали досуха. Получали чистый продукт в количестве 9,44 г (97%) в виде белого порошка.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 2.81 (4 H, м, OSu), 4.10 (2 H, с, CH2C6H5), 7.29-7.42 (5 H, м, C6H5).
б) L-триптофанил-L-изолейцина.
В колбу, содержащую суспензию 0,10 г 10% Pd/C в 20 мл метанола помещали 0,50 г (1,1 ммоль) Z-L-Trp-L-IleNH2, полученного как в Iж. Через полученную суспензию пропускали водород в течение 3 часов при интенсивном перемешивании. За ходом реакции следили методом TCX в системе CHCl3:MeOH 9:1. По окончании реакции катализатор отфильтровывали, промывали метанолом и DMF. Фильтрат упаривали, получали 0,30 г (85%) продукта в виде масла.
Спектр 1H-ЯМР (DMSO-d6) δ, м.д.: 0.78 (3 H, т, Cγ°Н3 Ile), 0.80 (3 H, д, CδH3 Ile), 0.95 и 1.34 (2 H, два м, СγH2 Ile), 1.64 (1 H, м, CβН Ile), 2.75 и 3.11 (2 H, два д.д., CβН Trp), 3.50 (1 H, м, CαН Trp), 4.14 (1 Н, д.д., CαН Ile), 6.94-7.55 (5 H, м, индол), 7.05 и 7.41 (2 H, 2 д, NH2 амид) 7.95 (1 H, д, NH Ile), 10.85 (2 H, уш с, NH2 Trp).
в) Амид N-фенилацетил-L-триптофанил-L-изолейцина, PhCH2C(O)-LTrp-L-Ile-NH2 (III).
К 0,12 г амида триптофанилизолейцина в 10 мл диметилформамида прибавляли 0,10 г сукцинимидного эфира фенилуксусной кислоты. Раствор перемешивали 24 часа. Контроль за ходом реакции вели методом TCX в системе А. Избыточное количество сукцинимидного эфира гасили добавлением DMAPA. Затем реакционную массу сильно разбавляли дистиллированной водой, упаривали на роторном испарителе. Полученные кристаллы переносили на стеклянный фильтр, промывали растворами 3% H2SO4, 5% NaHCO3 и дистиллированной водой. Сушили в вакуумном эксикаторе над CaCl2, выход составил 0,17 г (98%) вещества в виде белого порошка с t° плав. 226.3-230.0°C, [ α ] D 27 = − 16.2 ∘ , c=0.5, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.:0.78 (3 H, т, Cγ°Н3 Ilе), 0.81 (3 H, д, CδH3 Ile), 1.03 и 1.39 (2 H, два м, CγH2 Ile), 1.70 (1 H, м, СβН Ile), 2.95 и 3.09 (2 H, два д.д., СβН Trp), 3.39 (2 H, с, CH2C6H5), 4.15 (1 H, д.д., CαН Ile), 4,62 (1 H, м, CαН Trp), 6.97-7.38 (10 H, м, CH2C6H5, индол), 7.07 и 7.58 (2 H, 2 д, NH2 амид), 7.77 (1 H, д, NH Ile), 8.28 (1 H, д, NH Trp), 10.81 (1 H, с, NH индол).
ПРИМЕР 4. Получение амида N-фенилгексаноил-L-триптофанил-L-изолейцина, Phhex-L-Trp-L-Ile-NH2 (IV).
а) Синтез сукцинимидного эфира 6-фенилгексановой кислоты:
Растворяли в безводном ТГФ 5,00 г (26 ммоль) 6-фенилгексановой кислоты. При перемешивании прибавляли 3,30 г (28,6 ммоль) N-гидроксисукцинимида и 5,89 (28,6 ммоль) дициклогексилкарбодиимида. Реакцию вели 3 часа при комнатной температуре. Выпавший осадок дициклогексилмочевины отфильтровывали. Маточный раствор упаривали, разбавляли хлористым метиленом, выдерживали 12 ч в холодильнике при +8°C. Повторно выпавший осадок отфильтровывали, фильтрат упаривали досуха. Полученное масло закристаллизовывали в небольшом количестве изопропилового спирта. Выход составил 5,87 г (76%) в виде белых кристаллов с t° пл. 53°C.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 1,39 (2 H, м, CH2 цепи), 1,62 (4 H, м, (CH2)2 цепи), 2,56 (2 H, т, CH2 цепи), 2,65 (2 H, т, CH2 цепи), 2,80 (4 Н, м, OSu), 7,11-7,32 (5 H, м, -C6H5).
б) Синтез амида N-фенилгексаноил-L-триптофанил-L-изолейцина Phhex-L-Trp-L-Ile NH2 (IV).
Растворяли 0,30 г амида триптофанилизолейцина, полученного как в IIIб, в 5 мл DMF, при перемешивании добавляли 0,27 г сукцинимидного эфира 6-фенилгексановой кислоты. Перемешивали 5 ч, затем упарили. Полученное масло разбавляли 50 мл этилацетата, промывали 50 мл 5% раствора NaHCO3, затем дистиллированной водой (2×50 мл). Отделяли органическую фракцию, высушивали над MgSO4, упаривали. Получали 0,28 г (60%) продукта в виде белого порошка с t° плав. 202.1-204.0°C, [ α ] D 27 = 130 ∘ , c=0.5, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.81 (3 H, т, CδH3 Ile), 0.84 (3 H, д, Cγ°Н3 Ile), 1.06 и 1.13 (2 H, два м, CγН2 Ile), 1.15 (2 H, т, CH2 цепи), 1.43 (4 Н, м, CH2CH2 цепи), 1.72 (1 H, м, CβН Ile), 2.02 (2 H, т, CH2 цепи), 2.95 и 3.09 (2 H, два д.д., CβН Trp), 4.15 (1 H д.д., CαН Ile 4.59 (1 H м, CαН Trp), 6.96-7.60 (10 H, м, C6H5, индол), 7.70 (1 H, д, NH Ile), 8.07 (1 H, д, NH Trp) 7.16 и 7.39 (2 H, два с, NH2 амид),, 10.80 (1 H, с, NH индол).
ПРИМЕР 5. Получение метилового эфира L-триптофанил-L-изолейцина, L-Trp-L-IleOMe (V).
а) Гидрохлорид метилового эфир L-изолейцина, HCl*L-Ile-OMe.
В трехгорлую колбу, снабженную термометром, воздушным холодильником и капельной воронкой помещали 5,00 г (38 ммоль) L-изолейцина. Приливали 54 мл (133 ммоль) безводного метилового спирта (высушен над ситами с размером пор 3Å). Суспензию охладили до -10°C. При перемешивании по каплям прибавляли 5,75 мл (80 ммоль) хлористого тионила. Во время прибавления поддерживали температуру реакционной смеси -10°C. Реакцию вели при этой температуре до прекращения добавления хлористого тионила. Затем реакционную смесь нагревали до комнатной температуры и оставляли на 24 ч при перемешивании. Затем упаривали и помещали на 12 ч в холодильник. Получали стеклообразные кристаллы гидрохлорида метилового эфира L-изолейцина массой 7,38 г с резким запахом миндаля, которые высушивали над КОН и парафином. Получили чистый продукт массой 6,65 г (97%).
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0,86 (3 H, т, CδН3 Ile), 0,90 (3 Н, д, Cγ°H3 Ile), 1,27 и 1,44 (2 H, два м, CγH2 Ile), 1,94 (1 H, м, CβН Ile), 3,71 (3 H, с, -OCH3), 3,88 (1 Н, д.д., CαН Ile), 8,65 (3 H, уш. с, N+Н3 Ile)
б) Метиловый эфир N-карбобензокси-L-триптофанил-L-изолейцина, L-Z-Trp-L-IleOMe (V)
Растворяли 1,09 г (6,05 ммоль) HCl*L-Ile-OMe в 20 мл ДМФА с 1,05 мл (6,05 ммоль) DIPEA, к этому раствору прикапывали 2,09 г (6,66 ммоль) Z-L-TrpOSu в 50 мл ДМФА. Реакцию вели 24 часа при комнатной температуре (TCX-конроль в системе А). Реакционную массу упаривали досуха, разбавляли хлористым метиленом, выпавший осадок хлорида DIPEA отфильтровывали, фильтрат промывали 3% раствором H2SO4, затем 5% раствором NaHCO3 и дистиллированной водой. Органическую фракцию высушивали над безводным MgSO4, упаривали досуха, сушили в вакуумном эксикаторе над CaCl2. Получали 1,580 г (58%) вещества в виде белой пены с t° плав. 226.3-230.0°C, [ α ] D 27 = − 19.2 ∘ , c=0.5, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.86 (3 H, д, Cγ°H3 Ile), 0.87 (3 Н, т, CδН3 Ile), 1.20 и 1.41 (2 H, два м, CγН2 Ile), 1.80 (1 H, м, CβН Ile), 2.90 и 3.06 (2 H, два д.д., CβН Trp), 3.63 (3 Н, с, -OCH3), 4.29 (1 H, д.д., CαН Ile), 4,41 (1 H, м, CαН Trp),), 4.96 и 5.02 (2 Н, 2 д, -OCH2C6H5), 6.98-7.51 (10 H, м, -OCH2C6H5, индол), 7.67 (1 H, д, NH Trp), 8.27 (1 H, д, NH Ile), 10.83 (1H, с, NH индол).
ПРИМЕР 6. Получение N-карбобензокси-L-триптофанил-L-изолейцина, Z-LTrp-L-Ile-OH (VI).
а) N-Карбобензокси-L-триптофанил-L-изолейцин, Z-L-Trp-Ile-OH:
Растворяли 1,31 г (2,9 ммоль) Z-L-Trp-L-Ile-OMe, полученного как в Vб в 10 мл метанола, при перемешивании приливали раствор 0,23 г (5,8 ммоль) NaOH в воде. Перемешивали в течение 3 часов до полного растворения реакционной массы. Реакционную массу разбавляли водой, подкисляли 10% H2SO4 до рН 4. Экстрагировали этилацетатом, органическую фазу сушили над безводным MgSO4, отфильтровывали и переупаривали 3 раза с диэтиловым эфиром до получения устойчивой пены. Выход составил 1,11 г (87%) с t° плав. 66.4-68.9°C, [ α ] D 27 = − 13.7 ∘ , c=0.5,DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.77 (3 H, т, Cγ°Н3 Ile), 0.81 (3 H, д, CδН3 Ile), 1.07 и 1.41 (2 H, два м, CγH2 Ile), 1.78 (1 H, м, CβН Ile), 2.72 и 2.92 (2 H, два д.д., CβН Trp), 4.02 (1 H, д.д., CαН Ile), 4,41 (1 H, м, CαН Trp),), 4.89 и 4.99 (2 H, с, -OCH2C6H5), 6.89-7.46 (10 H, м, -OCH2C6H5, индол), 7.65 (1 H, д, NH Trp), 8.07 (1 H, д, NH Ile), 10.84 (1 H, с, NH индол), 12.63 (1 Н, уш с, OH).
ПРИМЕР 7. Получение метиламида карбобензокси-L-триптофанил-L-изолейцина, Z-L-Trp-L-IleNHCH3 (VII).
1,05 г (2,3 ммоль) Z-L-Trp-L-Ile-OMe, полученного как в Vб, растворили в 10 мл 5 М спиртовом растворе метиламида. Оставили в герметично закрытой посуде на 72 часа при комнатной температуре. Выпавший осадок отфильтровали, промыли этиловым спиртом, дистиллированной водой и диэтиловым эфиром. Высушили на воздухе. Получили 0,36 г (40%) вещества в виде белого порошка с t° плав. 235.6-237.8°C, [ α ] D 27 = − 17.7 ∘ , c=0.5, DMF.
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.77 (3 H, т, Cγ°H3 Ile), 0.81 (3 Н, д, CδН3 Ile), 1.16 и 1.39 (2 H, два м, CγH2 Ile), 1.68 (1 H, м, CβН Ile), 2.57 (3 H, д, -NHCH3), 2.91 и 3.11 (2 Н, два д.д., CβН Trp), 4.12 (1 H, д.д., CαН Ile), 4,35 (1 H, м, CαН Trp), 4.93 и 4.99 (2 H, 2 д, -OCH2C6H5), 6.91-7.28 (10 H, м, -OCH2C6H5, индол), 7.60 (1 Н, д, NH Trp), 7.85 (1 H, д, NH Ile), 10.83 (1 H, с, NH индол).
Результаты фармакологического изучения заявляемых соединений
1. Влияние соединений ГД-23, ГД-25, ГД-28, ГД-30, ГД-32, ГД-33, ГД-36 на поведение мышей линии Balb/c в условиях эмоционально-стрессового воздействия в тесте «открытое поле».
Тест «открытое поле» - распространенная модель оценки поведения грызунов в условиях эмоционального стресса, формирующегося как реакция на новую обстановку и угрожающую ситуацию. В работе применена методика освещенного «открытого поля», при котором перенос животного из темноты на ярко подсвеченную арену создает дополнительный стрессирующий фактор, основанный на естественном стремлении грызунов избегать ярко освещенных мест (С.Б. Середенин, А.А. Ведерников / Влияние психотропных препаратов на поведение инбредных мышей в условиях открытого поля / Бюлл. Эксп. Биол. Мед. - 1979. - Т.88, №7, с.38-40).
В исследовании использованы мыши-самцы инбредной линий Balb/c массой 19-25 г (НПП «Питомник лабораторных животных ФИБХ РАН). Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°C и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 [1993] и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%). Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов.
Соединения ГД-23, ГД-25, ГД-28, ГД-30, ГД-32, ГД-33, ГД-36 готовились в виде суспензии с Твин-80 и дистиллированной водой и вводились однократной внутрибрюшинной инъекцией.
Через 30 минут после внутрибрюшинного введения соединения животное сначала помещали на 1 мин в темную камеру, а затем - на один из периферических квадратов "открытого поля", которое представляет из себя белую круглую арену диаметром 1 метр с белыми бортами высотой 50 см. Арена равномерно освещена 4-мя бестеневыми лампами по 75 Вт каждая, расположенными на высоте 1 м над поверхностью поля. Все пространство арены равномерно разделено 4-мя концентрическими окружностями, которые в свою очередь разбиты радиусами на сектора так, что периферическая окружность состоит из 16 одинаковых криволинейных квадратов. Наблюдение за животным производили в течение 3 минут, раздельно фиксировали число пересеченных квадратов на периферии (ПА), в центральных областях (ЦА), число заходов в центр (Ц), а также число вертикальных стоек (ВА) и количество дефекаций (Д). Суммарное число пересеченных квадратов вместе с числом вертикальных стоек обозначали как общую активность (ОДА).
О наличии анксиолитического действия судили по выявлению активирующего эффекта на двигательную активность у животных с реакцией замирания в тесте «открытое поле» (линия Balb/c).
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни).
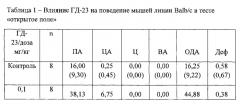
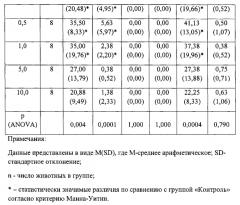
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении у соединения ГД-23 в дозах 0,1; 0,5; и 1,0 мг/кг обнаружено статистически значимое повышение периферической, центральной и общей двигательной активности мышей линии Balb/c по сравнению с контролем (таблица 1).
Соединения ГД-28 в дозе 1,0 мг/кг и ГД-32 в дозах 1,0 и 5,0 мг/кг статистически значимо (только по U-критерию Манна-Уитни)увеличивали периферическую и общую двигательную активность мышей по сравнению с контролем (таблица 3 и 5).
Таким образом, соединение ГД-23 в широком диапазоне доз при внутрибрюшинном способе введения обладает ярко выраженным анксиолитическим действием у мышей Balb/c. Данная активация происходила за счет увеличения периферической и центральной двигательной активности, что характерно для соединений, обладающих анксиолитическим действием.
2. Влияние соединения ГД-23 на поведение беспородных мышей CD-1 в тесте "приподнятый крестообразный лабиринт".
Метод «приподнятого крестообразного лабиринта» (ПКЛ) является в настоящее время общепринятым для оценки анксиолитического действия (File S.E. Factors controlling measures of anxiety and responses to novelty in the mouse.Behav Brain Res 2001; 125:151-7). Сущность метода заключается