Полученная из моноцита человека стволовая клетка для терапевтического применения и способ ее индукции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложены стволовые клетки, полученные культивированием моноцитов человека в присутствии (i) M-CSF с концентрацией от 5 до 100 нг/мл и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида с концентрацией от 1 до 100 мкг/мл и растворимого в воде растительного экстракта, экстрагированного методом экстракции Folch, с концентрацией от 0,1 до 100 мкг/мл, посредством этого дедифференцируя моноциты, где экспрессия гена CSCR4 указанных стволовых клеток более чем в три или четыре раза больше по сравнению с экспрессией стволовыми клетками, полученными путем культивирования моноцитов человека в присутствии M-CSF и IL-3, и экспрессия гена CSCR4 указанных стволовых клеток более чем в два или три раза больше по сравнению с экспрессией мезенхимальными стволовыми клетками, полученными из костного мозга, для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов. 4 н. и 11 з.п. ф-лы, 7 ил., 3 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения клеток для применения в клеточных лекарственных средствах благодаря быстро дифференцирующимся клеткам, которые должным образом дифференцированы в живом организме. Настоящее изобретение также относится к средству для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов. Настоящее изобретение, кроме того, относится к клеточному лекарственному средству, способу получения стволовых клеток, культуральной среде для дифференцирующихся моноцитов, средству, индуцирующему дедифференцирование, набору клеточного лекарственного средства, набору для получения дедифференцированных клеток и фармацевтической композиции, которые эффективно индуцируют клеточную дедифференциацию, и к стволовым клеткам.
Предшествующий уровень техники
Некоторое время тому назад внимание исследователей было привлечено к медицинским процедурам, направленным на содействие регенерации тканей для замещения клеток, утраченных по какой-либо причине, в качестве основного лечения заболеваний. В последние годы дальнейшее развитие получила концепция клеточных лекарственных средств, которые предназначены для регенерации и восстановления тканей в патологическом участке посредством взаимодействия межклеточных биологически активных веществ путем инъекции стволовых клеток или клеток-предшественников клеток ткани.
В связи с этим, было много сообщений о том, что дифференцированные клетки в ткани, например моноциты, происходящие из периферической крови, дифференцируются в стволовые клетки при культивировании в присутствии специфических цитокинов.
Однако, когда стволовые клетки или тканевые клетки-предшественники вводят в живой организм в виде клеточного лекарственного средства, то процентная доля клеток, поступающих в мишеневую поврежденную область, не всегда высока и непостоянна. Для решения этой проблемы требуется получение большого количества клеток. Кроме того, поведение клеток, которые распределяются в областях, отличных от области-мишени, еще не было детально исследовано, и остается вопрос побочных эффектов. Кроме того, хотя для усиленного терапевтического эффекта необходимо введение большого количества клеток, получение аутологичных клеток за короткий период времени представляется затруднительным.
Недавно стало ясно, что происходит феномен, называемый «хомингом». При этом феномене происходит экспрессия SDF1 (происходящий из клеток стромы фактор 1) или VEGF (сосудистый эндотелиальный клеточный фактор роста) поврежденной области в условиях ишемии; как части системы биологической репарации эти факторы служат в качестве индуцируемых молекул; и клетки, экспрессирующие рецепторы, соответствующие этим индуцируемым молекулам, принудительно направляются в поврежденную область. Рецепторами этих факторов являются CXCR4 для SDF1 и VEGFR для VEGF. Например, в непатентном документе 1 сообщается, что рана не заживает, если SDF1 блокируется в ишемической области, или когда клетки, экспрессирующие CXCR4, удаляются из крови.
Fändrich (непатентный документ 2), Huberman (непатентный документ 3) и т.д. сообщают о способах получения плюрипотентных стволовых клеток из моноцитов человека путем индукции дедифференциации. В этих способах для инкубации используются различные цитокины, включая M-CSF (фактор, стимулирующий колонии макрофагов). Каждый способ культивирования показал, что некоторые недифференцированные маркеры становились положительными. Кроме того, Kuwana et al. (непатентный документ 4) сообщают, что мультипотентные стволовые клетки (MOMC) могут быть индуцированы из мононуклеарных клеток человека с использованием культурального планшета, на который наносится фибронектин.
Список ссылок
Непатентный документ 1: Nat. Med. 2004 Aug; 10 (8): 858-64
Непатентный документ 2: Ruhnke M, Fändrich F, "Differentiation of in vitro-modified human peripheral blood monocytes into hepatocyte-like and pancreatic islet-like cells", Gastroenterology, 128 (2005) 1774
Непатентный документ 3: Yong Zhao, Eliezer Huberman, "A human peripheral blood monocyte-derived subset acts as pluripotent stem cells", PNAS 100 (2003) 2426
Непатентный документ 4: Kuwana M. et al., "Human circulating CD14+ monocytes as a source of progenitors that exhibit mesenchymal cell differentiation", J. Leukoc. Biol., 74 (2003) 833
Непатентный документ 5: Folch J., Lees M., Sloane-Stanley G. H., "A simple method for the isolation and purification of total lipids from animal tissues", J. Biol. Chem., 226, 497-509 (1957)
Краткое описание сущности изобретения
Техническая задача
Получение стволовых клеток, которые эффективно поступают в область-мишень, считалось проблематичным в области клеточных лекарственных средств. Целью настоящего изобретения является получение таких стволовых клеток, способ массового получения стволовых клеток за короткий срок и фармацевтическая композиция для индукции стволовых клеток.
Другой целью изобретения является получение средства для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
Еще одной целью изобретения является получение культуральной среды, индуцирующей дедифференциацию, средства, индуцирующего дедифференциацию, набора клеточного лекарственного средства, набора для получения дедифференцированных клеток и стволовых клеток.
Решение задачи
В качестве решения указанных выше задач, заявители обнаружили, что культивирование моноцитов периферической крови в течение короткого периода времени в присутствии индуцирующего дедифференциацию средства по настоящему изобретению продуцирует большое количество дедифференцированных клеток. Заявители также обнаружили, что непосредственное введение фармацевтической композиции по настоящему изобретению в живой организм значительно эффективно для лечения связанных с повреждением заболеваний. Заявители, кроме того, обнаружили, что введение по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, вызывает дедифференциацию моноцитов в клетки, способные восстанавливать поврежденные ткани или органы, такие как стволовые клетки, возможно, в кооперации с интравитальным M-CSF. Таким образом, настоящее изобретение относится к терапевтическому средству для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
В частности, настоящее изобретение относится к следующим аспектам.
Пункт 1. Стволовые клетки, полученные культивированием моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, посредством этого дедифференцируя моноциты.
Пункт 2. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта представляет собой сахар или содержащий сахар комплекс, причем активный ингредиент дедифференцирует моноциты.
Пункт 3. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта имеет молекулярную массу от 1000 до 500000, причем активный ингредиент дедифференцирует моноциты.
Пункт 4. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на колонке Con A, причем активный ингредиент дедифференцирует моноциты.
Пункт 5. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на анионообменной смоле, причем активный ингредиент дедифференцирует моноциты.
Пункт 6. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта представляет собой фракцию водной фазы растительного происхождения, экстрагированную методом Folch, или ее очищенный продукт.
Пункт 7. Стволовые клетки по п.1, где моноциты представляют собой моноциты человека.
Пункт 8. Стволовые клетки по любому из пп.1-7, где экспрессирован по меньшей мере один представитель недифференциированных маркеров Nanog, Nestin, c-Kit, CD9 и Oct3/4, и экспрессия гена CXCR4 является значимой, по сравнению со стволовыми клетками, полученными культивированием моноцитов в присутствии только M-CSF.
Пункт 9. Стволовые клетки, в которых экспрессирован по меньшей мере один представитель недифференцированных маркеров Nanog, Nestin, c-Kit, CD9 и Oct3/4, и экспрессия гена CXCR4 является значимой.
Пункт 10. Способ получения стволовых клеток, включающий культивирование моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Пункт 11. Способ по п.10, где культивирование выполняется в течение от 7 до 14 дней.
Пункт 12. Культуральная среда для дедифференциации моноцитов, содержащая (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Пункт 13. Фармацевтическая композиция, содержащая стволовые клетки по любому из пп.1-9 в качестве активного ингредиента.
Пункт 14. Клеточное лекарственное средство, содержащее стволовые клетки по любому из пп.1-9 в качестве активного ингредиента.
Пункт 15. Вызывающее дедифференциацию средство, содержащее (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве активных ингредиентов.
Пункт 16. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, содержащее по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве активного ингредиента.
Пункт 17. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, по п.16, где заболевания выбраны из группы, состоящей из наружных травм, воспалительных заболеваний, повреждением костей или хрящей, сердечно-сосудистых заболеваний, неврологических расстройств, заболеваний печени, почечных заболеваний, диабета, атопического дерматита и GVHD (болезни трансплантат против хозяина).
Пункт 18. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, по п.16, где заболевания выбраны из группы, состоящей из наружных травм, панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита, перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейцфелдта-Якоба, внешних повреждений или ишемии мозга или позвоночника, цирроза печени, хронического гепатита, хронической почечной недостаточности, гломерулонефрита, почечной ишемии, диабета, атопического дерматита и GVHD.
Пункт 19. Набор клеточного лекарственного средства, содержащий, по меньшей мере, стволовые клетки по любому из пп.1-9 в качестве существенного ингредиента.
Пункт 20. Набор для получения дедифференцированных клеток, содержащий (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве существенных ингредиентов.
Пункт 21. Набор по п.20, дополнительно содержащий моноциты в качестве компонента.
Пункт 22. Стволовые клетки, способ получения стволовых клеток, культуральная среда для дедифференциации моноцитов, клеточное лекарственное средство, средство для лечения заболеваний, средство, вызывающее дедифференциацию, набор клеточного лекарственного средства или набор для получения дедифференцированных клеток по пунктам 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21, где ганглиозид представляет собой по меньшей мере один представитель, выбранный из группы, состоящей из GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b и GQ1b.
Преимущества изобретения
Используя моноциты, настоящее изобретение обеспечивает массовое получение за короткий период времени стволовых клеток, поступающих в поврежденные ткани. Настоящее изобретение также относится к средству для индукции стволовых клеток. Таким образом, ожидается, что настоящее изобретение вносит вклад в область создания клеточных лекарственных средств.
Кроме того, было доказано, что ганглиозид и растворимый в воде экстракт растительного происхождения, такой как фракция водной фазы растительного происхождения, экстрагированная методом Folch, или ее очищенный продукт, служат в качестве лекарственного средства для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
Краткое описание чертежей
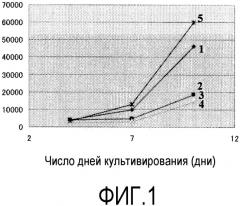
На фиг.1 показаны кривые роста стволовых клеток, индуцированных из моноцитов, культивированием в средах 1-5.
На фиг.2 показаны результаты генной экспрессии с использованием RT-PCR (полимеразной цепной реакции с обратной транскрипцией).
На фиг.3 представлены эффекты дедифференциации в стволовые клетки добавлением ганглиозидов.
Фиг.4 иллюстрирует формы клеток после добавления ганглиозидов.
На фиг.5 показана индуцирующая дедифференциацию активность каждой экстрагированной из растения фракции.
На фиг.6 показаны результаты активности фракций полученного из экстракта плодоножки сладкого картофеля индуцирующего дедифференциацию компонента, полученного хроматографией.
На фиг.7 представлены изображения окрашенных антиколлагеновых антител в мышиной печеночной ткани.
Наилучший способ осуществления изобретения
В настоящем изобретении используются моноциты, такие как моноциты периферической крови, в качестве клеток, подвергаемых дедифференциации.
В настоящем изобретении используются моноциты млекопитающего, полученные у людей, лошадей, коров, обезьян, таких как шимпанзе, свиней, овец, кроликов, мышей, крыс, собак, кошек и подобных млекопитающих. Среди них предпочтительны люди, обезьяны, включая шимпанзе, и тому подобные приматы. Особенно предпочтительны моноциты человека. Моноциты получают из костного мозга или крови. Предпочтительно использование моноцитов, полученных из крови, в частности, моноцитов, полученных из периферической крови.
Способ выделения моноцитов из образца крови или тому подобного материала хорошо известен. Например, существует способ, предусматривающий сначала выделение мононуклеарных клеток из крови с использованием раствора для сепарации клеток крови «LymphoprepTM» (Cosmo Bio Co. Ltd.), а затем обработку полученных мононуклеарных клеток покрытыми антителами магнитными шариками (Miltenyi Biotec), способными распознавать поверхностный антиген CD14, посредством этого отделяя моноциты-мишени. Мононуклеарные клетки могут также непосредственно использоваться в качестве источника для получения моноцитов по настоящему изобретению.
Моноциты человека могут быть выбраны из продуктов, которые являются коммерчески доступными, таких как PT038 (Lonza).
В соответствии с настоящим изобретением, осуществляется дедифференциация моноцитов в стволовые клетки, и полученные клетки пролиферируют перед введением испытуемому индивиду, такому как человек. В этом случае, моноциты получают у пациента, и поэтому необходимо получение как можно большего количества стволовых клеток из минимального количества моноцитов. Настоящее изобретение имеет преимущество дедифференциации стволовых клеток из моноцитов с высокой эффективностью пролиферации, посредством чего продуцируется большое количество стволовых клеток из небольшого количества моноцитов.
Примеры моноцитов включают клетки типа моноцитов (моноциты, мононуклеарные клетки, монобласты), имеющие рецептор M-CSF (c-fms). Поскольку моноциты пролиферируют только если и моноциты, и мононуклеарные клетки используются в одно и то же время, настоящее изобретение относится к возможности использования мононуклеарных клеток в качестве дедифференцированных клеток, в дополнение к моноцитам.
В настоящем описании термин «стволовая клетка» обозначает клетку, экспрессирующую недифференцированный маркер и имеющую ауторепродуктивное свойство. Путем использования моноцитов может быть получено большое количество стволовых клеток по настоящему изобретению. Стволовые клетки по настоящему изобретению могут вызвать дифференциацию и, предпочтительно, имеют свойство плюрипотентной дифференциации. Стволовые клетки, полученные в настоящем изобретении, являются CD14- и CD45-положительными.
Стволовые клетки по настоящему изобретению характеризуются значительной экспрессией генов CXCR4; они также отличаются тем, что экспрессирован по меньшей мере один представитель, предпочтительно, по меньшей мере два представителя, предпочтительнее, по меньшей мере три представителя, еще предпочтительно, по меньшей мере четыре представителя, особенно предпочтительно, экспрессированы все представители Nanog, Nestin, c-Kit, CD9 и Oct3/4.
В предпочтительной форме стволовой клетки по настоящему изобретению, ген CXCR4 значительно сильнее экспрессирован, чем ген в стволовых клетках, полученных культивированием моноцитов в присутствии только M-CSF, и экспрессирован по меньшей мере один представитель, предпочтительно, по меньшей мере два представителя, предпочтительнее, по меньшей мере три представителя, еще предпочтительнее, по меньшей мере четыре представителя, особенно предпочтительно, экспрессированы все пять представителей из Nanog, Nestin, c-Kit, CD9 и Oct3/4.
Ниже представлены признаки стволовых клеток по настоящему изобретению в более предпочтительном варианте осуществления:
(i) ген CXCR4 значительно сильнее экспрессирован, чем в стволовых клетках, полученных культивированием моноцитов в присутствии только M-CSF;
(ii) экспрессирован c-Kit; и
(iii) экспрессирован по меньшей мере один недифференцированный маркер, выбранный из группы, состоящей из Nanog, Nestin, CD9 и Oct3/4.
Признак, который дифференцирует полученные из моноцитов стволовые клетки по настоящему изобретению от других дифференцированных стволовых клеток, представляет собой значительную экспрессию гена CXCR4, который участвует в хоминге клеток. В стволовых клетках по настоящему изобретению, гены CXCR4 значительно сильнее экспрессированы, чем гены CXCR4 в стволовых клетках, полученных культивацией моноцитов в присутствии только M-CSF. Например, в предпочтительном варианте осуществления стволовых клеток по настоящему изобретению, количество экспрессии гена CXCR4, анализируемое RT-PCR или тому подобным способом, более чем в 3 или 4 раза больше, чем количество экспрессии в результате культивации моноцитов в присутствии только M-CSF, или в присутствии M-CSF+IL-3, M-CSF+IL-6&LIF и т.д. Кроме того, в предпочтительном варианте осуществления стволовых клеток по настоящему изобретению, гены CXCR4 значительно сильнее экспрессированы, чем гены CXCR4 в мезенхимальных стволовых клетках, полученных из костного мозга; конкретнее, количество экспрессии гена CXCR4, анализируемое RT-PCR или тому подобным способом, более чем в 2 или 3 раза больше, чем экспрессия гена CXCR4 в костном мозге.
Моноциты, полученные из стволовых клеток по настоящему изобретению, как и другие дедифференцированные стволовые клетки, характеризуются экспрессией c-Kit, который представляет собой маркер стволовых клеток.
Известно, что SDF1, лиганд рецептора CXCR4, экспрессирован в тканях, которые повреждены в результате перелома костей и циркуляторных заболеваний, в поврежденных частях нервной ткани или тому подобных. Поэтому клетки обеспечивают еще лучший эффект хоминга клеток в отношении поврежденных областей, когда он служит в качестве клеточного лекарственного средства.
Стволовые клетки, полученные по настоящему изобретению, могут использоваться для лечения заболеваний путем введения/инъекции их в пораженные области. Перед инъекцией предпочтительно культивирование стволовых клеток в соответствующей культуральной среде для пролиферации клеток. Затем клетки непосредственно вводят/инъецируют в пораженные области. Стволовые клетки можно культивировать в общей среде для клеточной культуры; однако предпочтительно культивировать стволовые клетки в вызывающей дедифференциацию культуральной среде по настоящему изобретению.
В соответствии с одним вариантом осуществления настоящего изобретения, стволовые клетки по настоящему изобретению могут использоваться для лечения внешних травм, воспалительных заболеваний (панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита), повреждения костей или хрящей (перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита), сердечно-сосудистых заболеваний (например, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита и т.д.), неврологических расстройств (например, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейтцфельдта-Якоба, внешних повреждений или ишемии мозга или позвоночника и т.д.), заболеваний печени (цирроза печени, хронического гепатита), почечных заболеваний (хронической почечной недостаточности, гломерулонефрита, почечной ишемии и т.д.), диабета, атопического дерматита, GVHD или тому подобных.
Дедифференцированные стволовые клетки по настоящему изобретению были депонированы в Депозитарии Международной Патентной Организации Национального Института Передовой Науки и Технологии (Central 6, 1-1, Higashi 1-chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 30 сентября, 2009 г., под номером доступа ABP-11184.
Как указано выше, моноциты преобразуются в стволовые клетки при культивировании моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
В настоящем описании «растворимый в воде растительный экстракт» обозначает экстракт всего растения или части растения (например, листьев, стеблей/стволов/плодоножек, подземных стеблей, корневищ, клубней, вьющихся растений, корней, цветов, почек, лепестков, завязей, плодов, коробочек, капсул, семян, волокон, семяпочек и т.д.). Примеры экстрагентов включают воду, водный растворитель (например, водный спирт, такой как водный метанол, водный этанол или водный пропанол; водный THF (тетрагидрофуран); водный ацетон) и полярные растворители, такие как DMF (диметилформамид), DMSO (диметилсульфоксид) или диметилацетамид. «Растворимый в воде растительный экстракт» представляет собой вещество, экстрагированное из такого растворителя, т.е. воды, водного растворителя или полярного растворителя, способного растворять полярное вещество в большом количестве. Растворимый в воде растительный экстракт может быть получен следующим образом. Сначала растение экстрагируют с использованием хлорированных углеводородов, таких как хлороформ или метиленхлорид; спиртов, таких как метанол, этанол или пропанол; ароматических углеводородов, таких как бензол или толуол; сложных эфиров, таких как этилацетат; простых эфиров, таких как THF или простой диэтиловый эфир; кетоны, такие как ацетон и метилэтилкетон; алифатические или алициклические углеводороды, такие как гексан или циклогексан. Затем растительный экстракт обрабатывают водой или водным растворителем для получения мишеневого растворимого в воде вещества. Таким образом, растворимое в воде вещество, полученное с использованием воды, водного растворителя или полярного растворителя, может, если требуется, кроме того, быть обработано хлорированными углеводородами, такими как хлороформ или метиленхлорид; ароматическими углеводородами, такими как бензол или толуол; сложными эфирами, такими как этилацетат; простыми эфирами, такими как THF или простой диэтиловый эфир; алифатическими или алициклическими углеводородами, такими как гексан или циклогексан, с тем чтобы отмыть липофильный компонент. Растворимый в воде растительный экстракт представляет собой предпочтительно экстрагированную по Folch из растения фракцию водной фазы или ее очищенный продукт.
Экстракт по Folch обозначает фракцию, остающуюся в водной фазе, в результате процесса экстракции растения с использованием растворителя хлороформ:метанол=2:1 и промывания смешанного растворителя водой. Вместо хлороформа могут использоваться другие хлорированные углеводороды, такие как метиленхлорид, тетрахлорид углерода или 1,2-дихлорэтан. Вместо метанола могут использоваться низшие спирты, такие как этанол, н-пропанол, изопропанол или бутанол. Отношение хлорированного углеводорода к спирту не ограничивается соотношением 2:1. Может использоваться широкий диапазон соотношений. В настоящем описании смешанный растворитель из хлорированного углеводорода и спирта имеет свойство высокого растворения, посредством этого содействуя экстракции. Отношение хлорированного углеводорода к спирту, предпочтительно, устанавливается на величину, которая может обеспечить разделение на водную фазу и органическую фазу при добавлении воды, посредством этого экстрагируя активное вещество в водной фазе. Если фаза не делится добавлением воды, то добавляется органический растворитель для разделения растворителя на два слоя. В настоящем описании, водная фаза, полученная в результате разделения на два слоя добавлением воды, называется «фракций водной фазы, экстрагированной из растения по Folch». Фракция водной фазы, экстрагированная другим способом, также включена в диапазон «фракции водной фазы, экстрагированной из растения по Folch», пока она имеет такое же активное вещество.
Растворимый в воде растительный экстракт по настоящему изобретению содержит подобное гликолипиду вещество (содержащее один или оба из гликолипида и сахара) в качестве активного ингредиента. Поскольку такое подобное гликолипиду вещество имеет низкую растворимость в органическом растворителе, растворимый в воде растительный экстракт предпочтительно выделяют в виде фракции водной фазы. Кроме того, растворимый в воде растительный экстракт может далее быть очищен с использованием различных видов хроматографии, таких как ионообменная хроматография или аффинная хроматография. Очищенный продукт может также использоваться в качестве активного ингредиента.
Активный ингредиент в растворимом в воде растительном экстракте может состоять только из сахара или может содержать и сахар, и другие компоненты (липиды и т.д.). Примеры сахарных компонентов включают глюкозу, арабинозу, ксилозу, рибозу, рамнозу, фукозу, деоксирибозу, маннозу, фруктозу, галактозу, мальтозу, лактозу, целлобиозу, сахарозу, трегалозу, раффинозу, мелибиозу, мальтотриозу, мелезитозу, туранозу, глюкуроновую кислоту, галактуроновую кислоту, маннуроновую кислоту, идуроновую кислоту, глюкозамин, галактозамин, маннозамин, N-ацетилглюкозамин, N-ацетилгалактозамин, N-ацетилманнозамин, нейраминовую кислоту, N-ацетилнейраминовую кислоту и тому подобные. Эти компоненты могут быть сульфатированными. Предпочтительно, они могут присутствовать в форме олигосахаридов, полисахаридов, гликозидов или гликолипидов. Конкретные примеры полисахаридов включают гликозаминогликан, α-глюкан, β-глюкан, леван, фруктан, галактан, маннан, ксилан, арабинан, пектиновую кислоту, альгиновую кислоту, пектиновые вещества, гуаран, сульфатированный полисахарид, полисахарид, в котором один или более видов сахарных остатков связаны, полисахариды, образованные из структурных единиц одного или более членов указанных выше сахарных остатков, и полисахарид, в котором множественные сахарные остатки сложно связаны. Предпочтительно, растворимый в воде растительный экстракт обработан катионообменной смолой после экстрагирования. В одном из вариантов варианте осуществления, растворимый в воде растительный экстракт по настоящему изобретению, предпочтительно, содержит компонент, который адсорбирован на анионообменной смоле (компонент, имеющий анионную группу в воде) в качестве активного ингредиента. В другом варианте осуществления, растворимый в воде растительный экстракт по настоящему изобретению, предпочтительно, содержит компонент, который связывается с агарозой Con A (конкавалин A) в качестве активного ингредиента. В предпочтительном варианте осуществления настоящего изобретения растворимый в воде растительный экстракт адсорбирован на анионообменной смоле и содержит компонент, который связывается с агарозой конкавалина A в качестве активного ингредиента. В качестве активного ингредиента, связывающегося с агарозой конкавалина A, предпочтительны полисахариды или сахара (включая содержащие сахар комплексы, такие как гликолипиды), содержащие остаток глюкозы и/или маннозы, в частности, остаток маннозы. В предпочтительном варианте осуществления растворимый в воде растительный экстракт содержит компонент, имеющий остаток сахара и растворимый в холодной воде или горячей воде (экстрагируемый). Компонент, предпочтительно, представляет собой полисахарид или содержащий сахар комплекс, в котором нижний предел молекулярной массы составляет примерно 500, 1000, 2000, 3000, 4000 или 5000, и выше примерно 500000, 300000, 200000, 100000, 80000, 60000, 50000, 40000, 30000 или 20000.
Индукция до стволовых клеток может выполняться культивированием моноцитов в присутствии по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Поскольку M-CSF уже существует в живом организме (например, в организме человека), один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, может служить в качестве индуктора для вызова превращения из моноцитов в стволовые клетки. Стволовые клетки поступают в пораженную область и, посредством этого, служат в качестве терапевтического средства для лечения различных видов заболеваний. Терапевтическое средство, содержащее в качестве активного ингредиента по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, эффективно для лечения внешних травм, воспалительных заболеваний (панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита), повреждения костей или хрящей (перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита), сердечно-сосудистых заболеваний (например, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита и т.д.), неврологических расстройств (например, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейтцфельдта-Якоба, внешних повреждений или ишемии мозга или позвоночника и т.д.), заболеваний печени (цирроза печени, хронического гепатита), почечных заболеваний (хронической почечной недостаточности, гломерулонефрита, почечной ишемии и т.д.), диабета, атопического дерматита, GVHD или тому подобных.
Эффективная доза терапевтического средства, содержащего по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта в качестве активного ингредиента, зависит, например, от применения, возраста и пола пациента, тяжести заболевания или тому подобных состояний. Обычно, количество используемого активного ингредиента составляет для взрослого примерно от 0,0001 до 100 мг, предпочтительно, примерно от 0,001 до 10 мг, а предпочтительнее, примерно от 0,01 до 5 мг на 1 кг массы тела. Суточная доза терапевтического средства может делиться на 1-4 приема.
«Фракция водной фазы, экстрагированной из растения по Folch» включает широкий диапазон растительных экстрактов, полученных аналогичными способами. Кроме того, активный ингредиент растворимого в воде растительного экстракта, содержащего фракцию водной фазы, экстрагированной из растения по Folch, может комбинироваться с анионообменными смолами и агарозой конкавалина A; и его активность может увеличиваться пропусканием через катионообменную смолу.
При применении в качестве лекарственного препарата терапевтическое средство или фармацевтическая композиция по настоящему изобретению может формироваться в обычную лекарственную форму путем использования фармацевтического носителя вместе с активным ингредиентом, который содержит по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта и, если требуется, M-CSF. Терапевтический носитель выбирается в зависимости от желательной лекарственной формы, дозировки и способа введения. Примеры терапевтических носителей включают различные разбавители и эксципиенты, такие как наполнители, агенты для увеличения объема, связывающие агенты, смачивающие агенты, разрыхлители, поверхностно-активные вещества, смазывающие вещества и т.д.
Лекарственная форма по настоящему изобретению может быть выбрана из различных форм, в зависимости от цели лечения. Характерные примеры лекарственных форм включают таблетки, пилюли, порошки, жидкости, растворы, суспензии, эмульсии, гранулы, капсулы, суппозитории, инъекционные лекарственные формы (жидкости, суспензии и т.д.), мази и т.д. Лекарственное средство получают в виде соответствующей лекарственной формы обычным способом с использованием подходящего носителя. Таблетка может представлять собой таблетку, имеющую обычное покрытие, такую как таблетки с сахарным покрытием, таблетки, покрытые желатином, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, двухслойные таблетки или многослойные таблетки и т.д. Когда лекарственные средства по настоящему изобретению получают в виде инъекционных препаратов в форме жидкости, эмульсии или суспензии, то лекарственное средство предпочтительно стерилизуется и является, предпочтительно, изотоничным относительно крови. Поэтому, фармацевтическая композиция по настоящему изобретению может содержать соль, глюкозу или глицерин в количестве, достаточном для получения изотонического раствора. Фармацевтическая композиция по настоящему изобретению может также содержать обычный солюбилизирующий агент, буфер, смягчающий агент и т.д. Кроме того, фармацевтическая композиция по настоящему изобретению может также содержать красящий агент, консервант, ароматизатор, отдушку, подсластитель и т.д., или другие лекарственные средства. При введении и M-CSF, и по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, они могут вводиться одновременно или отдельно.
По меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, может приниматься внутрь в виде пищевого продукта, например напитков, батончиков (батончиков с пищевой добавкой) и т.д. Такая пищевая композиция может быть получена в соответствии с обычным способом с использованием других целесообразных общеизвестных пищевых материалов (сырьевых материалов), эксципиентов, разбавителей и т.д.
Дедифференцированные стволовые клетки могут быть получены путем индуцирования дедифференциации путем культивирования указанного выше клеточного материала в комбинации (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в течение заданного периода.
Существуют связанные с мембраной M-CSF, молекулярная масса которых составляет приблизительно 22000, и секреторные M-CSF, молекулярная масса которых составляет приблизительно 42000. С дисульфидной мостиковой связью их молекулярная масса становится приблизительно 45000 (димер M-CSF с молекулярной массой 22000) и приблизительно 85000 (димер M-CSF с молекулярной массо