Штамм микроводоросли haematococcus pluvialis - продуцент натурального астаксантина
Иллюстрации
Показать всеИзобретение относится к фотобиотехнологии. Штамм микроводорослей Haematococcus pluvialis ВМ1 депонирован в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) под регистрационным номером IPPAS Н-2018 и может быть использован для получения астаксантина. Изобретение позволяет повысить выход астаксантина. 5 ил.
Реферат
Область применения
Изобретение относится к фотобиотехнологии и представляет собой новый штамм микроводоросли Haematococcus pluvialis ВМ1, предназначенный для получения натурального астаксантина.
Уровень техники
Астаксантин - кетокаротиноид красного цвета, наиболее эффективный природный антиокислитель, оказывающий многогранное благотворное влияние на организм человека и животных. Астаксантин широко востребован как компонент косметических формул, лекарственных средств, пищевых и кормовых добавок (Guerin, М.; Huntley, М.; Olaizola, М. Haematococcus astaxanthin: applications for human health and nutrition. Trends Biotechnol. 2003, 21, pp.210-216.; Han, D.; Li, Y.; Hu, Q. Biology and commercial aspects of Haematococcus pluvialis. In Handbook of Microalgal Culture: Applied Phycology and Biotechnology, 2 ed.; Richmond, A.; Hu, Q., Eds. Blackwell: 2013; pp.388-405). В частности, красный цвет панцирей ракообразных и мяса лососевых рыб обусловлен присутствием астаксантина; при этом единственный источник астаксантина у животных - пища (Lorenz, R.T.; Cysewski, G.R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin. Trends Biotechnol. 2000, 18, 160-167). В настоящее время значительная доля астаксантина синтезируется химическим путем, но синтетический пигмент, в отличие от натурального, является рацематом с большим содержанием стереоизомеров, не обладающих биологической активностью.
Самый богатый источник натурального астаксантина - зеленая микроводоросль Haematococcus pluvialis Flotow (Chlorophyta), накапливающая до 3-5% от сухого веса при действии неблагоприятных условий окружающей среды (Lemoine, Y.; Schoefs, В. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress. Photosynth. Res. 2010, 106, 155-177). H. pluvialis выживает даже в небольших дождевых бассейнах с чрезвычайно изменчивыми условиями, включая температуру, доступность элементов минерального питания и освещенность (Droop, М. Carotenogenesis in Haematococcus pluvialis. Nature 1955, 175, 42), главным образом благодаря способности к образованию богатых астаксантином неподвижных коккоидных клеток, исключительно устойчивых к неблагоприятным условиям среды (Boussiba, S. Carotenogenesis in the green alga Haematococcus pluvialis: cellular physiology and stress response. Physiol. Plant. 2000,108, pp.111-117; Solovchenko, A. Pigment composition, optical properties, and resistance to photodamage of the microalga Haematococcus pluvialis cultivated under high light. Russ. J. Plant Physiol. 2011, 58, 9-17; Solovchenko, A. Physiology and adaptive significance of secondary carotenogenesis in green microalgae. Russ. J. Plant Physiol. 2013, 60, 1-13). Значительное накопление астаксантина в клетках Н. pluvialis сопровождается интенсивным биосинтезом нейтральных липидов, главным образом триацилглицеринов (Zhekisheva, М.; Zarka, A.; Khozin-Goldberg, I.; Cohen, Z.; Boussiba, S. Inhibition of astaxanthin synthesis under high irradiance does not abolish triacylglycerol accumulation in the green alga Haematococcus pluvialis (Chlorophyceae). J. Phycol. 2005, 41, 819-826), поскольку астаксантин откладывается в цитоплазматических липидных глобулах, состоящих, главным образом, из триацилглицеринов. Соответственно, Н pluvialis также может быть источником ценных жирных кислот (Zhekisheva, М.; Boussiba, S.; Khozin-Goldberg, I.; Zarka, A.; Cohen, Z. Accumulation of oleic acid in Haematococcus pluvialis (Chlorophyceae) under nitrogen starvation or high light is correlated with that of astaxanthin esters. J. Phycol. 2002, 38, 325-331).
Несмотря на высокую способность микроводорослей к накоплению астаксантина, пигмент из микроводорослей в настоящее время едва ли может конкурировать с синтетическим аналогом из-за высокой себестоимости и ограниченных мощностей для культивирования Н. pluvialis. Эффективная конкуренция с синтетическим пигментом требует, по крайней мере, двукратного увеличения содержания астаксантина в клетках известных штаммов микроводорослей (типичные значения в настоящее время - 3% от веса сухой биомассы) (Del Campo, J.; Garcia-Gonzàlez, M.; Guerrero, M. Outdoor cultivation of microalgae for carotenoid production: current state and perspectives. Appl. Microbiol. Biotechnol. 2007, 74, 1163-1174). Кроме того, массовое культивирование Н. pluvialis требует много дефицитной пресной воды, поэтому поиск штаммов Н. pluvialis, более толерантных к солености, очень важен для снижения себестоимость получения обогащенной астаксантином биомассы.
Известен штамм дрожжей Phaffia rhodozyma (патент RU 2385925 C1). Изобретение относится к микробиологической промышленности. Штамм дрожжей Phaffia rhodozyma, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов под номером ВКПМ Y-2982, является продуцентом астаксантина и может быть использован в медицине при лечении ряда заболеваний сердечно-сосудистой системы, онкологических заболеваниях и косметике. Данный штамм получен из коллекционного штамма Phaffia rhodozyma ВКПМ Y-989 путем обработки нитрозогуанидином (НГ) и последующей многоступенчатой селекции с отбором наиболее продуктивных по астаксантину мутантов. Полученный штамм способен продуцировать астаксантин в количестве 7,0-8,0 мг/г сухой биомассы в условиях оптимальной (60 лк) и слабой (5 лк) освещенности. В темноте штамм продуцирует астаксантин в количестве до 5,5 мг/г сухой биомассы. Доля астаксантина в общем пуле каротиноидов может составлять до 70%. Однако невысокая суточная продуктивность как по биомассе, так и по выходу полезного продукта, а также достаточно высокая стоимость среды для культивирования этих микроорганизмов создают высокую стоимость конечного продукта при использовании этого штамма в качестве продуцента астаксантина для биотехнологической промышленности.
Известен способ культивирования Haematococcus pluvialis для промышленного производства биомассы, обогащенной астаксантином (патент US 6022701 C16P). Способ заключается в культивировании микроводоросли при освещении с интенсивностью в диапазоне 30-140 мкЕ ФАР/(м2·с) и температуре 15-28°C с использованием в качестве среды на водопроводной воде и барботировании культуры газовоздушной смесью, содержащей 1,5% CO2. Однако этот способ не описывает конкретные штаммы микроводорослей и не предусматривает возможность использования солоноватых вод.
Также известен способ эффективного производства каротиноидов, включая астаксантин, путем получения мутантных штаммов Haematococcus pluvialis (патент EP 1995325 A1). Изобретение описывает способ получения мутантных штаммов с повышенной способностью к накоплению каротиноидов, с использованием известных культур Haematococcus pluvialis CCAP34/8 и SAG34-1b.
Наиболее близким аналогом предполагаемого изобретения (прототипом) является штамм одноклеточной зеленой водоросли Chlorella zofingiensis АТСС 30412 (патент US 7063957 B2), обладающий способностью к гетеротрофному росту в темноте. Данный способ заключается в культивировании в течение 4 дней на среде с добавлением 10 г/л глюкозы и освещением 90 мкЕ/(м2·с) культуры Chlorella zofingiensis АТСС 30412 для получения посевного материала. Затем культивирование проводят на среде с концентрацией глюкозы 50 г/л при температуре 30°C и постоянном качаниИ (130 об/мин) в темноте в течение 2-х недель. В результате получают суспензию, содержащую до 10,3 мг/л. Данный способ предполагается использовать для коммерческого производства астаксантина с помощью промышленных ферментеров. К недостаткам прототипа относится высокая стоимость используемой среды, культивирование при температуре 30°C и качании 130 об/мин. Кроме этого высокое накопление астаксантина до 10,3 мг/л достигается лишь после 2-х недель культивирования. К недостаткам прототипа также относится низкая толерантность Chlorella zofingiensis АТСС 30412 к солености, что требует использования пресной воды и существенно увеличивает себестоимость при промышленном получении астаксантина из микроводорослей.
Раскрытие изобретения
Задача изобретения - получение штамма микроводоросли с высоким уровнем накопления астаксантина, высокой продуктивностью культуры и толерантностью к солености среды.
Эта задача была решена получением штамма микроводоросли Haematococcus pluvialis ВМ1, выделенного авторами из солоноватых супралиторальных ванн береговых скал острова Костьян Ругозергской губы Кандалакшского залива Белого моря, депонированного в Российскую Коллекцию Микроводорослей при учреждении Российской Академии Наук Институте Физиологии Растений им. К.А. Тимирязева (IPPAS) с присвоенным идентификатором IPPAS Н-2018.
Новизной настоящего изобретения является то, что впервые был получен штамм микроводоросли, способный к высокому уровню накопления астаксантина и обеспечивающий высокую продуктивность при выращивании на среде с содержанием хлорида натрия на уровне солоноватых вод.
Сущность изобретения заключается в том, что для достижения цели используют зеленую микроводоросль Haematococcus pluvialis штамм ВМ1, выделенный и идентифицированный авторами заявки, частичная последовательность гена 18S рибосомной РНК которого зарегистрирована в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) под номером ID JQ867352. В результате полученный штамм характеризуется способностью расти на средах, содержащих до 27‰ хлорида натрия, высокой способностью к накоплению астаксантина - до 3-6% сухой биомассы и обладает высокой продуктивностью культуры (до 300 мг сухой биомассы в сутки с 1 л культуры).
Для культивирования используют питательную среду BG-11 с содержанием хлорида натрия от 0 до 27‰. Инокулят вносят в среду до конечной концентрации хлорофилла 5-7 мкг/мл, культивирование проводят в фотобиореакторе при постоянном освещении с интенсивностью 40-60 мкЕ ФАР/(м2·с) с помощью светодиодов, при температуре 25-27°C и барботировании среды газовоздушной смесью с содержанием CO2 1-2% со скоростью 0,2-0,4 л/мин. Значение pH среды в начале культивирования 7.3-7.5, в конце культивирования 7.5-8.0. После этого отделяют биомассу от среды центрифугированием. В результате получают в сутки 100-300 мг/л биомассы (по сухому весу), содержащей 3-5% астаксантина и 20-40% липидов; содержание астаксантина - 95% от общих каротиноидов в гематоцистах. Потенциальная устойчивость к солености среды для культуры Н. pluvialis ВМ1 позволяет вести культивирование на средах с содержанием хлорида натрия до 27‰.
Краткое описание чертежей
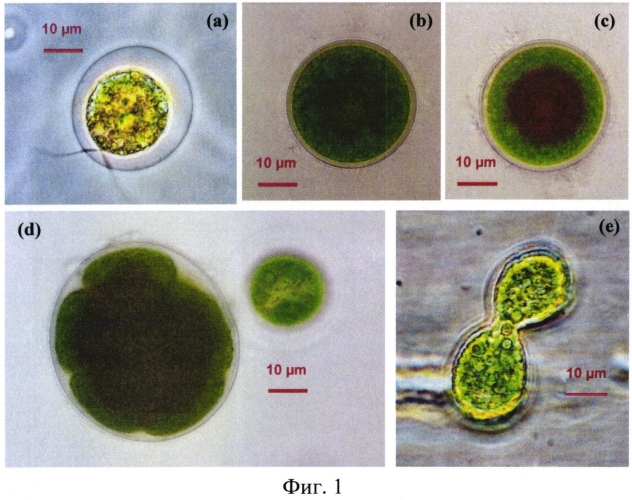
На Фиг. 1 представлен жизненный цикл Н. pluvialis ВМ1. Обозначения (а) - зооспоры; (b) - коккоидная клетка; (с) - коккоидная клетка с липидными включениями; (d) - половой процесс; (е) - спорангий.
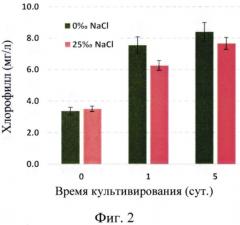
На Фиг. 2 показан рост культуры Н pluvialis ВМ1 на среде BG-11 с различным содержанием NaCl.
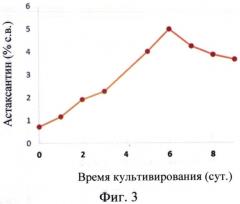
На Фиг. 3 показано накопление астаксантина в биомассе культуры Н. pluvialis ВМ1.
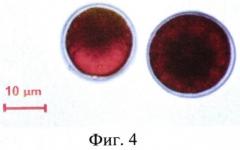
На Фиг. 4 представлена микрофотография гематоцист Н. pluvialis ВМ1 с высоким содержанием астаксантина.
На Фиг. 5 приводится частичная последовательность нуклеотидов гена 18S рРНК микроводоросли Н pluvialis ВМ1.
Осуществление изобретения
Штамм Haematococcus pluvialis ВМ1 выделен из опресненных ванн острова Костьян Ругозергской губы Кандалакшского залива Белого моря. Отселектирован в результате скрининга по толерантности к солености среды и уровню накопления астаксантина.
Способ выделения - интенсивное культивирование на среде BG-11.
Морфологические признаки
Клетки округлой формы, размером от 5 до 20 мкм. Пиреноид присутствует (несколько), размер 1-1,5 мкм, хроматофор многолопастной, окраска зеленая, жгутик присутствует у монадных клеток и гамет (Фиг. 1).
Физиологические свойства штамма
Оптимальные условия культивирования
Для культивирования используют жидкую питательную среду BG-11 следующего состава:
K2HPO4 - 0,04 г/л,
NaNO3 - 1,5 г/л,
MgSO4·7H2O - 0,075 г/л,
СаС12·2H2O - 0,037 г/л,
лимонная кислота - 0,006 г/л,
FeSO4·7H2O - 0,006 г/л,
Na2CO3 - 0,2 г/л,
ЭДТА - 0,001 г/л,
раствор FeSO4·7H2O (7,45 г/л) + ЭДТА (5,57 г/л) - 1 мл/л,
раствор микроэлементов (Н3BO3 - 2,86 г/л, MnCl2·4H2O - 1,86 г/л, ZnSO4·7H2O - 0,22 г/л, CuSO4·5H2O - 0,08 г/л, Na2MoO4·7H2O - 0,39 г/л, Co(NO3)2·6H2O - 0,05 г/л) - 1 мл/л,
pH - 7,0-7,2,
содержание CO2 в ГВС - 1-3%,
скорость барботажа 0,2-0,4 л/мин,
температура 25-27°C,
освещение круглосуточное,
освещенность: двухсторонняя, 40-60 мкмоль квантов ФАР на м2 в сек),
тип ламп: белые светодиодные.
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, мг/мл в сутки): 50-100;
выход полезного продукта (астаксантин) 0,03-0,06 мг/сутки на мг биомассы.
Для данной культуры отсутствует сезонность, отмечается толерантность к солености до 25-27‰, не выявлен автолиз, характерна сильная агглютинация при культивировании в шейкере.
Характеристика роста культуры при повышенной солености среды
Хорошо растет при повышенной солености среды (содержание NaCl до 25-27‰). При этом содержание хлорофилла достигает 70-80 мг/л (Фиг.2 ).
Отмечается высокое содержание астаксантина, составляющего до 95% от общих каротиноидов в гематоцистах (Фиг. 4).
Биотехнологическая характеристика штамма
Штамм Haematococcus pluvialis ВМ1 обладает следующими ценными биотехнологическими характеристиками: интенсивный рост при повышенной солености среды (до 25-27‰; Фиг. 2); биомассой, обогащенной каротиноидами с высокой долей содержания астаксантина (до 95%), накопление астаксантина в культуре составляет 3-6% от сухого веса биомассы микроводоросли (Фиг. 3).
Генотипирование
Выделение ДНК.
Для выделения ДНК отбирали 5-10 мг биомассы культуры микроводоросли. Выделение ДНК проводили методом фенол-хлороформной экстракции. Перед выделением проводили трехкратное замораживание образцов при -4°C с последующим оттаиванием. Это было необходимо для разрушения прочных клеточных стенок водорослей. Образцы инкубировали в течение часа в 300 мкл ТЕ буфера (10 mM Tris-Cl(pH 7.5), 1 mM EDTA), содержащего 10 мг/мл лизоцима при 37°C. Затем добавляли 2% додецилсульфата натрия и инкубировали в течение часа при 40°C и интенсивном перемешивании. Далее добавляли 1 М NaCl и оставляли на ночь на льду для высаливания белков. После чего проводили процедуру фенол-хлороформной экстракции. Чистоту образцов ДНК оценивали методом электрофореза в 1,5% агарозном геле. Полученные образцы ДНК хранили в ТЕ-буфере при -4°C.
Множественное выравнивание
Проведено множественное выравнивание известных нуклеотидных последовательностей Haematococcus для участка генов 18S рибосомальной РНК, включающих в себя последовательности ITS1, ITS2, с использованием программы ClustalW2.
Проведена ПЦР амплификация соответствующих участков геномной ДНК исследуемых изолятов. Продукты ПЦР очищены с использованием набора для очистки Cleanup Standard (Евроген, Россия) и отсеквенированы с использованием автоматического секвенатора ABI Prism. Для культуры получена последовательность нуклеотидов указанного участка как смысловой (Фиг. 5), так и антисмысловой цепи ДНК.
При помощи программы BLAST в базе данных GenBank был проведен поиск ближайших гомологов исследуемых последовательностей. Наибольшее сходство наблюдалось с последовательностями генов 18S pPHK водорослей из родов Haematococcus. При помощи полученного множественного выравнивания в программе ClustalW2 было построено филогенетическое дерево.
Филогенетический анализ
В результате анализа, полученного в работе множественного выравнивания, имеющуюся последовательность можно отнести к роду Haematococcus.
В результате проведенного филогенетического анализа установлена видовая принадлежность исследуемого изолята. Изолят идентифицирован как Haematococcus pluvialis и получил идентификатор ВМ1; после депонирования в Коллекции культур микроводорослей Института физиологии растений им К.А. Тимирязева РАН (IPPAS) ему присвоен идентификатор IPPAS Н-2018.
Полученный сиквенс зарегистрирован в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) под номером JQ867352.
Следующие материалы иллюстрируют достижение цели.
Штамм Haematococcus pluvialis ВМ1 демонстрирует интенсивный рост культуры при повышенной солености среды до 25-27‰, что не встречается у известных аналогов. Накопление астаксантина в культуре составляет 3-6% от сухого веса биомассы микроводоросли, то есть выход полезного продукта составляет 30-60 мг на г биомассы в сутки при накоплении биомассы 100-300 мг/л в сутки, что в несколько раз превышает продуктивность прототипа.
Штамм микроводросли Haematococcus pluvialis ВМ1 успешно прошел предварительное тестирование и этап пробного культивирования в экспериментальных и полупромышленных фотобиореакторах объемом до 50 л. Таким образом, можно считать степень готовности штамма к масштабированию культуры для промышленного применения высокой.
В результате получен штамм микроводоросли Haematococcus pluvialis ВМ1, депонированный в Коллекции культур микроводорослей Института физиологии растений им К.А. Тимирязева РАН (IPPAS) под регистрационным номером IPPAS Н-2018, который обладает более высокой толерантностью к солености, а также более высокой способностью к накоплению астаксантина по сравнению с известными аналогами.
Штамм микроводоросли Haematococcus pluvialis, депонированный в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS Н-2018- продуцент натурального астаксантина.