Применение просоматостатина в диагностике
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа диагностики и мониторинга у пациентов нарушений активности и/или функции желудочно-кишечного тракта, за исключением соматостатиномы, где указанный способ включает стадии взятия образца физиологической жидкости у пациента, определения уровня просоматостатина 1-64 или его фрагментов в указанном образце, определения корреляции уровня просоматостатина 1-64 или его фрагментов с диагнозом у указанного пациента нарушений активности и/или функции желудочно-кишечного тракта, за исключением соматостатиномы. Группа изобретений также касается набора для определения уровня просоматостатина 1-64 или его фрагментов, содержащего по меньшей мере два антитела. Группа изобретений обеспечивает диагностику и мониторинг нарушений активности и/или функции желудочно-кишечного тракта, выбранных из группы, состоящей из болезни Крона, панкреатита, дивертикулита, карциномы поджелудочной железы, неокарциномы поджелудочной железы, карциномы пищевода, карциномы желудка, карциномы ободочной кишки и неокарциномы ободочной кишки. 2 н. и 8 з.п. ф-лы, 9 ил., 1 табл., 1 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к детектированию просоматостатина 1-64 и его фрагментов в биологических образцах и к применению детектирования просоматостатина 1-64 и его фрагментов для диагностики, прогноза, мониторинга и оценки риска развития у пациентов нарушения активности желудочно-кишечного тракта и/или его функции, и/или нарушения режима питания, за исключением соматостатиномы.
Предшествующий уровень техники
Соматостатин (SST, также обозначаемый SRIF) был впервые описан как продукт, который секретируется гипоталамусом и действует как сильный ингибитор секреции человеческого гормона роста (hGH) (Siler et al. 7973. J. Clin Endocrinol Metab 37:632-634). Позднее было обнаружено, что соматостатин синтезируется в ряде тканей, например, в центральной и периферической нервной системе, в поджелудочной железе и в желудочно-кишечном тракте и, в меньших количествах, в щитовидной железе, почках, мозговом веществе надпочечника, подчелюстной железе, предстательной железе и в плаценте.
Зрелый человеческий соматостатин образуется из более крупной молекулы-предшественника (просоматостатина 1-116 (препро-SST 1-116; SEQ ID NO:1) и просоматостатина 1-92 (про-SST 1-92; SEQ ID NO:2)). Его последовательность кодируется хромосомой 3. После отщепления сигнальной последовательности (длиной в 24 аминокислоты), прогормон про-SST 1-92 затем процессируется в биологически активные пептиды соматостатина-28 (SST-28; длиной в 28 аминокислот; про-SST 65-92) или соматостатина-14 (SST-14; длиной в 14 аминокислот; про-SST 79-92). Фрагмент SST-28 (1-12) происходит от SST-28 (Benoit et al., 1990. Metabolism 39:22-25). Кроме того, был идентифицирован просоматостатин 1-76, пептид, содержащий SST-28 (1-12) у свого C-конца (Benoit et al. 1990. Metabolism 39:22-25).
Зрелый соматостатин, а именно, SST-14 и SST-28, имеет очень непродолжительное время полужизни в плазме, приблизительно 1-3 минуты (Sheppard et al. 7979. J. Clin Endocrinol Metab 48:50-53; Hildebrand et al. 1994. Eur J Clin Invest 24:50-56). Из-за его нестабильности, точное измерение уровня SST-14 и SST-28 в кровотоке представляет значительные трудности.
Концентрация соматостатина в сыворотке повышается после приема пищи (Penman et al. 1981. Gastroenterology 81:692-699; Polonsky et al. 1983. J. Clin Invest 71: 1514-1518). Ensinck и сотрудники показали, что уровень SST-28, но не SST-14, повышается после приема смешанной пищи, а также после употребления белков и жиров, а поэтому было высказано предположение, что жир является его главным стимулятором (Ensinck et al. 1990. Gastroenterology 98:633-638; Ensinck et al. 1989. J. Clin Invest 83: 1580-1589). В противоположность этому, концентрация SST-14 и SST-28 не изменяется после приема углеродов (Ensinck et al. 1990. Gastroenterology 98:633-638). Это различие в высвобождении SST-14 и SST-28, стимулируемом смешанной пищей и чистой глюкозой, может быть вызвано селективой стимуляцией клеток желудка, поджелудочной железы и D-клеток кишечника, поскольку SST-28 является главным продуктом слизистой кишечника, тогда как SST-14 преобладает в поджелудочной железе (Baldissera et al. 1985. Biochem Biophys Acta 838:132-143).
Соматостатин регулирует перистальтику желудочно-кишечного тракта посредством ингибирования опорожнения кишечника, ингибирует сокращение желчного пузыря и обладает функцией нейромедиатора в центральной нервной системе. Соматостатин участвует в ингибировании инсулина, глюкагона, гастрина, грелина (Norrelund et al. 2002. Clin Endocrinol (Oxf.) 57: 539-546), секретина, холецистокинина, вазоактивного пептида тонкого кишечника (VIP), норэпинефрина, TRH (TSH-рилизинг гормона), TSH, ACTH и CRH (кортикотропин-рилизинг гормона), желудочного сока и пепсина.
Было показано, что N-концевой фрагмент про-SST (просоматостатина 1-64, NT-про-SST) присутствует в крысиных (Aron et al. 1984. Biochem Biophys Res. Comm. 124:450-456; Aron et al. 1986. Endocrinology 118:218-222) и в человеческих (Aron et al. 1986. J Clin Endocrinol Metab 62:1237-1242) клетках карциномы мозгового вещества щитовидной железы. Кроме того, про-SST 1-64 был идентифицирован в поджелудочной железе, в слизистой кишечника и в плазме свиней (Bersani et al. 1989. J. Biol Chem 264:10633-10636; Hoist et al. 1988. Pancreas 3:653-661; Skak-Nielsen et al. 1987. Regul Pept 19:183-195). Rabbani с сотрудниками был идентифицирован крысиный про-SST 1-64 как продукт секреции в крови воротной вены и в среде культивированных клеток опухоли панкреатических островков (Rabbani and Patel 1990. Endocrinology 126:2054-2061). В плазме пациентов с соматостатиномой был обнаружен про-SST 1-64 в высокой концентрации, а поэтому, как обсуждалось, эта молекула является возможным маркером для диагностики соматостатиномы (Hoist et al. 1991. The endocrine pancreas. New York: Raven Press, page 125-152). Соматостатинома представляет собой злокачественную опухоль поджелудочной железы или двенадцатиперстной кишки, продуцирующей соматостатин.
Иммуногистохимический анализ крыс, проводимый с использованием хорошо охарактеризованной антисыворотки против синтетического пептида, аминокислоты которого идентичны аминокислотным остаткам 20-36 молекулы про-SST, выявил присутствие иммунореактивных нервных волокон и нервных окончаний в конкретных участках головного мозга крыс (Mikkelsen et al. 1991. Neuroendocrinology 54:469-476). Экстракты заднего гипофиза здоровых крыс, подвергнутые эксклюзионной хроматографии и ОФ-ВЭЖХ-анализу, обнаруживали присутствие одной иммунореактивной молекулы про-SST, соответствующей размеру про-SST 1-64. Авторами изобретения было установлено, что расположение этой молекулы в системе гипоталамуса-гипофиза дает основание предположить, что указанный конечный продукт процессинга про-SST высвобождается в воротную вену и, вероятно, также участвует в общей системе кровообращения. Функция про-SST 1-64 пока неизвестна. Были также идентифицированы фрагменты про-SST 1-64, а именно: про-SST 1-10 (называемый антрином) (Benoit et al. 1987. Science 238:1126-1129) и про-SST 1-32, присутствующие в кишечнике крыс (Schmidt et al. 1985. FEBS Lett 192:141-146), а также в экстрактах слизистой желудочно-кишечного тракта и в плазме крыс (Ravazzola et al. 1989. J. Clin Invest 83:362-366). Кроме того, собщалось о присутствии N-концевого про-SST 1-63 в человеческой опухоли поджелудочной железы (Conlon et al. 1987. Biochem J 248:123-127). Кроме того, было показано, что пептидный 7 кДа-фрагмент N-концевой части молекулы про-SST, предположительно, эквивалентный молекулам про-SST 1-63 или про-SST 1-64, присутствует в выскоих концентрациях в нервной системе крыс (Patel et al. 1988. J Biol Chem 263:745-751; Rabbani and Patel 1990. Endocrinology 126:2054-2061), а иммуногистохимический анализ, проведенный Lechan et al. (Lechan et al. 1983. Proc Natl Acad Sci USA 80: 2780-2784), выявил присутствие про-SST 43-57-иммунореактивных нейронов в головном мозге крыс, гле указанные нейроны могут содержать тот же самый фрагмент Pro-SST. Кроме того, Odum и Johnston описали человеческий просоматостатиновый фрагмент 29-92 в семенной жидкости, содержащий полноразмерный зрелый SST у своего C-конца (Odum and lohnston 1994. Biochem J 303(Pt1): 263-268).
Радиоиммуноанализ для определения иммунореактивности про-SST 20-36 был описан Bersani et al. (Bersani et al. 1989. J Biol Chem 264:10633-10636). С помощью антисыворотки, используемой в этом анализе, про-SST 1-64 был выделен из слизистой поджелудочной железы и кишечника. Aron и сотрудниками был синтезирован тетрадекапептид, содержащий первые 13 аминокислот крысиного про-SST, для разработки радиоиммуноанализа в целях определения амино-концевой части просоматостатина (Aron et al. 1984. Biochem Biophys Res Comm 124:450-456).
У индивидуумов с заболеваниями желудочно-кишечного тракта были определены уровни зрелого соматостатина в плазме, и были получены противоречивые результаты, что, по всей вероятности, обусловлено недостаточной эффективностью методов детектирования вследствие нестабильности зрелого соматостатина, как было описано выше. Хотя эти результаты фактически не могут быть оценены, однако, авторами изобретения были систематизированы данные, описанные в литературе. У пациентов с запором, сопровождающимся замедленной проходимостью кишечника, базальная концентрация SST не изменялась, а увеличение уровня SST в плазме после приема пищи продолжалось в течение длительного периода времени (Peracchi et al. 1999. Scand J Gastroenterol 34:25-28). У пациентов с воспалительными заболеваниями кишечника (включая болезнь Крона и язвенный колит) наблюдалось снижение уровней SST в ткани слизистой кишечника, что коррелировало с гистологической оценкой степени воспаления (Yamamoto et al. 1996. J Gastroenterol 31:525-532). Снижение уровня продуцирования SST наблюдалось в клеточных культурах слизистой оболочки ободочной кишки, полученных от пациентов с острым язвенным колитом, а продуцирование соматостатина в слизистой ободочной кишки у пациентов с язвенным колитом в состоянии ремиссии не имело значимых отклонений от контроля (Eliakim et al. 1991. Gastroenterology 100:А578). Однако, поскольку эти изменения в продуцировании SST наблюдались в слизистой ободочной кишки, то сделать какие-либо выводы о влиянии таких изменений на концентрации SST в кровотоке не представлялось возможным. В противоположность этому, было обнаружено, что у пациентов с язвенным колитом в острой фазе, циркадная ритмичность (24 часа) уровней зрелого соматостатина в плазме имела амплитуду более 24 часов, более высокий средний уровень и более длительную фазу с максимальными уровнями по сравнению с уровнями, наблюдаемыми у здоровых индивидуумов (Payer et al. 1994. Hepatogastro-enterology 41:552-553). Число SST-содержащих эндокринных клеток слизистой и подслизистой значительно снижалось у пациентов с болезнью Крона и язвенным колитом по сравнению со здоровым контролем, и при этом, также значительно снижалась степень воспаления (Watanabe et al. 1992. Dis Colon Rectum 35:488-494). Koch и сотрудниками было продемонстрировано снижение уровней SST в слизистой нисходящей ободочной кишки у пациентов с болезнью Крона и язвенным колитом (Koch et al. 1988. Dis Colon Rectum 31:198-203). Однако ни Watanabe и сотрудники, ни Koch и сотрудники не проводили исследования уровней соматостатина в плазме. У пациентов с хроническим панкреатитом, каких-либо различий в уровнях SST в плазме не наблюдалось (El-Eryani et al. 2000. Hepatogastroenterology 47:869-874), а у пациентов с острым панкреатитом наблюдалось увеличение концентраций SST (Aleryani et al. 1997. Vnitr Lek 43:733-737). Milutinovic и сотрудниками было продемонстрировано, что концентрации SST в плазме у пациентов, страдающих гастритом и инфицированных бактерией Helicobacter pylori, снижались, а в случае успешной терапии, у этих пациентов наблюдалось увеличение концентрации SST (Milutinovic et al. 2003. European J Gastroenterol Hepatol 15:755-766). Значимые различия в уровнях соматостатина за 24-часовой период наблюдалось у пациентов с язвой желудка и с атипическим гастритом, причем, у пациентов с атипическим состоянием, эти различия были более существенными (Payer et al. 1995. Vntr Lek 41:367-370). У пациентов, страдающих полипами толстой кишки, были проведены исследования циркадного ритма уровней соматостатина в плазме, и эти исследования показали значимые различия (например, с амплитудой более 24 часов) (Payer et al. 1995. Hepatogastroenterology 42:775-777).
Уровни соматостатина также измеряли у пациентов, страдающих раком, но и в этом случае были получены противоречивые результаты. Waisberg и сотрудниками была описана нейроэндокринная карцинома желудка (в высокой степени злокачественная опухоль, но редкого типа), в которой обнаруживалась экспрессия SST (Waisberg et al. 2006. World J. Gastroenterol 12:3944-3947). Кроме того, в литературе имеются сообщения о SST-продуцирующих опухолях клеток панкреатических островков (опухолях поджелудочной железы), где наблюдались повышенные концентрации SST в плазме (Karasawa et al. 2001. Intern. Med. 40:324-330; Howard et al. 1989. Surgery 105:227-229: Patel et al. 1983. J. Clin. Endocrinol. Med. 57:1048-1053: Permert et al. 1997, Pancreas 15:60-68). Как обсуждалось в литературе, SST представляет собой маркер в плазме, который используется для диагностики карциномы мозгового вещества щитовидной железы, и в данном случае были также получены противоречивые результаты, указывающие на увеличение уровней SST (Roos et al. 1981. J. Clin. Endocrinol Med 52:187-194: Saito and Saito 1982. Horm Metab Res 7: 77-76; Pacini et al. 1989. Cancer 63:1189-1195), на отсутствие каких-либо различий (Neradilova et al. 1989. Oncology 46:378-380) или на небольшое, но незначимое снижение (Grauer et al. 1995. Thyroid 5:287-291). Wood и сотрудники сообщали об увеличении уровней SST у некоторых пациентов с карциномой бронхов, но при этом, в плазме этих пациентов, какой-либо концентрации SST не обнаруживалось (Wood et al. 1982. J Clin Endocrin Metab 53:1310-1312). У пациентов с мелкоклеточной карциномой легких, уровни SST были слегка повышенными (Noseda et al. 1987. Thorax 42:784-789). El-Salhy и сотрудниками было продемонстрировано, что у пациентов, страдающих карциномой ободочной кишки, число клеток, продуцирующих SST в тканях ободочной кишки, снижалось (El-Salhy et al. 1998. Eur J Gastroenterol Hepatol 10:517-522). Уровни SST в плазме за период в 24 часа у пациентов, страдающих раком толстой кишки, сравнивали с уровнями SST у здоровых индивидуумов и пациентов, страдающих другими заболеваниями толстой кишки (язвенным колитом, полипами толстой кишки), и было обнаружено, что у пациентов всех этих групп отсутствовало какое-либо значимое различие в уровнях секреции SST за 24 часа (Payer et al. 1997. Hepatogastroenterology 44:72-77). Holst и сотрудниками были обнаружены высокие концентрации про-SST 1-64 в плазме пациентов, страдающих соматостатиномой, и было высказано предположение, что эта молекула может быть подходящим маркером для диагностики соматостатиномы (Holst et al. 1991. The endocrine pancreas. New York: Raven Press, page 125-152). Хотя у этих пациентов наблюдались высокие концентрации про-SST 1-64, однако, было показано, что концентрация зрелого SST-14 повышалась лишь незначительно, что, по всей вероятности, обусловлено крайне непродолжительным временем полужизни SST-14. Эти результаты со всей очевидностью продемонстрировали, что осуществление точных измерений уровней зрелого SST представляет серьезные трудности, и концентрации соматостатина, представленные в литературе, должны быть подвергнуты тщательной оценке.
Циркадный ритм был также описан для зрелого соматостатина (Payer et al. 1997. Hepatogastroenterology 44:72-77: Strazzulla et al. 1990. Chronobioloeia 17:219-225; Paver et al. 1994. Hepatogastroenterology 41:552-553).
В литературе были описаны аутоантитела против соматостатина и соматостатин-секретирующих клеток у пациентов с диабетом и у пациентов, страдающих заболеваниями желудочно-кишечного тракта (Bottazzo et al. 1976. Lancet 2:873-876; Jones et al. 1983. Gut 24:427-432).
В WO 00/22439 A2 описан просоматостатин, используемый для диагностики сепсиса и других инфекционных заболеваний.
Описание сущности изобретения
Главным объектом изобретения является способ диагностики, прогноза, мониторинга и оценки риска развития у пациентов нарушения активности и/или функции желудочно-кишечного тракта, и/или нарушения режима питания, за исключением соматостатиномы, где указанный способ включает стадии:
(i) взятия образца физиологической жидкости у пациента;
(ii) определения уровня просоматостатина 1-64 (SEQ ID NO: 6) или его фрагментов в указанном образце;
(iii) определения корреляции уровня просоматостатина 1-64 (SEQ ID NO: 6) или его фрагментов с диагнозом, прогнозом, мониторингом и оценкой риска развития у указанного пациента нарушения активности и/или функции желудочно-кишечного тракта и/или нарушения режима питания, за исключением соматостатиномы,
где указанные фрагменты имеют длину по меньшей мере в 6 аминокислотных остатков.
Варианты предпочтительных способов описаны в зависимых пунктах формулы изобретения. Настоящее изобретение также относится к антителу по п.16 и к набору, содержащему по меньшей мере два антитела по п.17.
Описание графического материала
Настоящее изобретение более подробно описано ниже со ссылками на описание графического материала, где:
Фиг. 1: корреляция между комбинациями поликлональных антител А и В.
Фиг. 2: корреляция между комбинациями поликлональных антител А и С.
Фиг. 3: корреляция между комбинациями поликлональных антител В и С.
Фиг. 4: кривая зависимости «доза-ответ», построенная по данным иммуноанализа с использованием моноклональных антител.
Фиг. 5: Ex vivo стабильность аналита про-SST.
Фиг. 6: нормальное распределение про-SST, n = 201, в пробах EDTA-плазмы, взятых у здоровых индивидуумов натощак.
Фиг. 7: корреляция между уровнями про-SST и индексом массы тела (BMI).
Фиг. 8: влияние приема пищи (смешанной пищи) на уровни про-SST.
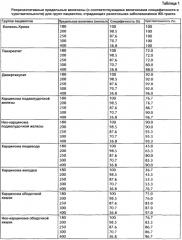
Фиг. 9: концентрации про-SST у пациентов с нарушением активности и/или функции желудочно-кишечного тракта и/или с нарушениями режима питания.
Подробное описание изобретения
Главным объектом изобретения является способ диагностики, прогноза, мониторинга и оценки риска развития у пациентов нарушения активности и/или функции желудочно-кишечного тракта, и/или нарушения режима питания, за исключением соматостатиномы, где указанный способ включает стадии:
(i) взятия образца физиологической жидкости у пациента;
(ii) определения уровня просоматостатина 1-64 (SEQ ID NO: 6) или его фрагментов в указанном образце;
(iii) определения корреляции уровня просоматостатина 1-64 (SEQ ID NO: 6) или его фрагментов с диагнозом, прогнозом, мониторингом и оценкой риска развития у указанного пациента нарушения активности и/или функции желудочно-кишечного тракта и/или нарушения режима питания, за исключением соматостатиномы,
где указанные фрагменты имеют длину по меньшей мере в 6 аминокислотных остатков.
Используемый здесь термин «желудочно-кишечный тракт» (ЖК) человека означает все структуры органов от ротовой полости до ануса. ЖК-тракт состоит из верхнего и нижнего отделов. Верхний отдел желудочно-кишечного тракта состоит из пищевода, желудка и двенадцатиперстной кишки. Нижний отдет желудочно-кишечного тракта включает большую часть тонкого кишечника и весь толстый кишечник. Тонкий кишечник состоит из трех частей, таких как двенадцатиперстная кишка, тощая кишка и подвздошная кишка, а толстый кишечник подразделяется на слепую кишку, ободочную кишку и прямую кишку.
В контексте настоящего изобретения, нарушения активности и/или функции желудочно-кишечного тракта и/или нарушения режима питания у человека являются результатом патологических изменений структур и/или функций ЖК-тракта, или патологических изменений при нарушении режима питания. Расстройствами ЖК-тракта, которые влияют на активность и/или функцию ЖК-тракта, и/или приводят к нарушению режима питания, являются воспалительные, инфекционные, органические и функциональные заболевания ЖК-тракта.
Инфекции желудочно-кишечного тракта, включая наиболее распространенные формы гастроэнтерита, могут быть вызваны вирусами, бактериями (такими как Salmonella, Shigella, Campylobacter или E. coli) или кишечными паразитами (такими как амебы и лямблии).
Гастроэнтерит (также известный как «желудочно-кишечный грипп» или «грипп желудка», хотя к гриппу он не имеет никакого отношения) представляет собой воспаление желудочно-кишечного тракта, включая воспаление желудка и тонкого кишечника, и вызывает сильную диарею и рвоту. Он может передаваться контактным путем при приеме зараженной пищи и воды. Такое воспаление чаще всего вызывается инфицированием некоторыми вирусами и реже бактериями, их токсинами (например, СЭВ (стафилококковым эндотоксином В)), паразитами или негативной реакцией на некоторые пищевые продукты или лекарственные препараты. По меньшей мере в 50% случаев, гастроэнтерит, связанный с пищевым отравлением, вызывается норовирусом. В других 20% случаев и в большинстве случаев тяжелого заболевания у детей, гастроэнтерит вызывается ротавирусом. Другими широко распространенными вирусными агентами являются аденовирус и астровирус. Гастроэнтерит может вызываться бактериями других видов, включая Salmonella, Shigella, Staphylococcus, Campylobacter jejuni, Clostridium, Escherichia coli, Yersinia, Vibrio cholerae и т.п. При гастроэнтерите часто наблюдаются боли в желудке или спазмы желудка, диарея и/или рвота, а также невоспалительные инфекционные заболевания верхнего отдела тонкого кишечника или воспалительные инфекционные заболевания толстой кишки. Такое состояние обычно имеет острую начальную стадию, продолжается в течение 1-6 дней и проходит спонтанно.
Воспалительными заболеваниями желудочно-кишечного тракта являются воспалительное заболевание кишечника (ВЗК), такое как болезнь Крона и язвенный колит; панкреатит; аппендицит; и глютеновая болезнь.
Воспалительное заболевание кишечника (ВЗК) представляет собой группу воспалительных состояний толстого и тонкого кишечника. Основными типами ВЗК являются болезнь Крона и язвенный колит. Другими формами ВЗК являются коллагенозный колит, лимфоцитарный колит, ишемический колит, колиты различной этиологии, болезнь Бехчета и колит неясной этиологии.
Болезнь Крона, также известная как региональный энтерит, представляет собой воспалительное заболевание кишечника, которое может поражать любую часть желудочно-кишечного тракта от ротовой полости до ануса с симптомами широкого ряда. Болезнь Крона, главным образом, вызывает боли в области брюшины, диарею (которая может давать кровотечение в тяжелой стадии воспаления), рвоту или потерю массы тела, но, при этом, она может также давать осложнения, выходящие за пределы желудочно-кишечного тракта, такие как кожная сыпь, артрит, воспаление глаз и сухожилий и нарушение внимания (Baumgart and Sandborn, 2007. The Lancet 369:1647-1657). Считается, что болезнь Крона является аутоиммунным заболеванием, при котором иммунная система организма атакует желудочно-кишечный тракт, что приводит к воспалению. Обычно, такое заболевание наблюдается в области желудочно-кишечного тракта и может быть отнесено к категории заболеваний, поражающих конкретную область желудочно-кишечного тракта. Заболевание подвздошной кишки (последней части тонкого кишечника, которая соединяется с толстым кишечником) и толстой кишки, а именно, энтероколит Крона, встречается в 50% всех случаев заболевания болезнью Крона.
Язвенный колит (Colitis ulcerosa) представляет собой форму воспалительного заболевания кишечника (ВЗК). Язвенный колит представляет собой форму колита, заболевания кишечника, а в частности, толстой кишки или ободочной кишки, которое характеризуется наличием язв или открытых ран в ободочной кишке. Главным симптомом острого заболевания обычно является непрерывная диарея с кровью, развивающаяся в течение длительного периода времени. Язвенный колит, который имеет сходство с болезнью Крона, представляет собой интермиттирующее заболевание с периодами ухудшения состояния и относительного улучшения состояния без каких-либо симптомов. Хотя симптомы язвенного колита иногда могут исчезать сами, однако, для достижения ремиссии обычно требуется лечение. У пациентов с язвенным колитом имеется повышенный риск развития рака прямой и ободочной кишки (Kulaylat and Dayton. 2010. J. Surg Oncol 101:706-712).
Панкреатит представляет собой воспаление поджелудочной железы, которое может встречаться в двух очень отличающихся друг от друга формах. Острый панкреатит возникает внезапно, а хронический панкреатит характеризуется рецидивирующей или персистентной абдоминальной болью вместе со стеатореей или сахарным диабетом или без этих симптомов. Диагностическими критериями панкреатита являются два из нижеследующих трех признаков: 1) абдоминальная боль, характерная для острого панкреатита, 2) уровень амилазы и/или липазы в сыворотке, который в ≥3 раза превышает верхний предел нормы, и 3) наличие характерных признаков остного панкреатита при КТ-сканировании (Banks and Freeman 2006. Am J Gastroenterol 101: 2379-2400).
Аппендицит представляет собой состояние, характеризующееся воспалением слепой кишки. Оно классифицируется как состояние, требующее неотложной медицинской помощи, при котором, во многих случаях необходимо удаление воспаленной слепой кишки путем лапаротомии или лапароскопии. При отсутствии лечения, риск летального исхода очень высок, главным образом, в результате перитонита и септического шока (Hobler 1998. The Permanente Journal 2:5-8).
Глютеновая болезнь представляет собой аутоиммунное расстройство тонкого кишечника, которое встречается у людей всех возрастов с генетической предрасположенностью к этому заболеванию, и начинает развиваться у детей среднего дошкольного возраста. Симптомами этого заболевания являются хроническая диарея, замедление развития (у детей) и усталость, однако, эти симптомы могут отсутствовать и могут наблюдаться симптомы в других органах, как было описано в литературе. Глютеновая болезнь вызывается реакцией на глиадин, проламин (белок глютен), обнаруженный в пшенице, и на аналогичные белки, обнаруженные в культурах рода Triticeae (который включает и другие широко распространенные зерновые, такие как ячмень и рожь). После контакта с глиадином, а в частности, с тремя пептидами, присутствующими в проламинах, тканевый фермент трансглутаминаза модифицирует белок, в результате чего иммунная система начинает перекрестно реагировать с тканью тонкого кишечника, что приводит к воспалительной реакции. Такая реакция приводит к усечению ворсинчатой выстилки тонкого кишечника (называемому атрофией ворсинок кишечника). Это препятствует всасыванию питательных элементов, поскольку кишечник ответственен за такое всасывание. Единственным известным способом эффективного лечения такого заболевания является длительная диета с отсутствием глютена (Sabatino and Corazza 2009. Lancet 373: 1480-1493). Хотя такое заболевание вызывается реакцией на белки пшеницы, однако, оно не означает аллергию на пшеницу. Это состояние имеет несколько других названий, включая: целиакию, глютеновую спру, нетропическую спру, эндемическую спру, глютеновую энтеропатию или глютен-чувствительную энтеропатию, и непереносимость глютена.
Органическими расстройствами являются расстройства, при которых участки ЖК-тракта имеют органические патологии, включая дивертикулит, пептическую язву и рак.
Дивертикулит представляет собой распространенное заболевание пищеварительной системы, которое развивается, в частности, в толстом кишечнике. Дивертикулит развивается из дивертикулеза, который характеризуется образованием карманов (дивертикул) за пределами ободочной кишки (Bogardus 2006. J Clin Gastroenterol 40 Suppl 3: 5108-5111). Дивертикулит возникает в случае воспаления одного из этих дивертикул. У пациентов с указанным заболеванием часто наблюдается классическая триада симптомов, таких как боли в левом нижнем квадранте, высокая температура и лейкоцитоз (увеличение числа лейкоцитов в анализах крови). У этих пациентов может также наблюдаться тошнота или диарея, а в некоторых случаях могут наблюдаться запоры.
Рак желудочно-кишечного тракта представляет собой злокачественные заболевания желудочно-кишечного тракта, включая пищевод, слюнные железы, желудок, печень, систему желчных протоков, кишечник, ободочную кишку и анус.
Неокарцинома определена как новообразование на основе уже имеющейся опухоли.
Пептическая язва или заболевание, ассоциированное с пептической язвой, представляет собой язву (определенную как эрозию слизистой размером 0,5 см или выше) области желудочно-кишечного тракта, которая обычно имеет кислотную природу и вызывает очень болезненные ощущения. До 70-90% случаев возникновения язв ассоциируются с бактерией Helicobacter pylori, то есть спиралевидной бактерией, которая присутствует в кислотной среде желудка, однако, лишь 40% пациентов с указанным заболеванием обращаются к врачу. Развитие или обострение язвы может вызываться приемом лекарственных средств, таких как аспирин, плавикс (клопидогрель), ибупрофен и другие НСПВС. В противоположность общепринятому мнению, пептические язвы чаще возникают в двенадцатиперстной кишке (в первой части тонкого кишечника, расположенной сразу за желудком), а не в желудке. Примерно в 4% случаев, язвы желудка вызываются злокачественной опухолью, а поэтому для исключения рака необходимо взятие множества биоптатов. Язвы двенадцатиперстной кишки обычно являются доброкачественными.
Функциональными расстройствами ЖК-тракта (FGID) являются ряд отдельных идиопатических расстройств, поражающих различные части желудочно-кишечного тракта. FGIDS определяют как комплекс хронических абдоминальных симптомов, которые возникают в отсутствии каких-либо имеющихся органических патологий. FGID, в соответствии с Римскими критериями (http://www.romecriteria.org; Gastroenterology 2006. Volume 730 (No. 5): 1377-1552), включают 6 основных расстройств у взрослых, а именно: функциональные расстройства пищевода (например, функциональная изжога, функциональная дисфагия), функциональные расстройства желудка и двенадцатиперстной кишки (например, функциональная диспепсия; расстройства, при которых наблюдаются отрыжка, тошнота и рвота), функциональные расстройства кишечника (например, синдром раздраженного кишечника (СРК)), синдром функциональной абдоминальной боли, функциональные расстройства желчного пузыря и сфинктера в области печеночно-поджелудочной ампулы и функциональные расстройства в аноректальной области.
Синдром раздраженного кишечника (СРК или спазмы в области ободочной кишки) представляет собой функциональное расстройство кишечника, характеризующееся хронической абдоминальной болью, дискомфортом, метеоризмом и изменением привычной работы кишечника в отсутствии любых детектируемых органических поражений (Mayer 2008. NEIM. 358: 1692-1699). В некоторых случаях, эти симптомы ослабляются при работе кишечника. При этом, может преобладать диарея или запор, либо они могут чередоваться. СРК может развиваться после инифицирования (постинфекционный СРК), либо он может быть следствием стрессовых жизненных ситуаций или наступлением зрелости без каких-либо других клинических признаков.
Диспепсия, также известная как расстройство желудка или пищеварения, означает состояние, связанное с нарушением пищеварения. Это клиническое состояние характеризуется хроническими или рецидивирующими болями в верхнем отделе брюшной полости, чувством переполнения верхнего отдела брюшной полости и ощущением наполненности желудка, раньше, чем это обычно происходит при приеме пищи. Оно может сопровождаться метеоризмом, отрыжкой, тошнотой или изжогой. Диспепсия представляет собой широко распространенное расстройство, и часто связана с гастроэзофагеальным рефлюксом (ГЕФР) или гастритом, но в некоторых немногочисленных случаях, она может быть первым симптомом пептической язвы (язвы желудка или двенадцатиперстной кишки), и иногда и рака. Функциональная диспесия представляет собой диспепсию «без явных признаков органического заболевания, которые можно было бы назвать симптомами», и по оценкам специалистов, ею страдает приблизительно 15% всего населения западных стран (Saad and Chey 2006. Aliment. Pharmacol. Ther. 24: 475-92).
Дисфагия представляет собой медицинский термин и означает симптом, выражающийся в затруднении проглатывания. Функциональная дисфагия определяется как дисфагия, не вызываемая ограническими изменениями, поддающимися обнаружению.
В предпочтительном варианте изобретения, диагностику, прогноз и оценку риска развития у пациентов воспалительного заболевания кишечника (включая болезнь Крона и язвенный колит), дивертикулита, гастроэнтерита, синдрома раздражения кишечника, панкреатита, аппендицита, пептической язвы желудка, глютеновой болезни и карциномы ЖК-тракта, за исключением соматостатиномы, осуществляют путем детектирования просоматостатина 1-64 и его фрагментов в биологическом образце.
Термин «режим питания» определяют как состояние организма с точки зрения потребления и усваиваемости питательных веществ и его способности поддерживать нормальную метаболическую целостность этих питательных веществ.
Соматостатин физиологически связан с некоторыми регуляторными процессами желудочно-кишечного тракта (например, с регуляцией перистальтики желудка и кишечника посредством ингибирования некоторых гормонов). Авторами изобретения было продемонстрировано, что патологии, при которых измеренные уровни про-SST были ниже нормы, имели общие признаки пониженной активности и/или функции ЖК-тракта, которые могут быть прямо или опосредованно вызваны данной патологией. Неожиданно было обнаружено, что активность и/или функция ЖК-тракта и/или режим питания являются единственными или по меньшей мере доминирующими параметрами, с которыми ассоциируются уровни про-SST в плазме, и еще более неожиданным оказалось то, что при нарушении активности и/или функции ЖК-тракта и/или режима питания, уровни про-SST являются пониженными по сравнению с нормой.
В одном из вариантов изобретения, по меньшей мере один определенный дополнительный пептид-предшественник или его фрагмент, присутствующий в ЖК-тракте, помимо просоматостатина 1-64 или его фрагментов, выбраны из группы, состоящей из грелина, холецистокинина, гастрина, мотилина, пептида YY, панкреатического полипептида, секретина, глюкагона, вазоактивного пептида кишечника, желудочного ингибирующего пептида (GIP), амилина, нейротензина, субстанции P, гастрин-рилизинг пептида (GRP) и бомбезина.
В предпочтительном варианте изобретения, уровень просоматостатина измеряют в образце, взятом у пациента натощак. В данном случае, слово «натощак» означает состояние пациента, не принимающего никакой пищи и питья, кроме воды, по меньшей мере в течение 8 часов.
В конкретном варианте изобретения, по меньшей мере один дополнительный клинический параметр определяют как параметр, выбранный из группы, включающей возраст, пол, индекс массы тела (ИМТ), наличие сахарного диабета и курение.
Индекс массы тела (ИМТ) определяют как массу тела индивидуума, деленную на квадрат роста данного индивидуума. Универсальной единицей измерения, используемой в медицине для определения ИМТ, является кг/м2. По оценке ВОЗ, нижний предел ИМТ, который может служить показателем недостаточной массы тела, расстройства питания или других проблем со здоровьем, составляет менее чем 18,5, а ИМТ более чем 25, рассматривается как избыточный вес, ИМТ выше 30 рассматривается как ожирение, а ИМТ выше 40 рассматривается как ожирение, при котором существует риск летального исхода (WHO 2000. Technical Report Series 894 Geneva World Health Organization. 2000).
В предпочтительном варианте изобретения измеряют N-концевой фрагмент, содержащий аминокислоты 1-64 (SEQ ID NO:6) просоматостатина (SEQ ID NO:2).
Термин «фрагмент», если он упоминается в контексте описания прогормонов, таких как просоматостатин, означает более мелкие белки или пептиды, происходящие от более крупных белков или пептидов, и следовательно содержащие неполную последовательность более крупного белка или пептида. Указанные фрагменты получают из более крупных белков или пептидов путем омыления по одной или более их пептидных связей. Указанные фрагменты, предпочтительно, детектируют с помощью описанных здесь иммунологических анализов.
Определение уровня просоматостатина 1-64 и его фрагментов в биологическом образце может быть осуществлено с применением любого подходящего аналитического метода, известного специалистам. Такими методами являются, но не ограничиваются ими, иммуноанализы, масс-спектрометрия, иммуноблот-анализы, иммуногистохимические методы, методы с использованием микромассивов белков и электрофоретические методы.
Настоящее изобретение также включает: антитело, связывающееся с эпитопом, содержащимся в пептиде, который представляет собой аминокислоты 43-64 (SEQ ID NO: 5) просоматостатина (SEQ ID NO:2), и набор для определения уровня просоматостатина 1-64 (SEQ ID NO: 6) или его фрагментов, содержащий по меньшей мере два антитела, выбранных из группы, состоящей из антитела, связывающегося с эпитопом, содержащимся в пептиде, который представляет собой аминокислоты 1-21 (SEQ ID NO: 3) просоматостатина (SEQ ID NO:2); антитела, связывающегося с эпитопом, содержащимся в пептиде, который представляет собой аминокислоты 22-42 (SEQ ID NO: 4) просоматостатина (SEQ ID NO:2), и антитела, связывающегося с эпитопом, содержащимся в пептиде, который представляет собой аминокислоты 43-64 (SEQ ID NO: 5) просоматостатина (SEQ ID NO:2). Указанные антитела и набор могут быть использованы в способе согласно изобретению.
В предпочтительном варианте изобретения, методы детектирования включают иммуноанализы в различных форматах, такие как, например, радиоиммуноанализ (РИА), хемилюминесцентные и флуоресцентные иммуноанализы, твердофазные иммуноферментные анализы (ELISA), анализы с использованием массивов сфер на основе Luminex, анализы с использованием микромассивов белков и анализы в формате экспресс-тестов, такие как, например, иммунохроматографические тест-полоски.
Такие анализы могут быть гомогенными или гетерогенными, конкурентными и неконкурентными. В особенно предпочтительном варианте изобретения, указанный анализ проводят в форме «сэндвич-анализа», представляющего собой неконкурентный иммуноанализ, в котором детектируемую и/или количественно оцениваемую молекулу присоединяют к первому антителу и ко второму антителу. Первое антитело может быть связано с твердой фазой, например, со сферой, с поверхностью лунки или с другим контейнером, а также с чипом или с полоской, а вторым антителом является антитело, которое было помечено, например, красителем, радиоизотопом или реакционноспособной