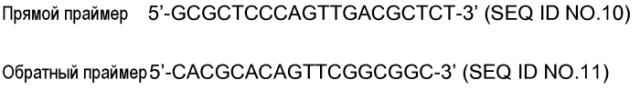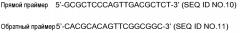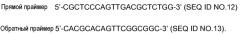Применение катепсина н
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается применения катепсина Н для идентификации соединений, которые модулируют нейропатическую боль. Группа изобретений также касается применения клетки, гетерологично экспрессирующей катепсин Н или его функциональный фрагмент, для идентификации соединений, которые модулируют нейропатическую боль; применения катепсин Н-нокаутной клетки для идентификации или анализа соединений, которые модулируют нейропатическую боль; способа идентификации или анализа соединений, модулирующих и/или предотвращающих нейропатическую боль. Группа изобретений обеспечивает идентификацию соединений, которые модулируют нейропатическую боль. 16 н.п. ф-лы, 1 пр., 11 ил.
Реферат
Настоящее изобретение относится к применению катепсина H. Другие аспекты изобретения относятся к способам скрининга лекарственных средств, диагностирования чувствительности к боли и лечения боли.
В западном мире хроническая боль является одной из основных нерешенных проблем здравоохранения, подрывающих здоровье и благополучие миллионов граждан. Хроническая боль серьезно ухудшает самочувствие испытывающего ее субъекта, и обычно ей сопутствуют или после нее наблюдаются вегетативные признаки, которые часто приводят к депрессии. Хроническая боль приводит к страданию отдельного человека и огромным социально-экономическим издержкам. Существующие виды фармакологической терапии боли часто являются неудовлетворительными как с точки зрения эффективности, так и безопасности.
С учетом серьезных недостатков, связанных с состоянием в области средств лечения боли, существует значительная потребность в новых средствах лечения уже существующей боли и диагностики и прогноза возможного развития хронической боли. Особенно в свете огромного разрыва между быстро растущим пониманием нейробиологии боли и неудовлетворенной клинической потребностью в предоставлении эффективных способов лечения, лишенных недостатков способов лечения существующего уровня техники, усилия должны быть направлены на открытие новых целей для новых классов анальгетиков.
Таким образом, целью настоящего изобретения является создание нового средства для разработки и предоставления новых классов лекарственных средств, модулирующих боль.
Указанная задача решается путем применения катепсина H или его функциональных фрагментов или производных для идентификации соединений, которые модулируют боль и особенно нейропатическую боль.
Изобретение основано на неожиданном открытии авторов изобретения, впервые показавших, что экспрессия катепсина H тесно коррелирует с чувствительностью к боли на мышиных моделях нейропатической боли.
Боль, согласно определению международной ассоциации по изучению боли, является неприятным сенсорным и эмоциональным переживанием, ассоциированным с реальным или потенциальным повреждением тканей, или описывается в терминах такого повреждения. Боль обычно является следствием активации ноцицептивной нервной системы, которая специализируется на обнаружении и кодировании повреждения или потенциального повреждения ткани. Таким образом, боль является частью системы сигнализации организма для инициации реакций по минимизации реального или потенциального повреждения организма. Боль может быть первичным симптомом медицинского состояния или может быть вторичным эффектом болезненного состояния, часто без какого-либо биологического значения.
Боль может быть острой или хронической. Острая боль является физиологическим сигналом о потенциальной или реальной травме. Появление боли сопровождается повреждением ткани, инфекцией, воспалением или другими острыми состояниями, предупреждая субъекта об опасности после телесного повреждения или нарушения функции. Если острую боль не лечить должным образом, это может привести к хронической боли.
Хроническая боль является болезненным состоянием, характеризующимся различным происхождением, продолжительностью, интенсивностью и специфическими симптомами.
Хроническая боль может быть ноцицептивного происхождения, воспалительного или нейропатического. Считается, что ноцицептивная боль соответствует текущей активации соматических или висцеральных нервных волокон, чувствительных к боли. Нейропатическая боль является болью, возникающей вследствие любого вида повреждения периферической или центральной нейрональной ткани; считают, что она поддерживается аберрантными соматосенсорными процессами в периферической нервной системе, в ЦНС или в обеих указанных системах. (Для обзора механизмов боли см., например, Scholz and Woolf, 2002; Julius and Basbaum, 2001, Woolf and Mannion, 1999; Wood, J.D., 2000; Woolf and Salter, 2000.)
Хроническая нейропатическая боль варьирует среди пациентов. Недавно полученные данные показывают, что индивидуальная чувствительность к боли играет важную роль для уровня индивидуального страдания, т.е. существует значительная наследственная предрасположенность к боли, в частности, к развитию нейропатической боли. Настоящее изобретение основано на обширных исследованиях авторов, которые направлены на идентификацию генов чувствительности к боли (т.е. генов, которые определяют степень боли, ощущаемой при наличии данной фиксированной степени повреждения ткани) в моделях хронической боли у грызунов. Модели на грызунах и экспериментальные параметры, используемые авторами изобретения, обеспечивали экспериментальные условия, при которых среди различных субъектов a) можно точно контролировать характер и равномерность нервного повреждения и b) можно минимизировать генетическую вариабельность и вариабельность, вызванную внешней средой.
Катепсин H (CTSH; альтернативные названия согласно Atlas of Genetics and Cytogenetics in Oncology and Haematology (http://atlasgeneticsoncology.org): ACC-4, ACC-5, CPSB, DKFZp686B24257, EC 3.4.22.16, MGC1519, алеураин, миницепь) является лизосомальной протеазой.
Генный локус катепсина H человека находится на хромосоме 15q24-125 (см., например, Atlas of Genetics and Cytogenetics in Oncology and Haematology). Ген содержит 12 экзонов, охватывающих свыше 23 kb геномных последовательностей. Нуклеотидная последовательность препрокатепсина H человека была опубликована, например, Fuchs and Gassen, 1989, Nucleic Acids Res. 17: 9471-9471. Генная структура катепсина H крысы была опубликована, например, Ishidoh et al, FEBS Letters, 1989, Vol. 253, number 1, 2, 103-107. Геномную последовательность CTSH homo sapiens на хромосоме 15 можно найти, например, на главной странице NCBI под номером доступа NG_009614.1 (SEQ ID NO:1).
Ген катепсина H имеет TATA- и CAAT-лишенный промотор и расположенный выше экзона 1 один бокс GC. Две различные формы кДНК катепсина H были обнаружены в тканях простаты и раковых клеточных линиях: непроцессированная форма (CTSH) и процессированная форма с делецией 12 аминокислот в области сигнального пептида (CTSHdelta 10-21) (см. Atlas of Genetics and Cytogenetics in Oncology and Haematology). Длина транскрипта препрофермента составляет 1005 п.н. Кодирующая полинуклеотидная последовательность катепсина H находится в открытом доступе в базе данных нуклеотидных последовательностей NCBI под несколькими номерами доступа, а именно: BC006878 (CTSH, полная кодирующая последовательность, mus musculus, SEQ ID NO:4, NM_004390.3 (CTSH Homo sapiens, транскриптный вариант 1 мРНК (SEQ ID NO:2), NM_148979.2 (CTSH Homo sapiens, транскриптный вариант 2 мРНК (SEQ ID NO:3)). Специалисту в данной области известно, как найти другие кодирующие или геномные последовательности катепсина H в базе данных NCBI (катепсин H других видов; мутанты или различные изоформы катепсина H, если существуют). Если в дальнейшем упоминается кодирующая последовательность катепсина H, это может означать любую из указанных выше мРНК или кодирующих последовательностей; причем последовательности согласно SEQ ID NO:2, 3 и 4 являются предпочтительными примерами.
Белковая последовательность катепсина H находится в открытом доступе в базе данных белков NCBI, например, под следующими номерами доступа: препробелок изоформы катепсина H homo sapiens (hs): NP_004381 (SEQ ID No:8); предшественник изоформы b hs: NP:683880 (SEQ ID NO:9); катепсин H мыши (mus musculus): препробелок: NP_031827; изоформа CRA_a mus musculus: EDL20900, изоформа CRA_b mus musculus: EDL20901; катепсин H крысы (Rattus norvegicus): NP_037071; изоформа CRA-a (Rattus norvegicus) катепсина H: EDL77562, изоформа CRA-b (Rattus norvegicus) катепсина H: EDL77563, катепсин H. Кроме того, последовательность белка находится в открытом доступе в базе данных UniProtKB (www.beta.uniprot.org), под номерами доступа: P09668 (HUMAN_CATH, катепсин H человека, SEQ ID NO:5). Если далее упоминается белок или аминокислотная последовательность катепсина H, это может означать любую из указанных выше белковых последовательностей или транслированных белковых последовательностей из перечисленных выше кодирующих последовательностей; например, следующих последовательностей: SEQ ID NO:5, 6, 7, 8 или 9.
NCBI является национальным центром биотехнологической информации (почтовый адрес: National Centre for Biotechnology Information, National Library of Medicine, Building 38A, Bethesda, MD 20894, USA; web-adress: www.ncbi.nhm.nih.gov). Дополнительные последовательности (например, последовательности, имеющие номера доступа SwissProt или EMBL) можно найти в базе данных UniProtKB по www.beta.uniprot.org.
Катепсин H является лизосомальной протеазой с аминопептидазной и слабой эндопептидазной функцией. Он принадлежит к семейству C1 (папаин-подобных) цистеинпротеаз. Белок катепсина H синтезируется в виде препрофермента из 335 аминокислот и протеолитически процессируется в активную одиночную цепь внутри эндосом или лизосом. Наряду с тяжелой и легкой цепью (называемых вместе длинной цепью), катепсин H содержит так называемую миницепь "EPQNCSAT", которая образуется из пропептида. (О структуре катепсина H см. также Turk et al., Biological Chemistry, 1997). Миницепь, по-видимому, участвует в аминопептидазной активности катепсина H и играет ключевую роль в распознавании субстрата. Показано, что рекомбинантная форма катепсина H человека, не имеющая миницепи, является эндопептидазой (Valiljeva et al, 2003). Эндопептидазными субстратами катепсина H являются, например: Bz-Arg+NHNap, Bz-Arg+NH-Mec, Bz-Phe-Val-Arg+NHMec. Катепсин H обладает дипептидил-пептидазной активностью в отношении субстратов: Pro-Gly+Phe и Pro-Arg+NHNap. Он обладает аминопептидазной активностью в отношении субстратов: H-Arg-NH-Mec, Bz-Arg-NH-Mec, Bz-Arg-NH-Mec и H-Cit-NH-Mec (см., например, Rothe and Dodt, 1992; Bz=бензоил, NH-Mec=e-метилкумарил-7-амид; Cit=цитруллин). Природными ингибиторами катепсина H являются цистатины, альфа2-макроглобулин, а также антигены, полученные из мышиных цитотоксических лимфоцитов CTLA-2beta.
Катепсин H экспрессируется повсеместно с наиболее высоким уровнем в почках. Его экспрессия может быть повышена в некоторых раковых тканях. Катепсин располагается преимущественно в эндосомально-лизосомальном компартменте, но также секретируется до некоторой степени и циркулирует в крови.
Функции катепсина H включают, как правило: протеазную активность, например, гидролазную активность, пептидазную активность, например аминопептидазную, дипептидилпептидазную, экзопептидазную или эндопептидазную активность, трансацилазную активность (см. Koga et al., 1991); расщепление перечисленных выше субстратов; расщепление нативного C5 и образование хемотаксина C5a, процессинг гидрофобного сурфактант-ассоциированного белка C, расщепление и/или деградация фибронектина и фибриногена. Более конкретно, он участвует в качестве лизосомальной цистеинпротеазы во внутриклеточной деградации белка. Он участвует в образовании хемотаксина C5a путем расщепления нативного C5. Катепсин H участвует в процессинге гидрофобного сурфактант-ассоциированного белка C. Кроме того, он, по-видимому, участвует в образовании нестабильных атеросклеротических бляшек и, возможно, также в начальном атерогенезе.
Применение по настоящему изобретению предусматривает идентификацию новых веществ для предотвращения и/или лечения боли и особенно нейропатической боли. Применение по настоящему изобретению включает идентификацию соединений с желательными характеристиками (т.е. снижение болевой чувствительности), а также идентификацию соединений с нежелательными характеристиками (т.е. увеличение болевой чувствительности). Кроме того, настоящее изобретение предусматривает дополнительную характеристику соединений, уже идентифицированных как пригодные для предотвращения и/или лечения какого-либо заболевания или болезненного состояния. В этом случае настоящее изобретение можно использовать, например, для исключения идентифицированных активных соединений, обладающих нежелательными побочными эффектами (т.е. увеличение болевой чувствительности): соединения-кандидаты для данного заболевания, например, могут быть профилированы по их влиянию на катепсин H (белок и/или нуклеиновая кислота, экспрессия и/или функция, и т.д.).
Соединение/тестируемое соединение/активное соединение, которое применяют в различных аспектах настоящего изобретения может представлять собой любое биологическое или химическое вещество или экстракт природного продукта, очищенный, частично очищенный, синтезированный или изготовленный посредством биохимических или молекулярно-биологических методов.
Соединение, рассматриваемое как активное в модулировании боли, в смысле различных аспектов настоящего изобретения может представлять собой любое вещество, оказывающее влияние на одну из функций катепсина H или на количество катепсина H (белка или нуклеиновой кислоты) в клетке, на экспрессию катепсина H, посттрансляционную модификацию (например, N-гликозилирование или процессинг (например, расщепление), сворачивание белка или активацию.
В связи с этим, вещество может модулировать любую из функций катепсина H (например, функции, которые перечислены выше или ниже). Активность белка катепсина H может быть модулирована веществом, например, путем непосредственного взаимодействия и интерференции полипептида/белка катепсина H или его фрагментов. Вещество также может модулировать экспрессию катепсина H, например, на уровне транскрипции (инициации, элонгации, процессинга и т.д.), стабильность транскрипта, трансляцию. Кроме того, оно может модулировать посттрансляционную модификацию, процессинг из неактивной в активную форму (расщепление препроформы до активного белка), а также сворачивание белка и т.д. катепсина H. Вещество может проявлять указанные выше эффекты непосредственно или косвенно (в значении косвенно, т.е. путем взаимодействия (положительного или отрицательного) с природными сигнальными каскадами, оказывающими влияние на функцию катепсина H/белковую активность/экспрессию и т.д.).
Функции катепсина H включают функции, которые перечислены выше, например, протеазную активность; способность удалять дипептиды с аминоконца одного или более белковых субстратов; способность специфически взаимодействовать с одним или более белковыми субстратами (белок-белковое взаимодействие), такими как субстраты, перечисленные выше; способность расщеплять и/или активировать один или более белковых субстратов, таких как субстраты, перечисленные выше; способность процессировать белковые или пептидные субстраты, такие как субстраты, перечисленные выше, способность ингибироваться одним из ингибиторов, которые перечислены выше.
Функции катепсина H включают обычно также способность белка катепсина H или нуклеиновой кислоты или их фрагментов взаимодействовать с другими молекулами (включая, но не ограничиваясь ими: белки, пептиды, нуклеиновые кислоты, синтетические молекулы) и предпочтительно относятся к его способности взаимодействовать с белковыми субстратами и расщеплять их.
Под субстратом фермента понимают, в терминах настоящей заявки, любую молекулу, которая может быть модифицирована ферментом. Природные субстраты в объеме настоящего изобретения представляют собой молекулы, которые соответствуют форме, в которой они находятся в природной физиологической или патологической ситуации (такие как молекулы, перечисленные выше), и которые также могут быть модифицированы соответствующим ферментом.
Модуляция боли и особенно нейропатической боли может представлять собой либо уменьшение, либо увеличение.
Согласно одному аспекту настоящей группы взаимосвязанных изобретений может быть использован фрагмент или производное катепсина H. Фрагмент может представлять собой фрагмент белка, полипептида или полинуклеиновой кислоты.
Фрагмент белка или полипептида представляет собой белок или полипептид, который содержит одну или более концевых областей (n- и/или c-концевые) и/или внутренние делеции одной, двух или более аминокислот, по сравнению с примерами непроцессированного катепсина H; фрагменты включают, например, домены и/или фрагменты, которые перечислены в описании фигуры 7 (см. ниже).
Функциональный фрагмент белка катепсина H представляет собой любой фрагмент данного белка, обладающий по меньшей мере одной или более функциональными характеристиками непроцессированного белка, особенно которые перечислены выше.
Фрагмент полинуклеотидной кислоты представляет собой полинуклеотидную кислоту или олигонуклеотид, содержащий одну или более концевых областей (5'- и/или 3'-) и/или внутренние делеции одного, двух или более нуклеотидов, по сравнению с непроцессированной геномной или кодирующей последовательностью. Функциональный фрагмент нуклеиновой кислоты катепсина H представляет собой любой фрагмент, обладающий по меньшей мере одной или более функциональными характеристиками непроцессированной полинуклеиновой кислоты (мРНК, геномная или кодирующая последовательность).
Термин “производное катепсина H” включает любой тип модификации катепсина H по сравнению с природной формой, и особенно по сравнению с катепсином H согласно SEQ ID NO:5, 6, 7, 8 или 9, которая не является делецией. Функциональное производное катепсина H представляет собой любое производное указанного белка, обладающее по меньшей мере одной и предпочтительно двумя или более функциональными характеристиками немодифицированного белка. Производные включают, например, модификации аминокислотной или нуклеотидной последовательности или любой другой вид модификации, такой как химическая или биологическая модификация, приводящая, например, к стабилизации полипептида или полинуклеотида (например, фосфоротиоатные модификации основной цепи нуклеиновой кислоты или замены связей между аминокислотами и т.д.), или придание специфической направленности полипептиду или полинуклеотиду к определенным клеткам, или облегчение их проникновения в клетки или их захвата клетками (такие как проникающие в клетку фосфопептиды, ортоприсоединение к проникающим в клетку пептидным векторам, например, на основе Antennapedia/проникновения, последовательности на основе TAT и сигнальных пептидов; или соединение с частями лигандов специфических переносчиков или импортеров).
Другой аспект настоящего изобретения относится к применению не являющегося человеком трансгенного животного, гетерологично экспрессирующего катепсин H или его функциональный фрагмент, для идентификации или анализа соединений, которые модулируют боль и особенно нейропатическую боль.
Не являющееся человеком животное может представлять собой любое животное, которое не является человеком. Предпочтительными являются грызуны, такие как крысы или мыши.
Трансгенное животное представляет собой животное, которое содержит в своем геноме чужеродную ДНК, которая была преднамеренно перенесена туда. Введение чужеродной ДНК в геном животного может быть осуществлено в соответствии со стандартными методиками (см., например, Transgenic Animal Technology A Laboratory Handboook. C.A. Pinkert, editor; Academic Press Inc., San Diego, California, 1994 (ISBN: 0125571658).
Термин “гетерологичная экспрессия” относится к экспрессии, отличающейся от обычной экспрессии гена в организме-хозяине (в отношении уровня устойчивого состояния, количества, времени или распределения в тканях экспрессированного гена или в отношении типа экспрессированного гена (т.е. ген в обычных условиях вообще не экспрессируется в хозяине)). Гетерологичная экспрессия может быть конститутивной или индуцируемой. Подходящие индуцируемые системы экспрессии хорошо известны в данной области (например, тетрациклин-индуцируемая система или т.п.). Организмом может быть клетка или не являющееся человеком животное.
Согласно другому аспекту настоящее изобретение относится к применению не являющегося человеком трансгенного животного, гетерологично экспрессирующего катепсин H или его функциональный фрагмент, в качестве модельной системы для повышенной болевой чувствительности, особенности чувствительности к нейропатической боли.
Еще один аспект настоящего изобретения относится к применению не являющегося человеком животного, нокаутного по гену катепсина H, для идентификации или анализа соединений, которые модулируют боль и особенно нейропатическую боль.
“Нокаутный организм” (например, животное или клетка) относится к организму, в котором экспрессия или функция гена частично или полностью делетируется и включает геномный и функциональный нокауты, индуцируемый и конститутивный нокауты. Создание нокаутных организмов хорошо известно в данной области, так же, как и клетки или животные, которые могут быть использованы для создания нокаутных организмов. Создание катепсин H-нокаутных мышей описано Pham and Ley, 1999.
Другой аспект настоящего изобретения относится к применению не являющегося человеком животного, нокаутного по гену катепсина H, в качестве модельной системы для пониженной болевой чувствительности и особенно пониженной чувствительности к нейропатической боли.
Применение клетки, гетерологично экспрессирующей катепсин H или его функциональный фрагмент, для идентификации соединений, которые модулируют боль, особенно нейропатическую боль, является другим аспектом настоящего изобретения.
Клетка может представлять собой любую прокариотическую или эукариотическую клетку, такую как клетки, способные к трансфекции нуклеиновокислотным вектором и экспрессии гена-репортера. Клетки включают, прежде всего, первичные клетки и клетки клеточной культуры, например, культуры эукариотических клеток, включая клетки, полученные от многоклеточных организмов и тканей (такие как клетки HeLA, CHO, COS, SF9 или 3T3) или от одноклеточных организмов, таких как дрожжи (например, s. pombe или s. cerevisiae), или из культуры прокариотических клеток, предпочтительно Pichia или E.coli. Клетки и образцы, извлеченные из ткани, могут быть получены хорошо известными методами, такими как забор крови, пункция тканей или хирургические методы.
Согласно одному варианту осуществления используют модифицированную клетку, обладающую более низкой активностью катепсина H по сравнению с ее немодифицированным состоянием. Таким образом, можно, например, проверить, способны ли соединения, подлежащие тестированию, усилить или восстановить пониженную или полностью отсутствующую активность катепсина Н. Или можно проверить, способны ли вещества выполнять свою функцию (например, модуляцию боли или такую же функцию при другом болезненном состоянии или заболевании) в условиях пониженной болевой чувствительности.
Модификация может представлять собой любой тип модификации (стабильная или транзиторная, предпочтительно стабильная), которая приводит к снижению активности катепсина H, уровня устойчивого состояния транскрипта катепсина H (т.е. за счет активации транскрипции катепсина H или стабилизации транскрипта) или уровня устойчивого состояния белка катепсина H (т.е. за счет активации трансляции катепсина H или его посттрансляционного процессинга; путем модуляции посттрансляционной модификации катепсина H или путем активации его стабилизации или с путем ингибирования его деградации). Указанное выше можно успешно осуществить, например, путем применения доминантных негативных мутантов катепсина H, антисмысловых олигонуклеотидов, конструкций на основе РНКи катепсина H, путем создания функциональных или геномных нокаутов катепсина H (которые могут быть, например, индуцируемыми) или других подходящих методов, известных на современном уровне развития техники. Для обзора указанных выше методов см., например: Current protocols in Molecular biology (2000) J. G. Seidman, Chapter 23, Supplement 52, John Wiley and Sons, Inc.; Gene Targeting: a practical approach (1995), Editor: A.L. Joyner, IRL Press; Genetic Manipulation of Receptor Expression and Function, 2000; Antisense Therapeutics, 1996; Scherr et al, 2003.
Согласно одному варианту осуществления используют нокаутную по гену катепсина H клетку. Клеточные линии, подходящие для создания нокаутов, хорошо известны на существующем уровне техники, см., например, Current protocols in Molecular Biology (2000) J.G. Seidman, Chapter 23, Supplement 52, John Wiley and Sons, Inc; or Gene Targeting a practical approach. (1995) Ed. A.L. Joyner, IRL Press. Получение нокаутных по гену катепсина H (DPPI) клеток также опубликовано Pham and Ley, 1999 (создание нокаутных клонов эмбриональных стволовых клеток мышей DPPI, см. стр. 8628, левая колонка, верхняя половина).
Другой аспект изобретения, таким образом, относится к применению катепсин-нокаутной клетки для идентификации или анализа соединений, которые модулируют боль, особенно нейропатическую боль.
Кроме того, применение катепсин-нокаутной клетки в качестве модельной системы с пониженной чувствительностью к боли, особенно с пониженной чувствительностью к нейропатической боли, является другим аспектом настоящей группы взаимосвязанных изобретений.
Согласно другому варианту осуществления настоящего изобретения клетка может характеризоваться более высоким уровнем катепсина H по сравнению с эталонной клеткой (например, той же самой клеткой в ее немодифицированном состоянии). Указанная клеточная система может служить для имитации состояния повышенной болевой чувствительности, поскольку уровень экспрессии катепсина H связан с болевой чувствительностью.
Настоящее изобретение, таким образом, относится также к применению клетки, гетерологично экспрессирующей катепсин H или его функциональный фрагмент, в качестве модельной системы с повышенной болевой чувствительностью, особенно чувствительностью к нейропатической боли.
Применение клетки, гетерологично экспрессирующей ген-репортер, связанный через экспрессию с промотором и/или энхансером катепсина H, для идентификации или анализа соединений, которые модулируют боль, особенно нейропатическую боль, является другим вариантом осуществления настоящей группы связанных изобретений.
Указанный выше аспект настоящего изобретения основан на типичном анализе гена-репортера, общеизвестном в данной области. С этой целью выбранный промотор вставляют в вектор экспрессии, подходящий для типа выбранной клетки-хозяина, выше выбранного гена-репортера, так чтобы обеспечить возможность экспрессии гена-репортера, если промотор является активным. Затем конструкцию вводят в выбранную клетку-хозяина. Подходящие способы трансформации или трансфекции хорошо известны в данной области, так же как и условия культивирования клеток и детекция экспрессии гена-репортера (см., например, стандартную литературу, перечисленную ниже). Подходящие условия хорошо известны в данной области, так же как и векторы, гены-репортеры и необходимые реагенты, которые также являются коммерчески доступными.
Вектор представляет собой кольцевую или линейную полинуклеотидную молекулу, например, плазмиду ДНК, бактериофаг или космиду, с помощью которой полинуклеотидные фрагменты (например, вырезанные из других векторов или амплифицированные с помощью ПЦР и вставленные в клонирующий вектор) могут быть специфически амплифицированы в подходящих клетках или организмах. Векторы экспрессии обеспечивают возможность гетерологичной экспрессии гена, представляющего интерес (например, гена-репортера), в клетке-хозяине или организме-хозяине. Тип клетки или организма в значительной степени зависит от задачи, и выбор находится в компетенции специалиста в данной области. Организмы, подходящие для амплификации нуклеиновой кислоты, представляют собой, например, преимущественно одноклеточные организмы с высокой скоростью пролиферации, как например, бактерии или дрожжи. Подходящие организмы также могут представлять собой выделенные и культивированные клетки многоклеточных тканей, как например, клеточные линии, полученные из различных организмов (например, клетки SF9 из Spodoptera Frugiperda и т.д.). Подходящие клонирующие векторы известны в данной области и коммерчески доступны от различных биотехнологических фирм-поставщиков, как например, Roche Diagnostics, New England Biolabs, Promega, Stratagene и многих других. Подходящие клеточные линии коммерчески доступны, например, в American Type Culture Collection (ATCC).
Что касается гетерологичной экспрессии белка или полипептида, то клетка может представлять собой любую прокариотическую или эукариотическую клетку, которая может быть трансфицирована нуклеиновокислотным вектором и может экспрессировать ген, представляющий интерес, например, ген-репортер. Клетки включают, прежде всего, первичные клетки и клетки клеточной культуры, предпочтительно культуры эукариотических клеток, включая клетки, полученные из многоклеточных организмов и тканей (такие как клетки HEK293, RIN-5F, HeLA, CHO, COS, SF9 или 3T3) или из одноклеточных организмов, таких как дрожжи (например, S. pombe или S. cerevisiae), или культуры прокариотических клеток, предпочтительно Pichia или E.coli. Клетки и образцы, извлеченные из ткани, могут быть получены хорошо известными методами, такими как забор крови, пункция тканей или хирургические методы.
В контексте настоящей заявки термин "трансфекция" относится к введению нуклеиновокислотного вектора в клетку-хозяина (прокариотическую или эукариотическую) и включает, таким образом, термин "трансформация".
Трансфекция может быть стабильной или транзиторной трансфекцией.
Промотор катепсина H является частью гена катепсина H, способной управлять экспрессией генного продукта, представляющего интерес, если он введен в подходящий вектор экспрессии выше кодирующей последовательности генного продукта. Промотор катепсина H является частью геномной вышележащей 5'-последовательности гена катепсина H, который управляет активацией транскрипции расположенного ниже, транскрибируемого участка и может быть найден, например, в Ishidoh et al., FEBS letters, 1989 или Ishidoh et al, Biomed. Biochim. Acta, 1991, 50(4): 541-7.
Ген-репортер может быть любым геном, который позволяет легко провести количественное определение своего генного продукта. Многообразие генов-репортеров для эукариотических или прокариотических хозяев, а также методы детекции и необходимые реагенты известны в данной области техники и являются коммерчески доступными. Они включают, например, гены бета-лактамазы (lacZ), люциферазы, зеленого или синего флуоресцентного белка (GFP или BFP), DsRed, HIS3, URA3, TRP1 или LEU2 или бета-галактозидазы. Указанные гены кодируют белки, которые можно легко обнаружить с помощью видимой (цветной или люминесцентной) реакции (например, lacZ, люцифераза). Они включают генные продукты, которые можно легко обнаружить с помощью видимой (цветной или люминесцентной) реакции, или генные продукты, придающие устойчивость к антибиотикам, таким как ампициллин или канамицин, при их экспрессии. Другие продукты гена-репортера дают возможность экспрессирующим клеткам расти в определенных условиях, как например, ауксотрофные гены.
Функциональный фрагмент гена-репортера представляет собой любой фрагмент указанного гена-репортера, который позволяет легко провести количественное определение его генного продукта.
В контексте настоящей заявки термин "трансфекция" относится к введению нуклеиновокислотного вектора в клетку-хозяина (прокариотическую или эукариотическую) и таким образом включает термин "трансформация".
Трансфекция может быть стабильной или транзиторной трансфекцией.
Клетка может представлять собой любую прокариотическую или эукариотическую клетку, способную к трансфекции нуклеиновокислотным вектором и к экспрессии гена-репортера. Клетки включают, прежде всего, первичные клетки и клетки клеточной культуры, предпочтительно культуры эукариотических клеток, включая клетки, полученные из многоклеточных организмов и тканей (такие как клетки HeLA, CHO, COS, SF9 или 3T3) или из одноклеточных организмов, таких как дрожжи (например, s. pombe или s. cerevisiae), или культуры прокариотических клеток, предпочтительно Pichia или E.coli. Клетки и образцы, извлекаемые из ткани, могут быть получены хорошо известными методами, такими как забор крови, пункция тканей или хирургические методы.
В контексте указанного выше аспекта настоящего изобретения контрольный вектор может быть любым подходящим вектором, который содержит ген-репортер или его функциональный фрагмент, но в котором экспрессия гена-репортера не управляется (функциональным) промотором катепсина H. Данный факт может означать, например, что ген-репортер или его функциональный фрагмент не связан функционально с функциональным промотором катепсина H (т.е. либо полностью лишенный промотора катепсина H, содержит нефункциональный промотор катепсина H или фрагмент промотора, либо в котором соединение промотора и гена-репортера не является функциональным). Другая возможность заключается в том, что ген-репортер или его функциональный фрагмент функционально связан с другим промотором, чем промотор катепсина H (например, SV40 или другой стандартный промотор). Функциональный вектор и контрольный вектор также могут быть трансфицированы в одну и ту же клетку, но в таком случае гены-репортеры должны быть различными.
Идентификация соединений в соответствии с указанными выше способами применения может быть осуществлена, например, согласно тестам, описанным ниже или известным в данной области техники.
Тест представляет собой любой тип аналитического метода или системы для наблюдения за биологическим процессом. Соответственно, молекулярные каскады и механизмы, представляющие собой части физиологических метаболических путей, а также патологических состояний, воспроизводятся в клеточных или биохимических (in vitro) системах. Фармакологическую активность предполагаемого фармацевтического соединения, таким образом, можно определить по его способности влиять на указанные каскады или механизмы или модулировать их.
Для применения в скрининге лекарственного средства, особенно высокопроизводительном скрининге новых фармацевтических соединений, тест должен быть воспроизводимым, а также предпочтительно масштабируемым и надежным. В объеме настоящего изобретения высокопроизводительный скрининг означает, что способ по настоящему изобретению проводят в очень небольшом масштабе, например, на 96, 386 или 1536-луночных планшетах в образцах очень небольшого объема в диапазоне от нескольких миллилитров до нескольких нанолитров или даже меньше. Таким образом, очень большое количество образцов можно проанализировать за короткое время. Высокопроизводительный скрининг преимущественно включает скрининг приблизительно 500000 различных соединений на определенное свойство с помощью всего одного теста. Тест предпочтительно подходит для высокопроизводительного скрининга химических веществ на их способность модулировать активность рассматриваемой молекулы-мишени. Тип теста зависит, например, от типа используемой молекулы-мишени (например, полипептид или полинуклеотид) и от "считывания", т.е. параметра, по которому определяют активность молекулы-мишени (см. ниже).
Различные типы таких тестов широко известны из уровня техники и коммерчески доступны от частных поставщиков.
Тесты, подходящие для различных целей, включают радиоизотопные или флуоресцентные тесты, например, тесты на основе флуоресцентной поляризации (такие как тесты, коммерчески предлагаемые Panvera) или Packard BioScience (HTRF; ALPHAScreen™) для измерения взаимодействия меченого члена с немеченым членом (например, взаимодействие меченых белков с их не мечеными белками-лигандами).
Дополнительные примеры включают клеточные тесты, в которых клеточная линия стабильно (индуцибельно или нет; в хромосомальной или эписомальной форме) или транзиторно экспрессирует рекомбинантный белок, представляющий интерес. Указанные тесты включают, например, тесты с использованием гена-репортера, в которых регуляция определенного промотора или пути сигнальной трансдукции участника каскада сигнальной трансдукции измеряют по активности репортерного фермента, экспрессия которого находится под контролем указанного определенного промотора. Для данного типа теста должна быть сконструирована рекомбинантная клеточная линия, содержащая ген-репортер под управлением определенного промотора, который исследуют или который регулируется изучаемым сигнальным каскадом. Подходящие репортерные ферменты широко известны из уровня техники и включают люциферазу светлячков, люциферазу Renilla (например, коммерчески доступные от Packard реагенты), β-галактозидазу. Подходящие клеточные линии зависят от цели теста, но преимущественно включают клеточные линии, которые легко трансфицировать и легко культивировать, такие как, например, HeLA, COS, CHO, NIH-3T3 и т.д.
Известны типичные форматы тестов для определения протеазной активности: например, применение субстрата, несущего репортерный маркер (например, белок/пеп