Коньюгаты для предупреждения или лечения никотиновой зависимости
Иллюстрации
Показать всеИзобретение относится к конъюгатам, в частности представлен никотиновый гаптен-носитель формулы (III):
W представляет собой -О- и находится в положении 5 пиридинового кольца; -(спейсер)- представляет собой С1-С8алкиленовую группу, С3-С10циклоалкиленовую группу или С1-С12алкиленовую группу, прерванную 1-4 атомами кислорода и возможно прерванную группой -N(H)C(O)-; X* представляет собой -NH- или -S-; m означает 1; n означает целое число от 1 до 1000; и Y представляет собой возможно модифицированный белок-носитель, выбранный из бактериальных анатоксинов, иммуногенных веществ, вирусов, вирусоподобных частиц, белковых комплексов, белков, полипептидов, липосом и иммуностимулирующих комплексов, которые могут быть использованы для приготовления вакцин для лечения и/или предупреждения никотиновой зависимости. 2 н. и 6 з.п. ф-лы, 23 ил.,7 табл., 22 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к никотиновым гаптенам, конъюгатам гаптен-спейсер и конъюгатам гаптен-носитель, которые служат в качестве антигенного компонента в анти-никотиновых вакцинах. Изобретение также относится к вакцинным композициям, содержащим антигены на основе таких конъюгатов никотиновый гаптен-носитель, приготовленным с адъювантами. Такие композиции применяют для увеличения частоты отказов от курения или снижения частоты рецидивов при попытках прекращения курения и при лечении табачной/никотиновой зависимости.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Курение оказывает множество серьезных вредных воздействий на здоровье и, в связи со многими государственными инициативами по снижению или предупреждению курения, становится социально менее приемлемым. Как следствие, многие курильщики желают бросить эту привычку, и, несмотря на многие предпринимаемые ежегодно попытки, только очень незначительное количество курильщиков контролирует себя, отказавшись от курения безвозвратно. Очень высокое количество неудач является результатом наркотической природы никотина плюс легкая доступность сигарет.
При курении или употреблении никотина в других формах (например, в нюхательных формах, в формах пластырей и жевательных резинок) никотин поступает в кровоток и после этого быстро поступает в головной мозг, где он стимулирует никотиновые ацетилхолиновые рецепторы, вызывая высвобождение дофамина, который в свою очередь активирует центры удовольствия. При попытке бросить курить теряется удовольствие, а также возникают симптомы отмены, включающие ухудшение когнитивной функции. Основной причиной рецидива является то, что утрата удовольствия и неприятные симптомы отмены сразу же могут быть ослаблены курением.
Существуют различные невакцинные терапии для прекращения курения. Никотин-заместительные терапевтические средства, такие как содержащая никотин жевательная резинка или содержащие никотин кожные пластыри, могут помочь отучить курильщиков от сигарет, но они не разрывают цикл зависимости, вызываемой никотином. Другой подход заключается в применении лекарственных средств, направленно воздействующих на никотиновые ацетилхолиновые рецепторы, таких как варениклин. Такие лекарственные средства, которые снижают удовольствие, обычно получаемое при курении, были относительно успешными при оказании помощи в отказе от курения, однако после окончания лечения лекарственным средством частота рецидивов остается высокой, поскольку какое-либо отклонение (например, курение одной сигареты) легко может превратиться в полный рецидив с реактивацией центров удовольствия.
Самые последние стратегии оказания помощи в отказе от никотина фокусируются на вакцинах, которые стимулируют иммунную систему продуцировать антиникотиновые антитела, которые связываются с никотином в кровотоке и за счет этого снижают количество и скорость, с которой никотин может поступать в головной мозг. Это в свою очередь предотвращает активацию центров удовольствия и способствует разрыву цикла зависимости. Поскольку антитела, индуцированные вакцинами, могут быть долгоживущими, анти-никотиновые вакцины полезны для оказания помощи в отказе от курения, а также для предупреждения рецидива. Дополнительно, поскольку антитела действуют на периферии, риск неблагоприятных воздействий на центральную нервную систему (ЦНС) отсутствует. Примеры таких вакцин приведены в WO 00/32239, WO 02/49667, WO 03/82329 и US 2006/111271. Производные никотина описаны в ЕР-А-421762, WO 01/70730, WO 01/80844 и US 2005/119480. Дополнительные производные никотина идентифицированы под регистрационными номерами 136400-02-7, 250683-10-4, 861023-80-5 и 861025-04-9. Никотиновые гаптены описаны в WO 99/61054, WO 02/58635, WO 03/82329, WO 2005/40338 и ЕР-А-1849780.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к никотиновым гаптенам, конъюгатам гаптен-спейсер и способам конъюгирования, которые могут быть использованы для получения иммуногенных конъюгатов гаптен-носитель для применения в вакцинах, предназначенных для увеличения числа бросивших курить или для снижения частоты рецидивов при попытках лечения с целью прекращения курения. Изобретение также относится к вакцинным композициям, содержащим вышеупомянутые конъюгаты вместе с адъювантами или эксципиентами, которые применяют для иммунизации курильщиков с целью выработки антител против гаптенов, которые в свою очередь будут также распознавать и специфически связываться с никотином. Изобретение также относится к способу увеличения частоты отказов от курения или снижения частоты рецидивов при попытках лечения с целью прекращения курения, включающему введение конъюгата гаптен-носитель курильщикам, желающим бросить курить. В других воплощениях вакцину можно применять у некурильщиков для предупреждения формирования у них зависимости от никотина, если после этого они будут подвергаться его воздействию посредством курения или употребления других средств.
Конъюгаты никотиновый гаптен-носитель по изобретению могут иметь преимущество в том, что они являются более иммуногенными, более специфическими, более стабильными или имеют другие более полезные свойства, чем конъюгаты никотиновый гаптен-носитель, известные в данной области.
Конъюгаты никотиновый гаптен-носитель по изобретению могут представлять собой более иммуногенные антигены, чем другие известные конъюгаты никотиновый гаптен-носитель для применения в антиникотиновых вакцинах. Кроме того, вакцинные композиции, содержащие конъюгаты никотиновый гаптен-носитель по изобретению в качестве антигена вместе с адъювантами, могут быть более иммуногенными, чем другие антиникотиновые вакцинные композиции, которые обычно содержат в качестве адъюванта гидрат окиси алюминия, и могут обеспечивать более высокие показатели частоты отказов от курения и более низкие показатели частоты рецидивов среди пациентов с зависимостью от никотина/табака и желанием бросить курить. Благодаря лучшей иммуногенности, присущей антигену, а также усилению адъювантами, вакцинные композиции по изобретению могут также продуцировать более высокие титры антиникотиновых антител быстрее и с меньшими дозами, приводя в результате к лучшему соблюдению пациентами режима и схемы лечения, по сравнению с вакцинными композициями, известными в данной области.
Пути синтеза никотиновых гаптеновых соединений по изобретению могут иметь преимущество в том, что они обеспечивают увеличение общего выхода в ходе синтеза (предпочтительно вплоть до 20-кратного увеличения общего выхода в ходе синтеза), включают меньшее количество стадий синтеза, обеспечивают более высокую чистоту полученных никотиновых гаптенов (например, чистоту>99%) или имеют другие более полезные свойства, чем пути синтеза никотиновых гаптеновых соединений, известные в данной области.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 иллюстрирует влияние иммунизации мышей вакцинами, содержащими конъюгаты никотиновых гаптенов по изобретению вместе с адъювантами, на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновыми гаптенами (из Получений 4, 7, 8 и 12), конъюгированными с дифтерийным анатоксином (DT; 10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555, 21-мерный агонист TLR9, содержащий иммуностимулирующие мотивы CpG (50 мкг). Уровни антиникотиновых антител (суммарные IgG (иммуноглобулины G)) (Анти-NIC IgG) в плазме крови измеряли методом ELISA (твердофазный иммуноферментный анализ).
Фиг.2 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, содержащими антигены-конъюгаты, которые содержат гаптены по изобретению, на авидность результирующих антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновыми гаптенами (из Получений 4, 7, 8 и 12), конъюгированными с дифтерийным анатоксином (DT; 10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Индекс авидности соответствует концентрации тиоцианата аммония, необходимой для элюирования 50% антиникотиновых антител из планшетов, покрытых никотин-BSA (бычий сывороточный альбумин), и необходимость в использовании более высоких концентраций свидетельствует о более высокой авидности антител.
Фиг.3 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, содержащими антигены-конъюгаты, которые содержат гаптены по изобретению, на распределение внутривенно (в.в.) введенного 3H-никотина в головном мозге и крови. Мышей BALB/c (n=6 на группу) иммунизировали никотиновыми гаптенами (из Получений 4, 7, 8 и 12), конъюгированными с дифтерийным анатоксином (DT; 10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после последней реиммунизации посредством внутривенной инъекции вводили 3H-никотин (3H-Nic) (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли соотношение 3H в плазме/в головном мозге.
Фиг.4 иллюстрирует взаимодействие с никотином антиникотиновых антител после иммунизации мышей вакцинами, полученными из гаптенов по изобретению. Мышей BALB/c (n=12 на группу) иммунизировали никотиновыми гаптенами (из Получений 4, 7, 8 и 12), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после последней реиммунизации взаимодействие антиникотиновых антител с никотином определяли методом конкурентного ELISA.
Фиг.5 иллюстрирует специфичность антиникотиновых антител после иммунизации мышей вакцинами, содержащими гаптены по изобретению. Мышей BALB/c (n=12 на группу) иммунизировали никотиновыми гаптенами (из Получений 4 и 12), конъюгированными с дифтерийным анатоксином (DT; 10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после последней реиммунизации специфичность антиникотиновых антител к никотину, котинину, ацетилхолину и варениклину определяли методом конкурентного ELISA.
Фиг.6 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, в которых использованы разные спейсеры для конъюгирования никотинового гаптена по изобретению с носителем, на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 4; 5'-аминопропилникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем в конъюгатах использованы разные линкеры (Получения 24-34), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и 50 мкг CpG 24555. Уровни антиникотиновых IgG Ab (антитела класса IgG) в плазме крови измеряли методом ELISA.
Фиг.7 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, в которых использованы разные спейсеры для конъюгирования никотинового гаптена по изобретению с носителем, на уровни и авидность антиникотиновых антител в плазме крови и на распределение 3H-никотина в плазме крови и головном мозге. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 4; 5'-аминопропилникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем в конъюгатах использованы разные линкеры (Получения 24-34), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после 3-ей иммунизации уровни антиникотиновых IgG Ab в плазме крови измеряли методом ELISA, и авидность измеряли анализом с использованием тиоцианата аммония, эн-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина) вводили внутривенной инъекцией, кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли соотношение 3H в плазме/в головном мозге.
Фиг.8 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, в которых использованы разные спейсеры для конъюгирования никотинового гаптена по изобретению с носителем, на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтоксиникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем в конъюгатах использованы разные линкеры (Получения 24-34), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA.
Фиг.9 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, в которых использованы разные спейсеры для конъюгирования никотинового гаптена по изобретению с носителем, на уровни и авидность антиникотиновых антител в плазме крови и на распределение 3H-никотина в плазме крови и головном мозге. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтоксиникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем в конъюгатах использованы разные линкеры (Получения 24-34), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после 3-ей иммунизации уровни антиникотиновых IgG Ab в плазме крови измеряли методом ELISA, и авидность измеряли анализом с использованием тиоцианата аммония, 3H-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина) вводили внутривенной инъекцией, кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли соотношение 3Н в плазме/в головном мозге.
Фиг.10 иллюстрирует влияние сукцинилирования конъюгатов гаптен-носитель по изобретению на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 4; 5'-аминопропилникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем каждый конъюгат был получен с использованием 2 разных условий, со стадией или без стадии использования янтарного ангидрида, посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA.
Фиг.11 иллюстрирует влияние сукцинилирования конъюгатов гаптен-носитель по изобретению на распределение 3H-никотина в крови и в головном мозге. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 4; 5'-аминопропилникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг), причем каждый конъюгат получен с использованием 2 разных условий, со стадией или без стадии использования янтарного ангидрида, посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через 2 недели после последней реиммунизации вводили внутривенной инъекцией эн-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H в головном мозге и в плазме крови.
Фиг.12 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами, в которых использованы разные спейсеры для конъюгирования никотинового гаптена по изобретению с носителем, на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтоксиникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг) или CRM197 (10 мкг), причем в конъюгатах использованы разные линкеры (Получения 24-34), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA.
Фиг.13 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами на распределение 3H-никотина у мышей. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтоксиникотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг) или CRM197 (10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через две недели после третьей иммунизации вводили внутривенной инъекцией 3H-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3Н и определяли % изменения уровня 3H-никотина в головном мозге относительно контрольных животных.
Фиг.14 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами на уровни антиникотиновых антител в плазме крови в разные моменты времени. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтокси никотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг) или CRM197 (10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Оценивали диапазон разных гаптеновых нагрузок. Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA.
Фиг.15 иллюстрирует влияние иммунизации мышей антиникотиновыми вакцинами на распределение 3H-никотина у мышей. Мышей BALB/c (n=12 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтокси никотин), конъюгированным с дифтерийным анатоксином (DT; 10 мкг) или CRM197 (10 мкг), посредством внутримышечной вакцинации (в дни 0, 28, 42) в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Оценивали диапазон разных гаптеновых нагрузок. Через две недели после третьей иммунизации вводили внутривенной инъекцией 3H-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли % изменения уровня 3H-никотина в головном мозге относительно контрольных животных.
Фиг.16-18 иллюстрируют влияние иммунизации мышей антиникотиновыми вакцинами на уровни антиникотиновых антител и авидность в плазме крови в разные моменты времени. Мышей BALB/c (n=10 на группу) иммунизировали никотиновым гаптеном (Получение 12; 5'-аминоэтоксиникотин), конъюгированным с CRM197 (10 мкг), посредством внутримышечной вакцинации в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг) или в присутствии ISCOMATRIX (IMX; от 0,1 до 3,0 единиц). Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA (день 21 и день 28), и авидность измеряли методом ELISA-ингибирования. На Фиг.16[i] представлены результаты через 3 недели после 1-ой дозы; и на Фиг.16[ii] представлены результаты через 1 неделю после 2-ой дозы. Фиг.17 иллюстрирует авидность (IC50) через 1 неделю после 2-ой дозы. Фиг.18 иллюстрирует секвестрацию никотина в плазме крови (вверху) и захват никотина в головной мозг (внизу).
Фиг.19 и Фиг.20 иллюстрируют влияние условий конъюгирования для конъюгатов никотиновый гаптен-носитель из Таблицы 6 на уровни антиникотиновых антител и соответствующие значения IC50. Мышей BALB/c (n=10 на группу) иммунизировали никотиновым гаптеном посредством внутримышечной вакцинации в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Уровни антиникотиновых антител (суммарные IgG) в плазме крови измеряли методом ELISA, и авидность измеряли методом ELISA-ингибирования.
Фиг.21 и Фиг.22 иллюстрируют распределение 3H-никотина в крови и в головном мозге для конъюгатов гаптен-носитель из Таблицы 6. Мышей BALB/c (n=10 на группу) иммунизировали никотиновым гаптеном посредством внутримышечной вакцинации в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и CpG 24555 (50 мкг). Через одну неделю после второй иммунизации вводили внутривенной инъекцией 3H-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли % изменения уровня 3H-никотина в крови и в головном мозге относительно контрольных животных.
На Фиг.23 представлены результаты тестирования в отношении связывания конъюгатов гаптен-носитель, имеющих разный процент мономерного белка-носителя, с CpG/Alhydrogel. Связывание определяли путем инкубирования CpG/Alhydrogel с известным количеством конъюгата гаптен-носитель и последующего измерения концентрации конъюгата, оставшегося в растворе после инкубирования. % снижения концентрации конъюгата эквивалентен % связывания конъюгата с CpG/Alhydrogel. Мышей BALB/c (n=10 на группу) иммунизировали 10 мкг разных конъюгатов внутримышечной инъекцией в присутствии гидрата окиси алюминия (квасцы; Alhydrogel-85: 40 мкг Al3+) и 10 мкг CpG 24555. Через одну неделю после второй иммунизации вводили внутривенной инъекцией 3H-никотин (0,05 мг/кг никотина, содержащего 3 мкКи 3H-никотина), кровь собирали, животных перфузировали, головной мозг извлекали, количественно определяли уровни 3H и определяли % изменения уровня 3H-никотина в крови и в головном мозге относительно контрольных животных.
[На Фиг.1-23: GMT = среднее геометрическое значение титра; CI = доверительный интервал; SEM = среднеквадратическая погрешность; OD = оптическая плотность]
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 является нуклеотидной последовательностью иммуностимулирующего олигонуклеотида ODN CpG 24555.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к гаптену формулы (I):
(1) где W представляет собой -СН2- или -O-; и Х представляет собой -NH2 или -SH.
В одном воплощении W находится в положении 2, 5 или 6 пиридинового кольца.
В другом воплощении W находится в положении 5 пиридинового кольца.
В другом воплощении W представляет собой -O-.
В другом воплощении W представляет собой -O-; и W находится в положении 5 пиридинового кольца.
В еще одном воплощении гаптен представляет собой
, ,
и .
В другом воплощении гаптен представляет собой
или .
В еще одном воплощении гаптен представляет собой .
Во втором аспекте изобретение относится к конъюгату гаптен-спейсер формулы (II):
где W представляет собой -СН2- или -O-; -(спейсер)- представляет собой С1-С8алкиленовую группу, С3-С10циклоалкиленовую группу или С1-С12алкиленовую группу, прерванную 1-4 атомами кислорода и возможно прерванную группой -N(H)C(O)-; и Х представляет собой -NH2 или -SH.
Используемый в данном описании термин "алкиленовая группа" означает группу -(СН2)n-, в которой n означает требуемое количество атомов углерода. Используемое в данном описании выражение "алкиленовая группа, прерванная 1-4 атомами кислорода" означает, например, -CH2CH2OCH2-, -CH2CH2OCH2CH2OCH2- или -CH2CH2OCH2CH2OCH2CH2OCH2CH2OCH2CH2-. Используемое в данном описании выражение "алкиленовая группа, прерванная 1-4 атомами кислорода и прерванная группой -N(H)C(O)-" означает, например, -CH2CH2CH2OCH2CH2OCH2CH2OCH2CH2CH2NHCOCH2CH2-.
В одном воплощении W находится в положении 2, 5 или 6 пиридинового кольца.
В другом воплощении W находится в положении 5 пиридинового кольца.
В еще одном воплощении W представляет собой -O-.
В другом воплощении W представляет собой -O-; и W находится в положении 5 пиридинового кольца.
В одном воплощении -(спейсер)- представляет собой С1-С6алкиленовую группу.
В другом воплощении -(спейсер)- представляет собой C1-С10алкиленовую группу, прерванную 1-4 атомами кислорода.
В еще одном воплощении -(спейсер)- представляет собой С1-С12алкиленовую группу, прерванную 3 атомами кислорода и прерванную группой -N(Н)С(O)-.
В одном воплощении конъюгат гаптен-спейсер представляет собой
.
Следующие дополнительные воплощения предусматривают:
(1) конъюгат гаптен-спейсер формулы (II), как описано выше, где W представляет собой -O-;
(2) конъюгат гаптен-спейсер формулы (II), как описано выше, где W представляет собой -СН2-;
(3) конъюгат гаптен-спейсер формулы (II), как описано выше или в воплощениях (1) и (2), где Х представляет собой -SH;
(4) конъюгат гаптен-спейсер формулы (II), как описан выше или в воплощениях (1)-(3), где W находится в положении 2, 5 или 6 пиридинового кольца;
(5) конъюгат гаптен-спейсер формулы (II), как описано выше или в воплощениях (1)-(4), где W находится в положении 5 пиридинового кольца;
(6) конъюгат гаптен-спейсер формулы (II), как описано выше или в воплощениях (1)-(5), где -(спейсер)- представляет собой С1-С8алкиленовую группу, С6циклоалкиленовую группу или С1-С12алкиленовую группу, прерванную 1-4 атомами кислорода и возможно прерванную группой -N(Н)С(O)-; и
(7) конъюгат гаптен-спейсер формулы (II), как описано выше или в воплощениях (1)-(6), где -(спейсер)- представляет собой C1-С8алкиленовую группу.
На приведенных ниже схемах, иллюстрирующих общие способы получения соединений формулы (I), заместители такие, как определено выше для соединений формулы (I) или их производных, если не указано иное.
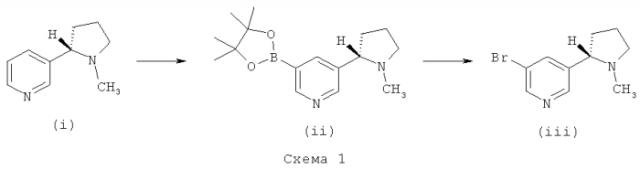
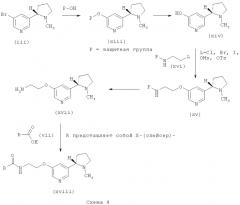
Боронатный эфир (ii) может быть образован в результате реакции (S)-(-)-никотина (i) с подходящим иридиевым катализатором, типично димером метокси(циклооктадиен)иридия(1), лигандом, таким как 4,4'-ди-трет-бутил-2,2'-дипиридил, и источником бора, таким как бис(пинаколато)дибор или 4,4,5,5-тетраметил-1,3,2-диоксаборолан, в подходящем растворителе, таком как 1,4-диоксан или THF (тетрагидрофуран), при температуре от комнатной температуры до температуры дефлегмации. Боронатный эфир (ii) затем может быть превращен в бромид (iii) с использованием бромида меди(И) в подходящей системе растворителей, такой как метанол/вода или этанол/вода, обычно при температуре от 60°С до температуры дефлегмации.
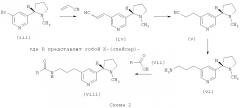
Бромид (iii) затем может быть превращен в ненасыщенный цианид (iv) при взаимодействии с акрилонитрилом в условиях реакции сочетания в присутствии палладия с использованием подходящего источника палладия, такого как ацетат палладия(П) или тетракис(трифенилфосфин)палладий, в присутствии подходящего фосфинового лиганда, такого как три(орто-толил)фосфин или трифурилфосфин, в присутствии подходящего основания, такого как карбонат натрия, триэтиламин или М-диизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил или 1,4-диоксан, обычно при температуре, приблизительно равной температуре дефлегмации.
Гидрирование соединения формулы (iv) до образования соединения формулы (v) обычно проводят с использованием подходящего катализатора, такого как палладий на углероде, гидроксид палладия на углероде или платина на активированном угле, в атмосфере водорода в подходящем растворителе, такой как метанол, этанол или этилацетат, обычно при температуре, приблизительно равной комнатной температуре.
Восстановление нитрила (v) в амин (vi) обычно проводят с использованием подходящего катализатора, такого как никель Ренея, в атмосфере водорода (обычно при давлении примерно 50-100 фунт/кв.дюйм (345-690 кПа)) в подходящем растворителе, таком как метанол или этанол, в присутствии концентрированного раствора аммиака, обычно при температуре примерно 40-70°С.
Образование амидов типа (viii) может быть осуществлено в стандартных условиях, известных из литературы. Кислота (vii) может быть превращена в хлорангидрид кислоты с использованием хлорирующего агента, такого как оксалилхлорид или тионилхлорид, в подходящем растворителе, таком как дихлорметан или толуол, возможно в присутствии каталитического количества DMF, при подходящей температуре, обычно от 0°С до комнатной температуры. Хлорангидрид кислоты затем может быть подвергнут взаимодействию с амином (vi) в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или толуол, при температуре от 0°С до комнатной температуры. Альтернативно, кислота (vii) может быть превращена в подходящее активированное соединение с использованием агента сочетания, такого как Т3Р, EDCI.HCl (гидрохлорид 1-этил-3-(3-диметиламинопропил)-карбодиимида), EDCI.Mel (метилйодид 1-этил-3-(3-диметиламинопропил)-карбодиимида), HBTU (гексафторфосфат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония), HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония), PyBop (гексафторфосфат бензотриазол-1-ил-окси-трис(пирролидино)фосфония), DCC (N,N'-дициклогексилкарбодиимид) или CDI (N,N'-карбонилдиимидазол), в подходящем растворителе, таком как дихлорметан или DMF. В присутствии EDCI.HCl или EDCI.Mel возможно добавляют НОВТ (1-гидроксибензотриазол). Также используют подходящее основание, такое как триэтиламин или диизопропилэтиламин, и реакцию обычно проводят при комнатной температуре.
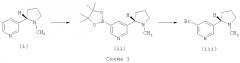
Депротонирование соединения (i) может быть осуществлено с использованием подходящего основания, такого как супероснование nBuLi-LiDMAE (продукт реакции н-бутиллития с диметиламиноэтанолом), в подходящем растворителе, таком как гексан, толуол, смесь гексан/толуол или смесь гексан/THF, при подходящей температуре, обычно от -78°С до 0°С. Образовавшийся анион можно блокировать подходящим источником хлора, таким как гексахлорэтан или М-хлорсукцинимид, при температуре от -78°С до комнатной температуры, с получением двух аналогов хлорпиридина (ix) и (х).
Аналоги хлорпиридина (ix) и (х) могут быть превращены в амины (xi) и (xii) с использованием этаноламина, предпочтительно в качестве растворителя и реагента, и с использованием подходящего сильного основания, такого как гидрид натрия или mpem-бутоксид калия, при температуре обычно 50-100°С.
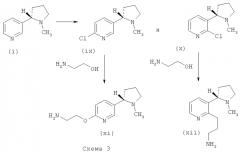
Бромид (iii) может быть подвергнут взаимодействию со спиртом, несущим на себе защитную группу (например бензиловым спиртом или, предпочтительно, пара-метоксибензиловым спиртом), с использованием подходящего основания, обычно гидрида натрия, в подходящем растворителе, такой как DMF или NMP (N-метилпирролидинон), обычно при температуре примерно 90-130°С. Удаление защитной группы с образованием соединения (xiv) может быть осуществлено с использованием стандартных способов, известных из литературы (например, в случае пара-метоксибензилового спирта можно использовать подходящую кислоту, такую как трифторуксусная кислота).
Спирт (xiv) может быть превращен в защищенный амин (xv) (защитной группой предпочтительно является ВОС (бутоксикарбонил)) с использованием подходящего алкилирующего агента (xvi), такого как галогенид, мезилат или тозилат, и основания, такого как карбонат калия или карбонат цезия, в подходящем растворителе, таком как ацетонитрил или DMF, обычно при температуре от 80°С до температуры дефлегмации. Удаление защитной группы амина может быть осуществлено стандартными способами, известными из литературы, с получением соединения (xvii) (например, в случае защитной группы ВОС удаление защитной группы может быть осуществлено с использованием подходящего источника кислоты, такого как трифторуксусная кислота или хлористый водород, в подходящем растворителе, таком как 1,4-диоксан, THF или дихлорметан).
Образование амидов типа (xviii) может быть осуществлено в стандартных условиях, известных из литературы. Кислота (vii) может быть превращена в хлорангидрид кислоты с использованием подходящего хлорирующего агента, такого как оксалилхлорид или тионилхлорид, в подходящем растворителе, таком как дихлорметан или толуол, возможно в присутствии каталитического DMF, при подходящей температуре, обычно от 0°С до комнатной температуры. Хлорангидрид кислоты затем может быть подвергнут взаимодействию с амином (xvii) в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или толуол, при температуре от 0°С до комнатной температуры. Альтернативно, кислота (vii) может быть превращена в подходящее активированное соединение с использованием агента сочетания, такого как Т3Р, EDCI.HCl, EDCI.Mel, HBTU, HATU, PyBop, DCC или CDI, в подходящем растворителе, таком как дихлорметан или DMF. В присутствии EDCI.HCl или EDCI.Mel возможно добавляют НОВТ. Подходящее основание, такое как триэтиламин или диизопропилэтиламин, также используют, и реакцию обычно проводят при комнатной температуре. Альтернативно, амин (xvii) может быть подвергнут взаимодействию с ангидридами кислот или лактонами с получением дополнительных производных общей структурной формулы (xviii). Например, гамма-бутиролактон или гамма-тиобутиролактон может быть использован в качестве источника ацила на этой стадии, или, например, ангидрид, такой как ангидрид янтарной или фталевой кислоты, с получением производных (xviii).
Спирт (xiv) может быть также получен через боронатный эфир (ii) с использованием подходящего окислителя, обычно перекиси водорода, и подходящей кислоты, такой как уксусная кислота, в подходящем растворителе, таком как ТНР или 1,4-диоксан.
В третьем аспекте изобретение относится к конъюгату гаптен-носитель формулы (III):
где W представляет собой -CH2- или -O-; -(спейсер)- представляет собой С1-С8алкиленовую группу, С1-С12алкиленовую группу, прерванную 1-4 атомами кислорода и возможно прерванную группой -N(Н)С(O)-, или С3-С10циклоалкиленовую группу; m означает 0 или 1; X* представляет собой -N(Н)- или -S-; n означает целое число от 1 до 1000; и Y представляет собой возможно модифицированный белок-носитель, выбранный из бактериальных анатоксинов, иммуногенных веществ, вирусов, вирусоподобных частиц, белковых комплексов, белков, полипептидов, липосом и иммуностимулирующих комплексов.
В некоторых воплощениях Y представляет собой дифтерийный анатоксин или CRM197.
Для присоединения гаптенов к белкам-носителям описанные ниже способы являются иллюстративными. Белок-носитель, такой как дифтерийный анатоксин (DT) или CRM197, например, может быть активирован путем обработки ангидридом, например ангидридом янтарной кислоты, с получением дериватизированной версии белка-носителя (xix). Это производное затем может быть связано с гаптеном (xvii) в присутствии стандартного реагента сочетания в результате превращения в подходящее активированное соединение с использованием, например, Т3Р, EDCI.HCl, EDCI.Mel, HBTU, HATU, PyBop, DCC или CDI, в подходящем растворителе или буфере (таком как забуференный фосфатами физиологический раствор, модифицированный по Дульбекко). В присутствии EDCI.HCl или EDCI.Mel, возможно добавляют НОВТ или N-гидроксисукцинимид (или его сульфатированный вариант), и реакцию обычно проводят при комнатной температуре с получением конъюгатов (хх). Альтернативно, стадия сукцинилирования/дериватизации может быть опущена, и может быть осуществлено прямое связывание гаптена со свободными карбоксильными группами на белке-носителе вышеописанными способами с получением конъюгатов (xxiv). Альтернативно, белок-носитель может быть обработан