Способ эндоваскулярной коррекции феномена "no-reflow" у пациентов с острым коронарным синдромом с подъемом сегмента st при проведении первичного чрескожного коронарного вмешательства инфаркт-зависимой артерии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к интервенционной кардиологии. Выполняют коронароангиографию, выявляют острую тромботическую окклюзию или стеноз, оценивают диаметр артерии, дистальный кровоток по градации степени восстановления коронарного кровотока и перфузии миокарда. Проводят коронарный проводник 0,014 дюйма в дистальные отделы ИЗА, после чего по проводнику устройством для аспирации тромба выполняют тромбаспирацию из ИЗА. Аспирационный катетер подсоединяют к Y-коннектору и по первому коронарному проводнику подводят к тромбу ИЗА, через основную шахту проводят второй коронарный проводник, по которому проводят коронарный баллон диаметром и длиной не более 1,5×10 мм и длиной доставки не менее 1500 мм за тромботическую окклюзию, раздувают его номинальным давлением в дистальной части ИЗА. Выполняют аспирацию тромба через дополнительный канал Y-коннектора. Коронарный проводник удаляют из основной шахты коронарного баллона и через нее вводят раствор вазодилататора в сочетании с внутривенным болюсным введением раствора эптифибатида в дозе 180 мкг/кг. После восстановления кровотока и перфузии миокарда выполняют стентирование ИЗА. Способ позволяет повысить лечебный эффект операции, обеспечить защиту дистальных ветвей от миграции остаточных тромботических масс, а также осуществить возможность одномоментной баллонной ангиопластики дестабилизированной атероматозной бляшки или пристеночных мелких тромботических масс. 7 ил., 1 пр.
Реферат
Изобретение относится к медицине, а именно к интервенционной кардиологии, и может быть использовано при рентгеноэндоваскулярных вмешательствах на коронарных артериях у пациентов с острым коронарным синдромом с подъемом сегмента ST, осложненным острым тромбозом инфаркт-зависимой артерии.
На сегодняшний день острый инфаркт миокарда (ОИМ) является одной из основных причин смертности и инвалидизации в экономически развитых странах, а также в Российской Федерации. Открытие основных патофизиологических механизмов острого нарушения коронарного кровотока позволило разработать ряд лечебных мероприятий, применение которых снижает риск неблагоприятных исходов заболевания. Наряду с антиагрегантной, антикоагулянтной терапией в настоящее время ведущее место в перечне методов патофизиологического лечения отводится хирургической реваскуляризации. Госпитальная летальность после коронарного шунтирования (КШ) при лечении инфаркта миокарда с подъемом сегмента ST (ИМпST) в первые 48 часов от начала приступа достигает 50%. Что наряду с лимитом времени восстановления кровотока в инфаркт-зависимом сосуде является основным сдерживающим фактором использования данного метода реваскуляризации у больных ИМпST. Наоборот, последние достижения интервенционной кардиологии позволили продемонстрировать неоспоримые преимущества чрескожных эндоваскулярных технологий над медикаментозным лечением, что ставит стратегию первичного чрескожного коронарного вмешательства (ЧКВ) в положение приоритетной методики в лечении ИМпST.
Существующие в настоящее время методы лечения острого коронарного синдрома (ОКС) основываются на восстановлении антеградного коронарного кровотока, поддержании адекватного антитромботического потенциала крови, уменьшении нейроэндокринной активации. Все они призваны уменьшить ишемическое повреждение кардиомиоцитов и предупредить некроз миокарда. В то же время при проведении процедуры реваскуляризации частички атероматозных и тромботических масс могут дислоцироваться по току крови, порой полностью перекрывая доступ в капилляры, что может быть причиной эмболизации и развития феномена «no-reflow».
Феномен «no-reflow» носит частично обратимый характер. Хотя микроциркуляция в коронарных сосудах постепенно восстанавливается, миокарду несколько часов или суток неадекватной перфузии могут нанести непоправимый вред. У пациентов, переживших «no-reflow», часто регистрируется снижение систолической функции, происходит ремоделирование миокарда, могут развиться дилатация камер сердца, их гипертрофия/гиперплазия, фиброз, аневризма левого желудочка. В результате «no-reflow» имеет существенное влияние на ближайший и отдаленный прогнозы пациентов, являясь независимым предиктором неблагоприятных исходов. Рефрактерный «no-reflow» ассоциирован со значительным повышением риска смерти, осложнений ИМ (особенно желудочковых аритмий), ухудшением систолической функции левого желудочка, развитием сердечной недостаточности [См. «Организация и тактика проведения чрескожного коронарного вмешательства при инфаркте миокарда с подъемом сегмента ST», Кемерово, 2012; Л.С. Барбараш, В.И. Ганюков, стр. 11, 149, 150-151].
Руководство ESC по ведению больных ИМ с подъемом ST (2008) рекомендует ориентироваться на ангиографические градации степени восстановления коронарного кровотока (Thrombolysis in Myocardial Infarction, TIMI) и перфузии миокарда (myocardial blush grade, MBG).
TIMI 0 (отсутствие кровотока) - отсутствие антероградного поступления контрастного вещества дистальнее места окклюзии.
TIMI 1 (минимальный кровоток) - контраст поступает дистальнее места окклюзии, но в небольших количествах, и не может полностью заполнить дистальный сегмент инфарктобусловившей артерии.
TIMI 2 (неполное восстановление кровотока) - контраст поступает дистальнее места окклюзии и заполняет дистальный сегмент инфарктобусловившей артерии, но и его заполнение, и освобождение от контраста происходит медленнее, чем в проксимальном сегменте от места окклюзии, и заполняет дистальный сегмент инфарктобусловившей артерии, но и его заполняет, и освобождение от контраста происходит медленнее, чем в проксимальном сегменте от места окклюзии.
TIMI 3 (полное восстановление кровотока) - нормальный антероградный кровоток дистальнее места окклюзии.
MBG 0 - отсутствие перфузии миокарда.
MBG 1 - перфузия регистрируется во время введения контраста, но немедленно исчезает после вымывания контраста из ствола коронарной артерии.
MBG 2 - перфузия регистрируется во время введения контраста и на протяжении <3 сердечных сокращений после вымывания контраста из ствола коронарной артерии.
MBG 3 - перфузия регистрируется во время введения контраста и на протяжении >3 сердечных сокращений после вымывания контраста из ствола коронарной артерии, но успевает исчезнуть до нового введения контрастного вещества.
MBG 4 - перфузия отмечается на протяжении достаточно длительного периода времени и не успевает полностью исчезнуть до нового введения контрастного вещества.
Феномен «no-reflow» можно диагностировать при недостаточной миокардиальной перфузии (MBG 0-3) на фоне полностью восстановленного кровотока (TIMI 3) [P. Sorajja et al; 2005].
Учитывая высокий риск возникновения жизнеугрожающих осложнений после проведения ЧКВ у пациентов с ИМпST, связанных с феноменом «no-reflow», в настоящее время предложен ряд методов профилактики данного феномена и дистальной эмболии коронарных сосудов. Их можно разделить на методы с использованием медикаментозных средств и специальных устройств.
К медикаментозным методам профилактики феномена «no-reflow» относится:
1. Интракоронарное введение вазодилататров: аденозин, верапамил, никорандил, папаверин и нитропруссид во время и после первичного ЧКВ вызывает улучшение кровотока в инфаркт-зависимой артерии (ИЗА) и перфузии миокарда и/или уменьшение размера инфаркта. Однако не всегда использование только вазодилататоров способствует хорошей перфузиии миокарда и купирования феномена «no-reflow» [См. «Организация и тактика проведения чрескожного коронарного вмешательства при инфаркте миокарда с подъемом сегмента ST», Кемерово, 2012; Л.С. Барбараш, В.И. Ганюков, стр. 151].
2. Интракоронарное введение блокаторов гликопротеиновых (ГП) IIb/IIIa рецепторов. Наибольшим доказанным положительным эффектом для предупреждения развития феномена «no-reflow» обладают блокаторы ГП IIb/IIIa рецепторов, которые могут обеспечить дополнительную и более эффективную реперфузию не только на уровне эпикардиальных сосудов, но и на уровне микроциркуляторного русла, что в свою очередь повлияет как на выживаемость больных в ближайшем, так и на снижение смертности в отдаленном периоде [См. Вестник ХНУ им В.Н. Каразина, 2011, №975, Серия «Медицина», Выпуск 22, Н.П. Капица, И.Р. Вишневская «Феномен «NO-REFLOW» - современный взгляд на проблему, место блокаторов гликопротениновых IIb/IIIa рецепторов в предупреждении данного состояния»].
3. Проведение внутрикоронарного тромболизиса при первичном ЧКВ при инфаркте миокарда с подъемом сегмента ST, осложненном явлением no-reflow, является малоэффективным [Тезисы Четвертого Российского съезда Интервенционных кардиологов России, Москва 21-23 марта 2011 г., №24, 2011, В.И. Ганюков, А.А. Азаров, О.Л. Барбараш, Л.С. Барбараш].
В настоящее время использование механических средств для удаления тромботических масс из коронарного русла во время первичного ЧКВ относится ко IIа классу показаний.
Все устройства можно разделить на три группы: устройства для механического удаления тромба (Angiojet), устройства для аспирации тромботических масс (Pronto, Driver, Export и т.д.) и устройства-фильтры для дистальной защиты сосудистого русла.
Предложенные выше методики направлены на предупреждение и профилактику феномена «no-reflow», но и они имеют ряд недостатков. Применение только медикаментозной поддержки при первичном ЧКВ, осложненном no-reflow, не всегда помогает в разрешении и коррекции этого опасного осложнения.
Применение устройства для механического удаления тромбов (Angiojet) в рутинной практике не всегда представляется возможным ввиду высокой цены самого устройства.
Применения устройств-фильтров для дистальной защиты сосудистого русла также имеет ряд недостатков, так как применение данных устройств целесообразно в артериях крупного диаметра.
Применение устройств для аспирации тромботических масс, как самостоятельного средства не всегда показывает свою эффективность в предотвращении феномена «no-reflow».
С точки зрения доказательной медицины для профилактики и лечения «no-reflow»-синдрома показано использование ингибиторов гликопротеиновых IIb/IIIa - рецепторов, вазодилататоров и применение устройств для аспирации тромбов [См. «Организация и тактика проведения чрескожного коронарного вмешательства при инфаркте миокарда с подъемом сегмента ST», Кемерово, 2012; Л.С. Барбараш, В.И. Ганюков, стр. 153]. Но предложенная методика не отвечает всем требованиям патогенетического механизма возникновения феномена «no-reflow», что в свою очередь не всегда ведет к удовлетворительному результату в коррекции данного осложнения.
Прототипом изобретения является способ эндоваскулярной коррекции феномена «no-reflow» у пациентов с острым коронарным синдромом с подъемом сегмента ST при проведения первичного чрескожного коронарного вмешательства инфаркт-зависимой артерии с использованием устройства для ручной аспирации тромба (Pronto extraction catheter; Vasc. solutions, Minneapolis, Minnesota, Diver Invatec, Export Medtronic) при первичном ЧКВ, заключающийся в следующем: после проведения коронарографии и выявлении острой тромботической окклюзии в инфаркт-зависимой артерии проводится коронарный проводник 0,014 дюйма в дистальные отделы ИЗА. По коронарному проводнику проводится устройство для аспирации тромбов. Аспирация тромба выполняется с помощью двухпросветного 6-F совместимого катетера для экстракции (Pronto extraction catheter; Vasc. solutions, Minneapolis, Minnesota, Diver Invatec, Export Medtronic). Меньший просвет катетера предназначен для стандартного 0,014 дюймового проводника, больший - для удаления тромба с помощью вакуумного шприца емкостью 30 мл. Дистальный конец катетера приспособлен для максимально полной аспирации тромба и защиты стенки сосуда во время продвижения устройства и удаления тромба. После прохождения проводника через место поражения проводится несколько медленных пассажей для продвижения катетера. Только в случае безуспешности прохождения катетера, 2-мм баллоном выполняется предилатация места поражения. Прямое стентирование рекомендуется всем пациентам [См. Silva-Orrego Р., Colombo P., Bigi R. et al. Thrombus Aspiration Before Primary Angioplasty Improves Myocardial Reperfusion in Acute Myocardial Infarction: The DEAR-MI (Dethrombosis to Enhance Acute Reperfusion in Myocardial Infarction) Study. J Am Coll Cardiol. Oct. 17, 2006 48: 1552-1559].
Недостатками данного метода являются: невозможность аспирации микроэмболов из микроциркуляторного русла, невозможность проведения катетера в дистальные отделы артерии меньшего диаметра для проведения аспирации, кроме того,риск дислокации тромба в дистальные отделы артерии с последующей эмболией мелких ветвей в момент проведения аспирационного катетера к тромбу.
Технический результат при использовании изобретения - повышение лечебного эффекта за счет проведения регионарной тромболитической терапии в сочетании с введением вазодилататоров в микроциркуляторное русло и последующей аспирацией тромботических масс, защита дистальных ветвей от миграции остаточных тромботических масс, возможность проведения одномоментной баллонной ангиопластики в области дестабилизированной атероматозной бляшки или мелких пристеночных тромбов.
Указанный технический результат достигается тем, что в способе эндовакулярной коррекции феномена «no-reflow» у пациентов с острым коронарным синдромом с подъемом сегмента ST при проведении первичного чрескожного коронарного вмешательства инфаркт-зависимой артерии, включающем на первом этапе выполнение коронароангиографии, выявление острой тромботической окклюзии или стеноза, оценку дистального кровотока по градации степени восстановления коронарного кровотока и перфузии миокарда; на втором этапе проведение коронарного проводника 0,014 дюйма в дистальные отделы ИЗА, после чего выполнение тромбоаспирации из ИЗА устройством для аспирации тромба по проводнику, стентирование ИЗА, согласно изобретению на третьем этапе аспирационный катетер подсоединяют к Y-коннектору и по первому коронарному проводнику подводят к тромбу ИЗА, через основную шахту проводят второй коронарный проводник, по которому проводят коронарный баллон диаметром и длиной не более 1,5×10 мм и длиной доставки не менее 1500 мм за тромботическую окклюзию, раздувают его номинальным давлением в дистальной части ИЗА, после чего выполняют аспирацию тромба через дополнительный канал Y-коннектора, на четвертом этапе второй коронарный проводник удаляют из основной шахты коронарного баллона и через нее вводят раствор вазодилататора в сочетании с внутривенным болюсным введением раствора эптифибатида в дозе 180 мкг/кг до достижения удовлетворительного ангиографического результата, соответствующего 3 степени восстановления коронарного кровотока и перфузии миокарда не менее 3, а на пятом этапе выполняют стентирование ИЗА. При этом в случае отсутствия удовлетворительного ангиографического результата болюсом интракоронарно через основную шахту аспирационного катетера вводят раствор тромболитика с последующим болюсным введением раствора натрия хлорида 0,9%.
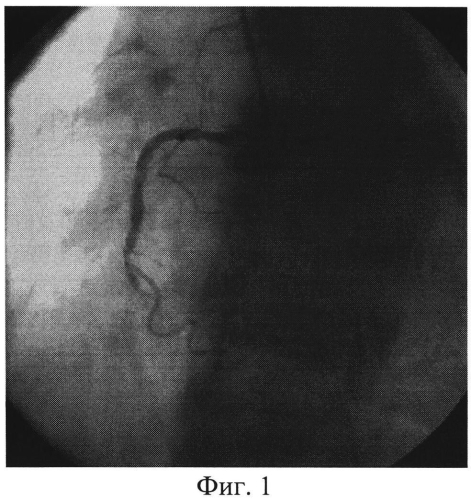
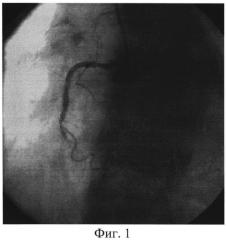
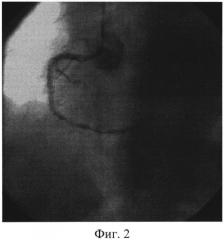
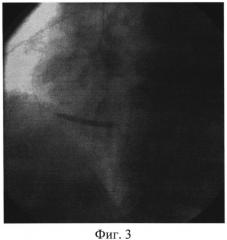
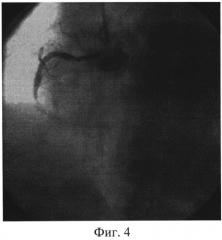
Изобретение иллюстрируется следующими фигурами: на фиг. 1 изображен вид до вмешательства; на фиг. 2-4 - этапы операции; на фиг. 5-7 - вид после вмешательства.
Предлагаемый способ осуществляется следующим образом: первым этапом выполняют коронароангиографию, выявляют острую тромботическую окклюзию или стеноз, оценивают диаметр артерии, дистальный кровоток по градации степени восстановления коронарного кровотока (Thrombolysis in Myocardial Infarction, TIMI) и перфузии миокарда (myocardial blush grade, MBG) на третьем этапе аспирационный катетер подсоединяют к Y-коннектору и по первому коронарному проводнику подводят к тромбу ИЗА, через основную шахту проводят второй коронарный проводник, по которому проводят коронарный баллон диаметром и длиной не более 1,5×10 мм (типа over the wire OTW) и длиной доставки не менее 1500 мм за тромботическую окклюзию, раздувают его номинальным давлением в дистальной части ИЗА. После чего выполняют аспирацию тромба через дополнительный канал Y-коннектора. Четвертым этапом коронарный проводник удаляют из основной шахты коронарного баллона и через нее вводят раствор вазодилататора (изокет - изосорбида динитрат, аденозин, верапамил, никорандил, папаверин и нитропруссид) в сочетании с внутривенным (в/в) болюсным введением раствора интегрилина (эптифибатид, блокатор гликопротеиновых IIb/IIIa рецепторов) в дозе 180 мкг/кг. В случае отсутствия удовлетворительного результата болюсом интракоронарно через основную шахту аспирационного катетера вводят раствор тромболитика (актилизе, метализе, стрептокиназа), с последующим болюсным введением раствора натрия хлорида 0,9%. На пятом этапе после восстановления кровотока и перфузии миокарда (TIMI 3, MBG≥3) выполняют стентирование ИЗА. Таким образом, предлагаемый способ обеспечивает коррекцию феномена «nо-reflow» посредством интракоронарного регионарного болюсного введения тромболитиков с вазодилататорами и одномоментной аспирацией тромботических масс с параллельным в/в болюсным введением блокаторов гликопротеиновых IIb/IIIa рецепторов. Это, в свою очередь, ведет к лизису микроэмболов микроциркуляторного русла, с одновременной вазодилатацией мелких артериол и аспирацией остаточных мелких фрагментов тромба и предупреждению повторного тромбообразования в ИЗА. Возможность дистальной защиты мелких ветвей от дислокации фрагментов тромба ИЗА, возможность проведения одномоментной баллонной ангиопластики в области дестабилизированной атероматозной бляшки или пристеночных мелких тромбов.
Предлагаемый способ применен у 13 пациентов с острым коронарным синдромом ИМпST.
Сущность изобретения поясняется следующим клиническим примеро:
Пациент С., 52 года, поступил в экстренном порядке с диагнозом: ИБС. Нижний без Q инфаркт миокарда. ЧКВ, стентирование ПКА. Осл.: ХСН 1. ФК II.
Жалобы: на давящие боли с иррадиацией в нижнюю челюсть, не купирующиеся нитратами.
По данным лабораторных и инструментальных методов диагностик и исследования:
тропонин I (нг/мл) - 9,105; N - 0-0,033
КФК-МВ (Ед/л) -148,91; N 0,00-24,00
миолгобин (мкг/л) - 87,8; N 3,50-78,00
ЭКГ: Синусовый ритм 67 в минуту. Интервал PQ 0,24 мс, AV - блокада 1 степени. Подъем сегмента ST во II, III, a VL на 2-4 мм
ЭХО КГ: зона гипокинеза базальных сегментов
Пациент доставлен в рентген-операционную. Принято решение о проведении ЧКВ, после предоперационной подготовки (нагрузочная доза «Плавикса» (Клапидогрель) - 600 mg) в условиях приемного отделения. Первым этапом выполнили коронароангиографию, выявили острую тромботическую окклюзию 3 сегмента ПКА, диаметр артерии - 3,5 мм, дистальный кровоток отсутствует - TIMI 0, перфузии миокарда не выявлено - MBG 0 (Фиг. 1). На втором этапе провели коронарный проводник 0,014 дюйма в дистальные отделы ПКА, после чего по проводнику подвели к месту окклюзии устройство для аспирации тромба Diver Invatec 6F, выполнили тромбаспирацию из ИЗА (Фиг. 2), и имплантировали голометалический стент 3,0×33 мм в 3 сегмент ПКА (Фиг. 3). После имплантации стента отмечается феномен «no-reflow» с наличием тромботических масс в теле стента. (Фиг. 4). На четвертом этапе после тщательной промывки основной шахты аспирационного катетера завели его повторно, подвели к тромбу, подсоединили его к Y-коннектору, через основную шахту аспирационного катетера провели второй коронарный проводник в дистальные отделы ИЗА, по которому провели коронарный баллон Sprinter Legend OTW 1,25×10 мм длиной доставки 152 см за тромботические массы, раздули баллон в дистальной части ИЗА, после чего выполнили аспирацию тромба через дополнительный канал Y-коннектора, подсоединив вакуумный шприц. Затем коронарный проводник удалили из основной шахты коронарного баллона и через нее ввели раствор изокета (изосорбида динитрат, периферический вазодилататор) 50 мкг в сочетании с раствором актилизе (тромболитик) 15 мл болюсом, с последующим болюсным введением раствора натрия хлорида 0,9%. Параллельно через кубитальный катетер в/в болюсом ввели раствор интегрилина (эптифибатид, блокатор гликопротеиновых IIb/IIIa рецепторов) в дозе 180 мкг/кг. (Фиг. 5). На пятом этапе после восстановления кровотока и перфузии миокарда (TTMI 3, MBG≥3) выполнили стентирование ПКА во 2 сегменте голометаллическим стентом 3,5×28 мм (Фиг. 6). На контрольной коронарографии: стенты раскрыты полностью, остаточного стеноза, диссекции интимы не выявлено. Феномен «no-reflow» купирован. Кровоток TIMI 3. Перфузия миокарда MBG 4 (Фиг. 7). Ангиографический результат признан удовлетворительным. Больной выписан на 7 сутки в удовлетворительном состоянии.
1. Способ эндовакулярной коррекции феномена «по-reflow» у пациентов с острым коронарным синдромом с подъемом сегмента ST при проведении первичного чрескожного коронарного вмешательства инфаркт-зависимой артерии (ИЗА), включающий на первом этапе выполнение коронароангиографии, выявление острой тромботической окклюзии или стеноза, оценку дистального кровотока по градации степени восстановления коронарного кровотока и перфузии миокарда; на втором этапе проведение коронарного проводника 0,014 дюйма в дистальные отделы ИЗА, после чего выполнение тромбоаспирации из ИЗА устройством для аспирации тромба по проводнику, стентирование ИЗА, отличающийся тем, что на третьем этапе аспирационный катетер подсоединяют к Y-коннектору и по первому коронарному проводнику подводят к тромбу ИЗА, через основную шахту проводят второй коронарный проводник, по которому проводят коронарный баллон диаметром и длиной не более 1,5×10 мм и длиной доставки не менее 1500 мм за тромботическую окклюзию, раздувают его номинальным давлением в дистальной части ИЗА, после чего выполняют аспирацию тромба через дополнительный канал Y-коннектора, на четвертом этапе второй коронарный проводник удаляют из основной шахты коронарного баллона и через нее вводят раствор вазодилататора в сочетании с внутривенным болюсным введением раствора эптифибатида в дозе 180 мкг/кг, этапе до достижения удовлетворительного ангиографического результата, соответствующего 3 степени восстановления коронарного кровотока и перфузии миокарда не менее 3, на пятом этапе выполняют стентирование ИЗА.
2. Способ по п. 1, отличающийся тем, что в случае отсутствия удовлетворительного ангиографического результата болюсом интракоронарно через основную шахту аспирационного катетера вводят раствор тромболитика с последующим болюсным введением раствора натрия хлорида 0,9%.