Гуманизированное моноклональное антитело, специфичное к легумаину
Иллюстрации
Показать всеИзобретение относится к области иммунологии, биотехнологии и медицины. Предложено моноклональное антитело, специфичное к легумаину, характеризующееся тем, что тяжелая цепь охарактеризована а.о. 28-463 аминокислотной последовательности SEQ ID NO: 1, легкая цепь охарактеризована а.о. 28-245 аминокислотной последовательности SEQ ID NO: 2, антитело используют в качестве действующего вещества для терапии опухолевых заболеваний, а также полинуклеотиды, кодирующие каждую из указанных цепей антитела. Изобретение позволяет получить антитело, обладающее высокой аффинностью к антигену, низкой иммуногенностью и высокой цитотоксичностью, которое можно получать в больших количествах за короткий промежуток времени. 3 н. и 2 з.п. ф-лы, 11 табл., 5 пр.
Реферат
Изобретение относится к области иммунологии, биотехнологии и медицины, а именно к области противоопухолевых лекарственных препаратов на основе моноклональных антител, и может быть использовано для лечения онкологических заболеваний.
Онкологические заболевания стоят на втором месте по смертности в мире после сердечно-сосудистых заболеваний [World Health Statistics 2012, http://www.who.int/healthinfo/EN_WHS2012_Full.pdf]. За последние 10 лет число заболевших онкологическими заболеваниями, по разным данным, возросло на 15%. Ежегодно в России регистрируется более 490 тысяч новых пациентов, 2,5 миллиона находятся под наблюдением и более 290 тысяч больных ежегодно умирает от различных форм рака. Ввиду этого целесообразны разработка и создание безопасных, эффективных и доступных противоопухолевых препаратов.
Одним из типов противоопухолевых препаратов являются продукты биотехнологического синтеза - моноклональные антитела (MAb). Известен ряд фармакологических решений, в их числе Mab к рецептору эпидермального фактора роста, вазоэндотелиальному фактору роста, которые имеют доказанное значение для жизнедеятельности опухолевых клеток и малозначимы для функционирования нормальных клеток различных тканей организма [Жуков Н.В., Тюляндин С.А. Целевая терапия в лечении солидных опухолей; практика противоречит теории / Биохимия 2008, Т. 73, вып. 5, с 751-768].
Препараты на основе моноклональных антител (Mab) все шире используются для терапии онкологических заболеваний. Несмотря на значительные успехи и перспективность этого направления существующие препараты Mab не всегда достаточно эффективны. Это связано, прежде всего, с относительно узким (не более 15%) спектром присутствия мишеней данных препаратов во всем многообразии человеческих опухолей. В связи с этим разработка препарата на основе МАЬ , мишенью которого является поверхностный антиген опухолевых клеток с частотой экспрессии более 50%, является актуальной задачей.
Легумаин [Chen JM, Dando РМ, Rawlings ND, Brown MA, Young NE, Stevens RA, Hewitt E, Watts C, Barrett AJ. Cloning, isolation, and characterization of mammalian legumain, an asparaginyl endopeptidase. J Biol Chem. 1997 Mar 21;272(12):8090-8] гиперэкспрессирован в большинстве (более 80%) опухолей, включая рак молочной железы, толстой кишки, поджелудочной железы, опухолей центральной нервной системы, и функционально активна в участках с низким pH [Wu W, Luo Y, Sun С, Liu Y, Kuo P, Varga J, Xiang R, Reisfeld R, Janda KD, Edgington TS, Liu C. Targeting cell-impermeable prodrug activation to tumor microenvironment eradicates multiple drug-resistant neoplasms. Cancer Res. 2006 Jan 15; 66(2): 970-80]. В нормальных тканях эндопептидаза С13 не экспрессирована.
Встречаются и иные обозначения легумаина: эндопептидаза С13, аспарагиниловая эндопептидаза (asparaginyl endopeptidase, АЕР), LGMN, ЕС 3.4.22.34, PRSC1.
В литературе описана экспрессия легумаина не только в опухоль-ассоциированных макрофагах [Lin Y, Wei С, Liu Y, Qiu Y, Liu C, Guo F. Selective ablation of tumor-associated macrophages suppresses metastasis and angiogenesis. Cancer Sci. 2013 Sep; 104 (9): 1217-25. doi: 10.1111/cas.12202. Epub 2013 Jun 19], но и в опухолевых клеточных линиях, например в клетках меланомы Mum-2B, ретинобластомы Y79 и WERI-Rb-1, MDA-6861n. Показано, что линии различных опухолевых клеток экспрессируют легумаин даже после попытки супрессии легумаина [Briggs JJ, Haugen МН, Johansen НТ, Riker AI, Abrahamson M, Fodstad ⌀, Maelandsmo GM, Solberg R. Cystatin E/M suppresses legumain activity and invasion of human melanoma. BMC Cancer. 2010 Jan 15; 10: 17. doi: 10.1186/1471-2407-10-17].
Эндопептидаза C13 при малигнизации накапливается в мембрано-ассоциированных везикулах, локализующихся на поверхности мембраны опухолевых клеток. Функционально эндопептидаза С13 связана со способностью опухолевых клеток мигрировать, проникать в нормальные ткани и осуществлять процесс метастазирования.
Имеются данные об эффективности вакцинации с использованием в качестве антигена легумаина [Luo Y, Zhou Н, Krueger J, Kaplan С, Lee SH, Dolman C, Markowitz D, Wu W, Liu C, Reisfeld RA, Xiang R. Targeting tumor-associated macrophages as a novel strategy against breast cancer. J Clin Invest. 2006 Aug; 116 (8): 2132-2141].
Доказана возможность специфических моноклональных антител связываться с эндопептидазой С13 и снижать ее активность [Wu В, Yin J, Texier С, Roussel М, Tan KS. Blastocystis legumain is localized on the cell surface, and specific inhibition of its activity implicates a pro-survival role for the enzyme. J Biol Chem. 2010 Jan 15; 285(3): 1790-8. doi: 10.1074/jbc.M 109.049064. Epub 2009 Nov 13].
Зарегистрированных препаратов моноклональных антител к легумаину, мишенью которых является поверхностный антиген легумаин, в настоящее время не существует.
Антителозависимая клеточная цитотоксичность (АЗКЦ) и комплементзависимая цитотоксичность (КЗЦ) антитела обуславливаются взаимодействием Fc фрагмента моноклональных антител с FcyRIII и Clq соответственно. Для большинства моноклональных антител используется Fc фрагмент IgG1 антител, антитела такой структуры имеют максимально продолжительную стабильность в крови после введения.
Для усиления АЗКЦ и КЗЦ предлагаемого антитела модифицировали Fc фрагмент - вводили в константный фрагмент тяжелой цепи антитела фрагменты цепей антитела изотипа IgG3. Кроме того, вероятно, задействуется и механизм непосредственного блокирования межклеточного легумаина и опухолеспецифических макрофагов.
Известны ингибиторы аспарагиниловой эндопептидазы - химически синтезированные соединения [WO 2011075678 (А1), дата приоритета 20091218, WO 03016335 (A3), дата приоритета 20010813]. К недостаткам данного типа соединений можно отнести возможность формирования энантиомеров, что негативно сказывается на выходе необходимого вещества. Последствия попадания в организм таких молекул, имеющих иную конформацию, непредсказуемы.
Известно мышиное антитело типа IgM к легумаину простейшего Blastocysts (mAb 1D5) [Wu В, Yin J, Texier С, Roussel M, Tan KS. Blastocystis legumain is localized on the cell surface, and specific inhibition of its activity implicates a pro-survival role for the enzyme. J Biol Chem. 2010 Jan 15; 285 (3): 1790-8. doi: 10.1074/jbc.M 109.049064. Epub 2009 Nov 13.]
Известна водная композиция, содержащая липосомные наночастицы, несущие противоопухолевый агент, нацеливающиеся на опухоли за счет присутствия нацеливающегося на легумаин липида [WO 2012031175 (А9), дата приоритета 20100902]. Данный липид содержит гидрофобную липидную часть, ковалентно связанную с легумаин-связывающей частью - легумаиновым ингибитором типа аза-аспарагин акцептор Майкла (aza-Asn Michael acceptor-type legumain inhibitor). Данное соединение также является химически синтезируемым.
Известно использование антител - антагонистов легумаина для ингибирования миграции клеток млекопитающего, пролиферации клеток эндотелия, а также ангиогенеза [WO/2007/139972, дата приоритета 06.12.2007]. Структура данного антитела не приведена.
Известно антитело к легумаину, связывающееся с эпитопом, важной частью которого является последовательность CGMKRASSPVPLPP [WO 2007064759 (А2), дата приоритета 07.06.2007]. Также предлагается его использовать совместно с ингибитором аспарагиниловой эндопептидазы или пролекарством приведенной структуры, а также дополнительно с другим химиотерапевтическим агентом для диагностики и лечения опухолевых заболеваний. Однако не указан тип антитела (класс и изотип иммуноглобулинов), его природа (мышиное/химерное/гуманизированное), не приведены аминокислотная и/или кодирующая последовательность, что затрудняет оценку эффективности данного антитела.
Известно использование антитела к легумаину в качестве нацеливающего и блокирующего данный фермент агента для лечения опухолевых заболеваний, используемого также в составе комплекса с лекарством, а также использование антитела к легумаину в качестве противовоспалительного агента [WO 2004111192 (А2) дата приоритета 23.12.2004]. Однако такое антитело также структурно не описано.
Наиболее близкими аналогами предлагаемого изобретения являются описанные в международных заявках на изобретение WO 2007064759 (А2) и WO 2004111192 (А2) антитела к легумаину. Недостатками данных изобретений является отсутствие раскрытия структуры данных антител, включая клональность, тип, изотип антитела, а также его природу. Более того, используются только функции нацеливания и блокировки мишени антитела.
Заявленное изобретение свободно от этих недостатков.
Таким образом, на сегодняшний день в литературе не описаны ни химерные, ни гуманизированные антитела к легуману человека. Структура антител в приведенных выше заявках на изобретение не раскрыта, что не позволяет осуществить данные изобретения и оценить их эффективность.
Технический результат от использования предложенного гуманизированного моноклонального антитела к легумаину выражается в расширении спектра моноклональных антител - противоопухолевых агентов, что позволяет проводить им лечение как минимум при индивидуальной непереносимости или плохой переносимости препаратов иных MAb.
Технический результат от использования предложенного гуманизированного моноклонального антитела к легумаину выражается и в создании структурно охарактеризованного MAb к легумаину, безопасного и эффективного.
Технический результат от использования предлагаемого антитела к легумаину выражается в увеличении аффинности к антигену и, соответственно, эффективности антитела. Указанный технический результат достигается гуманизацией антитела: использование каркасных участков человеческого антитела позволяет более точно сориентировать гипервариабельные участки, что увеличивает соответствие эпитопа и паратопа и, соответственно, аффинность.
Технический результат от использования предлагаемого антитела к легумаину также выражается в самостоятельной индукции цитотоксичности. Указанный технический результат достигается тем, что в константный фрагмент тяжелой цепи антитела изотипа IgG1 введены участки цепей антитела изотипа IgG3, что опосредует антитело- и комплементзависимую цитотоксичность.
Технический результат от использования предлагаемого антитела к легумаину также выражается в уменьшении иммуногенности, за счет гуманизации антитела.
Технический результат от использования предлагаемого антитела к легумаину также выражается в уменьшении стрессорного воздействия на организм противоопухолевого препарата, за счет того что действующим веществом является сама молекула моноклонального антитела - по природе белок, который впоследствии деградирует до аминокислот, т.е. при его использовании исключаются какие-либо последствия возможного невыведения из организма в течение какого-либо времени действующего агента (химического вещества небелковой природы) либо продуктов его распада.
Также техническим результатом является получение высокого уровня экспрессии антитела в клетках млекопитающих за короткий срок за счет кодонной оптимизации кодирующих последовательностей, а также введенной сигнальной секреторной последовательности на N-конце тяжелой и легкой цепи, что позволяет удешевить и ускорить производство.
Сущность изобретения
Задачей данного изобретения являлось создание универсального моноклонального антитела, мишенью которого является поверхностный антиген опухолевых клеток с частотой экспрессии более 50%, приемлемого для терапии опухолевых заболеваний, обладающего высокой аффинностью к антигену, низкой иммуногенностью и высокой цитотоксичностью, которое можно получать в больших количествах за короткий промежуток времени.
Данная задача решена тем, что предложено гуманизированное моноклональное антитело к легумаину на основе IgG1 с введенными в константный фрагмент тяжелой цепи антитела участками IgG3, обуславливающими формирование антителозависимой и комплементзависимой цитотоксичности, тяжелая цепь которого охарактеризована а.о. 28-463 аминокислотной последовательности SEQ ID NO: 1, легкая цепь - а.о. 28-245 аминокислотной последовательности SEQ ID NO: 2. Также предложены полинуклеотиды, кодирующие аминокислотную последовательность SEQ ID NO: 1 и SEQ ID NO: 2, кодонно оптимизированные для экспрессии в клетках млекопитающих, с введенной сигнальной секреторной последовательностью, на N-конце тяжелой и легкой цепи, отщепляющейся после секреции белков из клеток-продуцентов.
Предложенное гуманизированное антитело высокоаффинно связывается с гиперэкспрессированным на опухолевых клетках легумаином за счет гуманизации вариабельных фрагментов. Гипервариабельные участки полученных самостоятельно в результате иммунизации легумаином моноклональных антител мыши перенесены в наиболее структурно гомологичные по ключевым позициям акцепторные антитела человека, каркасные участки которых позволяют более точно сориентировать гипервариабельные участки в пространстве, что увеличивает соответствие эпитопа и паратопа и, соответственно, обеспечивает более высокую по сравнению с химерными антителами аффинность к мишени.
Конструкция предлагаемого антитела способна обеспечить его самостоятельный цитотоксический эффект по антителозависимому и комплементзависимому механизмам за счет оптимизации последовательности константного фрагмента тяжелой цепи (IgG1-IgG3 shifting), что обеспечивает привлечение клеток иммунной системы. Это позволяет отказаться от использования цитотоксического агента, т.е. от процедур выбора характера его использования в совокупности с MAb (присоединения или совместного использования), процедуры его конъюгации с антителом, поддержания активности обоих компонентов и других вытекающих последствий. Кроме того, имеет место антиметастатический эффект за счет блокирования межклеточной эндопептидазы С13.
Антитела IgG1 среди изотипов имеют самое длительное время полужизни и активируют комплемент, но в меньшей степени, чем IgG3. Использование фрагментов IgG3 в структуре IgG1 позволяет усилить данный эффект.
Введение сигнальной секреторной последовательности на N-конце тяжелой и легкой цепей, а также кодонная оптимизация нуклеотидных последовательностей, их кодирующих, для экспрессии в клетках млекопитающих позволяет получать антитело в больших количествах за малые сроки в таких клетках.
Предложенное гуманизированное антитело к легумаину обладает противоопухолевым эффектом: не только сдерживает рост опухоли и миграцию клеток, но и способствует их элиминации естественным путем.
Подтверждена возможность применения моноклональных антител к легумаину без причинения вреда организму животных. Предлагаемое Mab является безопасным и для человека с точки зрения побочных аллергических эффектов благодаря гуманизации.
Краткое описание графических материалов
Фигуры 1-4. Результат, полученный на проточном цитофлуориметре при окраске различных типов клеток человека (Фиг. 1 - лимфоциты, Фиг. 2 - клетки карциномы сигмовидной кишки, Фиг. 3 - клетки карциномы поджелудочной железы, Фиг. 4 - клетки карциномы легкого) для выявления связывания MAb по изобретению с легумаином. Темным цветом обозначен контроль (осуществляли инкубацию только со вторыми антителами), светлым цветом - клетки, предобработанные антителами против легумаина, для проявления которых использованы вторые антитела.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1. Получение моноклонального гуманизированного антитела к легумаину.
1.1. Получение легумаина.
Ген, кодирующий легумаин, был синтезирован посредством химико-ферментативного синтеза [Young L, Dong Q., Two step total gene synthesis method. Nucleic Acid Research: 32, e59, 2004] двуступенчатым методом. Полученный ген был клонирован в векторе pET151/D-TOPO, обеспечивающем высокий уровень синтеза рекомбинантного белка, сшитого с полигистидиновой последовательностью, для удобства дальнейшей очистки с помощью металлохелатной хроматографии, в результате которой можно получить белок в виде отдельной аминокислотной последовательности без полигистидина и каких-либо других примесей благодаря наличию сайта для TEV-протеазы в клетках E.coli BL21(DE3)Star, которые содержат мутированный ген me (me131), кодирующий усеченную форму РНКазы Е, что уменьшает внутриклеточное разрушение мРНК, приводя к увеличению ее ферментативной стабильности и, соответственно, продукции белка. Получили экспрессию данного гена в клетках E.coli BL21(DE3)Star.
Рекомбинантный белок выделяли из клеток штамма BL21[DE3]Star pETl 51 legumain, растворив клетки в лизирующем буфере. Проводили очистку легумаина с помощью металлохелатной хроматографии.
Препарат рекомбинантного белка имел чистоту 97% и был использован для получения гибридомы, продуцирующей моноклональные антитела мыши к легумаину, и тестирования полученных моноклональных антител.
1.2. Иммунизация мышей линии Balb/c легумаином.
Была проведена иммунизация мышей линии Balb/c, в качестве антигена использовали очищенный рекомбинантный белок легумаин. При первичной иммунизации мышам вводили подкожно 50 мкг антигена в полном адъюванте Фрейнда (ПАФ). Через 28 дней анализировали уровень иммунного ответа на введенный антиген, оценивая титр специфических сывороточных антител с помощью иммунноферментного анализа (ИФА). Животным с максимальным значением иммунного ответа повторно вводили подкожно 30 мкг антигена в неполном адъюванте Фрейнда (НАФ) и оценивали уровень вторичного иммунного ответа через 21 день, затем за 4-5 дней до проведения соматической гибридизации вводили 30 мкг антигена в физиологическом растворе (ФР) внутрибрюшинно.
1.3. Получение гибридомы, синтезирующей моноклональные антитела, специфичные к легумаину.
В качестве партнеров по слиянию использовали спленоциты иммунизированных мышей с титром сывороточных антител к белку легумаин примерно 1:30000 и клетки мышиной миеломы sp2/0-Ag14 (АТСС, CRL-1581) в соотношении 2:1. Гибридизацию проводили с использованием раствора полиэтиленгликоля (Sigma) в соответствии со стандартной методикой. Селекцию стабильных гибридных клеток проводили путем культивирования на среде IMDM (Iscove-s Modified Dulbecco Medium, Sigma), содержащей 10% сыворотки FCI (HyClone) и HAT (Gibco). Отбор клонов гибридных клеток, секретирующих антитела, специфичные к заданному антигену, проводили с помощью иммуноферментного анализа (ИФА). В результате первичного скрининга было отобрано 10 клонов гибридных клеток, продуцирующих моноклональные антитела к легумаину. После проведения пяти клонирований было получено 5 стабильных продуцирующих клонов. Из каждой из клеточных линий была выделена мРНК, кодирующая тяжелые и легкие цепи антитела к легумаину.
1.4. Получение нуклеотидных последовательностей тяжелых и легких цепей гуманизированного антитела к легумаину
Из стабильных клонов гибридных клеток, продуцирующих мышиные моноклональные антитела к легумаину, была выделена РНК с использованием набора «TRI Reagent» производства фирмы «Sigma», США, по инструкции изготовителя. На (5-10)×106 клеток использовали 1 мл лизирующего раствора «TRI Reagent». Синтез кДНК проводили с помощью набора Revert Aid® First Strand cDNA Synthesis Kit (производства фирмы «Fermentas», Литва).
Амплификацию генов, кодирующих вариабельные фрагменты мышиных антител, проводили методом ПЦР с использованием специфических праймеров (5′ вырожденных праймеров для отжига на неизвестных VH и VL участках) и в качестве матрицы синтезированной кДНК. Наработку фрагментов ДНК для клонирования проводили методом ПЦР с использованием высокоточной, термоустойчивой ДНК-полимеразы Pfx. Полученные ПЦР-продукты были клонированы в векторе pGMT-easy с использованием набора Fast Ligation Kit, Fermentas и секвенированы ферментативным методом по Сенгеру.
Результаты секвенирования были использованы для получения гуманизииованного моноклонального антитела.
Гуманизацию антитела проводили методом переноса выявленных (вычисленных с использованием компьютерных алгоритмов на полученных нуклеотидных последовательностях) гипервариабельных участков (CDR) вариабельного фрагмента мышиных антител, отвечающих за комплементарность антигену, на вариабельный фрагмент человека, помещали CDR между сответствующими каркасными участками, по результатам анализа баз данных и биоинформатического моделирования структурного сходства (аналогии) между антителами. Полученное гуманизированное антитело обладает специфичностью материнского мышиного антитела, но повышенной аффинностью за счет более подходящего пространственного расположения CDR, обусловленного каркасными участками.
Для молекулярной графики использовали программы: Insight II; Accelrys, СА.
Моделирование конформационной гомологии между донорным мышиным антителом и человеческим акцепторным антителом проводили с использованием WAM (http://antibody.bath.ac.uk), SWISS-MODEL (http://www.expasy.org), INSIGHT-HOMOLOGY (Accelrys), COMPOSER (Tripos, МО) и GCG Wisconsin Package. Последовательности вариабельных фрагментов мышиных антител были аннотированы и пронумерованы с использованием баз данных Kabat и Chothia.
Информация о структуре вариабельных фрагментов учитывается в нумерации, разработанной Chothia [Chothia С, Lesk AM. Canonical structures for the hypervariable regions of immunoglobulins. J Mol Biol. 1987 Aug 20; 196 (4): 901-17], однако в данной нумерации не рассматриваются остатки аминокислот в вариабельных фрагментах антител. В соответствии с указанными выше данными для нумерации и аннотирования вариабельных фрагментов использовался модифицированный Kabat и Chothia алгоритм Abhinandan KR и Martin AC [Abhinandan KR and Martin А С.Analysis and Prediction of VH/VL Packing in Antibodies, Protein Engineering Design and Selection. 2010, Abhinandan KR, Martin AC. Analysis and improvements to Kabat and structurally correct numbering of antibody variable domains. Mol Immunol. 2008 Aug; 45 (14): 3832-9]. При нумерации при этом учитывались не только исправленные данные множественных выравниваний последовательностей антител по Kabat и данные о структуре CDR по Chothia с учетом структуры FR, но и данные о VH/VL углах складывания в донорных и акцепторных антителах. Для автоматического аннотирования использовались программы с интерактивным web-интерфейсом: SeqTest (AbCheck) http://www.bioinf.org.uk/abs/seqtest.html, Abnum http://www.bioinf.org.uk/abs/abnum/, ручная корректировка и проверка проводились с использованием локальной версии базы данных Kabat http://www.kabatdatabase.com/index.html и программы KabatMan http://www.bioinf.org.uk/abs/simkab.html, средств IMGT http://imgt.cines.fr/ и данных множественного выравнивания последовательностей вариабельных фрагментов антител с использованием MUSCULE http://www.ebi.ac.uk/Tools/muscle/index.html и пакета программ FASTA http://fasta.bioch.virginia.edu/fasta_www2/fasta_down.shtml, структуры которых представлены в PDB на 2012 год, а также разработанных авторами изобретения нескольких Perl скриптов для автоматизации анализа данных. VH/VL углы складывания были рассчитаны и предсказаны исходя из алгоритма, предложенного Abhinandan [Abhinandan KR and Martin АС. Analysis and Prediction of VH/VL Packing in Antibodies, Protein Engineering Design and Selection. 2010]. Все необходимые расчеты, связанные с моделированием структуры белковых молекул, проводили с использованием Modeller и Swiss-Model.
Следующим шагом в гуманизации антител был выбор акцепторных вариабельных фрагментов антител человека для переноса. Правильный выбор акцепторного антитела человека практически на 100% гарантирует успешную гуманизацию антител, с Kd, достаточной для высокопрочного связывания с антигеном. С использованием методов молекулярного моделирования и описанных выше подходов была построена структурная модель вариабельного фрагмента мышиного моноклонального антитела против легумаина. С использованием полученных трехмерных моделей были определены наиболее гомологичные (особенно по ключевым позициям) последовательности акцепторных антител человека, при этом использовались только антитела со значением коэффициента «человечности» Н>1 (что потенциально может уменьшить НАНА ответ). На основании полученной модели рассчитали аминокислотные и, соответственно, нуклеотидные последовательности вариабельных фрагментов тяжелой и легкой цепей антитела.
1.5. Получение гуманизированных моноклональных антител к легумаину
Для получения искомых свойств антител в константный фрагмент тяжелой цепи вводили участки цепей антитела изотипа IgG3, который обладает самой высокой степенью активации системы комплемента из всех изотипов, а также высокой аффинностью по отношению к связыванию с Fc рецептором фагоцитирующих клеток, в структуру константного фрагмента IgG1, что сообщило антителу повышенную способность индукции антителозависимой и комплементзависимой цитотоксичности.
Соединили последовательности вычисленных вариабельного и константного фрагмента тяжелой цепи в одну аминокислотную последовательность, добавив на N-конце сигнальную секреторную последовательность (SEQ ID NO: 1). Соединили последовательности вычисленного вариабельного и константного фрагмента легкой цепи в одну аминокислотную последовательность, добавив на N-конце сигнальную секреторную последовательность (SEQ ID NO: 2).
Перевели аминокислотные последовательности белка в нуклеотидные, оптимизировав последние для увеличения продукции данного антитела в клетках млекопитающих (СНО) с помощью программы на сайте http://www.encorbio.com/protocols/Codon.htm.
В результате был получен окончательный вариант нуклеотидных последовательностей, кодирующих гуманизированное моноклональное антитело к легумаину, гены были синтезированы с использованием химического синтеза.
Синтезированные фрагменты клонировали в плазмидный вектор pUC57 для наработки, затем переклонировали в вектор pcDNA3.1 + для трансфекции клеток млекопитающих.
Трансфекцию клеток млекопитающих созданными плазмидами проводили методом кальций-фосфатного осаждения.
Для проведения трансформации клеток млекопитающих (СНО) плазмидными ДНК клетки высевали в 12-луночные планшеты (Costar, США) с плотностью посева 5×104 кл./см2. На следующий день для синхронизации клеточных делений культуральную среду заменяли. Через три часа к клеткам добавляли плазмидную ДНК, осажденную фосфатом кальция. Для приготовления осадка 250 мкл раствора, содержащего 50 мкг ДНК в 250 мМ CaCl2, медленно смешивали с 250 мкл раствора (1,64% NaCl, 1,13% HEPES pH 7,12 и 0,04% Na2HPO4). После 24 часов инкубации при 37°C в атмосфере 5% CO2 среду заменяли на аналогичную, но содержащую антибиотик 50 мкг/мл неомицин для селекции клонов, содержащих обе трансформированные плазмиды и, следовательно, экспрессирующих полноразмерные гуманизированные антитела, селекцию проводили в течение 20 суток в лунках, содержащих живые клетки, меняли среду (при этом предыдущую культуральную среду не выливали, а использовали для определения количества секретируемых антител методом ИФА), а еще через сутки клетки снимали с подложки и проводили анализ на экспрессию трансформированных генов. Анализ эффективности трансфекции проводили на проточном цитофлуориметре EPICS XL Beckman Coulter (Beckman Coulter, США).
Уровень гуманизированных антител в культуральной среде, полученных из стабильных трансфектом линии СНО, оценивали с использованием стандартного твердофазного ИФА.
В результате 5 клонирований были получены стабильные трансфектомы СНО, которые накапливали для криоконсервирования и наработки опытной партии антител. Продуктивность созданных трансфектом СНО, синтезирующих антитела к легумаину, составила 600 мкг/107 клеток/день.
1.6. Культивирование клеток-продуцентов гуманизированного моноклонального антитела к легумаину
Культивирование клеток-продуцентов осуществляли с использованием биореактора BIOSTAT® Bplus и автоклавированной среды IMDM с добавлением 45 г DFBS (0,5%) и 25,8 г (100 мМ) сульфата цинка семиводного (ZnSO4 × 7H2O) на 9 л среды. Задавали рабочий режим: температура 37°C, pH 6,9-7,2, концентрация кислорода 50% насыщения воздуха. После достижения заданного режима производили засев биореактора, для чего в асептичных условиях в него вводили посевной материал. Время культивирования составляло 3 суток.
По окончании культивирования культуральную жидкость фильтровали через стерильную капсулу «Sartopure» («Sartorius», Германия) с диаметром пор 1,2 мкм со скоростью 1 л/мин. Затем осветленную жидкость концентрировали на системе Viva Flow 200 («Sartorius», Германия) с использованием фильтра на 50 кДа. Концентрирование проводили до достижения общего объема - 250 мл.
1.7. Очистка полученного гуманизированного моноклонального антитела к легумаину
Хроматографическую очистку проводили в два этапа с использованием стерильных растворов. На первом этапе использовали систему BioLogic DuoFlow Pathfinder (Bio-Rad) с автоматическим коллектором фракций BioFracT и полупрепаративную хроматографическую колонку YMC TriArt, 250×4,6 мм, сорбент С18. Перед началом работы колонку уравновешивали с помощью 200 мл буфера (1 кг воды для инъекций и 1 г кислоты трифторуксусной) в ручном режиме через насос хроматографа на скорости 2 мл/мин.
Подготовленный материал в объеме 200 мл вносили в хроматограф через насос хроматографа на скорости 0,5 мл/мин. Элюцию производили буфером (2 кг ацетонитрила, 2 г кислоты трифторуксусной) со скоростью 0,5 мл в минуту. Собирали фракцию в максимуме поглощения при 260 нм. Объем фракции составил примерно 500 мл.
Второй этап очистки выполняли с использованием гель-хроматографической колонки BioSil SEC 125-5, 300×7,8 мм. Предварительно колонку уравновешивали 0,02 М PBS буфером. Полученный материал вносили в хроматограф через насос хроматографа на скорости 0,5 мл/мин. Элюцию производили буфером (0,6 М раствор NaCl) с градиентом концентрации от 0,1 до 0,6 М. Собирали фракцию, имеющую поглощение при А280 нм не менее 3.4 оптических единиц. Фракцию собирали во флаконы. Объем получаемого раствора составил примерно 1 л с концентрацией антитела 2,2 мг на 1 мл.
Было проведено измерение Kd полученного антитела, созданный препарат антитела к легумаину обладает достаточно большой аффинностью (Kd=7,2·10-9).
Моноклональное антитело согласно изобретению возможно получить с использованием также других клеток млекопитающих, например, HEK293, COS.
Были проведены лабораторные исследования, отражающие конкретные примеры реализации указанного изобретения.
Пример 2. Оценка общей безопасности моноклонального антитела к легумаину на здоровых животных.
Для эксперимента использовали взрослых самцов крыс линии Вистар, 180-190 г. Экспериментальные животные поступили из НПП «Питомник лабораторных животных» ФИБХ РАН. Животных содержали в условиях вивария с соблюдением режима приема пищи и воды.
Карантин
Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. В течение карантина проводили ежедневный осмотр каждого животного (поведение и общее состояние), дважды в день животных наблюдали в клетках (заболеваемость и смертность). Перед началом исследования животные, отвечающие критериям включения в эксперимент, были распределены на группы (опыт и контроль) с помощью метода рандомизации. Животные, не соответствующие критериям, были исключены из исследования в течение карантина.
Содержание животных
Клетки с животными были помещены в отдельные комнаты. Световой режим: 12 ч - свет, 12 ч - темнота. Температура воздуха поддерживалась в пределах 19-25°C, относительная влажность - 50-70%. Температура и влажность воздуха регистрировались ежедневно. При изменении погодных условий контролировался воздухообмен в помещении с помощью анемометра и путем измерения содержания в воздухе углекислого газа и аммиака. Был установлен режим проветривания, обеспечивающий около 15 объемов помещения в час, концентрацию CO2 не более 0.15 объемных %, аммиака - не более 0.001 мг/л. Животные получали воду ad libitum.
Эксперимент
1 группа (контрольная 1). Животные контрольной группы получали инъекции физиологического раствора. Количество животных в группе - 7.
2 группа (опытная 1). Инъекции раствора моноклональных антител к легумаину 1 раз в 7 дней в количестве 10 мг. Количество животных в группе - 7.
Данный режим выдерживали 28 дней.
Исследовали несколько показателей подострой токсичности крыс.
Регистрация показателей
Общее состояние оценивалось при ежедневном осмотре животных. Взвешивание, измерение ректальной температуры, потребления воды и корма выполнялось раз в неделю и после окончания кормления.
Физиологические исследования проводились до начала опыта и через 30 дней после начала исследования.
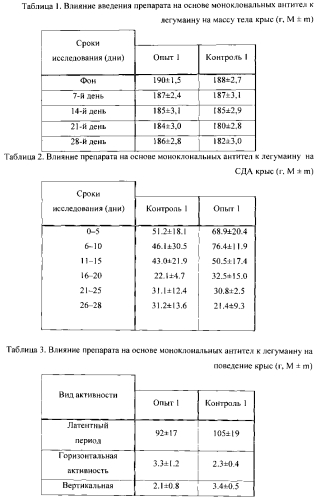
2.1. Влияние антитела к легумаину на массу тела здоровых животных (крыс). Точность используемых весов была верифицирована до начала исследования.
Результаты взвешивания крыс представлены в таблице 1.
2.2. Влияние антитела к легумаину на двигательную и исследовательскую активность здоровых животных (крыс).
В таблице 2 представлены данные по влиянию препарата на основе моноклональных антител к легумаину на спонтанную двигательную активность крыс (СДА). Крысы по одной помещались в регистрационную камеру автоматического регистратора «Coulburn Instruments)), где за каждые 5 минут на протяжении 35 минут у них регистрировалось количество движений.
Данные по контрольным животным свидетельствуют, что на протяжении исследования имело место общее снижение СДА (типичное явление в условиях длительных исследований).
2.3. Влияние антитела к легумаину на поведение здоровых животных (крыс) в «открытом поле».
Данные по влиянию препарата на основе моноклональных антител к легумаину на поведение крыс в «открытом поле» представлены в таблице 3.
Как видно из представленных данных, во всех экспериментальных группах животных не отмечается укорочение латентного периода, во всех группах нет увеличения активности, оцениваемое по количеству вертикальных стоек, пересечений и заглядываний по сравнению с фоновыми данными. Каких-либо статистически достоверных различий в структуре поведения животных опытной группы от контроля не отмечается.
Выводы
Тесты на подострую токсичность показали, что инъекции моноклональных антител не приводят к гибели животных: животные всех групп выжили.
Исследование двигательной и исследовательской активности показали, что инъекции моноклональных антител не приводят к снижению двигательной активности животных и уменьшения исследовательской активности по сравнению с контрольной группой.
Полученные данные свидетельствуют о возможности применения моноклональных антител к легумаину без причинения вреда организму животных.
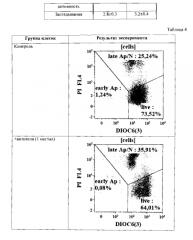
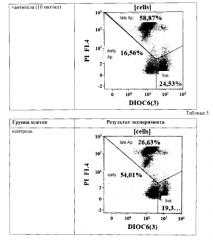
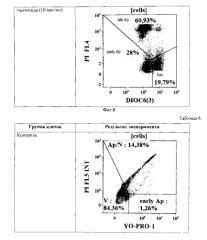
Пример 3. Демонстрация специфичного связывания антител к легумаину с опухолевыми клетками.
Отбор и обработка лимфоцитов. Забор венозной крови клинически здоровых доноров осуществляли в пробирки с добавлением гепарина (10 ЕД/мл). Кровь смешивали со стерильным забуференным фосфатами физиологическим растворов (ЗФР) в соотношении 1:2 и наслаивании на градиент плотности 1,077 г/мл Histopaque-1077 (Sigma-Aldrich, США), после чего центрифугировании в течение 30 мин при 400g и температуре 18-22°C. По завершении центрифугирования собирали слой мононуклеарных клеток, образовавшийся на границе раздела фаз. Полученную суспензию клеток дважды отмывали полной культуральной средой (ПКС), приготовленной на основе RPMI-1640 («Биолот», Санкт-Петербург) с добавлением 10% инактивированной эмбриональной телячьей сыворотки (ЭТС, «Биолот», Санкт-Петербург), 50 мкг/мл гентамицина («Биолот», Санкт-Петербург) и 2 мМ L-глутамина («Биолот», Санкт-Петербург), в течение 7 минут при 300g. После чего определяли количество полученных клеток при помощи гемоцитометра.
Выявление связывания MAb к легумаину с поверхностью клеток различных типов.
Клеточную суспензию дважды отмывали избытком PBS (7′ при 300g). Окраска проводилась в течение 30′ при +4°C (брали 10 мкл AT на 100 мкл клеточной суспензии - около 300000 клеток). Дважды отмывали избытком PBS, содержащим 2% FCS (7′ при 300 g). Ресуспендировали в 100 мкл свежего PBS и добавляли вторые AT, конъюгированные с FITC (349031 - goat anti-mouse Igs, BD) или РЕ (550083 - РЕ anti-mouse IgGl) по 5 и 2 мкл соответственно. Инкубировали при RT 15′. Однократно отмывали избытком PBS, содержащим 2% FCS (7′ при 300 g). Ресуспендировали в 100 мкл свежего PBS и добавляли 7-AAD (7 кл / 100 кл суспензии, ВС). Инкубировали при RT 10′ с ДНК-связывающим красителем 7-AAD (для удаления из зоны анализа разрушенных лимфоцитов). Добавляли по 250 мкл PBS и анализировали на цитометре.
Для настройки параметров флуоресценции по каналам FITC и РЕ в качестве контроля использовали клетки, окрашенные только вторыми антителами и проведенные через все стадии пробоподготовки. Анализировали не менее 15000 клеток, не входящих в «облака» агрегатов и негативный по 7-AAD («живых»), то есть с нормальной неповрежденной клеточной мембраной.
Результат связывания антител с поверхностью лимфоцитов человека приведен на Фиг. 1. Связывание не выявлено.
Результат связывания MAb к легумаину с поверхностью клеток COLO 320 HSR (происхождение: человек, карцинома сигмовидной кишки) приведен на Фиг. 2. Связывание MAb к легумаину с антигеном на поверхности данного типа клеток выявлено.
Результат связывания MAb к легумаину с поверхностью клеток PANC-1 (происхождение: человек, карцинома поджелудочной железы) приведен на Фиг. 3. Связывание MAb к легумаину с антигеном на поверхности данного типа клеток выявлено.
Результат связывания MAb к легумаину с поверхностью клеток А 549 (происхождение: человек, карцинома легкого) приведен на Фиг. 4. Связывание MAb к легумаину с антигеном на поверхности данного типа клеток выявлено.
Вывод: MAb