Селективные ингибиторы карбоксилэстеразы, представляющие собой алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты, способ их получения и применение
Иллюстрации
Показать всеИзобретение относится к алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатам общей формулы I, где R1= полифторалкил: при С=1 F=2-3, при С=2 F=2-5, при С=3 F=2-7; R2=Me, Et; R3=Н, Alk, AlkO, NO2. Алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты общей формулы I получают путем взаимодействия эквимолярных количеств смеси, предварительно полученной из эквивалентов ариламина и нитрита натрия в водном растворе соляной кислоты, и фторированного 3-оксоэфира в присутствии буфера в среде вода - органический растворитель, при этом процесс ведут с использованием в качестве органического растворителя хлоруглеводорода в присутствии галоидного тетраалкиламмония. Алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты общей формулы I применяют в качестве общих селективных ингибиторов карбоксилэстераз, в том числе как селективных ингибиторов карбоксилэстераз человека, карбоксилэстераз насекомых и карбоксилэстеразы плазмы грызунов. Алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты общей формулы I применяют как фармакологическое средство или в составе фармацевтической композиции или пестицидной рецептуры, регулирующие метаболизм и фармакокинетику лекарственных препаратов, содержащих сложноэфирные или амидные группировки. Технический результат - алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты в качестве эффективных и селективных ингибиторов карбоксилэстераз для повышения эффективности лекарственных препаратов и пестицидов, содержащих сложноэфирные и амидные группировки. 6 н. и 3 з.п. ф-лы, 2 табл., 1 ил., 6 пр.
Реферат
Изобретение относится к алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатам как эффективным и селективным ингибиторам карбоксилэстераз, усовершенствованному способу их получения, содержащим их фармацевтическим композициям и к их применению в медицине и сельском хозяйстве. В частности, оно относится к соединениям и композициям, которые демонстрируют способность эффективно и селективно ингибировать карбоксилэстеразы, что является особенно полезным для повышения эффективности лекарственных препаратов и пестицидов, содержащих сложноэфирные группы.
Карбоксилэстеразы (КЭ, КФ 3.1.1.1)- это сериновые гидролазы, принадлежащие к ферментам первой фазы метаболизма и детоксикации ксенобиотиков, содержащих сложноэфирные, амидные или карбаматные группы. Эти ферменты найдены в различных тканях животных (преимущественно в печени, сыворотке, легких, почках, кишечнике, гемато-энцефалическом барьере), растениях, грибах, дрожжах. Распределение этих ферментов по тканям коррелирует с их вовлечением в метаболизм ксенобиотиков. У человека важны два основных изофермента КЭ: это карбоксилэстераза 1 - hCE-1 (CES1), локализованная преимущественно в печени, и карбоксилэстераза 2 - hCE-2 (CES2, hiCE), которая находится преимущественно в тонком кишечнике [Imai Т. Human carboxylesterase isozymes: catalytic properties and rational drug design. Drug Metab Pharmacokinet. 2006, 21(3), 173-185; Sanghani SP et al, Human carboxylesterases: an update on CES1, CES2 and CES3. Protein Pept Lett. 2009, 16(10), 1207-1214].
Эндогенные субстраты КЭ до сих пор не идентифицированы. При этом известно, что КЭ являются ключевым ферментом гидролитического метаболизма большого числа разнообразных по химической структуре терапевтических средств, содержащих сложноэфирную, карбаматную или амидную группировку, определяя фармакокинетику этих препаратов. Это препараты различных фармакологических групп: антиагреганты (клопидогрел, дабигатрана этексилат, аспирин и др), ингибиторы ангиотензин-превращающего фермента (эналаприл, имидаприл, рамиприл и др), статины (симвастатин, ловастатин, клофибрат и др), препараты, действующие на ЦНС (метилфенидат, кокаин, героин, меперидин (петидин), флумазенил и др.), противовирусные средства (осельтамивир (Тамифлю), тенофовир дизопроксил, валацикловир и др.), иммунодепрессанты (метилпреднизолон, сукцинат), противораковые препараты (иринотекан, капецитабин и др.) [Laizure S.C. et al, The Role of Human Carboxylesterases in Drug Metabolism: Have We Overlooked Their Importance? Pharmacotherapy, 2013, 33(2), 210-222]. Анализ литературы показывает, что только в начале 2014 года в журнале Drug Metabolism and Disposition опубликовано порядка 10 статей по карбоксилэстеразному гидролизу применяемых на практике лекарственных средств.
В связи с этим ингибиторы КЭ, влияющие на скорость гидролиза таких лекарственных препаратов, и таким образом определяющие скорость превращения пролекарства в действующее лекарство или увеличивающие полупериод жизни активного препарата, гидролизующегося КЭ, и его биодоступность, имеют важное терапевтическое значение [Potter РМ, Wadkins RM. Carboxylesterases - detoxifying enzymes and targets for drug therapy. Curr Med Chem. 2006, 13 (9), 1045-1054].
Использование ингибиторов КЭ в качестве вспомогательных лекарственных средств (co-drugs, адъювантов) может существенно расширить применимость и повысить эффективность используемых в настоящее время лекарственных препаратов, а также снизить их побочные эффекты [Hatfield M.J., Potter P.M. Carboxylesterase inhibitors. Expert Opin Ther Pat. 2011, 21 (8), 1159-1171].
Доклинические исследования потенциальных лекарственных средств проводятся на грызунах, которые в отличие от человека имеют высокую активность КЭ плазмы. В связи с этим селективные ингибиторы КЭ чрезвычайно востребованы в качестве вспомогательного инструмента в доклинических исследованиях на грызунах новых фармакологических препаратов со сложноэфирными и амидными группировками. [Koitka Μ. et al. Improving the ex vivo stability of drug ester compounds in rat and dog serum: inhibition of the specific esterases and implications on their identity. J. Pharm. Biomed. Anal. 2010, 51(3), 664-678; Duysen E.G. et al. Production of ES1 plasma carboxylesterase knockout mice for toxicity studies. Chem. Res. Toxicol. 2011, 24(11), 1891-1898; Eng H. et al. Utility of the carboxylesterase inhibitor bis-para-nitrophenylphosphate (BNPP) in the plasma unbound fraction determination for a hydrolytically unstable amide derivative and agonist of the TGR5 receptor. Xenobiotica, 2010, 40(6), 369-380; Рудакова E.B. и др. Сравнительный анализ эстеразной активности крови человека, мыши и крысы. Бюлл. Эксп. Биол. Мед., 2011, 152(7), 80-83; Рудакова Е.В. и др. Новый селективный ингибитор карбоксилэстеразы плазмы мышей. ДАН, 2013, 449(2), 232-235].
Карбоксилэстеразы являются одним из основных ферментов детоксикации пестицидов у насекомых. Ингибирование КЭ насекомых потенцирует действие инсектицидов, гидролизующихся под действием КЭ, таких как пиретроиды и фосфорорганические инсектициды, содержащие сложноэфирные группы, например, малатион, а также антихолинэстеразных инсектицидов - за счет снижения их связывания с КЭ [Шипов А.Э., Генкина Г.К., Махаева Г.Ф., Малыгин В.В., Волкова Р.И., Рославцева С.А., Еремина О.Ю., Баканова Е.И., Мастрюкова Т.А., Кабачник М.И. Исследование механизма действия пестицидов ряда 2-арилокси-2-тио-1,3,2-оксазафосфоринана. Биоорган. химия, 1999, 25(1), 14-19]. Точечные мутации в аминокислотной последовательности КЭ, которые делают фермент более эффективным для детоксикации, приводят к появлению резистентности насекомых к пестицидам. Развитие устойчивости насекомых к пестицидам ведет к их более масштабному и неэффективному применению, которое может нанести вред окружающей среде, в том числе рыбам и животным, а также привести к существенному увеличению остатков пестицидов в продуктах питания. Использование ингибиторов КЭ является одним из путей преодоления резистентности насекомых к действию инсектицидов [Yan S, Cui F, Qiao С. Structure, function and applications of carboxylesterases from insects for insecticide resistance. Protein Pept. Lett., 2009, 16(10), 1181-1188].
Решением проблемы создания селективных и малотоксичных ингибиторов карбоксилэстераз в мире занимаются уже достаточное давно, однако в связи с большим структурным сходством сериновых эстераз имеется лишь ограниченное число сообщений о селективных ингибиторах КЭ.
Это прежде всего фосфорорганические ингибиторы (ФОИ), необратимо и продолжительно ингибирующие КЭ. Однако, поскольку большинство ФОИ также ингибируют ацетилхолинэстеразу, они чаще всего обладают высокой острой токсичностью. Известно всего несколько ФОИ, селективно ингибирующих КЭ. Это бис(пара-нитрофенил)фосфат [Heymann Ε, Krisch К. Phosphoric acid-bis-(p-nitro-phenylester), a new inhibitor of microsomal carboxylesterases. Hoppe-Seyler′s Z. Physiol. Chem., 1967, 348, 609-619] и циклические производные фосфорной кислоты Bomin-1, 2, и 3 [Цветков Е.Н., Дегтярев А.Н., Бовин А.Н., Махаева Г.Ф., Янковская В.Л. 2-Алкокси-2-оксо-5,6-бензо-1,4,2-диоксафосфоринаны в качестве избирательных ингибиторов неспецифических эстераз теплокровных животных. Авторское свидетельство на изобретение №1187444, приоритет от 11.03.1984, зарегистрировано 22.06.1985]. Недавно найдены селективные ингибиторы КЭ в ряду О-фосфорилированных 1-гидроперфторизопропанолов. Эти соединения обладают низкой острой токсичностью и могут быть использованы для селективного ингибирования КЭ плазмы грызунов [Патент РФ №2423132, приоритет от 15.04.2010, зарегистрирован 10.07.11. «Средство для необратимого ингибирования in vivo карбоксилэстеразы на основе фосфорилированных 1-гидроперфторизопропанолов, обладающее низкой острой токсичностью для теплокровных, и способ его применения для ингибирования карбоксилэстеразы в плазме грызунов». Авторы: Махаева Г.Ф., Рудакова Е.В., Аксиненко А.Ю., Соколов В.Б., Серебрякова О.Г., Галенко Т.Г.]. Однако практическое применение фосфорорганических ингибиторов карбоксилэстераз вызывает известную настороженность в связи с их возможным отставленным нейротоксическим эффектом.
Селективные псевдо-необратимые ингибиторы КЭ с низкой острой токсичностью найдены в ряду О-карбамоилированных 1-гексафторизопропанолов [Патент РФ №2449988, приоритет от 29.04.2011, зарегистрирован 10 мая 2012 г. «2,2,2-Трифтор-1-трифторметилэтиловый эфир циклогексилкарбаминовой кислоты в качестве эффективного средства для селективного необратимого ингибирования карбоксилэстеразы». Авторы: Махаева Г.Ф., Болтнева Н.П., Мухамадиева Г.Р., Соколов В.Б., Галенко Т.Г.].
К известным обратимым ингибиторами КЭ относятся замещенные трифторметилкетоны (ТФК). С точки зрения ферментативной кинетики ТФК являются прочными медленными обратимыми ингибиторами [Wadkins R.M., Hyatt J.L. et al, Analysis of mammalian carboxylesterase inhibition by trifluoromethylketone-containg compounds. Mol. Pharmacol. 2007, 71(3), 713). Однако эти соединения весьма гигроскопичны и легко гидролизуются [Wheelock С.Е., Severson T.F., Hammock B.D. Synthesis of new carboxylesterase inhibitors and evaluation of potency and water solubility. Chem. Res. Toxicol., 2001, 14(12), 1563-1572]. Кроме того, некоторые известные представители ТФК ингибируют холинэстеразы.
Недавно в качестве селективных ингибиторов КЭ были предложены ароматические 1,2-дионы и замещенные арилсульфонамиды и арилмочевины [Potter P.M., Hyatt J.L., Morton C.L., Beroza P.P., Damoradan K.V. Amide, aryl sulfonamide, aryl urea, and α,β-diketone derived carboxylesterase inhibitors, and their methods of use; patent US 7,973,034 B2; Jul. 5, 2011]. Бис-бензолсульфонамиды специфически ингибируют КЭ кишечника (hCE-2) с константами в наномолярной области, но обладают очень низкой растворимостью и слабой проницаемостью через мембраны. [Wadkins R.M. et al, Identification of novel selective human intestinal carboxylesterase inhibitors for the amelioration of irinotecan-induced diarrhea: Synthesis, quantitative structureactivity relationship analysis, and biological activity. Mol. Pharmacol, 2004, 65, 1336-1343; Hicks L.D. et al. Improved, selective, human intestinal carboxylesterase inhibitors designed to modulate 7-ethyl-10-[4-(1-piperidino)-1-piperidino]carbonyloxycamptothecin (Irinotecan; CPT-11) toxicity. J. Med. Chem. 2009, 52, 3742-3752]. Замещенные 1,2-дионы селективно ингибируют КЭ человека и являются, согласно последним данным, перспективным классом соединений для применения in vivo, однако недостаточная растворимость ограничивает их дальнейшее применение [Hatfield M.J., Potter P.M. Carboxylesterase inhibitors. Expert. Opin. Ther. Pat. 2011, 21(8), 1159-1171].
Замещенные трифторметилкетоны и ароматические 1,2-дионы являются наиболее близкими аналогами к предлагаемому техническому решению.
Задачей изобретения является расширение арсенала средств, которые могут быть использованы в качестве новых высокоэффективных и селективных ингибиторов карбоксилэстеразы для снижения карбоксилэстеразного гидролиза различных биологически активных сложных эфиров и амидов, в том числе пролекарств, лекарств, содержащих сложноэфирные группы, и пестицидов, и разработка промышленно применимого способа получения селективных ингибиторов карбоксилэстеразы.
Поставленная задача решается разработкой нового удобного, экономичного и промышленно применимого способа получения алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I и обнаружением и использованием нового их свойства - высокоэффективно и селективно ингибировать КЭ:
,
где R1= полифторалкил: при С=1, F=2-3, при С=2, F=2-5, при С=3, F=2-7;
R2=Me, Et;
R3=Η, Alk, AlkO, NO2.
Ранее был описан способ получения соединений I по реакции Яппа-Клингеманна, в результате которого происходит азосочетание солей арилдиазония с фторалкилсодержащими 3-оксоэфирами в водно-спиртовой или водно-ацетоновой среде в присутствии ацетата натрия [Щегольков Е.В., Бургарт Я.В., Худина О.Г., Салоутин В.И., Чупахин О.Н. 2-(Гет)арилгидразоно-1,3-соединения в органическом синтезе. Усп. химии. 2010, 79 (1), 33-64]. Ранее этот способ был использован для получения отдельных представителей соединений общей формулы I [Mitchell Α., Nonhebel D.C. Spectroscopic studies of tautomeric systems. III. 2-Arylhydrazones of 1,2,3-triketones. Tetrahedron. 1979, 35, 2013-2019; Кузуева О.Г., Бургарт Я.В., Салоутин В.И. Синтез 2-арилгидразонов фторсодержащих 1,2,3-трикарбонильных соединений алифатического ряда и их реакции с динуклеофилами. Изв. АН. Сер. Хим. 1998, 695-700; Burgart Ya.V., Fokin A.S., Kuzueva O.G., Chupakhin O.N., Saloutin V.I. Synthesis of fluorinated 2(3)-arylhydrazones of 1,2,3-tri(1,2,3,4-tetra)carbonyl compounds and their heterocyclization reactions. J. Fluor. Chem. 1998, 92, 101-108; Худина О.Г., Щегольков E.B., Бургарт Я.В., Салоутин В.И. Эфиры фторалкилсодержащих 2-арилгидразоно-3-оксокарбоновых кислот в реакциях с о-фенилендиамином. Журн. органич. химии. 2004, 40, 854-858; Худина О.Г., Бургарт Я.В., Щегольков Е.В., Салоутин В.И., Кажева О.Н., Чехлов А.Н., Дьяченко О.А. Пространственное строение 2-(гет)арилгидразоно-3-оксо-3-фторалкилпропионатов. Журн. органич. химии. 2009, 45, 819-827]. Общим недостатком этого способа при получении фторалкилсодержащих производных является проведение реакции азосочетания в водно-спиртовой или водно-ацетоновой среде, что приводит к протеканию побочных процессов, таких как кислотное расщепление с последующим образованием формазанов. При этом выход целевых продуктов I с «коротким» фторалкильным заместителем составляет 41-63%. Помимо этого, выделение и очистка алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов I осуществляется посредством колоночной хроматографии, что исключает возможность масштабирования процесса и использование этого способа в промышленности.
Нами предложен новый способ синтеза алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I путем проведения реакции азосочетания в условиях межфазного синтеза в системе хлоруглеводород - вода в присутствии катализатора - галоидного тетраалкиламмония. Такой способ исключает использование метанола - опаснейшего яда, малопригодного для использования в синтезе лекарственных препаратов, а также альтернативного растворителя - ацетона, являющегося пожароопасной легковоспламеняющейся жидкостью. Нами осуществлена замена этих растворителей на непожароопасные и менее токсичные хлоруглеводороды (дихлорметан, хлороформ, тетрахлорметан). Эффективность реакции достигается использованием четвертичной аммонийной соли в качестве катализатора межфазного переноса.
Преимуществом способа является большая селективность процесса азосочетания, в результате чего уменьшается образование побочных продуктов (формазанов), что значительно упрощает выделение и очистку продуктов I. Вместо трудоемкой колоночной хроматографии используют операции экстракции и перекристаллизации. Все это приводит к повышению выхода целевых продуктов I (до 81-87%), что особенно показательно для производных с «коротким» фторалкильным заместителем.
Общий способ синтеза алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I.
К раствору полифторалкилсодержащего 3-оксоэфира и тетраалкиламмония галогенида в соотношении 1:(0,1-0,5) в хлоруглеводороде приливают насыщенный водный раствор ацетата натрия. К полученной гетерофазной смеси при охлаждении и перемешивании медленно прикапывают раствор соли арилдиазония, приготовленный из ариламина, концентрированной соляной кислоты и водного раствора нитрита натрия. Перемешивают, отделяют органический слой. Водный слой экстрагируют хлоруглеводородом. Объединенные органические фракции сушат над сульфатом магния, растворитель упаривают. Остаток перекристаллизовывают из подходящего растворителя.
Чистоту полученных соединений контролируют методом ТСХ, значения Rf определяют с использованием пластинок Silufol-UV. Структуру полученных соединений подтверждают данными элементного анализа (С, Н, N-анализатор Perkin Elmer ΡΕ 2400 series II). ИК спектры регистрируют на Фурье-спектрометре Perkin Elmer Spectrum One с приставкой диффузного отражения (DRA). Спектры ЯМР 1Н и 19F соединений записывают на спектрометре Bruker DRX-400 с рабочей частотой 400 и 376 МГц, соответственно, в дейтерированном органическом растворителе с использованием внутренних стандартов ТМС (для ядер 1Н) и C6F6 (для ядер 19F). Температуры плавления определяют в открытых капиллярах на аппарате для определения точки плавления Stuart SMP30.
Ниже приведены примеры синтеза заявляемых соединений, которые иллюстрируют, но не ограничивают данное изобретение.
Пример 1. К раствору 1.84 г (10 ммоль) этилового эфира 3-оксо-4,4,4-трифторбутановой кислоты и 0.05 г (1.5 ммоль) бромистого тетрабутиламмония в 30 мл хлористого метилена приливают раствора 4.55 г ацетата натрия в 20 мл воды. К полученной гетерофазной смеси при охлаждении до 0°C и при перемешивании медленно прикапывают раствор соли фенилдиазония, приготовленной из 0.93 г (10 ммоль) анилина, 2 мл концентрированной соляной кислоты и раствора нитрита натрия (0.69 г, 10 ммоль) в 3 мл воды. Смесь перемешивают в течение 30 минут. Отделяют органический слой. Водный слой экстрагируют хлористым метиленом (2×30 мл). Объединенные органические фракции сушат над сульфатом магния, растворитель упаривают. Остаток перекристаллизовывают из этанола. Получают этиловый эфир 2-фенилгидразоно-3-оксо-4,4,4-трифторбутановой кислоты (1) (Соединение формулы I, где R1=CF3, R2=Et, R3=Η). Выход 2.48 г (86%), оранжевые кристаллы, т.пл. 90-91°C. ИК спектр (DRA), ν, см-1: 3150, 1625 (ΝΗ), 1680 (С=O), 1620, 1540, 1510 (C=N, С=С), 1250-1100 (C-F). Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 1.42 т (3Η, OCH2Me, 3JH,H 7.1), 4.41 к (2Н, OCH2CH3, 3JH,H 7.1), 7.24-7.26 и 7.43-7.46 оба м (5Н, С6Н5), 13.49 уш.с (1Н, NH). Найдено, %: С 50.01, Η 3.87, F 19.88, N 9.80. C12H11F3N2O3. Вычислено, %: С 50.01, Η 3.85, F 19.77, N 9.72.
Пример 2. Этиловый эфир 2-[(4-метилфенил)гидразоно]-3-оксо-4,4,4-трифторбутановой кислоты (2). (Соединение формулы I, где R1=CF3, R2=Et, R3=4-Ме). Получают аналогично примеру 1 из 1.07 г n-толуидина (10 ммоль) и 1.84 г (10 ммоль) этилового эфира 3-оксо-4,4,4-трифторбутановой кислоты. Выход 2.45 г (81%), желтый порошок, т.пл. 75-76°C. ИК спектр (DRA), ν, см-1: 3100, 1590 (ΝΗ), 1690 (С=O), 1630, 1520, 1500 (C=N, С=С), 1200-1080 (C-F). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.28 т (3H, ОСН2Ме, 3JH,H 7.1), 2.28 с (3H, Me), 4.30 к (2Н, ОСН2СН3, 3JH,H 7.1), 7.18-7.36 м (4Н, С6Н4), 11.65 уш.с (1H, NH). Найдено, %: С 51.89, Η 4.59, F 18.58, N 9.15. C13H13F3N2O3. Вычислено, %: С 51.66, Η 4.34, F 18.86, N 9.27.
Пример 3. Этиловый эфир 2-(4-метоксифенил)гидразоно-3-оксо-4,4,4-трифторбутановой кислоты (3). (Соединение формулы I, где R1=CF3, R2=Et, R3=4-ОМе). Получают аналогично примеру 1 из 1.23 г (10 ммоль) n-анизидина и 1.84 г (10 ммоль) этилового эфира 3-оксо-4,4,4-трифторбутановой кислоты. Выход 2.70 г (85%), желтые кристаллы, т.пл. 130-131°C. ИК спектр (DRA), ν, см-1: 3090 (NHвал), 1690 (С=O), 1640, 1580, 1520 (NHдеф, N=N, С=С), 1140-1050 (C-F). Спектр ЯМР 1Н [(CD3)2CO, δ, м.д., J/Гц]: 1.35 т (3H, СН2Ме, 3JH,H 6.8); 3.86 с (3H, ОМе); 4.38 к (2Н, OCH2Me, 3JH,H 6.8); 7.06-7.10, 7.57-7.60 оба м (4Н, С6Н4); 13.42 уш.с (1Н, NH). Спектр ЯМР 13С [(CD3)2CO, δ, м.д., J/Гц]: 55.94 (C6H4-OMe), 14.32 и 62.16 (OEt), 118.40 к (С4, lJC,F 292.9), 115.83, (Co), 119.04 (Cm), 121.36 (Cipso), 135.77 (С2), 159.59 (Ср), 174.29 к (С3, 2JC,F 31.5), 164.09 (С1). Спектр ЯМР 19F [(CD3)2CO, δ, м.д.]: 93.78 с (CF3). Найдено, %: С 49.05, Η 4.06, F 17.97, N 8.83. C13H13F3N2O4. Вычислено, %: С 49.06, Η 4.12, F 17.91, N 8.80.
Пример 4. Этиловый эфир 2-(2-нитрофенил)гидразоно-3-оксо-4,4,4-трифторбутановой кислоты (4). (Соединение формулы I, где R1=CF3, R2=Et, R3=2-NO2). Получают аналогично примеру 1 из 1.38 (10 ммоль) г о-нитроанилина и 1.84 г (10 ммоль) этилового эфира 3-оксо-4,4,4-трифторбутановой кислоты. Выход 2.86 г (86%), оранжевые кристаллы, т.пл. 99-100°C. ИК спектр (DRA), ν, см-1: 3120, 16130 (ΝΗ), 1685 (С=O), 1610, 1520, 1500 (C=N, С=С), 1220-1110 (C-F). Спектр ЯМР 1H (CDCl3, м.д., J/Гц): 1.45 т (3H, OCH2Me, 3JH,H 7.1), 4.50 к (2Н, ОСН2СН3, 3JH,H 7.1), 7.34 д.д.д (1Η, Н4, J 8.4, 7.3, 1.3), 7.60-7.86 м (1Н, Η5), 8.07 д.д (1Η, Η6, J 8.4, 0.9), 8.30 д.д (1Η, Η3, J 8.4, 1.3), 14.71 с (1Η, NH). Спектр ЯМР 19F (CDCl3, δ, м.д.): 90.96 с (CF3). Найдено, %: С 43.15, Η 3.07, F 17.35, N 12.80. C12H10F3N3O5. Вычислено, %: С 43.25, Η 3.02, F 17.10, N 12.61
Пример 5. Метиловый эфир 2-(4-метилфенил)гидразоно-3-оксо-4,4-дифторбутановой кислоты (5). (Соединение формулы I, где R1=CF2H, R2=Me, R3=4-Ме). Получают аналогично примеру 1 из 1.07 г (10 ммоль) n-толуидина и 1.52 г (10 ммоль) метилового эфира 3-оксо-4,4-дифторбутановой кислоты. Выход 2.21 г (82%), оранжевый порошок, т.пл. 102-103°C. ИК спектр (DRA), ν, см-1: 3130, 1620 (ΝΗ), 1700, 1680 (С=O), 1590, 1530 (C=N, С=С), 1220-1125 (C-F). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 2.37 с (3H, Me), 3.95 с (3H, ОМе), 6.69 т (1Н, HCF2, 2JH,F 54.3), 7.22-7.29 м (4Н, С6Н4), 13.44 уш.с (1H, NH). Спектр ЯМР 19F (CDCl3, δ, м.д., J/Гц): 34.55 д (HCF2, 2JF,H 54.3). Найдено, %: С 53.48; Η 4.42; F 14.00; N 10.12. C12H12F2N2O3. Вычислено, %: С 53.34; Η 4.48; F 14.06; N 10.37.
Пример 6. Метиловый эфир 2-(4-метоксифенил)гидразоно-3-оксо-4,4,5,5,6,6,6-гептафторгексановой кислоты (6). (Соединение формулы I, где R1=C3F7, R2=Me, R3=4-ОМе). Получают аналогично примеру 1 из 1.23 г (10 ммоль) n-анизидина и 2.70 г (10 ммоль) метилового эфира 3-оксо-4,4,5,5,6,6,6-гептафторгексановой кислоты. Выход 3.51 г (87%), желтые кристаллы, т.пл. 95-96°C. ИК спектр (DRA), ν, см-1: 3100, 1615 (ΝΗ), 1705, 1675 (С=O), 1600, 1545 (N=N, С=С), 1250-1150 (C-F). Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.84, 3.93 оба с (6Н, 2OMe), 6.95-6.99, 7.34-7.40 м (4Н, С6Н4), 13.66 с (1H, ΝΗ). Спектр ЯМР 19F (CDCl3, δ, м.д.): 37.50 м (2F, β-CF2), 49.66 м (2F, α-CF2), 81.40 м (3F, CF3). Найдено, %: С 41.49, Η 2.79, F 32.80; N 6.76. C14H11F7N2O4. Вычислено, %: С 41.60, Η 2.74, F 32.90, N 6.93.
В результате проведенных биологических испытаний обнаружено новое, ранее неизвестное свойство алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I - его способность к ингибированию КЭ.
Методика биологических испытаний - определения ингибиторной активности соединения общей формулы I в отношении карбоксилэстеразы, ацетилхолинэстеразы и бутирилхолинэстеразы.
Для кинетических исследований используют коммерческие препараты («Sigma», США) ацетилхолинэстеразы эритроцитов человека (АХЭ, КФ 3.1.1.7), бутирилхолинэстеразы сыворотки лошади (БХЭ, КФ 3.1.1.8) и карбоксилэстеразы печени свиньи (КЭ, КФ 3.1.1.1), которая имеет высокую гомологию, сходное строение активного центра и близкую ингибиторную специфичность с карбоксилэстеразой печени человека hCE-1 [Satoh Т., Hosokawa Μ. The mammalian carboxylesterases: from molecules to functions. Annu. Rev. Pharmacol. Toxicol. 1998, 38, 257-288].
Определение активности ферментов
Активность КЭ определяют спектрофотометрически по выделению 4-нитрофенола (λ 405 нм), субстрат - 4-нитрофенилацетат (1 мМ); условия определения: 0.1 Μ фосфатный буфер рН 8.0, 25°C [Sterri S.H. et al. A radiochemical assay method for carboxylesterase, and comparison of enzyme activity towards the substrates methyl [1-14C] butyrate and 4-nitrophenyl butyrate, Biochem. Pharmacol. 1985, 34(15), 2779-2785]. Активность АХЭ и БХЭ определяют методом Эллмана (λ 412 нм) [Ellman G.L et al. А new and rapid colorimetric determination of acetylcholinesterase activity, Biochem. Pharmacol. 1961. V. 7. P. 88-95] с использованием в качестве субстрата ацетилтиохолина (1 мМ) и бутирилтиохолина (1 мМ), соответственно; условия определения: 0.1 Μ фосфатный буфер рН 7.5, 25°C. Измерения проводят на микропланшетном спектрофотометре BioRad Benchmark Plus (Франция).
Определение величин IC50 для ингибирования КЭ, АХЭ и БХЭ
Первичную оценку ингибиторной активности соединений проводят путем определения степени ингибирования ферментов при концентрации соединения 20 мкМ, затем для наиболее активных соединений определяют величины IC50 - концентрации ингибитора, которые требуются для снижения активности фермента на 50%. Для определения IC50 ингибирования КЭ, АХЭ и БХЭ образец соответствующего фермента инкубируют с исследуемым соединением (концентрация ДМСО 2 об.%) в течение 10 минут, затем определяют остаточную активность фермента. Диапазон концентраций исследуемого соединения составляет 1×10-12 - 1×10-4 M. Каждый эксперимент проводят в трипликате. Измерения проводят на микропланшетном спектрофотометре BioRad Benchmark Plus, Франция. Вычисление IC50 проводят с использованием программы Origin 6.1.
Определение механизма ингибирования КЭ соединением общей формулы I и расчет кинетических констант ингибирования
Для выяснения механизма ингибирования определяют зависимость остаточной активности КЭ от концентрации ингибитора при различных концентрациях субстрата. Каждый эксперимент проводят в трипликате. Данные анализируют в двойных обратных координатах Лайнуивера-Берка. Механизм ингибирования определяют из анализа зависимостей 1/V=f(1/S), полученных для трех возрастающих концентраций ингибитора. Вычисление кинетических констант ингибирования Ki (конкурентная составляющая) и αKi (неконкурентная составляющая) проводят с использованием программы Origin 6.1.
Ниже приведены результаты биологических испытаний соединения общей формулы I, которые иллюстрируют, но не исчерпывают настоящее изобретение.
Определена ингибиторная активность представителей соединений общей формулы I в отношении целевого фермента - карбоксилэстеразы и двух сериновых эстераз, имеющих близкую структуру активного центра - ацетилхолинэстеразы, ингибирование которой приводит к острой холинергической токсичности, и бутирилхолинэстеразы.
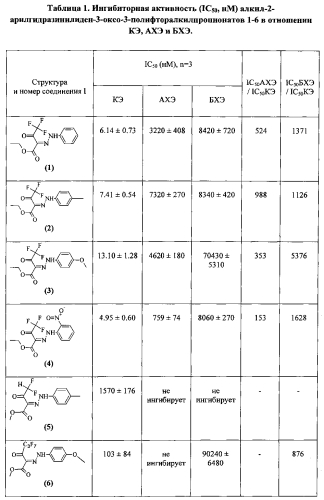
Полученные величины IC50 представлены в таблице 1. Результаты биологических испытаний показывают, что соединения формулы I проявляют высокую ингибиторную активность и селективность в отношении КЭ по сравнению с АХЭ и БХЭ. Максимальную активность в отношении КЭ проявляют соединения 1-4 (примеры 1-4), которые ингибируют КЭ в наномолярном диапазоне. Селективность этих соединений к КЭ по сравнению с БХЭ составляет три порядка, максимальную селективность, равную 5376 проявляет соединение 3. Селективность соединений к КЭ по сравнению с АХЭ находится в диапазоне от 153 (соединение 4) до 988 (соединение 2). Невысокая ингибиторная активность большинства соединений в отношении АХЭ, свидетельствует о низкой острой холинергической токсичности соединений.
Соединения 5 и 6 (примеры 5-6) менее активны в отношении КЭ - величины IC50 находятся в микромолярной области. При этом соединение 5 вообще не ингибирует АХЭ и БХЭ, а более активное соединение 6 не ингибирует АХЭ и является слабым ингибитором БХЭ (селективность КЭ/БХЭ равна 876).
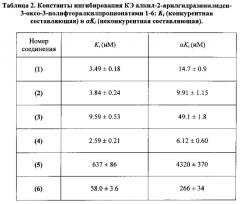
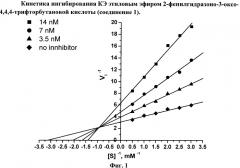
Исследован механизм ингибирования КЭ алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатами общей формулы I. На Фиг. 1 приведены зависимости ингибиторной активности соединением 1 (пример 1) от концентрации субстрата [S], полученные для трех возрастающих концентраций ингибитора 3.5 нМ, 7 нМ и 14 нМ. Зависимости представлены в координатах Лайнуивера - Берка. Пересечение прямых зависимостей 1/V=f(1/S), полученных для разных концентраций ингибитора, в левом верхнем квадранте свидетельствует о смешанном типе ингибирования. Конкурентная (Κi) и неконкурентная (αKi) компоненты константы ингибирования КЭ данным соединением составляют 3.49±0.18 нМ и 14.7±0.9 нМ, соответственно. Соединения 2-6 (примеры 2-6) ингибируют КЭ по аналогичному механизму.
Константы ингибирования КЭ алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатами 1-6 представлены в таблице 2.
В результате исследования ингибиторной активности алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I в отношении КЭ и структурно близких эстераз АХЭ и БХЭ установлено, что данные соединения являются эффективными и селективными обратимыми ингибиторами карбоксилэстеразы, ингибирующими фермент по смешанному типу.
Таким образом, другим важным аспектом настоящего изобретения является применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I в качестве ингибитора карбоксилэстераз.
Применение базируется на обнаружении у алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I ранее не известного свойства - способности эффективно и селективно ингибировать карбоксилэстеразу.
Основным применением данного изобретения является применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I в качестве общего селективного ингибитора карбоксилэстераз, в том числе как селективных ингибиторов карбоксилэстераз человека, карбоксилэстераз насекомых и карбоксилэстеразы плазмы грызунов.
Предпочтительным является применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I в качестве фармакологического средства для снижения (ингибирования) карбоксилэстеразного гидролиза различных лекарственных препаратов, содержащих сложноэфирные или амидные группировки, и регуляции таким образом их метаболизма и фармакокинетики. Такими лекарственными препаратами могут быть как пролекарства, где за счет карбоксилэстеразного гидролиза высвобождается активное вещество, так и действующие (активные) лекарственные средства. Применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I увеличивает полупериод жизни активного препарата, повышает биодоступность и эффективность лекарственных препаратов, содержащих сложноэфирные или амидные группировки.
Предпочтительно применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I как средства для ингибирования КЭ насекомых, что приводит к повышению эффективности применяемых на практике пестицидов, включая антихолинэстеразные инсектициды и пиретроиды.
Еще одним предпочтительным вариантом применения алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I является их применение для ингибирования КЭ плазмы грызунов при исследованиях на грызунах, в том числе доклинических, фармакологически активных соединений, содержащих сложноэфирные и/или амидные группы, для снижения скорости карбоксилэстеразного гидролиза таких соединений, в качестве инструмента стабилизации.
Следующим аспектом изобретения является фармакологическое средство на основе алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I, содержащее терапевтически эффективное количество соединения формулы I, регулирующее метаболизм и фармакокинетику лекарственных препаратов, содержащих сложноэфирные или амидные группировки. Заявляемое фармакологическое средство содержит активное начало и фармацевтически приемлемый носитель, новизна которого заключается в том, что в качестве активного начала используется эффективное количество соединения формулы I.
Понятие «фармакологическое средство» подразумевает использование любой лекарственной формы, содержащей соединение формулы I, которое могло бы найти профилактическое или лечебное применение в медицине в качестве средства для регуляции метаболизма и фармакокинетики лекарственных препаратов, содержащих сложноэфирные или амидные группировки.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование того количества соединения формулы I, которое в сочетании с его показателями активности и токсичности, а также на основании знаний специалиста, должно быть эффективным в данной лекарственной форме.
Для получения фармакологического средства одно или несколько соединений формулы I смешивают как активный ингредиент с фармацевтически приемлемым носителем, известным в медицине, согласно принятым в фармацевтике способом. В зависимости от лекарственной формы препарата могут быть использованы различные носители.
Соединение формулы I может быть введено в организм либо до, либо после или одновременно с лекарственным препаратом, который метаболизируется карбоксилэстеразой.
Дополнительным аспектом настоящего изобретения является фармацевтическая композиция на основе алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I, состоящая из известного лекарственного средства, содержащего сложноэфирную или амидную группировку, которое метаболизируется карбоксилэстеразой, и соединения формулы I, для повышения эффективности применяемого лекарственного средства. Подходящими представителями этерифицированных лекарственных средств, но не ограниченными этими лекарственными средствами, являются антиагреганты - клопидогрел, аспирин, ингибиторы ангиотензин-превращающего фермента - эналаприл, имидаприл, статины - симвастатин, ловастатин, противовирусные средства - осельтамивир (Тамифлю), валацикловир, иммунодепрессанты - метилпреднизолон.
Следующим дополнительным аспектом настоящего изобретения является пестицидная рецептура на основе алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионатов общей формулы I, содержащая соединение, активное как пестицид, и алкил-2-арилгидразинилиден-3-оксо-3-полифторалкил-пропионат общей формулы I в качестве ингибитора КЭ насекомых, для повышения эффективности пестицидов. Подходящими соединениями, активными в качестве пестицидов, но не ограниченными этими соединениями, являются карбофос (малатион), паратион, дурсбан (хлорпирифос), перметрин, дельтаметрин (децис), фенвалерат.
1. Селективные ингибиторы карбоксилэстеразы, представляющие собой алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты общей формулы I ,где R1 = полифторалкил: при C=1 F=2-3, при C=2 F=2-5, при C=3 F=2-7;R2=Me, Et;R3=H, Alk, AlkO, NO2.
2. Способ получения селективных ингибиторов карбоксилэстеразы по п. 1, включающий взаимодействие эквимолярных количеств смеси, предварительно полученной из эквивалентов ариламина и нитрита натрия в водном растворе соляной кислоты, и фторированного 3-оксоэфира в присутствии буфера в среде вода - органический растворитель, отличающийся тем, что процесс ведут с использованием в качестве органического растворителя хлоруглеводорода в присутствии галоидного тетраалкиламмония.
3. Применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I по п.1 в качестве общих селективных ингибиторов карбоксилэстераз, в том числе как селективных ингибиторов карбоксилэстераз человека, карбоксилэстераз насекомых и карбоксилэстеразы плазмы грызунов.
4. Применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I по п.3 как фармакологического средства, регулирующего метаболизм и фармакокинетику лекарственных препаратов, содержащих сложноэфирные или амидные группировки.
5. Применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I по п. 3 как средства для ингибирования карбоксилэстераз насекомых.
6. Применение алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов общей формулы I по п. 3 как средства для ингибирования карбоксилэстеразы плазмы грызунов.
7. Фармакологическое средство на основе соединений общей формулы I по п.1, содержащее терапевтически эффективное количество соединения формулы I, регулирующее метаболизм и фармакокинетику лекарственных препаратов, содержащих сложноэфирные или амидные группировки.
8. Фармацевтическая композиция на основе соединений общей формулы I, состоящая из известного лекарственного средства, содержащего сложноэфирную или амидную группировку, и эффективного количества алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионата по п. 1, для повышения эффективности указанного лекарственного средства.
9. Пестицидная рецептура на основе соединений общей формулы I, содержащая соединение, активное как пестицид, и алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионат по п. 1 в качестве ингибитора карбоксилэстеразы насекомых для повышения эффективности указанного пестицида.