Система и способ увеличения наружного диаметра вен
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Способ постоянного увеличения наружного диаметра и диаметра просвета периферической вены пациента для создания артериовенозной фистулы или артериовенозного трансплантата осуществляют с помощью системы для постоянного увеличения наружного диаметра и диаметра просвета периферической вены. При этом соединяют по текучей среде один конец узла насос-трубка с донорным сосудом. Соединяют по текучей среде другой конец узла насос-трубка с периферической веной. Перекачивают кровь из донорного сосуда в периферическую вену при скорости потока и в течение периода времени, достаточных для того, чтобы вызвать постоянное увеличение наружного диаметра и диаметра просвета периферической вены. Перекачивание крови ведет к напряжению сдвига стенки принимающей вены большему или равному 0,76 Па. Перекачивание крови ведет к среднему пульсовому давлению в принимающей вене ниже 40 мм рт.ст. При завершении перекачивания расширение остается постоянным в течение времени, необходимого для удаления насоса, трубки и для создания артериовенозной фистулы или артериовенозного трансплантата с использованием части периферической вены, содержащей постоянно увеличенный общий диаметр. Применение изобретений обеспечит создание артериовенозной фистулы или артериовенозного трансплантата, который остается в расширенном состоянии в течение времени, достаточного для создания места доступа. 2 н. и 44 з.п. ф-лы, 9 ил.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к системам и способам для постоянного увеличения наружного диаметра и диаметра просвета вен у пациентов. В частности, настоящее изобретение относится к системам и способам, в которых используют кровяной насос для увеличения скорости крови и напряжения сдвига стенки (НСС) на эндотелии периферических вен в течение некоторого периода времени, которое ведет к постоянному увеличению наружного диаметра и диаметра просвета этих вен.
2. Уровень техники
У многих пациентов с хронической почечной недостаточностью в конечном счете развивается терминальная стадия почечной недостаточности (ТСПН) и необходима почечная замещающая терапия для того, чтобы удалять текучие вещества и продукты метаболизма из организма и поддерживать их жизнь. Многие пациенты с ТСПН, нуждающиеся в почечной замещающей терапии, получают гемодиализ. Во время гемодиализа кровь удаляют из кровеносной системы, очищают в гемодиализаторе и затем возвращают в кровеносную систему. Хирурги создают отдельные «участки сосудистого доступа», которые можно использовать для быстрого удаления и возвращения крови у пациентов с ТСПН. Несмотря на то, что значительные достижения выполнены в самих гемодиализаторах и других частях процесса гемодиализа, в создании прочных и надежных участков сосудистого доступа, в которых кровь можно удалять и возвращать пациентам во время процедур гемодиализа, наблюдается лишь небольшое улучшение и оно остается ахиллесовой пятой почечной замещающей терапии. Часто это ведет к заболеваниям и смерти пациентов с ТСПН и накладывает большие обязательства на поставщиков медицинских услуг, плательщиков и программы социального обеспечения по всему миру.
Участки гемодиализного доступа, как правило, имеют три формы: артериовенозные фистулы (АВФ), артериовенозные трансплантаты (АВТ) и катетеры. Каждый тип участка имеет высокую степень отказа и осложнения, как описано ниже.
АВФ конструируют хирургически посредством создания непосредственного соединения между артерией и веной. Функциональная АВФ на запястье является наиболее долговечной, наиболее желательной формой гемодиализного доступа, со средним раскрытым состоянием приблизительно 3 года. Вену, отводящую от соединения, называют «выходной» веной. Расширение выходной вены является критичным компонентом для «созревания» и использования АВФ. Распространено предположение, что быстрый поток крови в выходной вене, создаваемый посредством АВФ, и НСС, которое он прикладывают к эндотелию вены, является основным фактором, управляющим расширением вены. К сожалению, приблизительно 80% пациентов не подходят для размещения АВФ на запястье, обычно вследствие недостаточного диаметра вены. У подходящих пациентов, где пытаются разместить АВФ, участок нельзя использовать без дополнительного вмешательства приблизительно в 50-60% случаев, проблема известна как «невозможность созревания». Малый диаметр сосуда, в частности малый диаметр вены, идентифицирован в качестве важного фактора невозможности созревания АВФ. Быстрое образование агрессивного рубцевания стенок вен, известное как «гиперплазия интимы», также идентифицировано в качестве важного фактора невозможности созревания АВФ. В целом, полагают, что турбулентность, создаваемая быстрым потоком крови, выходящим из артерии в вену, является основным фактором, вызывающим рубцевание стенки этой вены. Некоторые исследователи также постулируют, что циклическое растягивание вены, обусловленное вхождением пульсирующей артериальной крови, также может играть роль в стимуляции гиперплазии интимы и обструкции выходной вены в АВФ. По существу, имеет место идея о том, что быстрый поток является проблематичным, и предприняты попытки, чтобы снизить поток в участках гемодиализного доступа посредством ограничения диаметра просвета посредством бандажирования для того, чтобы минимизировать степень отказа. В настоящее время не существует способа, который сохраняет положительные эффекты опосредованного потоком расширения, при этом устраняя отрицательные эффекты рубцевания и обструкции стенки вены. Не удивительно, что пациенты со вновь диагностированной ТСПН и нуждающиеся в гемодиализе имеют только 50% шанс иметь функциональную АВФ в течение 6 месяцев после начала гемодиализа. Тем пациентам, которые не имеют функциональную АВФ, приходится проходить диализ с использованием более дорогих форм сосудистого доступа и иметь более высокий риск осложнений, заболеваний и смерти.
Второй тип сосудистого доступа для гемодиализа известен как артериовенозный трансплантат (АВТ). АВТ конструируют посредством размещения сегмента синтетической трубки между артерией и веной, обычно в руке или ноге. Часть синтетической трубки помещают непосредственно под кожу и используют для игольного доступа. Для АВТ подходит больше пациентов, поскольку вены, которые не видно на поверхности кожи, можно использовать для выходного потока, а степень раннего отказа значительно ниже, чем для АВФ. К сожалению, среднее первичное раскрытое состояние АВТ составляет только приблизительно 4-6 месяцев, в основном, по причине быстрого развития агрессивной гиперплазии интимы и рубцевания в стенке вены рядом с соединением с синтетической трубкой, которые ведут к стенозу и тромбозу. Подобно ситуации с отказом АВФ, полагают, что быстрый и турбулентный поток крови, создаваемый посредством АВТ, управляет гиперплазией интимы и рубцеванием в стенке выходной вены, которые часто ведут к обструкции АВТ. Некоторые исследователи также постулируют, что циклическое растягивание вены, обусловленное вхождением пульсирующей артериальной крови, также может играть роль в формировании гиперплазии интимы и обструкции выходной вены в АВТ. Несмотря на то, что АВТ менее желательны, чем АВФ, приблизительно 25% пациентов проходят диализ с использованием АВТ, в основном потому, что они не подходят для получения АВФ.
Пациенты, не способные получать гемодиализ через АВФ или АВТ, должны иметь большой катетер, вставленный в шею, грудную клетку или ногу для того, чтобы получать гемодиализ. Часто происходит инфицирование этих катетеров, подвергающее пациента высокому риску сепсиса и смерти. Пациентам с катетерным сепсисом обычно требуется госпитализация, удаление катетера, установка временного катетера, лечение антибиотиками внутривенно и затем размещение нового катетера или другого типа участка доступа, когда инфекция устранена. Катетеры также подвержены обструкции тромбами и отложениями фибрина вокруг кончика. Гемодиализные катетеры имеют среднее раскрытое состояние приблизительно 6 месяцев и, как правило, представляют собой наименее желательную форму гемодиализного доступа. Несмотря на то, что катетеры являются менее желательными, чем АВФ и АВТ, приблизительно 20% пациентов проходят диализ с использованием катетера, в основном, потому, что они еще не способны получать функциональную АВФ или АВТ, или не подходят для получения АВФ или АВТ.
В последнее время проблеме отказа участка гемодиализного доступа уделяют больше внимания, поскольку в мире возросло число пациентов с ТСПН, подвергающихся регулярному гемодиализу. В 2004 году Centers for Medicare & Medicaid Services (CMS) объявило инициативу «Fistula First» для увеличения использования АВФ в предоставлении гемодиализного доступа для пациентов с терминальной стадией почечной недостаточности. Эта основная инициатива является ответом на опубликованные данные Medicare, которые показывают, что те пациенты, которые проходят диализ с использованием АВФ, имеют сниженную болезненность и смертность по сравнению с пациентами с АВТ или катетером. Затраты, связанные с пациентами с АВФ, по существу, ниже, чем затраты, связанные с пациентами с АВТ в первый год диализа и в последующие годы. Экономия затрат на диализ с использованием АВФ еще выше, если сравнивать с диализом с использованием катетера.
Чтобы подходить для АВФ или АВТ, пациент должен иметь периферическую вену с диаметром просвета по меньшей мере 2,5 мм или 4 мм, соответственно. Однако, в настоящее время не существует способа постоянного увеличения наружного диаметра и диаметра просвета периферических вен у пациентов с ТСПН, которые не подходят для АВФ или АВТ вследствие неподходящего размера вены. Следовательно, пациентам с венами, которые слишком малы для того, чтобы попробовать АВФ или АВТ, приходится использовать менее желательные формы сосудистого доступа, такие как катетеры. Аналогичным образом, в настоящее время не существует способа лечения невозможности созревания АВФ, которая непропорционально выпадает на долю пациентов с малым диаметром вен. Таким образом, нужны системы и способы увеличения наружного диаметра и диаметра просвета вены перед созданием АВФ или АВТ. Важность этой потребности подчеркнута недавним исследованием, которое демонстрирует, что пациенты с ТСПН, которым приходится использовать менее желательные формы сосудистого доступа, такие как катетеры, имеют, по существу, более высокий риск заболевания или смерти по сравнению с пациентами, которые способны использовать АВФ или АВТ для гемодиализа.
Также существует потребность постоянно увеличивать диаметр вены для других пациентов, таких как пациенты с атеросклеротическим закупориванием периферических артерий, которые нуждаются в трансплантации периферического шунта. Пациенты с заболеванием периферических артерий (ЗПА), которые имеют обструкцию потока крови в артериях ног, часто страдают от хромоты, образования язв на коже и ишемии тканей, и многим из этих пациентов в конечном итоге требуется ампутация частей пораженной конечности. У некоторых из этих пациентов обструкцию можно облегчить до адекватной степени посредством баллонной ангиопластики или имплантации сосудистого стента. Однако у многих пациентов обструкция является слишком тяжелой для этих типов минимальной инвазивной терапии. Следовательно, хирурги обычно будут создавать трансплантат шунта, который отводит кровь вокруг обструктивных артерий и восстанавливает достаточный поток крови в пораженную конечность. Однако многие пациенты, нуждающиеся в трансплантате периферического шунта, не могут использовать своих собственные вены в качестве шунтирующих трубок вследствие недостаточного диаметра вены, и им приходится использовать синтетические трубки, выполненные из таких материалов, как политетрафторэтилен (ПТФЭ, например, Gore-Tex) или полиэтилентерефталат (ПЭТ, например, Dacron). Исследования показали, что использование собственных вен пациента в качестве шунтирующих трубок ведет к улучшенному длительному раскрытому состоянию, чем использование синтетических шунтирующих трубок, выполненных из таких материалов, как ПТФЭ или Dacron. Использование синтетической шунтирующей трубки повышает риск стеноза в артерии на дистальном конце трансплантата и тромбоза всей трубки, что ведет к отказу трансплантата шутна и возвращению или ухудшению симптомов. Таким образом, необходимы системы и способы увеличения наружного диаметра и диаметра просвета вен перед созданием трансплантата шунта, в частности, для пациентов, которые не подходят для использования своих собственных вен для создания трансплантата шунта вследствие неподходящего диаметра вены.
Ввиду указанного выше, специалистам в данной области будет очевидно из этого раскрытия, что существует потребность в системе и способе постоянного увеличения диаметра просвета и наружного диаметра периферических вен с тем, чтобы эти вены можно было использовать для создания участков гемодиализного доступа и трансплантатов шунтов. Изобретение, описанное в настоящем документе, направлено на эту потребность в данной области, а также на другие потребности, которые будут очевидны специалистам в данной области из этого раскрытия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам использования кровяного насоса для увеличения наружного диаметра и диаметра просвета периферических вен. Описаны системы и способы, где напряжение сдвига стенки (НСС), прикладываемое к эндотелию периферической вены, увеличивают посредством размещения кровяного насоса выше по потоку относительно периферической вены в течение периода времени, достаточного для того, чтобы привести к расширению периферической вены. Насос направляет кровь в периферическую вену предпочтительно таким образом, при котором кровь имеет пониженное давление по сравнению с пульсовым давлением крови в периферической артерии.
Исследования показали, что гемодинамические силы и изменения в гемодинамических силах в венах играют жизненно важную роль в определении наружного диаметра и диаметра просвета этих вен. Например, постоянные увеличения скорости крови и НСС могут вести к расширению вены, причем количество расширения зависит как от уровня увеличенной скорости крови и НСС, так и времени, в течение которого скорость крови и НСС повышены. Повышенную скорость крови и НСС воспринимают клетки эндотелия, которые запускают сигнальные механизмы, которые ведут к стимуляции сосудистых гладкомышечных клеток, привлечению моноцитов и макрофагов и синтезу и высвобождению протеаз, способных разрушать компоненты внеклеточного матрикса, такие как коллаген и эластин. По существу, настоящее изобретение относится к увеличению скорости крови и НСС в течение периода времени, достаточного, чтобы привести к ремоделированию и расширению вены, предпочтительно в течение периода времени более чем семь суток. Настоящее изобретение также относится к способам периодической корректировки параметров насоса, чтобы оптимизировать ремоделирование и расширение вены.
Показано, что напряжение сдвига стенки является ключевым фактором для расширения кровеносного сосуда в ответ на увеличенный поток крови. Если предположить в сосуде поток крови по Хагену-Пуазейлю (т.е. ламинарное течение с полностью развернутым параболическим профилем скоростей), то НСС задается уравнением
НСС(τ)=4Qμ/πR3,
где Q = объемная скорость потока, мл/с
μ = вязкость крови в единицах, П
R = радиус сосуда, см
τ = напряжение сдвига стенки, дина/см2
Системы и способы, описанные в настоящем документе, увеличивают уровень НСС в периферической вене. Нормальное НСС для вен находится в диапазоне между 0,076 Па и 0,76 Па. Системы и способы, описанные в настоящем документе, увеличивают уровень НСС до диапазона между 0,76 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 7,5 Па. Предпочтительно, НСС увеличивают в течение от 7 суток до 84 суток или предпочтительно от 7 до 42 суток, чтобы вызвать постоянное расширение в периферической принимающей вене так, что вены, которые были изначально непригодны для применения в качестве участка гемодиализного доступа или трансплантата шунта вследствие малого диаметра вены, становятся пригодными. Также это можно выполнять посредством периодического увеличения НСС во время периода лечения, находящегося между периодами нормального НСС.
Системы и способы, описанные в настоящем документе, также увеличивают скорость крови в периферических венах и в определенных случаях в периферических артериях. В покое средняя скорость крови в цефалической вене у человека, как правило, составляет 5-9 см/с, тогда как скорость крови в плечевой артерии, как правило, составляет 10-15 см/с. Для систем и способов, описанных в настоящем документе, среднюю скорость крови в периферической вене увеличивают до диапазона 15-100 см/с, предпочтительно до диапазона между 25 см/с и 100 см/с, в зависимости от диаметра периферической принимающей вены и длительности времени, в течение которого планируют прокачивание крови в периферическую принимающую вену. Предпочтительно, среднюю скорость крови увеличивают в течение от 7 суток до 84 суток, или предпочтительно от 7 до 42 суток, чтобы вызвать постоянное расширение в периферической принимающей вене так, что вены, которые изначально не подходили для применения в качестве участка гемодиализного доступа или трансплантата шунта вследствие малого диаметра вены, становятся пригодными. Также это можно выполнять посредством периодического повышения средней скорости крови во время периода лечения, находящегося между периодами нормальной средней скорости крови.
В настоящем документе изложен способ увеличения диаметра просвета и наружного диаметра периферической вены у пациента. Способ включает осуществление первой процедуры для получения доступа к артерии или вене (донорный сосуд) и периферической вене (принимающая вена) и соединение донорного сосуда с принимающей веной с использованием насосной системы. Затем насосную систему приводят в действие, чтобы искусственным образом направлять кровь из донорного сосуда в принимающую вену. Способ также включает мониторинг процесса перекачивания крови в течение определенного периода времени. Способ дополнительно включает корректировку скорости насоса, скорости перекачиваемой крови или НСС на эндотелии принимающей вены и снова мониторинг процесса перекачивания. По истечении определенного периода времени, чтобы сделать возможным расширение вены, диаметр принимающей вены измеряют для того, чтобы определить, достигнуто ли достаточное постоянное увеличение наружного диаметра и диаметра просвета принимающей вены, и, по мере необходимости, снова корректируют процесс перекачивания. Когда достигают достаточного количества постоянного увеличения наружного диаметра и диаметра просвета принимающей вены, осуществляют второе хирургическое вмешательство, чтобы удалить насос. Участок гемодиализного доступа (такой как АВФ или АВТ) или трансплантат шунта можно создавать в этот момент, или в более поздний момент, используя по меньшей мере часть постоянно увеличенной принимающей вены.
В одном из вариантов осуществления хирургическую процедуру осуществляют для того, чтобы обнажить сегменты двух вен. Один конец первой синтетической трубки соединяют «по текучей среде» (т.е. стыкуют просвет к просвету, чтобы сделать возможной между ними сообщение по текучей среде) с веной, из которой удаляют кровь (донорная вена). Другой конец первой синтетической трубки соединяют по текучей среде с входным портом насоса. Один конец второй синтетической трубки соединяют по текучей среде с веной, в которую следует направлять кровь (принимающая вена). Другой конец второй синтетической трубки соединяют по текучей среде с выходным портом того же насоса. Деоксигенированную кровь перекачивают из донорной вены в принимающую вену, пока вена постоянно расширена до желаемого наружного диаметра и диаметра просвета. Термин «постоянно расширена» используют в настоящем документе для обозначения того, что даже если насос выключают, увеличение наружного диаметра или диаметра просвета сосуда все еще может быть продемонстрировано по сравнению с диаметром вены до периода перекачивания крови. То есть сосуд стал более независимым от давления, создаваемого посредством насоса. После возникновения желаемого количества постоянного увеличения вены осуществляют вторую хирургическую процедуру, чтобы удалить насос и синтетические трубки. Участок гемодиализного доступа (такой как АВФ или АВТ) или трансплантат шунта можно создавать в этот момент или в более поздний момент, используя по меньшей мере часть постоянно увеличенной принимающей вены. В этом варианте осуществления, порт насоса может быть соединен по текучей среде непосредственно с донорной веной или принимающей веной без использования вставляемой синтетической трубки. В вариации этого варианта осуществления принимающая вена может быть расположена в одном местоположении в организме, например цефалическая вена в руке, а донорная вена может быть в другом местоположении, например бедренная вена в ноге. В этом случае два конца узла насос-трубка должны быть расположены в организме, а шунтирующая часть узла насос-трубка может быть экстракорпоральной (за пределами организма, например носимой под одеждой) или интракорпоральной (внутри организма, например проложенной под кожей). Кроме того, в определенных случаях донорный сосуд может быть более периферическим по относительному местоположению в организме, чем принимающая вена.
В другом варианте осуществления способ включает хирургическую процедуру, которую осуществляют для того, чтобы обнажить сегмент периферической артерии и сегмент периферической вены. Один конец первой синтетической трубки соединяют по текучей среде с периферической артерией. Другой конец первой синтетической трубки соединяют по текучей среде со входным портом насоса. Один конец второй синтетической трубки соединяют по текучей среде с периферической веной. Другой конец второй синтетической трубки соединяют по текучей среде с выходным портом того же насоса. Перекачивание оксигенированной крови из периферической артерии в периферическую вену осуществляют до тех пор, пока вена не будет постоянно расширена до желаемого наружного диаметра и диаметра просвета. Когда происходит желаемое количество увеличения вены, вторую хирургическую процедуру осуществляют для удаления насоса и синтетических трубок. Участок гемодиализного доступа (такой как АВФ или АВТ) или трансплантат шунта можно создавать в этот момент, или в более поздний момент, используя по меньшей мере часть постоянно увеличенной принимающей вены. Предусмотрена вариация этого варианта осуществления, где порт насоса может быть соединен по текучей среде непосредственно с артерией или веной без использования вставляемой синтетической трубки.
В еще одном другом варианте осуществления, пару специализированных катетеров вставляют в венозную систему. Первый конец одного катетера прикрепляют к входному порту насоса (далее «входной катетер»), тогда как первый конец другого катетера прикрепляют к выходному порту насоса (далее «выходной катетер»). Необязательно, два катетера могут быть соединены вместе, например, с использованием двухпросветного катетера. Катетеры конфигурируют для того, чтобы вставлять в просвет венозной системы. После вставления кончик второго конца входного катетера размещают в любом месте в венозной системе, где достаточное количество крови может быть забрано во входной катетер (например, правое предсердие, верхняя полая вена, подключичная вена, или брахицефалическая вена). После вставления кончик второго конца выходного катетера размещают в сегменте периферической вены (принимающей вены) в венозной системе, куда можно доставлять кровь посредством выходного катетера (например, цефалическая вена). Затем насос засасывает деоксигенированную кровь в просвет входного катетера из донорной вены и выбрасывает кровь из выходного катетера и в просвет принимающей вены. В этом варианте осуществления насос и часть входного катетера и выходные катетеры остаются вне пациента. Насос работает до тех пор, пока в принимающей вене не возникнет желаемое количество постоянного увеличения наружного диаметра и диаметра просвета, после чего насос и катетеры удаляют. Участок гемодиализного доступа (такой как АВФ или АВТ) или трансплантат шунта можно создавать в этот момент, или в более поздний момент, используя по меньшей мере часть постоянно увеличенной принимающей вены.
Предусмотрена система для увеличения скорости крови и НСС в вене посредством доставки деоксигенированной крови из донорной вены в принимающую вену у пациента, которая содержит две синтетические трубки, каждая с двумя концами, кровяной насос, блок управления и источник питания. Эта система также может содержать один или несколько блоков датчиков. В одном из вариантов осуществления системы синтетические трубки и насос, совместно известные как «узел насос-трубка», выполнены с возможностью засасывать деоксигенированную кровь из донорной вены или правого предсердия и закачивать эту кровь в принимающую вену. Узел насос-трубка выполнен с возможностью перекачивать деоксигенированную кровь. В другом варианте осуществления системы, узел насос-трубка выполнена с возможностью засасывать оксигенированную кровь из периферической артерии и закачивать кровь в периферическую вену. Кровь перекачивают таким образом, который увеличивает скорость крови в артерии и вене и увеличивает НСС, прикладываемое к эндотелию артерии и вены в течение периода времени, достаточного для того, чтобы вызвать постоянное увеличение в наружнем диаметре и диаметре просвета периферической артерии и вены. Предпочтительно, кровь, перекачиваемая в периферическую вену, имеет низкую пульсацию, например более низкую пульсацию, чем кровь в периферической артерии. Предусмотрена вариация этого варианта осуществления, в соответствии с которой насос соединяют по текучей среде непосредственно с артерией или веной (или с обеими) без использования вставляемой синтетической трубки. Насос содержит впускное и выпускное отверстия, и насос выполнен с возможностью доставлять деоксигенированную или оксигенированную кровь в периферическую вену таким образом, который увеличивает скорость крови в вене и НСС, прикладываемое к эндотелию в вене, для того чтобы вызвать постоянное увеличение наружного диаметра и диаметра просвета периферической вены. Кровяной насос может быть имплантирован пациенту, может оставаться вне пациента или может иметь имплантированные и внешние части. Все или некоторые синтетические трубки могут быть имплантированы пациенту, могут быть имплантированы подкожно или могут быть имплантированы внутри просвета венозной системы, или любое их сочетание. Можно периодически осуществлять мониторинг и корректировку имплантированных частей узла насос-трубка, например, каждые семь суток.
Изобретение содержит также предусмотренные способы увеличения скорости крови в периферической вене и увеличения НСС, которое прикладывают к эндотелию периферической вены пациента-человека, нуждающегося в участке гемодиализного доступа или трансплантате шунта. С этой целью также можно использовать устройство, разработанное для усиления артериального потока крови для лечения сердечной недостаточности. В частности, вспомогательное желудочковое устройство (ВЖУ), которое оптимизировано для слабого потока крови, будет способно перекачивать кровь из донорного сосуда в периферическую вену, чтобы вызвать постоянное увеличение наружного диаметра и диаметра просвета периферической вены. В различных вариантах осуществления можно использовать педиатрическое ВЖУ, или миниатюрное ВЖУ, разработанное для лечения умеренной сердечной недостаточности у взрослых (такое, как насос Synergy компании Circulite). Также можно использовать другие устройства, включая ЛВЖУ или ПВЖУ, которые оптимизированы для слабого потока крови.
Способ включает соединение по текучей среде слаботочного ВЖУ, его производного или устройства схожего типа с донорным сосудом, засасывание крови из донорного сосуда и закачивание ее в периферическую принимающую вену в течение достаточного количества времени, чтобы вызвать желаемое количество постоянного увеличения наружного диаметра и диаметра просвета периферической вены. Кровяной насос может быть имплантирован пациенту или он может оставаться вне пациента. Когда насос находится вне пациента, он может быть прикреплен к пациенту для непрерывного перекачивания. Альтернативно, насос можно выполнить с возможностью открепления от донорного и принимающего сосудов пациента для периодических и/или прерывистых сеансов перекачивания.
Можно осуществлять мониторинг диаметра просвета периферических принимающих вен, при этом перекачивая кровь в вену, используя стандартные способы, такие как визуализация с использованием ультразвука или диагностическая ангиография. Узел насос-трубка или узел насос-катетер может содержать признаки, которые облегчают диагностическую ангиографию, например рентгеноконтрастные маркеры, которая идентифицирует участки, к которым можно получить доступ с использованием иглы для инъекции контраста в узел, который впоследствии будет течь в принимающую периферическую вену и делать ее видимой во время флуороскопии с использованием как стандартной, так и цифровой субстракционной ангиографии.
Когда часть узла насос-трубка или узла насос-катетер* размещают вне организма, тогда противомикробное покрытие или манжета может быть прикреплена к части устройства, которая соединяет имплантированный и внешний компоненты. Например, когда контроллер и/или источник питания, прикрепленный к ремню, прикрепляют ремнем к запястью или носят в сумке или пакете, тогда противомикробное покрытие помещают на или вокруг соединения и/или входной точки, в которой устройство входит в организм пациента.
Эти и другие цели, признаки, аспекты и преимущества настоящего изобретения станут яснее специалистам в данной области из следующего подробного описания, которое, взятое в сочетании с прилагаемыми чертежами, раскрывает предпочтительные варианты осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИИЕ ЧЕРТЕЖЕЙ
Далее, со ссылкой на приложенные чертежи, которые образуют часть этого оригинального раскрытия:
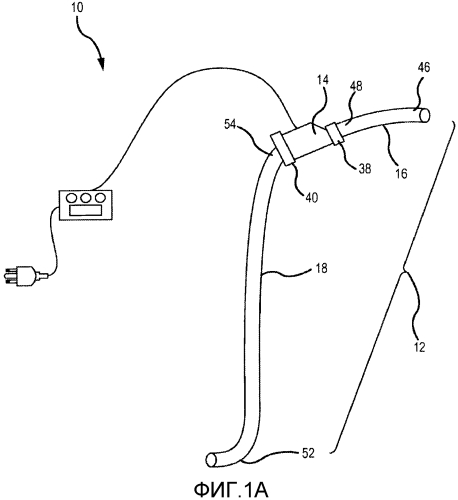
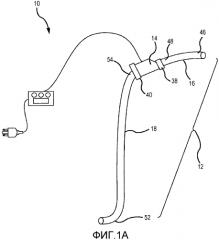
на фиг. 1A представлен схематический вид узла насос-трубка системы и способа в соответствии с первым вариантом осуществления настоящего изобретения;
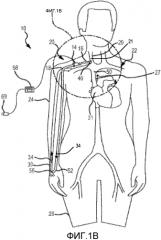
на фиг. 1B представлен схематический вид узла насос-трубка с фиг. 1A, как применяют к кровеносной системе пациента в соответствии с первым вариантом осуществления настоящего изобретения;
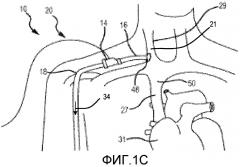
на фиг. 1С представлен увеличенный вид части фиг. 1B;
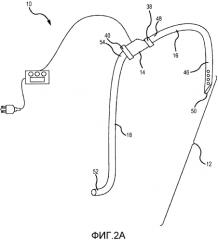
на фиг. 2A представлен схематический вид узла насос-трубка системы и способа в соответствии с вторым вариантом осуществления настоящего изобретения;
на фиг. 2B представлен схематический вид узла насос-трубка с фиг. 2A, как применяют к кровеносной системе пациента в соответствии с вторым вариантом осуществления настоящего изобретения;
на фиг. 2C представлен увеличенный вид части фиг. 2B;
на фиг. 3 представлен схематический вид узла насос-трубка системы и способа, как применяют к кровеносной системе пациента в соответствии с третьим вариантом осуществления настоящего изобретения;
на фиг. 4A представлен схематический вид узла насос-катетер системы и способа в соответствии с четвертым вариантом осуществления настоящего изобретения;
на фиг. 4B представлен схематический вид узла насос-катетер с фиг. 4A, как применяют к кровеносной системе пациента в соответствии с четвертым вариантом осуществления настоящего изобретения;
на фиг. 5A представлен схематический вид узла насос-трубка системы и способа в соответствии с пятым вариантом осуществления настоящего изобретения;
на фиг. 5B представлен схематический вид узла насос-трубка с фиг. 5A, как применяют к кровеносной системе пациента в соответствии с пятым вариантом осуществления настоящего изобретения;
на фиг. 6 представлено схематическое изображение насоса, работающего в сочетании с блоком управления, для использования в любом из указанных выше вариантов осуществления;
на фиг. 7 представлена блок-схема способа в соответствии с первым и третьим вариантам осуществления настоящего изобретения;
на фиг. 8 представлена блок-схема способа в соответствии со вторым и четвертым вариантами осуществления настоящего изобретения; и
на фиг. 9 представлена блок-схема способа в соответствии с пятым вариантом осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее предпочтительные варианты осуществления настоящего изобретения объяснены со ссылкой на чертежи. Из этого раскрытия специалистам в данной области будет очевидно, что следующее описание вариантов осуществления настоящего изобретения предоставлено только для иллюстрации и не для ограничения изобретения, как определено посредством приложенной формулы изобретения и ее эквивалентов. Сначала, со ссылкой на фиг. 1-4, проиллюстрирована система 10 для увеличения наружного диаметра вен, как используют для пациента 20. Система 10 удаляет деоксигенированную венозную кровь из венозной системы пациента 22 и перенаправляет эту кровь в принимающую периферическую вену 30. Система 10 также увеличивает скорость крови в принимающей периферической вене 30 и увеличивает НСС, прикладываемое к эндотелию принимающей периферической вены 30, для увеличения диаметра принимающей периферической вены 30, которая расположена, например, в руке 24 или ноге 26. Диаметр кровеносных сосудов, таких как периферические вены, можно определять посредством измерения диаметра просвета, который представляет собой открытое пространство в центре кровеносного сосуда, где течет кровь. Для целей этой заявки это измерение обозначают как «диаметр просвета». Диаметр кровеносных сосудов можно определять посредством измерения диаметра таким образом, который включает стенку кровеносного сосуда. Для целей этой заявки это измерение обозначают как «наружный диаметр». Изобретение относится к одновременному и постоянному увеличению наружного диаметра и диаметра просвета периферической вены посредством направления крови (предпочтительно со слабой пульсацией) в периферическую вену, тем самым увеличивая скорость крови в периферической вене и увеличивая НСС на эндотелии периферической вены. Описаны системы и способы, где скорость крови в периферической вене и НСС на эндотелии периферической вены увеличивают посредством использования насоса. Предпочтительно, насос направляет кровь в периферическую вену, где перекачиваемая кровь имеет сниженную пульсацию, например, когда пульсовое давление ниже, чем у крови в периферической артерии.
Описанные в настоящем документе системы и способы увеличивают уровень НСС в периферической вене. Нормальное НСС для вен варьирует между 0,076 Па и 0,76 Па. Описанные в настоящем документе системы и способы выполнены с возможностью увеличения уровня НСС в принимающей периферической вене до диапазона приблизительно от 0,76 Па до 23 Па, предпочтительно до диапазона от 2,5 Па до 7,5 Па. Поддерживаемое НСС менее чем 0,76 Па может расширять вены, но при скорости, которая сравнительно мала. Поддерживаемое НСС более чем 23 Па вероятно вызовет денудацию (утрату) эндотелия вены, который, как известно, задерживает расширение кровеносных сосудов в ответ на увеличение скорости крови и НСС. Перекачивание крови таким образом, который увеличивает НСС до желаемого диапазона в течение предпочтительно по меньшей мере 7 суток, и более предпочтительно между приблизительно 14 и 84 сутками, например, дает такое количество постоянного расширения в принимающей периферической вене, что вены, которые изначально были непригодны для применения в качестве участка гемодиализного доступа или трансплантата шунта вследствие малого диаметра вены, становятся пригодными. Можно периодически осуществлять мониторинг и коррекцию процесса перекачивания крови. Например, насос можно корректировать каждые семь суток, чтобы учитывать изменения в периферической вене до достижения желаемого постоянного расширения.
Описанные в настоящем документе системы и способы также увеличивают скорость крови в периферических венах и в определенных случаях, в периферических артериях. В покое средняя скорость крови в цефалической вене у людей, как правило, составляет 5-9 см/с, тогда как скорость крови в плечевой артерии, как правило, составляет 10-15 см/с. Для описанных в настоящем документе систем и способов среднюю скорость крови в периферической вене увеличивают до диапазона 15-100 см/с, предпочтительно до диапазона от 25 см/с до 100 см/с, в зависимости от диаметра периферической принимающей вены и запланированной длительности времени перекачивания крови в периферическую принимающую вену. Предпочтительно, среднюю скорость крови увеличивают в течение между 7 сутками и 84 сутками, или предпочтительно между 7 и 42 сутками, чтобы вызвать такое постоянное расширение периферической принимающей вены, что вены, которые изначально были не пригодны для применения в качестве участка гемодиализного доступа или трансплантата шунта вследствие малого диаметра вены, становятся пригодными. Также это можно выполнять посредс