Комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом, обладающее фунгицидными свойствами
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом получают путем механохимического взаимодействия в устройствах ударно-истирающего действия. В качестве полисахарида используют арабиногалактан, или крахмал, или хитозан, или пектин. Мольное соотношение метилового эфира кислоты и полисахарида составляет 1:(1-8). Соединение является действующим веществом фунгицидного средства, представленного в форме концентрата суспензии или в форме смачивающегося порошка. Соединение может быть получено предварительно или в процессе приготовления фунгицидного средства. Обеспечивается снижение норм расхода действующего вещества. 5 з.п. ф-лы, 5 ил., 7 табл.
Реферат
Изобретение относится к созданию новых комплексных соединений, обладающих фунгицидными свойствами, и фунгицидных средств на их основе, а также к сельскому хозяйству с целью применения созданных соединений для протравливания семян и защиты посевов полезных культур от фитопатогенных грибов.
Метиловый эфир 2-бензимидазолилкарбаминовой кислоты (далее - карбендазим, БМК) - простейшее производное бензимидазола, нашедший широкое практическое применение в качестве системного фунгицида в сельском хозяйстве. ЛД50 для крыс 6400, для кроликов 8000, для собак 8000 мг/кг. Препарат используется в концентрации 0,03-0,06% по действующему веществу. В применяемых концентрациях БМК не фитоциден для большинства растений [Мельников Н.Н. Химия и технология пестицидов. М.: Химия, 1974, С. 635].
Карбендазим - один из первых фунгицидов системного действия, который применяют и в настоящее время. Он эффективен в отношении ряда заболеваний растений и, в первую очередь, в отношении мучнистой росы.
Недостатком этого препарата является сравнительно быстрое приобретение устойчивости к нему ряда фитопатогенных грибов. Кроме того, несмотря на низкую острую токсичность в больших дозах он может вызвать тератогенный эффект [Мельников Н.Н. Пестициды. Химия, технология и применение. М.: Химия, 1987, С. 565].
Разрешен к применению на территории Российской Федерации в виде концентрата суспензии 200 г/л, 500 г/л на пшенице, ячмене, озимой ржи, сахарной свекле от корневой и прикорневой гнили, церкоспореллеза, снежной плесени, мучнистой росы, каменной и пыльной головни, бурой ржавчины, на яблонях от парши и мучнистой росы, на картофеле от фузариозной гнили и ризоктониоза (Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. Приложение к журналу «Защита и карантин растений», №4, 2012, С. 162-164).
Крахмал - главный резервный полисахарид растений; накапливается в виде зерен в клетках семян, луковиц, клубней, а также в листьях и стеблях. Бесцветное аморфное вещество, не растворим в холодной воде, диэтиловом эфире, этаноле, в горячей воде образует клейстер; [a]D от +180 до +210°. В зернах крахмала содержатся 98-99,5% полисахаридов и 0,5-2% неуглеводных компонентов (в т.ч. липиды, белки, зольные элементы). Крахмал представляет собой смесь линейного (амилозы) и разветвленного (амилопектина) полисахаридов. Амилоза построена главным образом из остатков a-D-глюкопиранозы с 1:4-связями. В зависимости от вида растения молекулярная масса амилозы колеблется от 150 тыс. (рисовый, кукурузный крахмал) до 500 тыс. (картофельный крахмал). Молекулы амилопектина сильно разветвлены и состоят из фрагментов амилозы (около 20 моносахаридных остатков), связанных между собой а-1:6-связями. Молекулярная масса 106-109. В структуре амилопектина различают центральную цепь с количеством звеньев более 60, несущую остаток глюкозы со свободной восстанавливающей группой, короткие цепи из 15-20 остатков (S-цепи), расположенные на периферии молекулы и внутри нее, и длинные (около 45 звеньев) L-цепи. По строению амилопектин близок к гликогену. В воде амилопектин так же, как амилоза, образует мицеллярные растворы. Соотношение амилозы и амилопектина в крахмале зависит от вида растения и стадии его развития. В среднем крахмал содержит 15-25% амилозы и 75-86% амилопектина; в результате селекции выделены сорта растений, крахмал которых обогащен одним из полисахаридов (Химическая энциклопедия. Т. 2, М.: Сов. энц., 1990, С. 498-499).
Молекула арабиногалактана, получаемого главным образом из древесины лиственницы, имеет высокоразветвленное строение; главная цепь ее состоит из звеньев галактозы и арабинозы, а также уроновых кислот, в основном глюкуроновой. Соотношение звеньев галактозы и арабинозы примерно 6:1. Химическая формула [(C5H8O4)(C6H10O5)6]n, где n=200-300. Состав макромолекул арабиногалактана варьируется также в зависимости от условий выделения из древесины и молекулярной массы [Е.Н. Медведева, В.А. Бабкин, Л.А. Остроухова. Арабиногалактан лиственницы - свойства и перспективы использования (обзор) // Химия растительного сырья. 2003. №1. С. 27-37].
Пектины (пектиновые вещества) (от греч. pektos - свернувшийся, сгущенный, замерзший), растительные полисахариды, в основе молекул которых лежит главная цепь из 1→4-связанных остатков a-D-галактуроновой кислоты, содержащая некоторое (иногда значительное) количество остатков 2-О-замещенной L-рамнопиранозы. Карбоксильные группы остатков галактуроновой кислоты часто существуют в виде метиловых эфиров (встречаются как низкометилированные, так и высокометилированные пектины со степенью этерификации св. 50%), а гидроксилы при С-2 и С-3 могут быть ацетилированы. Остатки L-рамнозы обычно образуют единичные включения в главную цепь, но изредка бывают соединены друг с другом; для ряда пектинов с высоким содержанием рамнозы доказано строгое чередование остатков a-D-галактуроновой кислоты и a-L-рамиопиранозы в главной цепи. В положении 4 остатков рамнозы, а иногда и в других положениях главной цепи могут присоединяться более или менее сложные боковые цепи, построенные из остатков D-галактозы, L-арабинозы, реже D-ксилозы, D-глюкуроновой кислоты, L-фукозы, D-апиозы и других моносахаридов; содержание этих дополнительных моносахаридов колеблется в широких пределах (от 0 до 50%). Небольшая часть гидроксильных групп молекул некоторых пектинов может быть этерифицирована феруловой кислотой (4-НО)(S-CH3O)С6Н3СН=СНСООН (Химическая энциклопедия. Т. 3, М.: Сов. энц., 1992, С. 452-453).
Особую группу среди линейных полисахаридов занимает хитозан, он является аминосахаридом, полимерная цепь которого построена из случайно связанных β-(1-4) D-глюкозаминовых звеньев и небольшого количества N-ацетил-Р-глюкозаминовых звеньев (~15%).
Хитозан растворим в кислотах с образованием солей, дающих высоковязкие растворы. Хитозан дает прочные соединения с белками, анионными полисахаридами, образует хелатные комплексы с металлами и т.д., на чем основано его применение для удаления белка из сточных вод в производстве пищевых продуктов (мясная, рыбная, молочная промышленность, сыроделие), создания хелатирующих ионообменников, иммобилизации живых клеток в биотехнологии, при изготовлении медицинских препаратов, отделке бумаги и текстильных волокон (Химическая энциклопедия. Яндекс. Словари).
Известны фунгицидное средство и способ его получения (RU 2469536, опубл. 16.06.2011). Фунгицидное средство содержит тебуконазол и водорастоворимые природные или синтетические полимеры из группы: бета-циклодекстрин, арабиногалактан, гидроксиэтилкрахмал, пектин полиэтиленгликоль, поливинилпирролидон, в массовом соотношении 1:(1-5) соответственно. Средство получают путем механохимического взаимодействия указанных компонентов.
Задачей настоящего изобретения является создание комплексных соединений метилового эфира 2-бензимидазолилкарбаминовой кислоты с природными полисахаридами и на их основе эффективных фунгицидных средств, обеспечивающих снижение норм расхода действующего вещества - метилового эфира 2-бензимидазолилкарбаминовой кислоты, снижение фунгицидной нагрузки на окружающую среду.
Решение поставленной задачи достигается за счет создания обладающего фунгицидной активностью комплексного соединения метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом, выбранным из арабиногалактана (далее - АГ), или крахмала, или хитозана, или пектина.
Заявляемое комплексное соединение получают путем механохимического взаимодействия БМК и природного полисахарида. Предпочтительное мольное соотношение БМК и природного полисахарида соответственно 1:(1-8) в расчете на усредненную молекулярную массу одного звена гликозидной цепочки природного полисахарида. В качестве аппаратов для механохимической обработки могут быть использованы шаровые валковые, планетарные, вибрационные, виброцентробежные и т.п. мельницы, т.е устройства ударно-истирающего воздействия.
На основе указанных выше новых комплексных соединений получены также фунгицидные средства в форме концентрата суспензии (текучей суспензионной пасты (т.п.с.), содержащие в качестве действующего вещества (далее - д.в.) комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом и приемлемые вспомогательные компоненты, при следующем соотношении компонентов, % мас.:
| Комплексное соединение метилового эфира 2-бензимидазолил-карбаминовой кислоты с природным полисахаридом | 3-30 |
| Поверхностно-активное вещество | 2-7 |
| Наполнитель | 0,2-5 |
| Пленкообразователь | 1-2 |
| Умягчитель жесткости воды | 0,5-1 |
| Краситель | 0,2-1 |
| Антифриз | 3-12 |
| Дисперсионная среда | остальное |
Все компоненты в композициях выполняют определенную задачу, обеспечивая стабильность препаратов при хранении в течение двух и более лет, а также их рабочих составов (при разбавлении водой) в течение трех часов.
В качестве ПАВ композиции содержат неионогенные ПАВ - неонол АФ 9-12, неонол АФ 9-10, ОП-7, ОП-10, синтанол ДС-10, синтанол АЛМ-10 и др., которые выполняет роль смачивателя, способствуют достижению оптимальных результатов при проведении мокрого помола. Анионоактивные ПАВ - концентрат сульфитно-дрожжевой бражки (КСДБ), концентрат сульфитно-спиртовой барды (КССБ), концентрат барды порошкообразной (КБП), лигносульфонаты, алкилсульфат, АБСК и др. выполняют роль диспергатора, препятствуя агломерации высокодисперсных частиц. Неионогенные и анионоактивные ПАВ используют индивидуально или в смеси. Аэросил А-175, белая сажа, каолин и др. являются наполнителями, а также в сочетании с диспергатором обеспечивают стабилизацию дисперсного состава в процессе хранения и при разбавлении препарата водой в процессе применения. Триполифосфат натрия (ТПФН) в составе препаратов играет роль умягчителя жесткости воды в процессе применения. Введенный в композицию полимер (Лакрис 20А, стиромаль, поливиниловый спирт, ВПКФ-20) выполняет роль пленкообразователя, прочно закрепляющего д.в. на поверхности семян, препятствуя пылению д.в. с поверхности семян после протравливания. В состав препаративной формы вводят краситель (пигмент красный 5С, родамин С, родамин Ж) для придания семенам сигнальной окраски. Для повышения морозостойкости в состав композиции входит антифриз (этиленгликоль, пропиленгликоль), обеспечивающий возможность хранения при низких температурах (до -25°C) с сохранением физико-химических свойств препарата. Этиленгликоль является также дисперсионной средой, также роль дисперсионной среды выполняет вода.
На основе указанных выше новых комплексных соединений получены также фунгицидные средства в форме смачивающегося порошка, содержащие в качестве действующего вещества комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом и приемлемые вспомогательные компоненты, при следующем соотношении компонентов, % мас.:
| Комплексное соединение метилового эфира 2-бензимидазолил-карбаминовой кислоты с природным полисахаридом | 50-70 |
| Поверхностно-активное вещество | 1,0-10 |
| Наполнитель | 20-40 |
| Краситель | 0-1,0 |
С целью установления структуры полученных аддуктов и характера взаимодействия БМК с хитозаном, АГ, крахмалом, пектином записаны ИК спектры исходных компонентов и полученных аддуктов, приведено их сравнение.
ИК-спектр исходного БМК (фиг. 5) характеризуется полосами поглощения основных функциональных групп бензимидазолов и карбаматов. Валентные колебания аминогрупп проявляются одной интенсивной узкой полосой 3319 см-1, характерной для ассоциированных молекул. Полоса 1711 см-1 средней интенсивности обусловлена колебаниями карбонильной группы. Поглощение бензимидазольного кольца и амидной группы проявляется двойной интенсивной полосой 1630, 1595 см-1, высокая интенсивность которой обусловлена сопряжением бензольного и имидазольного колец. Интенсивные полосы 1267, 1286. 1095 см-1 характеризуют валентные колебания групп C-N и С-О-С.
Наличие в структуре молекулы пектина, крахмала и арабиногалактана одинаковых звеньев обуславливает близость их ИК-спектров (фиг. 2-а, 3-а, 4-а). В спектрах всех изученных полисахаридов наблюдается широкая интенсивная полоса 3300-3400 см-1, обусловленная валентными колебаниями гидроксильных групп, связанных водородными связями. В спектрах пектина, арабиногалактана и крахмала наблюдается полоса 1634 см-1 деформационных колебаний Н-О-Н кристаллизационной воды. Присутствие в структуре пектина карбонильных групп от кислотных и эфирных радикалов обуславливает в его спектре присутствие полосы 1732 см-1 валентных колебаний карбонильной группы, которая отсутствует в спектрах АГ и крахмала. Валентные колебания группы С-О-С и С-О-Н проявляются в виде ряда интенсивных полос в области 1000-1200 см-1.
ИК-спектр хитозана характеризуется полосам поглощения указанных функциональных групп (фиг. 1-а). Широкая интенсивная полоса в области 3200-3500 см-1 с максимумами 3300, 3319, 3358 см-1 обусловлена валентными колебаниями гидроксильных групп, связанных водородными связями, а также валентными колебаниями ассоциированных аминогрупп. Присутствие в структуре хитозана амидной группы обуславливает наличие в ИК-спектре хитозана полос средней интенсивности 1647 и 1593 см-1 "амид I" и "амид II", характерных для валентных колебаний аминогруппы. Валентные колебания С-О-С и С-О-Н, а также деформационные колебания C-N проявляются в виде широкой интенсивной полосы в области 1200-900 см-1 с максимумами 1153, 1078, 1036 см-1.
ИК-спектры комплексов БМК с АГ, крахмалом и пектином незначительно отличаются от спектров исходных компонентов, но не являются простой совокупностью полос спектров двух соединений. Небольшое изменение частоты и относительной интенсивности полос поглощения гидроксильных, карбонильных, карбоксильных групп характеризует образование молекулярных комплексов БМК с природными полисахаридами.
В ИК-спектрах комплексов БМК с природными полисахаридами остается неизменной полоса валентных колебаний аминогруппы 3319 см-1. Участие гидроксильных групп полисахаридов в образовании комплексов с БМК проявляется в значительном уменьшении интенсивности полосы валентных колебаний гидроксильных групп в области 3600-3300 см-1 (фиг. 1-5). В спектрах комплексов БМК с крахмалом или пектином (фиг. 3-б, 4-б) интенсивность полосы поглощения vОН уменьшается в несколько раз, в спектрах комплекса БМК - АГ (фиг. 2-б) интенсивность поглощения vОН снижается почти вдвое. Изменение характера поглощения валентных колебаний гидроксильных групп характеризует также разрушение межмолекулярных водородных связей при механической активации смесей и комплексообразовании.
В молекуле БМК возможными центрами образования аддукта (комплекса) с хитозаном являются аминогруппа бензимидазольного кольца, амидная, карбонильная и метоксигруппа.
В ИК-спектрах комплексов БМК: хитозан (фиг. 1-б) сохраняется положение полос, характерных для БМК, но несколько меняется их относительная интенсивность, что зависит от содержания БМК в комплексе, Происходит небольшое смещение (~10 см-1) полосы аминогруппы с 1591 см-1 до 1601 см-1 в спектрах всех комплексов БМК: хитозан, что позволяет предположить взаимодействие БМК-хитозан по азоту имидазольного кольца. Проследить изменение полос поглощения карбонильной и аминогруппы хитозана не представляется возможным, т.к. эти полосы перекрыты более интенсивным поглощением БМК.
Изменение поглощения в области 3200-3500 см-1 в спектрах комплексов БМК: хитозан по сравнению со спектрами хитозана свидетельствует об участии гидроксильных, а возможно и аминогрупп хитозана в образовании аддукта с БМК. При эквимолярном соотношении БМК: хитозан в ИК-спектре комплекса наблюдается полоса поглощения аминогруппы БМК 3321 см-1 на фоне поглощения гидроксильных и аминогрупп хитозана в области 3200-3500 см-1; небольшая интенсивность этого фонового поглощения в композиции свидетельствует не только о содержании хитозана в комплексе (50%), но и об уменьшении поглощения гидроксильных и аминогрупп, принимающих участие во взаимодействии с БМК. Тот же характер ИК-спектра в области 3200-3500 см-1 сохраняется и у комплекса БМК:хитозан = 1:2. При увеличении содержания хитозана в комплесах БМК:хитозан = 1:4; 1:8; 1:20 происходит рост интенсивности полосы поглощения vOH+vNH, что соответствует увеличению хитозана в комплексе.
В спектрах всех комплексов БМК с природными полисахаридами неизменными по частоте и интенсивности остались полосы поглощения валентных колебаний карбонильной группы 1711 см-1 и амидной группы 1633 см-1, характерные для БМК, что позволяет предположить о незначительном вкладе карбаматной группы молекулы БМК в комплексообразование с природными полисахаридами. Однако интенсивность полосы поглощения валентных колебаний карбонильной группы пектина 1732 см-1 в спектре комплекса БМК - пектин значительно снижается, что свидетельствует об ее участии в комплексообразовании. Подтверждением взаимодействия БМК с полисахаридами по азоту имидазольного кольца является небольшое смещение на 6 см-1 с 1595 до 1601 см-1 полосы поглощения имидазольного кольца и уменьшение ее относительной интенсивности в спектрах комплексов БМК с природными полисахаридами. Участие гидроксильных групп природных полисахаридов проявляется в спектрах комплексов в области 1000-1200 см-1 валентных колебаний групп С-О-Н: БМК - крахмал появляется новая полоса 1001 см-1, исчезают полосы 1015 см-1 и 1011 см-1 соответственно. Лучшее разрешение полос в области 1000-1200 см-1 в спектрах комплексов БМК - природный полисахарид по сравнению со спектрами исходных полисахаридов обусловлено как уменьшением степени полимеризации полисахаридов, так и образованием комплексов БМК - природный полисахарид.
Для проведения биологических испытаний были приготовлены и испытаны на проростках пшеницы препаративные формы заявляемых комплексов в виде текучей суспензионной пасты или смачивающегося порошка. При этом комплексные соединения получают либо предварительно, либо они образуются в процессе приготовления препаративных форм.
Были приготовлены препаративные формы в виде концентратов суспензии (текучих суспензионных паст) комплексов БМК с арабиногалактаном, или пектином, или хитозаном, или крахмалом в мольном соотношении 1:(1-8) в расчете на усредненную молекулярную массу одного звена гликозидной цепочки полисахарида. Механохимическая обработка исследуемой смеси проводилась в аппаратах ударно-истирающего действия, например на планетарно-шаровой мельнице-активаторе. Центробежные силы, действующие на шары и реагенты, превышают силу тяжести в десятки раз, что и приводит к механохимической активации веществ, способных в нашем случае взаимодействовать с образованием комплексного соединения без использования растворителя.
Препараты были испытаны на фунгицидную активность на проростках пшеницы.
Ниже приведены примеры осуществления изобретения.
Пример 1.
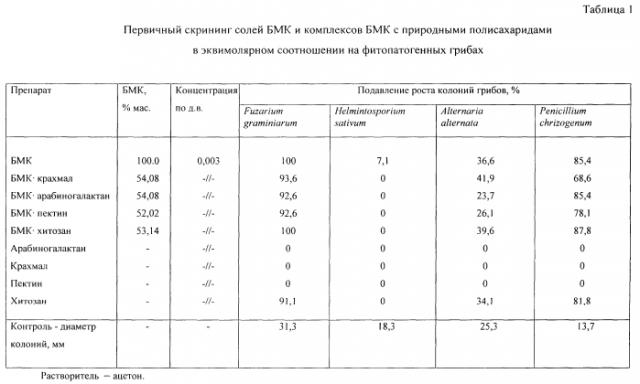
Фунгицидная активность комплексов БМК с природными полисахаридами была оценена на культурах Fuzarium graminiarum, Helmintosporium sativum, Alternaria alternata, Penicillium chrizogenum методом посева фитопатогенных грибов на питательную среду (картофельно-глюкозный агар, содержащий испытуемое вещество). Химическое соединение, растворенное в ацетоне, вводили в субстрат, имеющий температуру 40-50°C, который после тщательного перемешивания разливали в чашки Петри. В каждую чашку Петри высеивали одновременно в трех точках мицелии гриба. Посевы инкубировали в термостате при 25°C в течение 72 часов, после чего измеряли диаметр колоний. Подавление роста колоний грибов находили по формуле Эббота [Методические рекомендации по испытанию химических веществ на фунгицидную активность. Черкассы: НИИТЭХИМ. 1990, С. 5]. Результаты испытаний представлены в табл. 1.
Пример 2.
Для проведения биологических испытаний были приготовлены и испытаны на проростках пшеницы препаративные формы заявляемых комплексных соединений в форме текучей суспензионной пасты. При этом комплексные соединения получают либо предварительно, либо они образуются в процессе приготовления препаративных форм.
Были приготовлены препаративные формы в форме текучей суспензионной пасты (концентратов суспензии) комплексов БМК с арабиногалактаном, или пектином, или хитозаном, или крахмалом в мольном соотношении 1:(1-8) в расчете на усредненную молекулярную массу одного звена гликозидной цепочки полисахарида. Механохимическая обработка исследуемой смеси проводилась на планетарно-шаровой мельнице-активаторе MAC 1-2-0.1. Диаметр используемых стальных шаров - 5 мм. Масса шаров (шаровая нагрузка) составляет около 80% от общей загрузки. Скорость вращения контейнеров - 1500 оборотов в минуту.
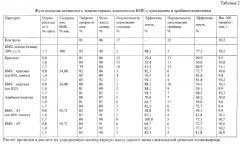
Препараты были испытаны на фунгицидную активность на проростках пшеницы. Повторность - трехкратная.
Результаты испытаний представлены в табл. 2-5.
Пример 3.
Испытания были проведены на проростках пшеницы комплекса БМК с пектином в форме смачивающегося порошка. В качестве вспомогательных веществ используют наполнитель (аэросил и белая сажа в массовом соотношении 1:1), поверхностно-активное вещество (сульфонол). Препаративные формы были получены непосредственно в планетарной мельнице. Время помола составляло 10 мин, режим вращения барабанов 1500 об/мин, диаметр стальных шаров - 5 мм. Масса шаров (шаровая нагрузка) составляет около 80% от общей загрузки. Повторность - трехкратная. Результаты биологических испытаний представлены в табл. 6.
Пример 4.
Биологические испытания были проведены в посевах яровой пшеницы сорта «Экада 70» в фазе флаговый лист-колошение. Выявлена биологическая эффективность комплекса БМК с крахмалом и комплекса БМК с арабиногалактаном в эквимолярном соотношении в отношении заболеваний, как-то: мучнистая роса, бурая ржавчина, септориоз. Повторность - четырехкратная. Результаты испытаний представлены в табл. 7.
Новые комплексные соединения согласно данному изобретению позволяют заменить карбендазим как активное начало в фунгицидных композициях, тем самым снизить загрязнение окружающей стороны при сохранении биологической эффективности. Вместе с тем частичная замена карбендазима на доступные и дешевые природные полисахариды представляется экономически целесообразным решением.
1. Комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом, обладающее фунгицидными свойствами, полученное путем механохимического взаимодействия.
2. Комплексное соединение по п. 1, в котором природный полисахарид выбирают из арабиногалактана, или крахмала, или хитозана, или пектина.
3. Комплексное соединение по п. 1, которое получают путем механохимического взаимодействия метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом в устройствах ударно-истирающего действия.
4. Комплексное соединение по п. 1, которое получают при предпочтительном мольном соотношении метилового эфира 2-бензимидазолилкарбаминовой кислоты и природного полисахарида соответственно 1:(1-8) в расчете на усредненную молекулярную массу одного звена гликозидной цепочки полисахарида.
5. Комплексное соединение по п. 1, которое является действующим веществом фунгицидного средства, дополнительно содержащего приемлемые вспомогательные компоненты и представленного в форме концентрата суспензии или в форме смачивающегося порошка.
6. Комплексное соединение по п. 5, характеризующееся тем, что комплексное соединение метилового эфира 2-бензимидазолилкарбаминовой кислоты с природным полисахаридом получают предварительно либо в процессе приготовления фунгицидного средства.