Способ диагностики наличия заболевания у животных по изменению лейкограммы после ультразвукового воздействия
Иллюстрации
Показать всеИзобретение относится к области ветеринарии и предназначено для диагностики наличия заболевания у животных по изменению лейкограммы после ультразвукового воздействия. Способ включает воздействие на образцы крови объемом от 1 мл до 1,5 мл, помещенные в кювету, непрерывной бегущей ультразвуковой волной частотой 880 кГц интенсивностью от 0,05 до 0,1 Вт/см2 с экспозицией воздействия на кровь животных от 15 с - 30 с, обработку образцов крови в абсолютно одинаковых условиях, поддержание постоянной температуры образцов в кюветах с проточным охлаждением и анализ морфологического состояния клеток методами световой микроскопии. При уменьшении числа лимфоцитов и изменении числа нейтрофилов диагностируют наличие заболевания. Изобретение позволяет регистрировать наличие ухудшения гематологических показателей больных животных и диагностировать наличие или отсутствие заболевания по изменению лейкограммы. 2 ил., 5 табл., 1 пр.
Реферат
Изобретение относится к ветеринарии и медицине и может использоваться при неинвазивном исследовании крови животных с помощью ультразвуковых волн.
Известен способ диагностики различных заболеваний, связанный с оценкой механической резистентности эритроцитов с использованием ультразвукового воздействия на суспензию эритроцитов (ультразвуковой гемолиз эритроцитов).
Этот способ применяется для оценки патологических состояний организма по появлению на эритрограммах участков с высокоустойчивыми и низкоустойчивыми эритроцитами при различных патологиях.
Недостатком данного способа является оценка состояния по одному виду клеток [1].
С 80-х годов исследуются особенности акустического управления функциональным состоянием отдельных клеток, а также возможности пространственного перемещения клеток и частиц. Проверяются различные возможности применения ультразвука на практике, например, в микроскопии [2, 3], приготовлении образцов [4], биотехнологиях [2, 5-9], микромеханической обработке или космических технологиях [10, 11]. При работе с клетками в ультразвуковом (УЗ) поле необходимо учитывать основные биофизические механизмы взаимодействия ультразвука с биологическими объектами (кавитационный, тепловой и механический) для определения функционального состояния клеток. В зависимости от интенсивности УЗ может преобладать один из механизмов. В терапевтическом диапазоне интенсивностей необходимо обращать основное внимание на изменение функционального состояния клеток под действием механических факторов воздействия: попдермоторных сил, действующих в УЗ полях на клетки, микротечений. При повышении интенсивности УЗ рассматриваются тепловые факторы воздействия как преобладающие. При дальнейшем повышении интенсивности УЗ рассматриваются, в первую очередь, кавитационные эффекты, приводящие, как правило, к повреждению биологических систем по свободнорадикальному механизму и за счет образования мощных микротечений вблизи кавитирующих или осциллирующих микропузырьков. В медицинской лабораторной диагностике УЗ успешно применяется для ускорения проведения серологических реакций. Возможность перераспределения клеток в объеме под действием сил УЗ поля привело к развитию ряда новых методов концентрирования и разделения клеток в поле стоячей УЗ волны для медицинских, биотехнологических целей и для научных исследований в области биологии клетки.
Известны также способы неинвазивного диагностического исследования, в которых широко применяются методы ультразвуковой диагностики, отражающие структурные изменения в исследуемых тканях животных и человека.
Недостатками этих способов является разрешающая способность систем диагностики, ограниченная минимальной длиной волны, применяемой в аппаратуре.
В то же время вопросам функционального изменения нормальных и патологически измененных клеток под действием ультразвука в контексте использования этих изменений в качестве диагностического критерия уделено недостаточно внимания.
Степень выраженности данных изменений зависит от типа излучателя, интенсивности УЗ воздействия, времени воздействия.
Прототипом предлагаемого изобретения, наиболее близким ему по совокупности существенных признаков, является способ получения культуры клеток животных (SU 1597387 А1, опубл. 07.10.1990) при помощи воздействия на клетки ультразвуком с частотой 880 кГц и интенсивностью 0,02-0,08 Вт·см2 в течение 5-30 секунд с целью увеличения прироста клеточной массы.
Недостатком данного прототипа является невозможность проведения анализа функционального состояния всех типов клеток из-за последовательного воздействия ультразвука на разные типы клеток, находящиеся в питательных средах. При этом существенным отличием заявленного изобретения от указанного аналога является обработка проб бегущей, а не стоячей УЗ волной.
Целью предлагаемого изобретения является определение процентного соотношения клеток в образцах крови при оптимальных условиях воздействия непрерывным ультразвуком терапевтической интенсивности и частоты 880 кГц на живую систему/in vitro, приводящих к изменению лейкограммы, которая является основой для определения состояния животного (здоровое или больное).
Поставленная цель осуществляется путем нахождения оптимальных условий ультразвукового воздействия, приводящего к изменению лейкограммы больных животных и сохранению лейкограммы здоровых животных.
Показано, что в большинстве случаев получаемые эффекты воспроизводимы на практически всех тестируемых объектах. Результаты демонстрируют возможности и направления использования подобных методик в ветеринарной медицине.
Задачей заявляемого изобретения является создание способа экспресс-диагностики наличия заболевания у животных при помощи определения особенностей клеточного ответа на действие акустических (УЗ) волн терапевтической интенсивности in vitro. Выявление особенностей взаимодействия клеток крови больных и здоровых животных с УЗ безопасного диапазона: минимальной терапевтической интенсивности и предельно низкого времени экспозиции. Способ позволяет регистрировать наличие ухудшения гематологических показателей больных животных, а следовательно, диагностировать наличие или отсутствие заболевания по изменению лейкограммы, вызванному действием ультразвука определенной частоты и интенсивности на клетки крови.
Указанная задача осуществляется тем, что на образцы крови объемом от 1 мл до 1,5 мл, помещенные в кювету, воздействуют непрерывной бегущей ультразвуковой волной частотой 880 кГц интенсивностью от 0,05 до 0,1 Вт/см2 с экспозицией воздействия на кровь животных от 15 с - 30 с. Обработку образцов крови осуществляют в абсолютно одинаковых условиях, поддерживают постоянную температуру образцов в кюветах с проточным охлаждением, а также проводят анализ морфологического состояния клеток методами световой микроскопии. Ультразвуковое воздействие производится одновременно на все типы клеток крови различных животных, находящиеся в одинаковой среде культивирования. Это позволяет наблюдать изменения в лейкограмме здоровых и больных животных и по этим изменениям делать оценку состояния животных.
Заявленный способ осуществляется следующим образом.
Воздействовали ультразвуком in vitro (фиг. 1). Экспозиция УЗ: время от 15 с до 30 с, ISATA - средняя по пространству и времени интенсивность - от 0,05 до 0,1 Вт/см2, частота 880кГц. Аппараты: УЗТ - 1-01Ф; УЗТ-5 и УЗТ-1.02С. Бегущая УЗ волна, режим непрерывный. Кровь брали из подкожной вены предплечья у кошек, собак, кроликов, яремной вены лошадей натощак в утренние часы. Кровь забирали в ветеринарной клинике во время ежегодного контроля здоровья, а также у животных с выявленными патологиями. Транспортировку образцов осуществляли при температуре 0-4°C без доступа воздуха для стабилизации процессов свободнорадикального окисления и приступали к апробации способа. От лабораторных и мелких домашних животных систематически получать большой объем крови при развернутой серии биофизических экспериментов для достоверной статистики считаем негуманно, поэтому была специально разработана и апробирована методика озвучивания образцов минимально допустимого объема. Для каждого объема крови подбиралась экспозиция таким образом, чтобы получались сопоставимые результаты. Образцы крови от 1,0-1,5 мл (собаки, кошки, лошади) озвучивались в абсолютно одинаковых условиях (площадь излучателя, охлаждение, циркуляция жидкости). Ультразвуковое воздействие на клетки крови, находящейся в термостатируемой кювете, осуществлялось с помощью терапевтического излучателя. Стенки кюветы выполнены из пластика или пластмассы, но могут быть изготовлены из любых, проводящих ультразвук, материалов. В качестве охлаждающей жидкости применялась непрерывно циркулирующая дистиллированная вода (т.н. «проточное охлаждение») (фиг. 2). Результат воздействия УЗ на клетки сразу же наблюдали в световой микроскоп. Число клеток в единице объема крови определяли с помощью камеры Горяева и светового микроскопа. Делали мазки и окрашивали по методу быстрого дифференциального окрашивания биопрепаратов ДИФФ-КВИК: мазки фиксировали в абсолютном метаноле 15 с, выдерживали в растворах красителей в течение 10 с, промывали в забуференной воде, высушивали и микроскопировали (микроскоп «Микмед-5», объектив 100x/1,25, окуляр 10х/18). Подсчет лейкоцитов вели по линии «Меандра»: 3-5 полей зрения вдоль края мазка, 3-5 полей зрения под прямым углом к середине мазка, потом 3-5 полей зрения параллельно краю мазка и вновь под прямым углом к краю мазка. Так продолжали до тех пор, пока не было подсчитано 100 целых клеток [12]. Считали все лейкоциты, находящиеся в 25 больших квадратах, содержащих по 16 малых квадратов (т.е. в 400 квадратах). Для расчета в 1 мл использовали формулу:
где
X - количество лейкоцитов в 1 мл крови; M - количество лейкоцитов, подсчитанное в 25 квадратах; 20 - разведение крови; 400 - количество квадратов [13]. Лейкограмма отражает соотношение между различными видами лейкоцитов периферической крови и в клинической практике выражается в процентах.
Статистическую обработку результатов проводили с использованием пакета прикладных программ «Statistica 6.0». Достоверность различий средних значений определяли, используя парный t-критерий Стъюдента; достоверными считали различия при р<0,05.
В результате данного этапа работы была отработана оптимальная схема «озвучивания» крови in vitro. Были определены восприимчивость и резистентность клеток крови здоровых и больных животных к УЗ воздействию, а также отслежены возможные изменения жизнеспособности клеток крови и гематологических показателей в поле бегущей ультразвуковой волны.
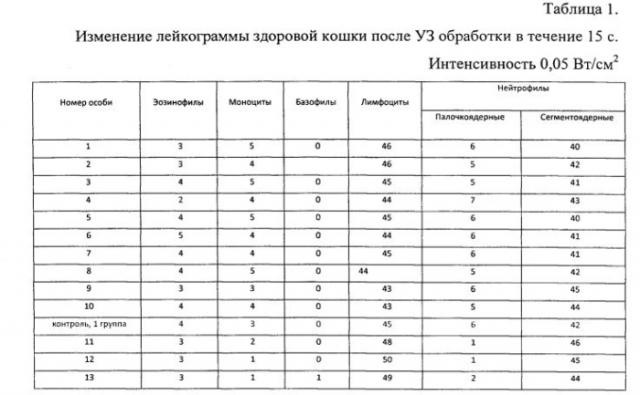
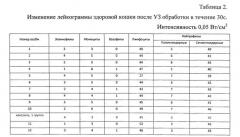
Изменение лейкограммы
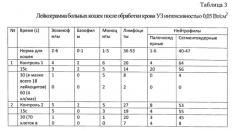
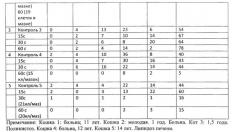
При обработке крови здоровых животных минимальной терапевтической интенсивностью 0,05 Вт/см2 от 5 с до 30 с лейкограмма меняется незначительно (табл. 1, 2). В крови больных может отмечаться значительное уменьшение числа лейкоцитов в поле зрения мазков уже после 10-15-секундного воздействия (табл. 3) или резкое изменение процентного соотношения в лейкограмме (кошки №3, 4; лошадь №2). Повышение времени воздействия до 20-30 с влечет за собой появление поврежденных клеток, частичную их гибель. Дальнейшее увеличение экспозиции (45-60 с) приводит к «съеживанию» клеток, появлению клеточных фрагментов, участков из оформленных белковых масс или нетипируемых клеток, лизису клеток, а также скоплений голоядерных элементов (Табл. 3-5). У здоровых животных такие изменения начинают регистрироваться лишь при УЗ интенсивности, превышающей 0,2 Вт/см2, и времени экспозиции не менее 30 с.
Дальнейшее последовательное увеличение интенсивности действующего ультразвука от 0,1 до 2,0 Вт/см2 приводит к экспоненциальному уменьшению числа жизнеспособных клеток. При росте экспозиции озвучивания от 1 до 5 мин в поле зрения микроскопа обнаруживаются морфологически поврежденные комплексы клеток, и отмечается прогрессивно возрастающий цитоцидный эффект. Изменения в лейкограммах различных животных зависят от интенсивности УЗ волны, времени экспозиции, состояния здоровья и, в значительно меньшей степени, от вида животного. Этиология заболевания и степень его проявления никак не влияют на особенности клеточного ответа. Однако стадия развития патологического процесса в ряде случаев (Табл. 3, 4: собаки №1, 2; кошка №5) может быть выявлена при помощи предлагаемой методики.
Выводы.
1. Отработана схема УЗ обработки клеток крови в фиксированном и термостатируемом объеме.
2. УЗ интенсивности 0,05 Вт/см2 является «безопасным» для клеток крови здоровых животных: не влияет на жизнеспособность и лейкограмму.
3. Диапазон интенсивностей 0,05-0,1 Вт/см2 приводит к уменьшению числа жизнеспособных клеток крови больных животных. Степень выраженности изменений зависит главным образом от интенсивности УЗ волны, времени экспозиции и состояния здоровья. Этиология заболевания на особенности клеточного ответа не влияет. При значительном росте экспозиции отмечается прогрессивно возрастающий цитоцидный эффект.
4. При наличии заболеваний инвазивной и неинвазивной этиологии у животных разного вида, пола и возраста после кратковременной, до 30 с, обработки крови УЗ минимальной терапевтической интенсивности 0,05 Вт/см2 достоверно разнонаправлено необратимо изменяется лейкограмма (процентное соотношение лейкоцитов): уменьшается число лимфоцитов, количество нейтрофилов может как увеличиваться, так и уменьшаться. Может наблюдаться лейкопения, лизис цитоплазматической мембраны или клеток полностью, а также деструкция клеток. Изменение лейкограммы может являться диагностическим критерием при выявлении различных патологических состояний животных.
5. Разработанный способ может быть применен в любой диагностической лаборатории благодаря простоте осуществления, доступности и малым временным затратам на его выполнение.
Литература
1. Справочник по клиническим лабораторным методам исследования под ред проф. Кост Е.А., Москва, «Медицина», 1975.
2. Hertz Н.М. Standing-wave acoustic trap for no intrusive positioning of microparticles. J Appl Phys 78(8), (1995), 4845-4849.
3. Wu J. Acoustical tweezers. J Acoust Soc Am 89(5), (1991) - P. 2140-2143.
4. Holwill I.L., Davies G.B., Titchener-Hooker N.J., Hoare M.. Particle manipulation by ultrasonic standing wave field to complement dynamic light scattering experiments. Part Syst Charact 12(3), (1995), 139-147.
5. Takeuchi M., Yamanouchi K.. Ultrasonic micromanipulation of small particles in liquid. Jpn J Appl Phys (Part 1), 33(5B), (1994). - P. 3045-3047.
6. Takashi M., Tetsuo O. Ultrasonic Radiation - Novel Principle for Microparticle Separation. ANALYTICAL SCIENCES. - 2001, vol. 17.
7. T.N. Pashovkin, D.G. Sadikova, M.S. Pashovkina, G.V. Shil′nikov // Use of ultrasonic standing wave in biological studies and cell technologies. // Bull Exp Biol Med 144(1):118-22 (2007), PMID 18256768.
8. Т.N. Pashovkin, D.G. Sadikova // Cell Exfoliation, Separation, and Concentration in the Field of a Standing Ultrasonic Wave // Acoustical Physics, 2009, Vol. 55, No. 4-5, pp. 584-593.
9. D.G. Sadikova, T.N. Pashovkin // Cell concentration and separation in the field of a standing ultrasonic wave for medicine and biotechnology. // Open Journal of Biophysics, 2013, 3, p. 70-75 (http://www.script.org/journal/ojbiphy)
10. Kozuka Т., Tuziuti Т., Mitome H., Fukuda T. One-dimensional transportation of particles using an ultrasonic standing wave. Proc MHS ′95 - IEEE 6th Int Symp on Micro Machine and Human Science, 1995 - P. 179-185. ISBN 0-7803-2676-8.
11. Kozuka Т., Tuziuti Т., Mitome H., Fukuda T. Non-contact micromanipulation using an ultrasonic standing wave field. Proc IEEE 9th Ann Int Workshop on Micro Electro Mechanical Systems, 1996. P. 435-440. ISSN 1084-6999.
12. Новиков Д.К., Новикова В.И. Оценка иммунного статуса - М. Витебск, 1996.
13. Кондрахин И.П., Курилов Н.В., Малахов А.Г. и др. Клиническая лабораторная диагностика в ветеринарии. - М.: Агропромиздат, 1985. - С. 59-64.
14. Методические рекомендации к определению и выведению гемограммы у животных. / Н.А. Любин, Л.Б. Конова. Методические рекомендации к определению и выведению гемограммы у сельскохозяйственных и лабораторных животных при патологиях. Ульяновск: ГСХА, 2005. - 113 с.
Способ диагностики наличия заболевания у животных по изменению лейкограммы после ультразвукового воздействия, включающий воздействие на образцы крови объемом от 1 мл до 1,5 мл, помещенные в кювету, непрерывной бегущей ультразвуковой волной частотой 880 кГц интенсивностью от 0,05 до 0,1 Вт/см2 с экспозицией воздействия на кровь животных от 15 с - 30 с, обработку образцов крови в абсолютно одинаковых условиях, поддержание постоянной температуры образцов в кюветах с проточным охлаждением и анализ морфологического состояния клеток методами световой микроскопии, и при уменьшении числа лимфоцитов и изменении числа нейтрофилов диагностируют наличие заболевания.