Композиции для легочной доставки антагонистов мускариновых рецепторов длительного действия и агонистов β2-адренергических рецепторов длительного действия и связанные с ними способы и системы
Иллюстрации
Показать всеПредложена группа из 13 изобретений. Она включает композиции и способы респираторной доставки антагониста мускариновых рецепторов длительного действия формотерола и/или агониста β2-адренергических рецепторов длительного действия гликопирролята через ингалятор с отмеряемой дозой, а также указанный ингалятор и способы лечения заболевания или нарушения легких с их использованием. Фармацевтическая композиция и содержащий её ингалятор включают, помимо указанных активных веществ, множество суспензирующих частиц, нерастворимых в суспензионной среде, сухие перфорированные микроструктуры, содержащие фосфолипид, причем общая масса суспендирующих частиц превышает общую массу частиц активного вещества и образует с ними косуспензию. Технический результат состоит в обеспечении физической и химической стабильности композиции, в обеспечении единообразия доставляемой косуспензиями дозы на протяжении опустошения емкости ингалятора. 13 н. и 127 з.п. ф-лы, 30 ил., 14 табл.
Реферат
Техническая область
Настоящее изобретение относится, главным образом, к фармацевтическим составам и способам доставки одного или нескольких активных веществ через дыхательные пути. В определенных аспектах настоящее изобретение относится к композициям, способам и системам для легочной доставки антагонистов мускариновых рецепторов длительного действия и агонистов β2-адренергических рецепторов длительного действия через ингалятор с отмеряемой дозой.
Уровень техники
Часто являются желательными способы направленной доставки лекарственных средств, которые доставляют активное вещество в область действия. Например, направленная доставка активных веществ может снизить нежелательные побочные эффекты, уменьшить требуемые дозировки и снизить стоимость лечения. В контексте респираторной доставки ингаляторы представляют собой хорошо известные устройства для введения активного вещества в дыхательные пути индивидуума, и в настоящее время доступно несколько различных ингаляторных систем. Три общеизвестных ингаляторных системы включают ингаляторы сухого порошка, небулайзеры и ингаляторы с отмеряемой дозой (MDI).
MDI можно использовать для доставки лекарственных средств в солюбилизированной форме или в качестве суспензии. Как правило, в MDI используется пропеллент с относительно высоким давлением пара для выталкивания аэрозолированных капель, содержащих активное вещество, в дыхательные пути, когда MDI активируют. Ингаляторы сухих порошков, как правило, основаны на дыхательных усилиях пациента для введения лекарственного порошка в дыхательные пути в форме сухого порошка. С другой стороны небулайзеры образуют аэрозоль лекарственного средства, подлежащего ингаляции, путем сообщения энергии жидкому раствору или суспензии.
MDI представляют собой устройства для доставки активного вещества, в которых используется давление, создаваемое пропеллентом. Обычно в качестве пропеллентов в системах MDI используют хлорфторуглероды (CFC) вследствие их низкой токсичности, желаемого давления пара и пригодности для образования стабильных суспензий. Однако понятно, что традиционные CFC-пропелленты имеют отрицательное влияние на окружающую среду, которое привело к разработке альтернативных пропеллентов, которые, как полагают, являются более экологически благоприятными, таких как перфторированные соединения (PFC) и гидрофторалканы (HFA).
Активное вещество, подлежащее доставке с помощью суспензии в MDI, как правило, предоставляют в качестве тонких частиц, диспергированных в пропелленте или комбинации двух или более пропеллентов (т.е., в пропеллентной "системе"). Для образования тонких частиц активное вещество, как правило, микронизируют. Тонкие частицы активного вещества, суспендированные в пропелленте или пропеллентной системе, имеют тенденцию к быстрой агрегации или оседанию в виде хлопьев. Это особенно справедливо для активных веществ, присутствующих в микронизированной форме. В свою очередь, агрегация или оседание в виде хлопьев этих тонких частиц может осложнять доставку активного вещества. Например, агрегация или оседание в виде хлопьев могут приводить к механическим повреждениям, таким как повреждения, которые могут быть вызваны закупоркой отверстия клапана контейнера с аэрозолем. Нежелательная агрегация или оседание в виде хлопьев частиц лекарственного средства также могут привести к быстрому оседанию или отслаиванию частиц лекарственного средства, и такое поведение может привести к нестабильной доставке дозы, что, в свою очередь, может вызвать особые трудности в случае высоко сильнодействующих лекарственных средств малой дозы. Другая проблема, связанная с такими суспензионными составами для MDI относится к росту кристаллов лекарственного средства в процессе хранения, что приводит к снижению с течением времени аэрозольных свойств и единообразию доставляемой дозы из таких MDI. Позднее были предложены подходы для решения этих проблем, такие как подходы, описанные в патенте США No. 6964759, для составов MDI, содержащих антихолинэргетики.
Одним из подходов для улучшения характеристик аэрозоля в ингаляторах сухого порошка являлся включение частиц-носителей тонких частиц, таких как лактоза. Применение таких высокодисперсных эксципиентов не было исследовано в большой степени для MDI. В недавнем сообщении Young et al., "The influence of micronized particulates on the aerosolization properties of pressurized metered dose inhalers"; Aerosol Science 40, pgs. 324-337 (2009), указано, что применение таких носителей тонких частиц в MDI в действительности приводит к ухудшению характеристик аэрозоля.
В традиционных системах CFC, когда активное средство, присутствующее в составе MDI, солюбилизируют в пропелленте или пропеллентной системе, часто используют поверхностно-активные вещества для покрытия поверхностей активного средства в целях минимизации или предупреждения проблемы агрегации и сохранения по существу единообразной дисперсии. Применение поверхностно-активных веществ, таким образом, иногда называют "стабилизацией" суспензии. Однако многие поверхностно-активные вещества, которые являются растворимыми и, таким образом, эффективными в системах CFC, не являются эффективными в пропеллентных системах HFA и PFC, поскольку такие поверхностно-активные вещества проявляют отличающиеся характеристики растворимости в не-CFC пропеллентах.
Краткое описание рисунков
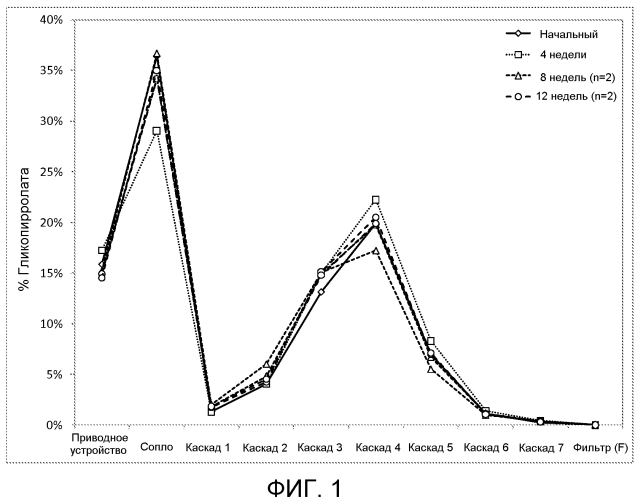
На фиг. 1 представлен график, изображающий распределение размера частиц, которое проявляла иллюстративная косуспензионная композиция согласно настоящему описанию, которая включала гликопирролат, антагонист мускариновых рецепторов длительного действия, в качестве активного вещества. MDI с косуспензией подвергали циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С) в течение 12 недель.
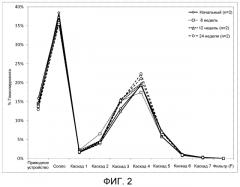
На фиг. 2 представлен график, изображающий распределение размера частиц, которое проявляла иллюстративная косуспензионная композиция согласно настоящему описанию, которая включала гликопирролат, антагонист мускариновых рецепторов длительного действия, в качестве активного вещества. MDI с косуспензией подвергали циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С) в течение 24 недель.
На фиг. 3 представлена микрофотография, иллюстрирующая морфологию различных суспендирующих частиц, полученных согласно примеру 5.
На фиг. 4 представлена фотография двух флаконов, которая позволяет визуализацию косуспензии, образовавшейся при использовании частиц активного вещества, сформированных с использованием гликопирролата, и суспендирующих частиц, сформированных с использованием сахарида.
На фиг. 5 представлен график, на котором изображен уровень концентрации гликопирролата в сыворотке, достигаемый в течение 24 часов после однократного введения четырех различных доз гликопирролата, доставляемого с помощью косуспензионной композиции, как описано в настоящем документе.
На фиг. 6 представлен график, на котором изображено средние изменение FEV1 от исходного уровня (в литрах), испытываемое пациентами в течение периода 24 часов после проведения однократного введения указанной дозы гликопирролата, изготовленного в виде косуспензии, как описано в настоящем документе. В этом исследовании в качестве активного контроля был включен, Spiriva (18 мкг тиотропия), и также представлено среднее изменение FEV1 от исходного уровня (в литрах), испытываемое пациентами, которым проводили однократное введение Spiriva.
На фиг. 7 представлена столбиковая диаграмма, на которой изображено изменение пика FEV1 от исходного уровня (в литрах), испытываемое пациентами после проведения однократного введения указанной дозы гликопирролата, изготовленного в виде косуспензии, как описано в настоящем документе, относительно плацебо, площадь под кривой FEV1 в течение 12 часов после дозирования, и площадь под кривой FEV1 в течение 24 часов после дозирования относительно плацебо для четырех оцениваемых доз. В этом исследовании, в качестве активного контроля был включен Spiriva (18 мкг тиотропия) и также на этой фигуре представлены результаты после однократного введения Spiriva для указанных выше параметров.
На фиг. 8 представлен график, на котором изображена доля пациентов, которые достигли более 12% изменения FEV1 от исходного уровня и улучшения в виде изменения на 150 мл от исходного уровня или абсолютного улучшения в виде 200 мл от исходного уровня, независимо от % изменения FEV1 от исходного уровня, после однократного введения указанных доз косуспензии гликопирролата, как описано в настоящем документе. В этом исследовании, в качестве активного контроля был включен Spiriva (18 мкг тиотропия) и также на этой фигуре представлены результаты после однократного введения Spiriva для указанных выше параметров.
На фиг. 9 представлена столбиковая диаграмма, на которой изображено изменение пика емкости вдоха у пациентов после проведения однократного введения указанных доз косуспензии гликопирролата, как описано в настоящем документе. В этом исследовании, в качестве активного контроля был включен Spiriva (18 мкг тиотропия) и также на этой фигуре представлены результаты после однократного введения Spiriva для указанных выше параметров.
На фиг. 10 представлена столбиковая диаграмма, на которой показано изменение AUC для FEV1, достигаемое у пациентов после проведения однократного введения указанных доз косуспензии гликопирролата, как описано в настоящем документе. Результаты, достигаемые с помощью косуспензии гликопирролата согласно настоящему описанию, представлены по сравнению с изменением AUC FEV1, описанным в опубликованном исследовании у пациентов, которым вводили порошковый состав гликопирролата, приготовленный не согласно указаниям, представленным в настоящем документе.
На фиг. 11 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 4,5 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг. 12 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 36 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг. 13 представлен график, на котором изображена доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 4,5 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц.
На фиг. 14 представлен график, на котором изображена доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 36 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц.
На фиг. 15 представлен график, на котором изображено распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 36 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц и подвергнутой хранению в течение 12 месяцев при 25°C/60% RH в отсутствие защиты.
На фиг. 16 представлен график, на котором изображена средняя доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 32 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг. 17 представлен график, на котором изображено распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 32 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температуры (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг. 18 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему описанию, содержащей 24 мкг гликопирролата/доставляемая при приведении в действие доза и 6 мг/мл суспендирующих частиц и подвергнутой хранению в течение 6 недель при 50°C/атмосферной относительной влажности и в течение 12 недель при 40°С.
На фиг. 19 представлена фотография, которая позволяет визуализацию косуспензионных композиций, полученных согласно настоящему описанию, которые включают частицы активного вещества формотерола фумарата.
На фиг. 20 представлен график, на котором представлено единообразие доставляемой дозы, достигаемое с помощью косуспензионных композиций формотерола фумарата, полученных согласно настоящему описанию.
На фиг. 21 представлен график, на котором показано распределение аэродинамического размера частиц, определенное с помощью каскадного импактора иллюстративных косуспензионных композиций формотерола фумарата, полученных согласно настоящему описанию и хранившихся в течение трех месяцев при 25°С/75% RH с защитной оберткой или при 40°С/75% RH без защитной обертки.
На фиг. 22 представлен график, на котором изображена химическая стабильность иллюстративных косуспензионных композиций, включающих формотерола фумарат в качестве активного вещества. Результаты, представленные на этой фигуре, позволяют сравнение химической стабильности формотерола фумарата, достигаемой в косуспензионной композиции, изготовленной с использованием кристаллического формотерола фумарата, с химической стабильностью суспензионных составов, полученных с использованием высушенного распылительной сушкой формотерола фумарата.
На фиг. 23 - фиг. 26 представлены электронные микрофотографии суспендирующих частиц, полученных из различных материалов, причем на фигуре 23 представлена микрофотография суспендирующих частиц трегалозы, на фигуре 24 представлена микрофотография суспендирующих частиц HP-β-циклодекстрина, на фигуре 25 представлена микрофотография суспендирующих частиц Ficoll MP70, и на фигуре 26 представлена микрофотография суспендирующих частиц инулина.
На фиг. 27 представлен график, на котором показано распределение аэродинамического размера частиц, определенное путем последовательного сжатия иллюстративных косуспензионных композиций, полученных согласно настоящему описанию и включающих частицы активного вещества гликопирролата.
На фиг. 28 представлен график, на котором показано распределение аэродинамического размера частиц, определенное путем последовательного сжатия иллюстративных косуспензионных композиций, полученных согласно настоящему описанию и включающих частицы активного вещества формотерола фумарата.
На фиг. 29 представлен график, на котором изображено единообразие доставляемой дозы, достигаемое с помощью косуспензионных композиций формотерола фумарата сверхнизкой дозы, полученных в соответствии с настоящим описанием.
На фиг. 30 представлены графики, иллюстрирующие распределение размера частиц гликопирролата (сверху) и формотерола (снизу), достигаемое с помощью иллюстративной косуспензии по сравнению с распределениями размера частиц, достигаемыми с помощью составов, включающих либо гликопирролат, либо формотерола фумарат отдельно.
Подробное описание
Настоящее изобретение относится к композициям, способам и системам для респираторной доставки активных веществ с помощью MDI. В конкретных вариантах осуществления композиции, способы и системы, описанные в настоящем документе, адаптированы для респираторной доставки активных веществ, выбранных из антагониста мускаринового рецептора длительного действия ("LAMA") и агониста β2-адренергических рецепторов длительного действия ("LABA"). В определенных вариантах осуществления, активное вещество LAMA или LABA может быть сильнодействующим или высоко сильнодействующим и, таким образом, изготавливаемым в низких концентрациях и доставляемым в низких дозах. Фармацевтические композиции, описанные в настоящем документе, можно изготавливать для легочной или назальной доставки с помощью MDI. Способы, описанные в настоящем документе, включают способы стабилизации составов, включающих активные вещества LAMA или LABA, для респираторной доставки, а также способы легочной доставки активных веществ LAMA и LABA с помощью MDI. Также в настоящем документе описаны способы изготовления MDI для доставки активного вещества LAMA или LABA.
В конкретных вариантах осуществления способы, описанные в настоящем документе, включают способы лечения легочного заболевания или нарушения, поддающихся лечению путем доставки активного вещества LAMA или LABA с помощью MDI. Например, композиции, способы и системы, описанные в настоящем документе, можно использовать для лечения воспалительных или обструктивных легочных заболеваний или состояний. В определенных вариантах осуществления композиции, способы и системы, описанные в настоящем документе, можно использовать для лечения пациентов, страдающих заболеванием или нарушением, выбранным из астмы, хронического обструктивного заболевания легких (COPD), обострения гиперреактивности дыхательных путей вследствие терапии другим лекарственным средством, аллергического ринита, синусита, сужения сосудов легких, воспаления, аллергии, затрудненного дыхания, респираторного дистресс-синдрома, легочной гипертензии, сужения сосудов легких и любого другого респираторного заболевания, состояния, признака, генотипа или фенотипа, которые могут отвечать на введение LAMA или LABA отдельно или в комбинации с другими способами терапии. В определенных вариантах осуществления композиции, системы и способы, описанные в настоящем документе, можно использовать для лечения воспаления и обструкции легких, ассоциированных с кистозным фиброзом. Как используют в настоящем документе, термины "COPD" и "хроническое обструктивное заболевание легких" охватывают хроническое обструктивное заболевание легких (COLD), хроническое обструктивное заболевание дыхательных путей (COAD), хроническое ограничение воздушного потока (CAL) и хроническое обструктивное респираторное заболевание (CORD) и включают хронический бронхит, бронхоэктаз и эмфизему. Как используют в настоящем документе, термин "астма" относится к астме любого типа или генеза, включая как эндогенную (неаллергическую) астму, так и экзогенную (аллергическую) астму, мягкую астму, умеренную астму, тяжелую астму, астму вследствие бронхита, индуцируемую физической нагрузкой астму, профессиональную астму и астму, индуцируемую бактериальной инфекцией. Также подразумевают, что астма охватывает детский астматический синдром.
Хорошо понятно, что варианты осуществления, как описано в настоящем документе, являются иллюстративными. Представленное ниже более подробное описание различных вариантов осуществления не предназначено для ограничения объема настоящего изобретения, а является только типичным примером различных вариантов осуществления. Более того, порядок стадий или действий в способах, описанных применительно к вариантам осуществления, описанным в настоящем документе, может быть изменен специалистами в данной области без отклонения от объема настоящего изобретения. Иными словами, если для надлежащего эффекта вариантов осуществления требуется конкретные стадии или действия, порядок или применение конкретных стадий или действий может быть модифицирован.
I. Определения
Если конкретно не определено иначе, технические термины, как используют в настоящем документе, имеют их обычное подразумеваемое в данной области значение. Представленные ниже термины определены конкретно для ясности.
Термин "активное вещество" используют в настоящем документе как включающий любое вещество, лекарственное средство, соединение, композицию или другое вещество, которое можно использовать у человека или животного или вводить человеку или животному и представляет собой LAMA или LABA. Термин "активное вещество" может быть использован взаимозаменяемо с терминами "лекарственное средство", "фармацевтическое средство", "медикамент", "лекарственное вещество" или "терапевтическое средства".
Термины "ассоциировать", "ассоциировать с" или "ассоциация" относится к взаимодействию или взаимосвязи между химической структурной единицей, композицией или структурой в условиях близости к поверхности, такой как поверхность другой химической структурной единицы, композиции или структуры. Ассоциация включает, например, адсорбцию, адгезию, связывание ковалентной связью, связывание водородной связью, связывание ионной связью и электростатическое притяжение, взаимодействия Лифшица-Ван-дер-Ваальса и полярные взаимодействия. Термин "прикрепляться" или "адгезия" представляет собой форму ассоциации и их используют в качестве общего термина для всех сил, имеющих тенденцию к тому, чтобы вызывать привлечение частицы или массы к поверхности. "Прикрепляться" также относится к осуществлению контактирования и поддержанию контакта частиц друг с другом, так чтобы по существу не было видимого разделения между частицами вследствие их различных выталкивающих сил в пропелленте в нормальных условиях. В одном варианте осуществления термином "прикрепляться" охватывается частица, которая присоединена к поверхности или связана с ней. Нормальные условия могут включать хранение при комнатной температуре или под действием ускоряющей силы вследствие гравитации. Как описано в настоящем документе, частицы активного вещества могут ассоциировать с суспендирующими частицами с образованием косуспензии, где по существу отсутствует видимое разделение между суспендирующими частицами и частицами активного вещества или их осадок в виде хлопьев вследствие различий в выталкивающей силе в пропелленте.
"Суспендирующие частицы" относятся к материалу или комбинации материалов, которые приемлемы для респираторной доставки и действуют в качестве носителя для частиц активного вещества. Суспендирующие частицы взаимодействуют с частицами активного вещества, способствуя повторяющемуся дозированию, доставке или транспорту активного вещества в заданную область доставки, т.е., в дыхательные пути. Суспендирующие частицы, описанные в настоящем документе, диспергированы в суспензионной среде, включающей пропеллент или пропеллентную систему, и им может быть придана конфигурация любой формы, размера или поверхностных характеристик, подходящих для достижения желаемой стабильности суспензии или эффективности доставки активного вещества. Иллюстративные суспендирующие частицы включают частицы, которые имеют размер частиц, который упрощает доставку в дыхательные пути активного вещества, и имеют физические конфигурации, подходящие для изготовления и доставки стабилизированных суспензий, как описано в настоящем документе.
Термин "косуспензия" относится к суспензии двух или более типов частиц, имеющих различные композиции, в суспензионной среде, где частицы одного типа ассоциируют по меньшей мере частично частицами одного или нескольких других типов. Ассоциация приводит к поддающемуся выявлению изменению одной или нескольких характеристик по меньшей мере одного из отдельных типов частиц, суспендированных в суспензионной среде. Характеристики, модифицируемые ассоциацией, могут включать, например, одно или несколько из скорости агрегации или оседания в виде хлопьев, скорости или характера разделения, т.е. оседания или отслаивания, плотности отслоившегося слоя или осадка, адгезии к стенкам контейнера, адгезии к компонентам клапана и скорости и уровня диспергирования при встряхивании.
Иллюстративные способы оценки того, имеется ли косуспензия, включают следующие: если один тип частиц имеет пикнометрическую плотность, превышающую пикнометрическую плотность пропеллента, и другой тип частиц имеет пикнометрическую плотность более низкую, чем пикнометрическая плотность пропеллента, визуальное исследование характера отслаивания или оседания можно использовать для определения наличия косуспензии. Термин "пикнометрическая плотность" относится к плотности материала, из которого состоит частица, за исключением пустот в частице. В одном варианте осуществления материалы могут быть изготовлены и перенесены в прозрачный флакон, как правило, в стеклянный флакон, для визуального исследования. После первоначального встряхивания флакон оставляют, не трогая, в течение достаточного времени для образования осадка или отслоившегося слоя, как правило, 24 часов. Если осадок или отслоившийся слой наблюдают в качестве полностью или по большей части однородного единого слоя, то имеется косуспензия. Термин "косуспензия" включает частичные косуспензии, где большая часть из по меньшей мере двух типов частиц ассоциируют с друг с другом, однако может наблюдаться некоторое разделение (т.е., меньше чем большинство) по меньшей мере двух типов частиц.
Иллюстративный тест косуспензии можно проводить при различных температурах пропеллента, уделяя внимание характеру оседания или отслаивания типов частиц с плотностью, близкой к плотности пропеллента при комнатной температуре. Если различные типы частиц имеют одинаковый характер разделения, т.е. все они выпадают в осадок или все отслаиваются, наличие косуспензии можно определять путем измерения других характеристик суспензии, таких как скорость агрегации или выпадения в осадок в виде хлопьев, скорость разделения, плотность отслоившегося слоя или слоя осадка, адгезия к стенкам контейнера, адгезия к компонентам клапана и скорость и уровень диспергирования при встряхивании, и сравнение их с соответствующими характеристиками сходным образом суспендированных отдельных типов частиц. Для измерения этих характеристик можно использовать различные аналитические способы, обычно известные специалистам в данной области.
В контексте композиции, содержащей или обеспечивающей пригодные для вдыхания агрегаты, частицы, капли, и т.д., такой как композиции, описанные в настоящем документе, термин "доза тонких частиц" или "FPD" относится к дозе, либо в виде общей массы, либо в виде части номинальной дозы или отмеряемой дозы, которая находится в пригодном для вдыхания диапазоне. Дозу, которая находится в пределах пригодного для вдыхания диапазона, определяют in vitro как дозу, которая депонируется за стадией сопла в каскадном импакторе, т.е. сумму дозы, доставляемой через каскады от 3 до фильтра в импакторе Next Generation Impactor, работающем при скорости потока 30 л/мин.
В контексте композиции, содержащей или обеспечивающей пригодные для вдыхания агрегаты, частицы, капли и т.д., такой как композиция, описанная в настоящем документе, термин "фракция тонких частиц" или "FPF" относится к доле доставляемого материала относительно доставляемой дозы (т.е., количества, которое выходит из приводного механизма устройства для доставки, такого как MDI), которая находится в пределах пригодного для вдыхания диапазона. Количество доставляемого материала в пригодном для вдыхания диапазоне определяют in vitro как количество материала, который накапливается за стадией сопла в каскадном импакторе, т.е. сумму дозы, доставляемой после 3 каскадов через фильтр в импакторе Next Generation Impactor, работающем при скорости потока 30 л/мин.
Как используют в настоящем документе, термин "ингибирует" относится к поддающемуся измерению уменьшению тенденции к возникновению явления, симптома или состояния или степени, с которой возникают эти явление, симптом или состояние. Термин "ингибирует" или любую его форму используют в его наиболее широком значении, и он включает минимизацию, предупреждение, снижение, сдерживание, подавление, приостановку, ограничение, задерживание, замедление прогрессирования и т.п.
"Массовый медианный аэродинамический диаметр" или "MMAD", как используют в настоящем документе относится к аеродинамическому диаметру аэрозоля, ниже которого 50% массы аэрозоля состоит из частиц с аэродинамическим диаметром, меньшим чем MMAD, где MMAD вычисляют согласно монографии 601 United States Pharmacopeia ("USP").
При упоминании в настоящем документе термин "оптический диаметр" указывает на размер частиц при измерении с помощью режима дифракции Фраунтгофера с использованием лазерно-дифракционного анализатора размера частиц, оборудованного распределителем сухого порошка (например, Sympatec GmbH, Clausthal-Zellerfeld, Германия).
Термин "опосредуемое раствором преобразование" относится к явлению, при котором более растворимая форма твердого материала (т.е. частицы с малым радиусом кривизны (движущая сила для оствальдовского созревания), или аморфный материал) растворяется и перекристаллизуется в более стабильную кристаллическую форму, которая может сосуществовать в равновесии с ее насыщенным раствором пропеллента.
"Пациент" относится к животному, у которого активные вещества LAMA или LABA могут иметь терапевтический эффект. В одном варианте осуществления, пациентом является человек.
"Перфорированные микроструктуры" относятся к суспендирующим частицам, которые включают структурную матрицу, которая проявляет, определяет или содержит пустоты, поры, дефекты, полости, пространства, внутрипоровые пространства, щели, отверстия или углубления, которые позволяют окружающей суспензионной среде проникать, заполнять или пропитывать микроструктуру, такой как материалы и препараты, описанные в патенте США No. 6309623, выданном Weers et al. Преимущественная форма перфорированной микроструктуры, главным образом, не является важной, и в настоящем документе предусматривается любая конечная конфигурация, которая обеспечивает желаемые характеристики состава. Таким образом, в одном варианте осуществления перфорированные микроструктуры могут обладать приближенно сферической формой, такие как полые, высушенные распылительной сушкой суспендирующие микросферы. Однако также могут быть пригодными сплющенные, рифленые, деформированные или имеющие трещины материалы в виде частиц с любой преобладающей формой или отношением размеров.
Как является справедливым для суспендирующих частиц, описанных в настоящем документе, перфорированные микроструктуры могут быть образованы из любого биосовместимого материала, который по существу не деградирует или не растворяется в выбранной суспензионной среде. Хотя можно использовать широкое множество материалов для формирования частиц, в некоторых вариантах осуществления структурная матрица ассоциирована с или включает поверхностно-активное вещество, такое как фосфолипид или фторированное поверхностно-активное вещество. Хотя это и не требуется, включение совместимого поверхностно-активного вещества в перфорированную микроструктуру или, более часто, суспендирующие частицы, может повысить стабильность респираторных дисперсий, увеличить отложение в легких и упростить получение суспензии.
Термин "суспензионная среда", как используют в настоящем документе, относится к веществу, обеспечивающему непрерывную фазу, в которой частицы активного вещества и суспендирующие частицы могут быть диспергированы с образованием косуспензионного состава. Суспензионная среда, используемая в косуспензионных составах, описанных в настоящем документе, включает пропеллент.
Как используют в настоящем документе, термин "пропеллент" относится к одному или нескольким фармакологически инертным веществам, которые обеспечивают достаточно высокое давление пара при нормальной комнатной температуре для продвижения лекарственного средства из емкости MDI к пациенту при приведении в действие отмеряющего клапана MDI. Таким образом, термин "пропеллент" относится как к единичному пропелленту, так и к комбинации двух или более различных пропеллентов, образующих "пропеллентную систему".
Термин "пригодный для вдыхания", главным образом, относится к частицам, агрегатам, каплям и т.д., имеющим такой размер, чтобы они могли ингалироваться и достигать дыхательных путей легкого.
При использовании в отношении косуспензионных композиций, описанных в настоящем документе, термины "физическая стабильность" и "физически стабильный" относятся к композиции, которая является устойчивой к одному или нескольким из агрегации, оседания в виде хлопьев и изменений размера частиц вследствие опосредуемого раствором преобразования и способна по существу сохранять MMAD суспендирующих частиц и дозу тонких частиц. В одном варианте осуществления физическую стабильность можно оценивать, подвергая композиции условиям ускоренной деградации, таких как циклическое изменение температуры, как описано в настоящем документе.
При указании на активные вещества термин "сильнодействующий" указывает на активные вещества, которые являются терапевтически эффективными при дозах или ниже доз, находящихся в диапазонах от приблизительно 0,01 мг/кг до приблизительно 1 мг/кг. Типичные дозы сильнодействующих активных веществ, как правило, находятся в диапазоне от приблизительно 100 мкг до приблизительно 100 мг.
При указании на активные вещества термин "высоко сильнодействующий" указывает на активные вещества, которые являются терапевтически эффективными при дозе или ниже дозы приблизительно 10 мкг/кг. Типичные дозы высоко сильнодействующих активных веществ, как правило, находятся в диапазоне вплоть до приблизительно 100 мкг.
Термины "стабильность суспензии" и "стабильная суспензия" относятся к суспензионным составам, способным сохранять свойства косуспензии частиц активного вещества и суспендирующих частиц в течение периода времени. В одном варианте осуществления стабильность суспензии можно измерять по единообразию доставляемой дозы, достигаемому с помощью косуспензионных композиций, описанных в настоящем документе.
Термин "по существу нерастворимый" означает, что композиция является либо полностью нерастворимой в конкретном растворителе, либо слаборастворима в этом конкретном растворителе. Термин "по существу нерастворимый" означает, что конкретное растворимое вещество обладает растворимостью менее одной части на 100 частей растворителя. Термин "по существу нерастворимый" включает определения "слаборастворимый" (от 100 до 1000 частей растворителя на 1 часть растворенного вещества), "очень слаборастворимый" (от 1000 до 10000 частей растворителя на 1 часть растворенного вещества) и "практически нерастворимый" (более 10000 частей растворителя на 1 часть растворенного вещества) как приведено в таблице 16-1 в Remington: The Science and Practice of Pharmacy, 21 st ed. Lippincott, Williams & Wilkins, 2006, p. 212.
Термин "поверхностно-активное вещество", как используют в настоящем документе, относится к любому веществу, которое предпочтительно адсорбируется на поверхности контакта между двумя несмешивающимися фазами, такой как поверхность контакта между водой и раствором органического полимера, поверхность контакта вода/воздух или поверхность контакта органический растворитель/воздух. Поверхностно-активные вещества, как правило, обладают гидрофильной частью и липофильной частью, так что при адсорбции к микрочастицам они имеют тенденцию к предоставлению непрерывной фазе групп, которые не привлекают частицы со сходным покрытием, таким образом, снижая агломерацию частиц. В некоторых вариантах осуществления поверхностно-активные вещества также могут обеспечивать адсорбцию лекарственного средства и увеличивать биодоступность лекарственного средства.
"Терапевтически эффективное количество" представляет собой количество соединения, которое обеспечивает терапевтический эффект путем ингибирования заболевания или нарушения у пациента или путем профилактического ингибирования или предупреждения возникновения заболевания или нарушения. Терапевтически эффективное количество может представлять собой количество, которое смягчает в некоторой степени один или несколько си