Способ коррекции патологических состояний кожи человека, связанных со старением
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа коррекции патологических состояний кожи человека, связанных со старением, включающего использование аутогенных фибробластов пациента с дальнейшим введением их пациенту, где производят отбор материала и выращивание клеток с последующим выделением культуры фибробластов пациента, производят генетические исследования культуры фибробластов путем определения последовательности ДНК и активности генов, выбранных из группы, включающей TGFB1, TGFBR2, COL1A1, COL1A2, SOD1, SOD2, GPX1, GPX3, CLCA2, после чего производят сопоставительный анализ полученных результатов с нормальными последовательностями ДНК и данными нормального уровня экспрессии соответствующих генов, создают генетические конструкции, содержащие кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения, и внедряют эти генетические конструкции в культуру фибробластов пациента, затем вводят пациенту эти модифицированные аутогенные фибробласты. Изобретение обеспечивает уменьшение клинических признаков старения кожи, сопровождающееся положительной динамикой функциональных параметров кожи. 7 з.п. ф-лы, 16 пр., 13 ил., 20 табл.
Реферат
Область, к которой относится изобретение
Изобретение относится к медицине и может быть использовано для лечения и омоложения кожи человека.
Предшествующий уровень
Старение кожи - биологический процесс, включающий в себя как структурные, так и функциональные изменения. К структурным изменениям относятся уменьшение количества коллагена, истончение подкожного жирового слоя, к функциональным - потеря эластичности и стимуляция меланогенеза.
Существует несколько причин, вызывающих эти процессы:
накопление токсических метаболитов, повышенный уровень образования свободных радикалов, оксидативное повреждение (Dermatoendocrinology 2012, 4(3), 227-231). Одна из основных причин - накопление мутаций в геноме - как точечных, так и хромосомных. (Tokai J Exp Clin Med 2010, 35(4) 152-164; Exp Dermatol 2001, 10(4) 272-279; Exp Dermatol 2004, 13(11), 691-699). Вообще, накопление соматических мутаций - как точечных, так и делеций и транслокаций участков хромосом - одна из причин старения организма в целом (Mutat. Res. 1995, 338 (1-6), 25-34; Trends Genet. 2008, 24(2) 77-85).
Применяются различные подходы к коррекции возрастных изменений кожи.
Известны способы коррекции возрастных изменений кожи (Facial Plastic Surgery 1999, 1(3), 165-170; Dermatol Surg 2007, 33(3) 263-268; Cell Transpl 2008, 17(7) 775-783; Вестник эстетической медицины 2011, 10(2), 16-26; Патент РФ №2382077), заключающиеся во введении в область лечения суспензии фибробластов, как правило, аутогенных, чтобы не вызвать иммунного ответа организма пациента. Основной принцип этих методик - внести в организм популяцию фибробластов, способных выполнять свою специализированную функцию по синтезу коллагена и гликозаминогликанов и усиливать ее за счет восполнения количества клеток. При этом фибробласты вводят вместе с культуральной жидкостью, содержащей различные стимулирующие факторы, активируя тем самым процесс пролиферации собственных фибробластов пациента, а также синтез структурных компонентов кожи.
Данный метод эффективен только в том случае, если фибробласты пациента не имеют генетических дефектов, и потеря фибробластов или снижение их активности вызваны только внешним воздействием.
Известно также решение по патенту РФ №2320720 ″Способ культивирования фибробластов для заместительной терапии″, включающий выделение клеток и их инкубирование в питательной среде. При этом выделение фибробластов осуществляют из биоптатов кожи человека путем ферментативной обработки в растворе DMEM / 5% ЭБС / 0,2% диспазы /0,1 мг/мл коллагеназы I типа при постоянном помешивании и пипетировании при температуре 37°C в течение 1,5 ч в стерильных условиях, а полученную суспензию клеток центрифугируют 5 мин при 200g, супернатант сливают, осевшие клетки ресуспендируют в среде DMEM / 10% ЭБС / 100 ед/мл пенициллина, 100 ед/мл стрептомицина, 100 ед/мл фунгизона и высевают на чашки, затем фибробласты переводят на длительное культивирование в среде с собственной сывороткой крови пациента: DMEM / 10% ССКП / 100 ед/мл стрептомицина, 100 ед/мл фунгизона или в терапевтической среде AIM-V. Перед введением пациентам клетки несколько раз отмывают в буфере Krebs-Ring, обрабатывают раствором, содержащим 0,25% трипсина / 0,02% ЭДТА, для снятия клеток с подложки, добавляют 1 мл Krebs-Ringer, центрифугируют 5 мин при 200g, супернатант сливают, клетки ресуспендируют в новой порции раствора Krebs-Ringer для введения пациентам. Культивированные фибробласты дополнительно обрабатывают добавлением rhTGF-β1 в концентрации 5 нг/мл в среду культивирования для увеличения количества миофибробластов. Полученную суспензию вводят с помощью инъекции.
Однако данный метод, как и описанные ранее, эффективен только в том случае, если фибробласты не имеют генетических дефектов, и потеря фибробластов или снижение их активности вызваны только внешним воздействием.
Известно также решение по патенту WO 2004048557 A, в котором с целью терапии дефектов кожи, в том числе вызванных старением, предлагается вводить суспензию аутологичных фибробластов, содержащую биологические вещества, которые могут быть активаторами фибробластов. Аналогичная методика описана в патенте US 5660850
Известно также решение по патенту РФ №2373941 ″Способ коррекции возрастных и патологических изменений кожных покровов человека″. По данному патенту способ включает использование аутогенных фибробластов с добавлением гиалуроновой кислоты, при этом аутогенные фибробласты вводят в область лечения или омоложения кожи в физиологическом растворе, а кожный покров предварительно обрабатывают ростовой средой фибробластов с биологически активными веществами - факторами ростовой среды, включающими в т.ч. факторы роста фибробластов. Для этого готовят 0,5 мл суспензии, содержащей 1 млн фибробластов в физиологическом растворе с добавлением 0,5 мл раствора гиалуроновой кислоты в концентрации 0,02-0,1%, суспензию перемешивают и по 0,1-0,2 мл вводят шприцем в область омоложения или лечения. В составе геля используют либо бессывороточную ростовую среду, в которой содержались фибробласты в течение 14-28 часов, с содержанием БАВ 49%, гиалуроновой кислоты или гиалуроната натрия 0,5-1,5%, глицерина 49,5-48,5%, ароматизатора 0-0,5%, либо используют ростовую среду, в которой содержались фибробласты в течение 14-28 дней с сывороткой, с содержанием БАВ 49%, гиалуроновой кислоты или гиалуроната натрия 0,5-1,5%, глицерина 49,5-48,5%, ароматизатора 0-0,5%. При этом факторы ростовой среды перед употреблением концентрируют с использованием известных методик либо подвергают лиофилизации. Факторы ростовой среды добавляют в гель в объеме 0,5-3%, гель также состоит из глицерина 70%, коллагена крупного рогатого скота 1,5%, гиалуроновой кислоты 1,5%, необходимого количества очищенной воды до 100%.
Однако данный метод, как и описанные ранее, эффективен только в том случае, если фибробласты не имеют генетических дефектов, и потеря фибробластов или снижение их активности вызваны только внешним воздействием.
В случае же если нехватка структурных компонентов кожи и/или функциональные изменения вызваны нарушением экспрессии гена или наличием в структуре гена мутаций, изменяющих активность или функцию белка, кодируемого этим геном, это решение малоэффективно, т.к. недостаточно просто восполнить количество клеток, необходимо также компенсировать имеющийся в них дефект. Генетические дефекты в прототипе не исследовались, фибробласты использовались аутогенные с использованием гиалуроновой кислоты.
Раскрытие изобретения
Задачей данного изобретения является создание способа коррекции патологических состояний кожи человека, связанных со старением, при котором будут учтены генетические дефекты, а также нарушения экспрессии генов, если они имеют место, или наличие в структуре генов мутаций, изменяющих активность или функцию белков, кодируемых этими генами.
Решение направлено не просто на восполнение количества клеток, но также на компенсацию имеющихся в них генетических дефектов.
Задача решается за счет того, что в способе коррекции патологических состояний кожи человека, связанных со старением, включающем использование собственных фибробластов пациента с дальнейшим введением их пациенту, предварительно проводят оценку кожных покровов пациента, затем производят отбор материала и выращивание клеток с последующим выделением культуры фибробластов пациента, после чего полученный клеточный материал разделяют - первую часть культуры фибробластов направляют на исследования, а вторую часть культуры фибробластов сохраняют, затем производят анализ культуры фибробластов путем определения последовательности ДНК и активности генов, после чего производят сопоставительный анализ полученных результатов с данными групп нормы и выявляют отклонения в геноме фибробластов, на основании полученных данных генетического исследования делают вывод о связи выявленных отклонений в структуре и/или функции гена с изменениями кожи пациента, после чего производят действия, позволяющие компенсировать эти отклонения, а именно, создают генетические конструкции, содержащие кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения, с обеспечением структуры и функции указанных генов как нормальных генов, внедряют эти генетические конструкции в культуру фибробластов пациента, затем вводят пациенту аутогенные фибробласты, модифицированные генетическими конструкциями, содержащими кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения. Трансфекцию созданных генетических конструкций, содержащих кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения, в культуру клеток пациента осуществляют с помощью вирусного или невирусного вектора, или иным не описанным известным способом, являющимся очевидным для специалиста любого уровня. При этом оценку кожных покровов проводят путем функциональной диагностики с применением измерительных приборов, дающих возможность получить количественные параметры, характеризующие состояние кожи пациента. Отбор материала производят в зоне, защищенной от ультрафиолета. При сопоставительном анализе полученных результатов с данными групп нормы для выявления отклонения в геноме фибробластов за норму принимают последовательности генов, приведенные в базе данных GenBank, а также данные по экспрессии гена в базе данных UniGene.
Реализация изобретения
Реализацию изобретения осуществляют путем следующих действий:
1. Проводят функциональную диагностику кожи пациента, применяя измерительные приборы, дающие возможность получить количественные параметры, характеризующие состояние кожи пациента.
2. Производят отбор биопсийного материала в зоне, защищенной от ультрафиолета, например за ухом;
3. Производят выращивание клеток и выделение культуры фибробластов пациента;
4. Разделяют полученный клеточный материал фибробластов: 1-ю часть направляют на исследования, 2-ю часть сохраняют для последующей модификации и введения пациенту;
5. Производят анализ первичной культуры фибробластов путем определения последовательности ДНК генов и активности этих генов.
5а) анализируют последовательность ДНК этих генов, например, методом секвенирования, с целью выявления мутаций, т.е. определяют, соответствует ли ДНК норме.
5б) анализируют экспрессию генов путем измерения относительного количества специфической мРНК, т.е. определяют активность генов.
6. Производят сопоставительный анализ полученных результатов с данными групп нормы, при этом за норму принимают последовательности генов, приведенные в базе данных GenBank, a также данные по экспрессии гена в базе данных UniGene.
7. На основании полученных данных генетического исследования делают вывод о связи выявленных отклонений с изменениями кожи пациента.
8. Производят действия, позволяющие компенсировать эти отклонения:
8.1. Создают генетические конструкции, содержащие кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения, с обеспечением структуры и функции указанных генов как нормальных генов;
8.2. Внедряют эти генетические конструкции в культуру фибробластов пациента.
Для внедрения кДНК в клетки генетическую конструкцию используют в комплексе с дендримерными макромолекулами или в комплексе с липосомами, или в комплексе с амфифильными блок-сополимерами, что не исключает других методов трансфекции генетической конструкции в культуру фибробластов пациента.
9. Возвращают в организм пациента клеточную культуру модифицированных аутогенных фибробластов, несущую генетическую конструкцию.
При этом вводят пациенту аутогенные фибробласты, модифицированные генетическими конструкциями, содержащими кДНК тех генов, активность которых у пациента изменена или в структуре ДНК которых у пациента имеются отклонения.
10. Исследуют параметры кожи пациента после введения ему модифицированных аутогенных фибробластов, несущих созданную генетическую конструкцию.
Перечень фигур
На фиг. 1
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения аутогенных фибробластов у пациента 1А:
представлена кривая параорбитальной зоны,
щечной зоны,
околощечной зоны.
На фиг. 2
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения аутогенных фибробластов у пациента 2А:
представлена кривая параорбитальной зоны,
щечной зоны,
околощечной зоны.
На фиг. 3
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения аутогенных фибробластов у пациента 3А:
представлена кривая параорбитальной зоны,
щечной зоны,
околощечной зоны.
На фиг. 4
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения аутогенных фибробластов у пациента 4А:
представлена кривая параорбитальной зоны;
щечной зоны;
околощечной зоны.
На фиг. 5
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения модифицированных аутогенных фибробластов у пациента 1Б:
представлена кривая параорбитальной зоны;
щечной зоны;
околощечной зоны.
На фиг. 6
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения модифицированных аутогенных фибробластов у пациента 2Б;
представлена кривая параорбитальной зоны;
щечной зоны;
околощечной зоны.
На фиг. 7
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения модифицированных аутогенных фибробластов у пациента 3Б:
представлена кривая параорбитальной зоны;
щечной зоны;
околощечной зоны.
На фиг. 8
Представлено относительное уменьшение морщин (в процентах) в зависимости от времени после введения модифицированных аутогенных фибробластов у пациента 4Б:
представлена кривая параорбитальной зоны;
щечной зоны;
околощечной зоны.
В ходе старения кожи, в первую очередь, под воздействием ультрафиолетовых лучей и/или активных форм кислорода, происходит снижение активности TGF-β-зависимого сигнального пути либо за счет уменьшения количества рецепторов II типа для TGF-β (TβRII), либо за счет снижения активности гена TGFB1. Данное нарушение приводит к снижению экспрессии фактора роста соединительной ткани (CTGF) и коллагена I типа (COL1A1 и COL1A2), которые регулируются TGF-β. Увеличение количества рецепторов TGFβRII и уровня белка TGF-β восстанавливает TGF-β сигнализацию и приводит к возрастанию экспрессии CTGF и коллагена I типа (Age (Dordr) 2014 Feb 20; Am. J. Pathol. 2004, 165(3) 741-751).
Еще один эффект, имеющий место при старении, - снижение уровня супероксиддисмутазы (SOD1 и SOD2) и глутатионпероксидазы (GPX1 и, GPX3), которые защищают кожные фибробласты (и другие клетки) от воздействия ультрафиолета и активных форм кислорода (Aging (Albany NY) 2012, 4(1), 3-12; J Gerontol A Biol Sci Med Sci. 2009, 64, 1114-1125).
Также значительное снижение экспрессии CLCA2 влияет на процессы старения кожи (Br. J. Dermatol. 2014 Apr.4).
Исходя из этого при проведении исследований с целью реализации заявленного способа были выбраны следующие гены:
TGFB1 - бета-1-трансформирующий фактор роста,
TGFBR2 - бета-II-рецептор трансформирующего фактора роста,
COL1A1 - альфа-1-коллаген 1 типа,
COL1A2 - альфа-2-коллаген 1 типа,
SOD1 - растворимая супероксиддисмутаза-1,
SOD2 - растворимая супероксиддисмутаза-2,
GPX1 - глютатион-пероксидаза-1,
GPX3 - глютатион-пероксидаза-3,
CLCA2 - вспомогательный белок-2 канала для ионов хлора
Специалисту любого уровня понятно, что гены для исследования и соответствующей дальнейшей возможной модификации, приведенные в данных примерах, не ограничивают использование заявленного способа для остальных известных генов. Данные гены были выбраны для доказывания заявленного способа, как наиболее подверженные изменениям при старении кожи.
Данное изобретение подтверждается примерами:
Пример 1
Задача данного примера заключается в проведении функциональной диагностики кожи большого количества пациентов с целью подбора для дальнейших исследований 4 пар пациентов, причем в каждой паре должны быть пациенты одного пола, близкие по возрасту с одинаковым типом старения кожи, с выявленным снижением экспрессии одного и того же гена у какой либо из пар, либо с одним и тем же мутантным вариантом гена. Такой подбор осуществляется для того, чтобы одному из представителей пары вводить культуру аутологичных фибробластов без генетических модификаций - контрольная группа, второму же пациенту из пары вводить фибробласты, модифицированные генетическими конструкциями согласно заявленному изобретению.
Выбирали 200 пациентов-добровольцев обоих полов в возрасте от 38 до 67 лет. Производили функциональную диагностику кожи пациента, с применением измерительных приборов, дающих возможность получить количественные параметры, характеризующие состояние кожи пациента.
Брали биопсийные пробы кожи. Отбор материала производили в области, не подвергающейся действию ультрафиолета, находящейся за ухом, с использованием устройства для взятия биопсии кожи Epitheasy 3.5 (Medax SRL). Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца был не менее 3 мм. Затем биоптат использовали для получения первичной культуры фибробластов пациента. Для этого биоптат помещали в стерильную чашку Петри, промывали средой DMEM и инкубировали в 0,25% растворе трипсина при комнатной температуре 30 минут. После этого отделяли дерму от эпидермиса и измельчали дерму с помощью хирургических ножниц на 3-4 фрагмента. Затем удаляли среду и подсушивали кусочки биоптата на воздухе 15 минут для лучшего прикрепления. Потом добавляли к биоптату среду DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл и помещали чашку в инкубатор.
Выращивание клеток осуществляли при +37°C в атомосфере, содержащей 5% CO2.
За ростом клеток следили по образованию ″гало″ вокруг кусочков биоптата. После того, как клетки покрывали 75% поверхности, опять производили трипсинизацию, добавляя 1 мл 0,25% раствора трипсина в культуральной среде. После отделения клеток (2-3 минуты инкубации при комнатной температуре) добавляли 3 мл культуральной среды и осторожно ресуспендировали. Часть суспензии использовали для иммуногистохимического анализа. Для этого монослой фибробластов, выращенный на стеклянной пластинке, промывали буфером PBS, фиксировали в 4% формальдегиде и обрабатывали моноклональными антителами к коллагену-4 и к филаггрину, а также поликлональными антителами к коллагену-1 и коллагену-3. Окрашивание препаратов проводили с помощью стрептавидин-биотин-пероксидазной системы с визуализацией диаминобензидином.
Остальную суспензию растили 5 дней в инкубаторе при +37°C в атомосфере, содержащей 5% CO2. Трипсинизацию и пересев производили каждые 5 дней.
Для длительного хранения 2 мл суспензии после трипсинизации центрифугировали 5 минут при 700 об/мин, клеточный осадок отмывали средой без кальция и магния, центрифугировали еще раз и ресуспендировали осадок в среде, состоящей из 30% DMEM, 10% фетальной сыворотки и 10% ДМСО. Суспензию хранили при температуре минус 150°C.
Одну часть культуры фибробластов направили на исследования, включающие выделение РНК и ДНК с их последующим анализом. Вторую часть сохранили для последующего введения пациентам; также эту часть фибробластов использовали для генетического модифицирования перед введением пациентам, согласно заявленному изобретению.
Выделение РНК производили с целью анализа уровня экспрессии следующих генов: TGFB1, TGFBR2, COL1A1, COL1A2, SOD1, SOD2, GPX1, GPX3 и CLCA2.
РНК выделяли из суспензии, содержащей не менее 106 клеток. Для выделения РНК использовали набор RNeasy Mini Kit (Qiagen). Выделенную РНК анализировали спектрофотометрически, измеряя соотношение оптической плотности при 260 и 280 нм, а также с помощью капиллярного электрофореза на приборе QlAxcel (Qiagen), используя картридж RNA Qiality Control. Для дальнейшей работы использовали только те образцы, для которых общее количество выделенной РНК было не менее 50 мкг РНК, соотношение D260: D280 - не менее 1,8, а соотношение полос 28S: 18S на капиллярном электрофорезе - не ниже 1:1. Синтез суммарной кДНК проводили, используя обратную транскриптазу RevertAid (Fermentas), согласно рекомендациям изготовителя. 1-2 мкг суммарной РНК использовали в качестве матрицы для синтеза первой цепи кДНК. В реакционную смесь для проведения обратной транскрипции вносили 100-200 ЕД обратной транскриптазы и 10 пмоль случайного 9-нуклеотидного праймера.
Анализ уровня экспрессии генов проводили по общеизвестной методике, описанной, например, в [Analytical Biochemistry 2001, 295 (1), 17-21] и в [Nucleic Acids Research 1993, 21(4), 993-998]. В состав амплификационной смеси (объем 40 мкл) внесли 50 нг суммарной кДНК первой цепи, 0,5 мкМ каждого праймера, 250 мкМ каждого дезоксинуклеотидтрифосфата, 10 мМ Трис-HCl pH 9, 50 мМ NH4Cl, 1,5 мМ MgCl2 и 1 ЕД Taq-полимеразы (Fermentas). Амплификацию проводили с помощью амплификатора MasterCycler Gradient (Eppendorf). Применили следующие условия амплификации: первоначальная денатурация при +94°C в течение 3 минут, затем от 25 до 33 циклов, включающих денатурацию при +94°C в течение 30 секунд, отжиг праймеров при +57°C в течение 30 секунд и элонгацию при +72°C в течение 1 минуты. По окончании циклов проводили завершающую элонгацию при +72°C в течение 5 минут.
В качестве контроля при оценке активности этих генов использовали конститутивные гены, уровень экспрессии которых в фибробластах сопоставим с таковым у исследуемых генов в норме. Данные об экспрессии генов в норме взяли из базы данных UniGene (www.ncbi.nlm.nih.gov/UniGene).
Уровень экспрессии генов TGFB1, SOD2 и CLCA2 сравнивали с таковым гена ТРМТ;
уровень экспрессии гена TGFBR2 - с PRKAG;
уровень экспрессии гена COL1A1 - с PGK1;
уровень экспрессии гена COL1A2 - с UQCRC1;
уровень экспрессии гена SOD1 и GPX1 - с HADHA;
уровень экспрессии гена GPX3 - с SGSH;
Анализ продуктов амплификации проводили путем капиллярного электрофореза с помощью установки для капиллярного электрофореза QlAxcel (Qiagen). Использовали картридж DNA High Resolution, позволяющий определить длину продуктов амплификации с точностью до 3 пар нуклеотидов. Использовали маркер - QX DNA Size Marker 50 bp -1.5 kb (Qiagen). Анализ геля с целью определения длины и концентрации продуктов амплификации проводили с помощью программного обеспечения BioCalculator Software v 2.0 (Qiagen).
Выделение ДНК производили с целью выявления мутаций, влияющих на активность гена и/или активность белка, кодируемого этим геном. Анализ первичной структуры ДНК производили методом пиросеквенирования. Анализировали те мутации, функциональное значение которых описано в литературных источниках.
ДНК для генотипирования выделяли с помощью набора QlAamp DNA Mini Kit (Qiagen), согласно прилагаемой к набору инструкции, используя методику выделения ДНК из культуры клеток. Концентрацию ДНК определяли спектрофотометрически, анализируя спектр оптической плотности от 320 до 240 нм.
Для генотипирования области ДНК, содержащие анализируемые мутации, амплифицировали со специфических ПЦР-праймеров. Для амплификации использовали набор GenePak PCR Core (производитель ООО ″Лаборатория Изоген″, РФ), согласно прилагаемой к набору инструкции. В амплификационную смесь добавляли 50 нг ДНК и 1 мкМ каждого праймера. Применили следующие условия амплификации: первоначальная денатурация при +94°C в течение 3 минут, затем 37 циклов, включающих денатурацию при +94°C в течение 30 секунд, отжиг праймеров при +55°C в течение 30 секунд и элонгацию при +72°C в течение 1 минуты. По окончании циклов провели завершающую элонгацию при +72°C в течение 3 минут.
Анализ продуктов амплификации с целью выявления мутаций проводили путем пиросеквенирования на приборе PyroMark Q96ID (Qiagen).
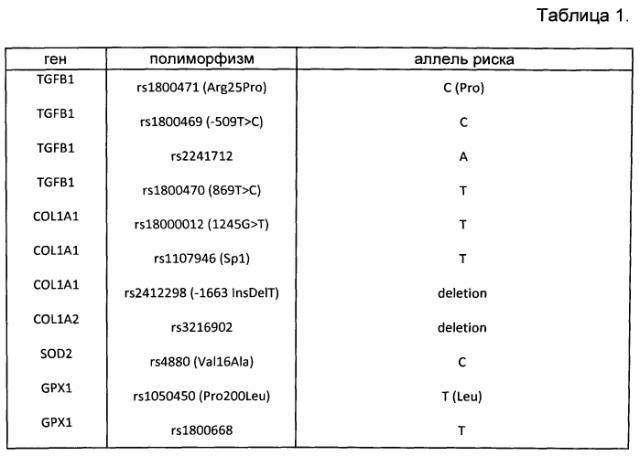
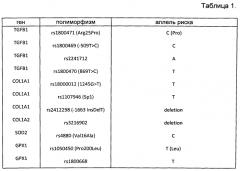
Список анализируемых полиморфизмов ДНК представлен в таблице 1.
На основании полученных данных отобрали 4 пары пациентов. В каждой паре - пациенты одного пола, близкие по возрасту (разница не более 4 лет), с одинаковым типом старения кожи. У пациентов, входящих в одну пару, выявили снижение экспрессии одного и того же гена, выраженное в сходной степени. Также в одну из пар включили пациентов с одним и тем же мутантным вариантом гена TGFB1 [вариант С (Pro) в области полиморфизма rs1800471 (G/C; Arg25Pro)].
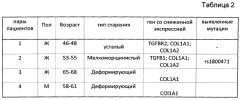
Сведения о парах, отобранных по описанному ранее принципу, представлены в таблице 2.
Пример 2
Одному из пациентов из каждой пары вводили культуру аутогенных фибробластов без генетических модификаций (этих пациентов обозначили буквой А). Для этого вторую (сохраненную) часть клеточной культуры еще раз центрифугировали при 700 об/мин, дважды отмывали клетки физиологическим раствором, ресуспендировали в физиологическом растворе из расчета 5 млн клеток в 1 мл и использовали для введения одному пациенту из каждой пары, обозначенному буквой А, по изложенной ниже методике. Аналогичная методика описана в Вестнике эстетической медицины, 2011, 10(2), 16-26). Суспензию клеток в физиологическом растворе вводили, например, туннельным методом иглами 30G длиной 13 мм на глубину 3 мм в область морщин кожи лица. Общая однократная доза не превышала 15 млн клеток (3 мл суспензии). Суспензию фибробластов вводили 3 раза - через 4 и 8 недель после первого введения. Топографические особенности поверхности кожи пациентов до начала всех процедур, на 4 и 8 неделе перед инъекцией, а также через 12 недель после первой инъекции фибробластов обследовали с помощью метода лазерной профилометрии PRIMOS (Phase (shift) Rapid In Vivo Measurement Of Skin) с разрешением 0,004 мм. Также производили расчет клинического индекса старения лица и шеи CAI по 11 признакам (Clinical Aging Index, R. Bazin):
Основные признаки старения:
морщины лба, носогубная складка, глубина ″гусиных лапок″, количество ″гусиных лапок″, морщины уголков рта, морщины верхней губы, мешки под глазами, морщины под глазами, морщины межбровья, птоз нижней части лица, круговые складки шеи.
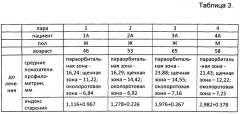
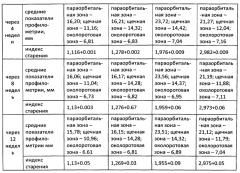
Результаты профилометрии и расчета индекса старения для пациентов группы А приведены в таблице 3.
Относительное уменьшение морщин у пациентов 1А, 2А, 3А, 4А после введения аутологичных фибробластов представлены на фигурах 1-4.
В таблице 4 приведены данные оценки параметров кожи лица, полученные при опросе и осмотре пациентов.
Все пациенты субъективно ощущали повышение общего тонуса и работоспособности после первой инъекции. В течение 2 суток после первого введения фибробластов у пациентов наблюдали явления субфебрилитета без присоединения инфекционных заболеваний.
Из данных, приведенных в таблице 3, следует, что введение аутологичных фибробластов без каких-либо дополнительных модификаций не привело к объективным значимым изменениям кожи лица, выявляемым с помощью индекса старения и профилометрии.
Пример 3
Каждому второму пациенту из каждой пары (в дальнейшем данных пациентов обозначали буквой Б) вводили аутогенные фибробласты, модифицированные генетическими конструкциями, содержащими кДНК того гена, активность которого изменена, или в первичной структуре ДНК которого имеются отклонения.
Описание общей последовательности действий для пациентов группы Б.
На основании полученных данных генетического исследования делали вывод о связи выявленных отклонений в структуре и/или функции генов с изменениями кожи пациента;
Производили действия, позволяющие компенсировать эти отклонения: синтезировали кДНК этих генов и помещали эти кДНК в векторную конструкцию для последующей трансфекции в клетки.
В данном изобретении использовали метод коррекции генетических нарушений, при котором вносимая в фибробласты генетическая информация не включается в геном клетки.
Для эффективной экспрессии ген-мишень помещали в векторную конструкцию, в которой он будет находиться под контролем регуляторных элементов, работающих независимо от ядерного аппарата (Int J Pharm 2001, 229, 1-21; Hum Gene Ther 1997, 8, 1763-1772; Anesth. Analg. 2001, 92, 19-25; Journal of Gene Medicine 2001, 3, 384-393; Human Gene Therapy 2000, 11, 2253-2259; Human Gene Therapy 1996, 7, 1205-1217). Время жизни таких конструкций в клетке может измеряться неделями, но эффект оказывается выраженным и продолжительным.
Для внесения в клетку полученных конструкций использовали метод, не требующий дополнительного участия вирусных частиц. В одном случае применяли вспомогательные молекулы, называемые дендримерами [Chem. Rev. 2009, 109, 3141-3157; Mol. Pharmaceutics 2012, 9, 341; PNAS 1996, 93, 4897-4902; US 20120045430; ЕР 2543659 А1]. Дендример - это макромолекула, обладающая ветвистой структурой и несущая на поверхности заряженные группы, облегчающие ее проникновение через клеточную мембрану. ДНК образует комплекс с макромолекулой, комплекс проходит через цитоплазматическую мембрану клетки, и генетическая конструкция оказывается в цитоплазме. Эффективность использования комплекса дендримера с генетической конструкцией, не требующей встраивания в геном, сопоставима с широко распространенным методом трансфекции, при котором вносимая генетическая информация встраивается в геном клетки. Как правило, это метод требует использования векторных конструкций на основе вирусов - аденовируса, аденоассоциированного вируса или ретровируса (Lancet 2007, 369(9579), 2097-2105; Science 2000, 288(5466), 669-672; Cancer Gene Ther 2007, 14, 599-615; US 6461606 B1). Методика с использованием вирусных конструкций может обладать потенциальной биологической опасностью, поскольку она требует наличия вирусных белков, что может, в частности, вызвать иммунный ответ (Асе Chem Res 1993, 26, 274-278; Curr Opin Biotechnol 1993, 4, 705-710; Science 2000, 286, 2244-2245). Однако не исключено использование вирусных конструкций для реализации данного изобретения. Вместо дендримеров для экспериментов также использовали липосомы - макромолекулярные фосфолипидные комплексы, образующиеся в водных растворах и способные взаимодействовать с макромолекулами (например, нуклеиновыми кислотами) и транспортировать их в клетку (подобный метод описан в Gene Therapy, 5(3), 380-387 (1998)). Также для внесения генетических конструкций в клетку использовали амфифильные блок-сополимеры, включающие в себя гидрофильный и гидрофобный полимерные блоки, также способные взаимодействовать с макромолекулами (например, нуклеиновыми кислотами) и транспортировать их в клетку (Клеточная трансплантология и тканевая инженерия, 2012, 7(3), 101-104; Int J Pharm, 2012, 427, 80-87).
Созданную генетическую конструкцию внедряли в клетки пациента, например, путем введения комплекса генного материала с дендримерными макромолекулами, липосомами или амфифильными блок-сополимерами или иным не описанным известным способом, являющийся очевидным для специалиста любого уровня.
Для внесения в клетку полученных конструкций в данных исследованиях использовали метод, не требующий дополнительного участия вирусных частиц. В одном случае применяли полиамидоаминные дендримеры (Sigma-Aldrich). Для повышения стабильности водородный водного раствора дендримера доводили до pH 7,4. Плазмидную конструкцию также растворяли в деионизованной воде и инкубировали в течение 30 минут с раствором дендримера в массовом соотношении плазмида: дендример, равном 1:2. Эффективность связывания дендримера с плазмидой оценивали по замедлению миграции комплекса ДНК-дендример в 1% агарозном геле. Затем к клеткам добавляли раствор, содержащий 5-10 мкг комплекса ДНК-дендример в среде DMEM с 10% фетальной сывороткой и ампициллином и растили клетки в этой среде 72 часа.
Также для доставки плазмиды в клетки использовали структуры, назваемые липосомами. В этом случае применяли липид-растворимый комплекс, состоящий из катионного липида и бета-циклодекстрина. Применялась известная методика, описанная в (Gene Therapy, 5(3), 380-387 (1998)) с некоторыми изменениями. Холестерол, растворенный в метил-бета-циклодекстрине, смешивали с катионным липидом DOTAP (N-[1-(2,3-Диолеоилокси)]-N,N,N-триметиламмоний пропан) в соотношении 2:1, доводили pH до 8,0 20 мМ буфером HEPES и инкубировали при комнатной температуре 15 минут (все реактивы - Sigma-Aldrich). Затем к смеси добавляли раствор ДНК в деионизованной воде, конечное соотношение масс ДНК: DOTAP: холестерол составляло 1:2:4, и инкубировали при комнатной температуре 30 минут. Смесь для трансфекции (конечный объем 150 мкл) добавляли к суспензии клеток в 1 мл культуральной среды DMEM с 10% фетальной сывороткой и ампициллином и растили клетки в этой среде 72 часа.
Также для доставки плазмиды в клетки использовали амфифильные блок-сополимеры. Применяли известную методику, описанную, например, в (Int J Pharm, 2012, 427, 80-87) или в (Macromol. Biosci. 2011, 11, 652-661), с некоторыми изменениями. Блок-сополимер синтезировали из смеси линейного полиэтиленимина (ПЭИ) (Polyscience Inc., США) и бифункционального полиэтиленгликоля (ПЭГ) N-гидроксисукцинимидил-75-N-(3-малеимидопропионил)-амидо-4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37, 40, 43, 46, 49, 52, 55, 58, 61, 64, 67, 70, 73 - тетракосаоксапента-гептаконтаноата (MAL-dPEG™-NHS ester, Quanta BioDesign, Ltd., США) в боратном буфере. Полиплекс готовили за 1 час до введения в клетки, смешивая раствор блок-сополимера с ДНК. Смесь для трансфекции добавляли к суспензии клеток в 1 мл культуральной среды DMEM с 10% фетальной сывороткой и ампициллином и растили клетки в этой среде 72 часа.
После чего возвращали клеточную культуру, несущую генетическую конструкцию - модифицированные аутогенные фибробласты - в организм пациента.
Исследовали параметры кожи пациента человека после курса терапии, состоящего из введения пациенту аутологичных фибробластов, несущих созданную генетическую конструкцию.
Исследовали состояние пациентов после введения пациенту аутологичных фибробластов, несущих созданную генетическую конструкцию.
Всем пациентам до введения модифицированных фибробластов проводили оценку дерматологического статуса. Для изучения эффективности проводимого лечения применяли тестирование пациентов с помощью специальных инструментальных методов функциональной диагностики. Тестирование проводили до начала курса лечения, а также через 4, 8 и 12 недель дней после процедуры, и это тестирование включало следующие методики:
1) оптическая профилометрия PRIMOS (Phase (shift) Rapid In Vivo Measurement Of Skin) с разрешением 0,004 мм;
2) расчет клинического индекса старения лица и шеи CAI (согласно атласу R. Bazin) по 11 признакам.
Пример 4
Последовательности действий для пациента 1Б.
Пациент 1Б из 1 пары, женщина, 48 лет. Тип старения - усталый (см. таблицу 2).
При обследовании отмечали: снижение тургора кожи, отечность лица, изменения тонуса мимической мускулатуры лица, выраженность носогубных складок, опущение уголков глаз и губ, создающие впечатление усталости, утомленности.
Клинический индекс старения CAI (атлас R. Bazin) до введения аутологичных фибробластов пациенту составил 1,16+0,967, что свидетельствует о слабой степени выраженности инволюционных изменений.
При анализе активности генов из вышеприведенного списка выявили снижение уровня экспрессии гена TGFBR2 в 2,5 раза по сравнению с ожидаемым (относительно экспрессии контрольного гена PRKAG). Кроме того, выявили снижение уровня экспрессии генов COL1A1 и COL1A2 в 2 и 2,2 раза, соответственно (относительно контрольных генов PGK1 и UQCRC1). При генотипировании выявили только аллели дикого типа. Поскольку уровень белка, кодируемого геном TGFBR2, нарушает сигнализацию при участии TGF-b и тем самым влияет на активность генов COL1A1 и COL1A2, предположили, что сниженный уровень экспрессии генов COL1A1 и COL1A2 является следствием уменьшения экспрессии гена TGFBR2. Поэтому решили трансфицировать культуру фибробластов пациента 1Б генетической конструкцией, содержащей кДНК гена TGFBR2.
Для этого сконструировали плазмиду pAAV-TGFBR2: кДНК, соответствующую белок-кодирующей области гена TGFBR2, поместили в векторную плазмиду pAAV-MCS под контроль промотора CMV [Clin. Med. J. (EngI) 2004, 117(4), 562-565; Gene 1999, 238(2), 397-405]. Затем произвели трансфекцию плазмиды в культуру аутологичных фибробластов пациента. Трансфекцию осуществили с помощью полиамидоаминных дендримеров 5 поколения (РАМАМ-дендримеры с этилендиаминовыми структурами на поверхности, Sigma-Aldrich) [Pharm. Sci. Tecnol. Today 2000, 3(7), 232-245; Nanomedicine 2009, 5(3) 287-297]. После трансфекции культуру фибробластов растили еще 72 часа и затем вводили пациенту суспензию к