Способ разделения органической и минеральной составляющей костной ткани
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к способу разделения органической и минеральной составляющей костной ткани. Способ разделения органической и минеральной составляющей костной ткани, в котором подготавливают пластины губчатой костной ткани, из них получают костный порошок, полученный костный порошок подвергают двукратному экстракционному концентрированию, на первом этапе отбирают среднюю пробу полученного костного порошка и добавляют смесь хлороформ:этиловый спирт, испаряют растворитель и дважды добавляют дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 1 и фильтрат 1, на втором этапе к сухому остатку 1 добавляют хлорид натрия, испаряют растворитель и дважды добавляют дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 2 и фильтрат 2, высушивают и анализируют, при определенных условиях. Вышеописанный способ позволяет отделить водо- и солерастворимые белковые составляющие костного матрикса от минеральной компоненты для их изучения при различных функциональных состояниях костной ткани, а также позволяет повысить степень извлечения белковых соединений костной ткани, что в свою очередь позволяет проводить количественное определение белковых составляющих костной ткани. 2 з.п. ф-лы, 2 табл., 4 ил.
Реферат
Изобретение относится к медицине и неорганической химии, а конкретно к технологии выделения биологических веществ для изучения межклеточного вещества (матрикса) костной ткани человека при различных функциональных состояниях, в том числе при костно-суставных заболеваниях (например, при коксартрозе и остеопорозе).
Более глубокие представления о протекании заболеваний костной системы человека могут быть получены при изучении структурной организации костной ткани на ультра- и микроуровнях, а именно, минеральной и органической составляющих костного матрикса, интенсивности процессов их формирования и резорбции (ремоделирования или реконструкции) (Карякина Е.В., Персова Е.А. Особенности ремоделирования костной ткани при воспалительных и дегенеративных заболеваниях тазобедренного сустава // Саратовский научно-медицинский журнал, 2009, Т.5, №2, С.227-230; Зацепин С.Г. Костная патология взрослых, М.: Медицина, 2001, 640 с.; Некачалов В.В. Патология костей и суставов, СПб.: Сотис, 2000, 288 с., Корнилов А.С., Аврунин А.С. Адаптационные процессы в органах скелета, СПб.: МОРСАР АВ, 2001, 269 с.). Однако проведение таких исследований сопряжено с рядом проблем, которые в первую очередь связаны с многокомпонентным составом и трудностью разделения каждой из указанных компонент. Известно, что минеральная основа костной ткани представлена гидроксилапатитом, другими фосфатами кальция, водой и т.д. Органический матрикс кости на 90% образует полифазный коллаген 1 типа, включающий две фракции, отличающиеся наличием поперечных связей: проколлагена - растворимой в воде, кислотах, солях и колластромина - нерастворимой («нативной» или «зрелой»). Считается, что проколлаген, выделяемый в межклеточное пространство - легкоэкстрагируемый нейтральносолерастворимый («молодой»). В дальнейшем он превращается в нерастворимый коллаген непосредственно или через кислоторастворимую фракцию. Считается, что кислоторастворимый коллаген является побочным продуктом деградации нерастворимого коллагена. В состав органической компоненты межклеточного вещества входят также неколлагеновые белки, липиды, углеводы, кислоты и их комплексы (Слуцкий Л.И. Биохимия нормальной и патологически измененной соединительной ткани, М.: Медицина, 1969, 375 с.; Мухамеджанова Л.Р., Галеев И.М. Изучение фракционного состава коллагена костной ткани альвеолярного отростка у больных генерализованным пародонтом // Успехи современного естествознания, 2003, №8, С.63-64; Касавина Б.С. Торбенко В.П. Жизнь костной ткани, М.: Издательство «Наука», 1979, 176 с.; Ньюман У., Ньюман М. Минеральный обмен кости, М.: Издательство иностранной литературы, 1961, 262 с.).
В настоящее время существующие изобретения, направленные на извлечение органической компонентов из кости при сохранении ее исходной минеральной основы, используют для получения биосовместимых материалов. Известны способы удаления органики путем термического отжига в интервалах температур 250-395°C в течение 3-18 часов (патент РФ №2326680) и 600-1200°C в течение 3-5 мин (патент РФ №2189823). Известно, что длительное температурное воздействие приводит к изменению кристалличности минеральной компоненты за счет преобразования состава адсорбционного слоя. При отжиге при температурах выше 600°C происходят процессы десорбции продуктов разложения карбонатных групп из кристаллической решетки костного апатита (Zyman Z.Z., Rokhmistrov D.V., Glushko V.I., Ivanov I.G. Thermal impurity reactions and structural changes in slightly carbonated hydroxyapatite // Journal of Materials Science-materials in Medicine, 2009, V.20, P.1389-1399, Баринов С.М., Комлев B.C. Биокерамика на основе фосфатов кальция, М.: Наука, 2005, с.204).
В другой группе изобретений проводят очистку кости от фибриллярного белка коллагена, гликопротеинов и гликолипидов с помощью ферментов папаина или смеси папина:триписина с последующей обработкой растворами перекисью водорода и этанола различной концентрации. Полученные образцы стерилизуют облучением 2,5 Мград (патент РФ №2136298, патент РФ №2136297). Несомненно, применение ферментов для выделения органических веществ с меньшей, чем у коллагена молекулярной массой (неколлагеновых белков, протеогликанов, гликопротеинов) является достоинством данных способов. Однако в указанных изобретениях не учитывается фракционный состав коллагена, а именно, наличие его солерастворимой части. Кроме того, для получения максимальной активности ферментов целесообразно использовать активаторы, ускоряющие их действие. Так, папаин действует более активно в присутствии 2,3-меркаптопропанола или смеси цистеина (0,005 М) с этилентетрауксусной кислотой (0,002 М) или с версеном (0,001 М) (Валуева Т.А. Карта белка папина // http://humbio.ru/humbio/proteins/000a47b8.htm). Существует информация о том, что коллаген медленно переваривается пепсином и почти не переваривается трипсином (Перкель Т.П. Физико-химические и биохимические основы производства мяса и мясных продуктов учебное пособие, Кемерово: Издательство: КемТИПП, 2004, 100 с).
Наиболее близким по технической сущности к заявляемому является способ получения и консервации минерализованного матрикса (патент РФ №2495567), заключающийся в том, что предварительно очищенную от остатков хрящевой ткани губчатую кость перфорируют спицей диаметром 1,5 мм и последовательно обрабатывают при постоянном перемешивании на магнитной мешалке раствором смеси 0,8%-ого хлорида натрия и 0,1%-ого твина-100 в течение 6 ч, меняя его 3 раза через каждые 2 ч, далее помещают на 24 часа в раствор 6%-ой перекиси водорода, заменяя его через 6 ч, центрифугируют при 3000 об/мин, после чего на 12 ч погружают в смесь этанола и хлороформа в соотношении 1:1, меняя 3 раза через каждые 4 ч, затем в течение 6 ч обрабатывают спирт-эфирную смесь (1:2), проветривают губчатую кость в токе воздуха в течение 12 ч, замораживают при -70°C и лиофильно высушивают. Высушенную губчатую кость помещают в герметичный пластиковый контейнер и стерилизуют потоком быстрых электронов дозой 18+5 кГр на линейном ускорителе электронов У003 MB.
Основное преимущество данного способа заключается в экстракции полярных липидов, гликолипидов протеолипидов, углеводов и аминокислот, а также время его реализации 48 часов. Однако в нем также не учитывается фракционный состав коллагена. В рамках метода не проводится физико-химический анализ полученных после разделения минеральной и органической составляющих костного матрикса.
Экстракционное разделение минеральной и органической составляющих костной ткани // Экстракция органических соединений (ЭОС 2010): материалы IV Междунар. конф. Воронеж, 2010, С. 263-264), включающий последовательную экстракцию органического вещества 1 масс. % раствором хлорида натрия и смесью хлорофом-спирт в объемном соотношении 2:1, экстракционное концентрирование проводили при комнатной температуре в течение 3 суток. Сохранность структуры апатита костной ткани при извлечении белковых фракций подтверждена путем анализа рентгенограмм сухого костного порошка с помощью рентгенофазового анализа.
В данном способе извлечение липидов и белков производится экстрагенами, не оказывающими разрушающего воздействия на минеральную кристаллическую фазу костной ткани. Однако не проводится анализ состава и количества извлекаемых органических соединений, а только используется рентгенофазовый анализ, позволяющий охарактеризовать лишь минеральную составляющую межклеточного костного матрикса. Также не учитывается фракционный состав коллагена костных тканей, а именно проведение экстракции первоначально 1%-ым хлоридом натрия, а далее органической смесью хлороформ-спирт не позволяет извлекать поэтапно соле- и водорастворимые фракции коллагена, следовательно, оценить их изменение при костных заболеваниях. Кроме того, не обоснован выбор времени экстракционного концентрирования каждым растворителем.
Задачей настоящего изобретения является разработка способа разделения минеральной и органической составляющих межклеточного костного матрикса с сохранением структуры минеральной компоненты для их изучения при различных функциональных состояниях костной ткани, в том числе при костных заболеваниях.
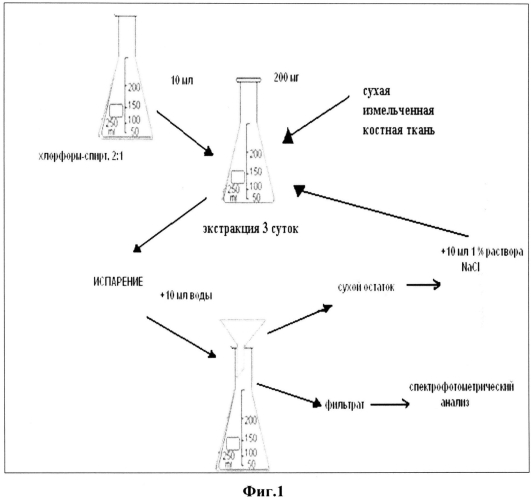
Указанный технический результат достигается тем, что предложен способ разделения органической и минеральной составляющей костной ткани, в котором подготавливают пластины губчатой костной ткани толщиной 0,2-0,5 мм, получают из них костный порошок, полученный костный порошок подвергают двухкратному экстракционному концентрированию, на первом этапе отбирают среднюю пробу, полученного костного порошка массой 200 мг и добавляют 10 мл смеси хлороформ:этиловый спирт в объемном отношении 2:1, помещают на трое суток в темное место при температуре не выше 25°C, испаряют растворитель и дважды добавляют по 5 мл дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 1 и фильтрат 1, на втором этапе к сухому остатку 1 добавляют 10 мл 0,9 масс. % хлорида натрия и помещают на трое суток в темное место при температуре не выше 25°C, испаряют растворитель и дважды добавляют по 5 мл дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 2 и фильтрат 2, высушивают при 105°C в течение 60 мин и анализируют его с помощью ИК-спектроскопии и рентгенофлуоресцентного анализа. При этом в качестве биологического материала используют губчатую костную ткань головок бедренных костей человека, из которых получают пластины от 0,2 до 0,5 мм, а в фильтратах определяют степень извлечения: водорастворимых белковых фракций и солерастворимых белковых фракций в процессе экстракционного концентрирования средней пробы костного порошка.
В данном способе пластины губчатой костной ткани толщиной 0,2-0,5 см обрабатывают раствором 3%-ого пероксида водорода, промывают пятикратно дистиллированной водой, измельчают в агатовой ступке (размеры частиц 3-300 микрон), сушат при 105°C в течение 60 мин, отбирают среднюю пробу и подвергают последовательному экстракционному концентрированию в смеси состава хлороформ:этиловый спирт в объемном отношении 2:1 в течение 3 суток, экстрагент-смесь испаряют, сухой остаток растворяют в определенном объеме воды для получения оптимальной концентрации белка, отфильтровывают и костную ткань подвергают дальнейшему концентрированию в 0,2 М растворе хлорида натрия в течение 3 суток в однократной повторности, испаряют экстрагент, а сухой остаток растворяют в определенном объеме воды, отфильтровывают костный порошок и высушивают его при 105°C в течение 60 мин и анализируют его с помощью РФА и ИК-спектроскопии. В фильтратах определяют содержание белка спектрофотометрическим методом.
Материалом исследования являлась губчатая костная ткань коллекции головок бедренных костей, которые удалены у жителей Омского региона в ходе тотального эндопротезирования с заболеванием деформирующий коксартроз и у лиц, у которых отсутствуют костные патологии («норма»). Последние образцы извлекались в соответствии с нормативными документами №694 от 21.07.1978 г. п. 2.24, №8-ФЗ от 12.01.1996 г. п. 3. №73-ФЗ от 31.05.2001 г. п. 14, 16.
В данном способе подготовка пластин костной ткани для анализа осуществляется следующим образом: с головки бедренной кости удаляют остатки мягких тканей, промывают проточной водой и делят ее на три равные части, из середины которых выпиливают три костных среза толщиной от 0,2 до 0,5 см (верхний, средний, нижний - порядок чередования приведен в направлении гиалиновый хрящ - бедренная кость). Подбор толщины образцов осуществлялся экспериментально. Данные размеры срезов являются оптимальными для получения средней пробы массой 200 мг методом квартования и экстрагирования органических веществ с помощью указанных выше растворов. После чего удаляют со срезов хрящевую ткань, пятикратно промывают их от костной пыли проточной водой и выдерживают для удаления клеточных элементов в 3%-ом растворе пероксида водорода в течение 30 мин, заменяя раствор однократно через 15 мин. Более длительный интервал обработки перекисью водорода может привести к денатурации неколлагеновых белков, которую следует избегать на этапе механической подготовки образцов для анализа. Полученные срезы высушивают на воздухе в эксикаторе в течение 24 часов, измельчают до размеров частиц 3-300 микрон, отбирают средние пробы массой по 200 мг методом квартования.
Полученный костный порошок подвергают экстракционному концентрированию. На начальном этапе подобраны условия проведения экстрагирования. С этой целью исследована экстракция этих органических веществ рядом растворителей: хлороформом, этиловым спиртом, смесью хлороформ:этиловый спирт в объемных соотношениях 1:1, 1:2 и 2:1, диэтиловым эфиром и хлоридом натрия. Так как концентрация хлорида натрия в плазме крови и тканевых жидкостях организма составляет 0,9 масс.%, изучена экстракция белковых соединений, данных электролитом в интервале концентраций от 0,1 до 10 масс.%. Кроме того, определены оптимальное время экстрагирования каждым растворителем (от 12 ч до 7 суток), кратность (от одного до трех раз) и последовательность их применения.
Установлено, что наиболее эффективное экстрагирование органических веществ происходит при двукратной экстракции (по 3 суток) следующими растворителями смесью хлороформ-спирт (2:1) и 0,2 масс.% раствором хлорида натрия при соблюдении следующих условий (фиг.1). На первом этапе проводят экстракцию липидов, их соединений с белками и углеводами, а также неколлагеновых белков и водорастворимой фракции коллагена. Для этого 200 мг полученного костного порошка помещают в колбу с притертой пробкой и добавляют 10 мл раствора смеси хлороформ:этиловый спирт в объемном отношении 2:1, оставляют на трое суток в темном месте при температуре не выше 25°C. По истечении указанного времени испаряют растворитель и дважды добавляют по 5 мл дистиллированной воды, перемешивают и отфильтровывают (фильтрат 1 или анализируемый раствор 1 и сухой остаток 1). На втором этапе выделяют оставшуюся часть липидов, неколлагеновых белков и солерастворимую фракцию коллагена. В колбу с притертой пробкой переносят сухой остаток 1 и добавляют 10 мл 0,9 масс.% раствора, закрывают пробкой, хранят в течение 3 суток в темном месте. После чего аналогичным образом проводят процедуры по испарению экстрагента и получению сухого остатка 2 и фильтрата 2 (анализируемый раствор 2). В фильтратах определяют содержание белка реактивом Бенедикта спектрофотометрическим методом (патент RU 2239195, C1 МПК7 01N 33/68, 27.10.2014). Фоновые растворы готовят аналогично на основе испаренных растворителей без внесения пробы костной ткани. Оптическую плотность измеряют на спектрофотометре СФ-46 λэфф=330 нм, 1=10 мм. Количественное определение белковых составляющих определяют методом градуировочного графика с применением стандартного раствора альбумина (КлиниТест-ОБ, «Эко-Сервис», коэффициент корреляции 0,9998, P=0,95). Предел обнаружения при определении водорастворимых белковых соединений составляет 30 мкг/мл, относительное стандартное отклонение - 0,03-0,04.
Эффективность экстрагирования оценивается величиной степени извлечения (R). За общее значение количеств белковых соединений в костной ткани принято содержание общего азота, полученное по методике ГОСТ 13496.4-93 на автоматизированной линии «КОНТИФЛО» (ГОСТ 13496.4-93. Корма, комбикорма, комбикормовое сырье. Методы определения содержания азота и сырого протеина, М.: ИПК Изд. стандартов, 1995, С.11-17). Проводится анализ ИК-спектров и рентгенограмм до и после экстракции.
Главное отличие предлагаемого способа от прототипа заключается в последовательности выделения органических веществ, а именно проводится поэтапное извлечение и селективное определение водорастворимых и солерастворимых белков, включая соответственно данные фракции коллагена. Возможно, применение именно такого порядка проведения процедур связано с наибольшей растворимостью органических веществ в неполярных растворителях.
Результаты применения способа.
Полученные результаты статистически обработаны с помощью программного пакета программного пакета статистической обработки данных StatSoft Statistica 6.0.
В таблице 1 приведены содержание и степень экстракционного извлечения (R) белкового азота в костной ткани лиц, у которых отсутствуют костные заболевания, и лиц, больных коксартрозом при (n=3; P=0,95) по данному способу.
| Таблица 1 | ||||
| Костные срезы | Белковый азот, % | R, % | ||
| Хлороформ-спирт (2:1) | NaCl, 1% раствор | |||
| Коксартроз | Верхний | 0,908±0,270 | 1,028±0,030 | 43,30 |
| Средний | 1,300±0,300 | 1,116±0,154 | 55,70 | |
| Нижний | 0,796±0,452 | 0,769±0,220 | 54,80 | |
| «Норма» | 1,920±0,920 | 0,623±0,123 | 69,30 |
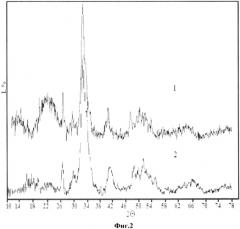
На фиг.2 представлены дифрактограммы костной ткани до экстракции (1); после экстракции двукратной экстракции (2). На данных дифрактограммах отмечается заметное снижение фоновых сигналов, особенно в области от 10.8 до 16.8 29, принадлежащей аморфной компоненте, прежде всего органической. Рефлексы гидроксилапатита более разрешенные.
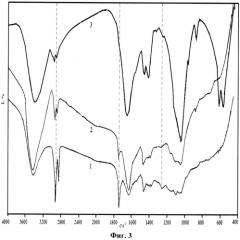
На фиг.3 представлены ИК-спектры костной ткани до экстракции (1); после экстракции смесью хлороформ:спирт (2:1) (2); после экстракции 1% раствором NaCl. При этом на ИК-спектрах после поэтапного воздействия растворителей отмечается уменьшение полос поглощения колебаний связей органических групп следующих частот: 2950-2800 см-1, 1790-1700 см-1, 1242-1260 см-1, принадлежащих соответственно ν(C-Hn), ν(C=O), ν(NH). Кроме того, на всех спектрограммах присутствуют более четкие полосы поглощения колебаний связей, основной вклад в интенсивности которых принадлежит молекулам и ионам неорганической фазы костной ткани, см-1: 3600-3200 - νOH- в молекулах воды; 1680-1610 - H-O-H в H2O; 1590-1500 - C-O в , указывающие на замещение ими в структуре апатита фосфатных тетраэдров по A-механизму; 1480-1410 - C-O в B-типа; 1090-1030 - υ3 P-O в ; 962-968 - υ1 P-O в ; 872-879 - ν2 ; 574-605 - υ4 O-P-O в .
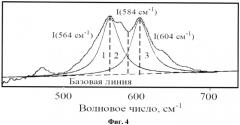
На фиг.4 представлено разложение ИК-спектра в области 400-650 см-1 колебаний ν4 O-P-O связей PO43 - на три элементарные полосы поглощения (PeakFit_v 4.11.)
Для характеристики степени кристалличности костных образцов проводится математическая обработка спектров с помощью программного пакета PeakFit_v 4.11, заключающаяся в разложении спектральной области 400-650 см-1 на три элементарных полосы поглощения (распределение по Лоренцу, P=0,99). По результатам разложения рассчитывается параметр инфракрасного расщепления антисимметричного деформационного колебания ν4 связи O-P-O, полученный как отношение интенсивностей двух пиков к интенсивности «впадины» между ними (фиг.4): IRSF=I(564 см-1)+I(604 см-1)/I(584 см-1) (Shi J., Klocke A., Zhang М., Bismayer U. Thermally-induced structural modification of dental enamel apatite: Decomposition and transformation of carbonate groups // European Journal of Mineralogy, 2005, V.17, P.769-775).
В таблице 2 представлены значения параметра IRSF до- и после экстракции костной ткани мужчин и женщин (46-56 лет). Показано, что процедуры экстрагирования не оказывают влияние на степень кристалличности минеральной основы костной ткани, следовательно, применение способа позволяет ее исследовать более детально с помощью методов, таких как РФА и ИК-спектроскопия (табл.2).
| Таблица 2 | ||
| Костная ткань | IRSF | |
| До экстракции | После экстракции | |
| Мужчин | 2,31-2,93 | 2,31-2,99 |
| Женщин | 2,11-2,22 | 2,12-2,73 |
Анализ полученных данных позволяет также оценить изменения, которые происходят на ультра- и микроструктурных уровнях организации костной ткани человека при костных заболеваниях (на примере коксартроза). Установлено, что для проб поврежденных срезов характерна наименьшая суммарная степень извлечения белковых компонент (R (водорастворимой и солерастворимой фракций), %). Возможно, это связано с переходом данных растворимых белковых компонент в нерастворимые за счет деформации меж- и внутримолекулярных связей коллагеновых волокон (Copenhaver W.M., Kelly D.E., Wood R.L. The connective tissues: cartilage and bone, Baltimore: Williams & Wilkins, 1978, P.170-205). Следовательно, для коллагеновых молекул костных тканей при коксартрозе характерна большая степень агрегации. При этом в отличие от «нормы» при более глубоком поражении костной ткани (в верхнем срезе) увеличивается содержание извлекаемой солерастворимой белковой составляющей, из которой формируется «зрелый», что может указывать на снижение интенсивности процессов формирования коллагеновых волокон и усиление резорбции органического матрикса.
Таким образом, заявляемый способ позволяет отделить водо- и солерастворимые белковые составляющие костного матрикса от минеральной компоненты, а также проводить их исследование при различных костно-суставных патологиях и разрабатывать эффективные методы профилактики, диагностики и лечения данных функциональных нарушений.
1. Способ разделения органической и минеральной составляющей костной ткани, в котором подготавливают пластины губчатой костной ткани толщиной 0,2-0,5 мм, получают из них костный порошок, полученный костный порошок подвергают двухкратному экстракционному концентрированию, на первом этапе отбирают среднюю пробу полученного костного порошка массой 200 мг и добавляют 10 мл смеси хлороформ:этиловый спирт в объемном отношении 2:1, помещают на трое суток в темное место при температуре не выше 25°C, испаряют растворитель и дважды добавляют по 5 мл дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 1 и фильтрат 1, на втором этапе к сухому остатку 1 добавляют 10 мл 0,9 мас.% хлорида натрия и помещают на трое суток в темное место при температуре не выше 25°C, испаряют растворитель и дважды добавляют по 5 мл дистиллированной воды, перемешивают, отфильтровывают, получают сухой остаток 2 и фильтрат 2, высушивают при 105°C в течение 60 мин и анализируют его с помощью ИК-спектроскопии и рентгенофлуоресцентного анализа.
2. Способ по п. 1, отличающийся тем, что в качестве билогического материала используют губчатую костную ткань головок бедренных костей человека, из которых получают пластины от 0,2 до 0,5 мм.
3. Способ по п. 1, отличающийся тем, что дополнительно в фильтратах определяют степень извлечения: водорастворимых белковых фракций и солерастворимых белковых фракций в процессе экстрационного концентрирования средней пробы костного порошка.