Способ получения трехмерного остеотрансплантата
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к травматологии и ортопедии, и предназначено для замещения дефектов костной ткани и коррекции травматических повреждений костей. Описан способ получения трехмерного остеотрансплантата, заключающийся в остеогенной дифференцировке пластического материала, где в качестве пластического материала используют трехмерный хондротрансплантат из культивированных хондробластов и межклеточного матрикса, а остеогенную дифференцировку осуществляют путем направленной дифференцировки трехмерного хондротрансплантата. Трансплантат с остеогенными потенциями отвечает всем требованиям био-, гистосовместимости и механической прочности для коррекции и замещения дефектов костной ткани. 3 ил.
Реферат
Изобретение относится к области медицины, а именно к травматологии и ортопедии, и предназначено для замещения дефектов костной ткани и коррекции травматических повреждений костей.
Известны способы создания органоподобных трехмерных структур почки, печени, нервной ткани (Захарова И.С., Шевченко И.А. Органы «из пробирки» // Наука из первых рук №1 (55) 2014) и костной ткани на основе дифференцированных плюрипотентных клеток.
Известен способ получения трехмерного хондротрансплантата для замещения дефектов костной ткани, из культивированных хондробластов позвоночника мини-поросенка, RU №2392973 (МПК A61L 27/38, опубл. 27.06.2010). Способ осуществляется следующим образом. Стерильно выделенные пластинки роста тел позвонков новорожденных мини-свиней помещают в раствор Хенкса с канномицином 1 г/л на 5 минут. В условиях ламинарного шкафа, после двукратного промывания в чашке Петри стерильным раствором фосфатного буфера пластинки роста измельчают скальпелем на кусочки 1×1 мм2, которые переносят в пробирки со средой RPMI-1640 с добавлением 20% FBS и раствором 1.5% коллагеназы с активностью 240 ЕД/мл, инкубируют при 37°C в течение 8 часов, объем раствора превышает в 10 раз объем обрабатываемой ткани. Далее суспензию пропускают через стерильное сито (70 мкм) и центрифугируют при 2000 об/мин в течение 10 минут. Клетки ресуспензируют в среде PBS, производят подсчет витальных хондробластов при помощи красителя трипанового синего в счетной камере Горяева.
Культивирование изолированных хондробластов производят в инкубаторе при 37°C, при 90% влажности и 5% CO2 в культуральных плоскодонных флаконах в среде RPMI-1640 с добавлением 20% FBS и гентамицином 1 г/л и аскорбиновой кислотой 50 мг/мл. Среду меняют через каждые 3 дня. По достижении необходимой концентрации (50-60 млн) производят пассирование клеток с помощью смеси растворов 0,25% трипсина и 0,02% ЭДТА, далее клетки центрифугируют при 2000 оборотов в минуту в течение 10 минут. Клеточный агрегат перемещают в 6-ти луночный планшет с питательной средой RPMI-1640 с добавлением 10% FBS, культивируют 4-6 недель. Смену среды осуществляют 2 раза в неделю, с интервалом 2-3 дня до получения хондротрансплантата размером 2×2×2 мм3.
Недостатком трехмерного хондротрансплантата является то, что он не обладает достаточными прочностными свойствами, поэтому не применим для регенерации значительных по площади дефектов костной ткани. Трехмерный хондротрансплантат может быть использован для коррекции межпозвонкового остеохондроза, а также небольших по площади дефектов и повреждений костной ткани. Кроме того, к недостаткам трехмерного хондротрансплантата следует отнести необходимость длительной фиксации зоны трансплантации.
Известен способ получения тканеинженерного эквивалента костной ткани путем заселения деминерализованного костного матрикса стромальными клетками с потенциями ММСК. Данный тканеинженерный эквивалент разрабатывали для дальнейшего лечения пациентов с объемными повреждениями костей (Бозо И.Я., Деев Р.В., Цупкина Н.В., Гребнев А.Р., Пинаев Г.П. Экспериментальное обоснование использования тканеинженерного эквивалента для устранения дефектов длинных трубчатых костей // Вопросы морфологии XXI века. Гистогенез и регенерация С. 61-66).
Основными требованиями, предъявляемыми к пластическому материалу, являются биосовместимость, гистосовместимость и механическая прочность. Тканеинженерный эквивалент костной ткани на основе деминерализованного костного матрикса, заселенного клетками, этими свойствами не обладает. При его использовании могут возникать проблемы резорбции, а деминерализация костного матрикса существенно снижает механическую прочность полученного на его основе эквивалента костной ткани.
Известен способ получения биотрансплантата для восстановления объема костной ткани при дегенеративных заболеваниях и травматических повреждениях по патенту РФ на изобретение №2530622 (МПК A61L 27/24, A61K 35/28, A61P 19/10, опубл. 10.10.2014), принятый в качестве прототипа. Способ характеризуется тем, что для его изготовления используют смесь мезенхимальных стромальных клеток, культивированных в стандартных условиях и ММСК, дифференцированные в остеогенном направлении, смешанные с матрицей-носителем. Выделенные ММСК помещают в стандартную среду культивирования AdvanceSTEMTM/Antibiotic/Antimycotic Solution 100x (фирма-производитель HyClone) с добавлением 10% аутологичной сыворотки крови пациента и выращивают в CO2 инкубаторе (5% CO2) при 37°C до первого пассажа. После чего ММСК снимают с подложки и разделяют на 2 равные части: одну часть клеток продолжают культивировать в стандартных условиях (AdvanceSTEMTM/Antibiotic/Antimycotic Solution 100x/10% аутологичной сыворотки крови пациента), а другую часть дифференцируют в остеогенном направлении за счет добавления в стандартную среду культивирования аскорбиновой кислоты в концентрации 50 мг/л и Дексаметазона в концентрации 0.1 мк/моль.
Культивирование осуществляют в конфлюентном монослое в течение 2 недель, меняя среду на свежую каждые 3 дня. Затем все ММСК снимают с подложек и смешивают в соотношении 1:1. Перед использованием матрицу-носитель (коллаген-минеральный носитель, например гранулы «КоллапАн-Г») смачивают в небольшом объеме среды AdvanceSTEMTM. В емкости, предназначенной для изготовления биотрансплантата, клетки смешивают с матрицей-носителем в количестве 107 клеток на 1 г веса матрицы-носителя и инкубируют в течение суток при 37°C в атмосфере 5% CO2. Продолжительность всего технологического процесса изготовления биотрансплантата составляет от 20 до 30 суток. Полученный трансплантат должен быть использован в течение 4-8 часов.
В основе структуры матрицы носителя используют коллаген-минеральный комплекс, идентичный по составу костному материалу.
Преимущество данного способа заключается в использовании комбинации недифференцированных и дифференцированных в остеогенном направлении ММСК, что позволяет одновременно решить две основные задачи: обеспечение трофики за счет формирования сосудов (за счет продукции ММСК, культивированными в стандартной среде, факторов роста, цитокинов и трофических факторов) и формирование минерализованной костной ткани.
К основным недостаткам способа по патенту РФ №2530622 следует отнести использование коллаген-минерального матрицы-носителя, который является искусственно синтезированным компонентом тканеинженерной конструкции и не обладает свойствами био- и гистосовместимости.
Еще одним недостатком матриксов и матриц-носителей является проблема равномерного заселения, миграции и размещения клеток в объеме матрицы и отсутствие биодеградации вещества матрицы. Так как от равномерного распределения клеток в объеме матрицы зависит их способность к адгезии, пролиферации, последующей дифференцировке и синтетической активности. Также недостатком вышеизложенного способа получения трансплантатов является проблема резорбции матриц-носителей и ремоделирования биотрансплантата в костную ткань.
Задачей данного изобретения является формирование трансплантата с остеогенными потенциями, отвечающего всем требованиям био-, гистосовместимости и механической прочности для коррекции и замещения дефектов костной ткани.
Поставленная задача решается тем, что в способе получения трехмерного остеотрансплантата, заключающемся в остеогенной дифференцировке пластического материала, согласно изобретению в качестве пластического материала используют трехмерный хондротрансплантат из культивированных хондробластов и межклеточного матрикса, а остеогенную дифференцировку осуществляют путем направленной дифференцировки трехмерного хондротрансплантата.
Использование в качестве пластического материала трехмерного хондротрансплантата из культивированных хондробластов и межклеточного матрикса позволяет получить трансплантат, состоящий только из клеток и матрикса и обладающий способностью к формированию диффинитивной костной ткани.
Остеогенная дифференцировка предлагаемого пластического материала путем направленной дифференцировки трехмерного хондротрансплантата обеспечивает дифференцировку клеток трехмерного хондротрансплантата в остеогенном направлении, изменение их фенотипа и синтетической активности. Причем дифференцировка пластического материала в данном случае является эволюционно закрепленным механизмом формирования кости (мезенхима-хрящ-кость) как при регенерации, так и в эмбриогенезе.
Полученный по предлагаемому способу остеогенный трансплантат содержит остеогенные клетки, предкостный матрикс, содержащий гидроксиапатит и коллаген I типа, а также формирующиеся примитивные сосуды и капилляры. Это обеспечивает активный метаболизм, быструю адаптацию и формирование органоспецифической костной ткани в зоне пересадки.
Целесообразно направленную дифференцировку трехмерного хондротрансплантата осуществлять в стандартной питательной среде с добавлением индукторов остеогенной дифференцировки: β-глицерофосфата (10 мМ), аскорбиновой кислоты (0,05 мМ) и дексаметазона (4 мг/мл на 200 мл среды).
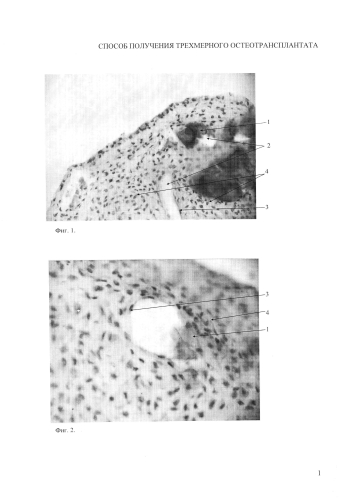
Предлагаемое изобретение поясняется микрофотографиями гистологических срезов заявляемого остеотрансплантата, где на фиг. 1 представлена морфологическая структура остеотранспланатата (×400); на фиг. 2 - формирование сосуда в трехмерном остеотрансплантате (×400); на фиг. 3 - синтез матрикса остеогенными клетками трехмерного остеотрансплантата, окраска альциановым синим (×400).
На представленных микрофотографиях хорошо видны кальцификаты 1 (фиг. 1, 2), формирующиеся сосуды 2 (фиг.1), эндотелиальные клетки 3 (фиг. 1, 2), остеогенные клетки 4 (фиг. 1, 2), межклеточный матрикс 5 (фиг. 3).
Предлагаемый способ осуществляют следующим образом.
Известными методами, например по способу, описанному в патенте РФ №2392973 «Способ получения трехмерного хондротрансплантата», получают хондротрансплантат из культивированных хондробластов и межклеточного матрикса. Осуществляют направленную дифференцировку полученного хондротрансплантата в остеогенном направлении путем культивирования его в питательной среде, содержащей индукторы остеогенной дифференцировки клеток, до получения трехмерного остеотрансплантата.
В качестве питательной среды для остеогенной дифференцировки целесообразно использовать питательную среду DMEM F12, содержащую 15% FBS, стрептомицин-пенициллин, амфотеризин B и индукторы остеогенной дифференцировки клеток: 10 милимоль/л β-глицерофосфата, 100 наномоль/л дексометазона и 0,2 милимоль/л аскорбиновой кислоты. Трехмерные трансплантаты с остеогенным потенциалом дифференцировки культивируются в течение от 3 до 6 недель. Смену питательной среды производят каждые 3-е суток. Состав и количество добавляемых веществ в культуральную среду не меняется.
Пример конкретного выполнения способа формирования остеопластического трансплантата.
Новорожденный мини-поросенок вводится в наркоз. Путем верхнего доступа извлекается позвоночник и помещается в физиологический раствор. В стерильных условиях ламинарного шкафа выделяются хрящевые тела позвонков. Материал дважды промывают раствором фосфатного буфера и измельчают в чашке Петри скальпелем. Кусочки переносятся в пробирки с раствором 1,5% коллагеназы в среде RPMI 1640 с добавлением 20% FBS. Инкубируют в течение 12 часов. Далее суспензию дважды промывают от коллагеназы раствором фосфатного буфера. Клетки ресуспензируют в PBS. Жизнеспособность клеток оценивается с помощью красителя трипанового синего в счетной камере Горяева.
Выделенные хондробласты культивируют в условиях инкубатора при 37°C при 90% влажности и 5% CO2 в чашках Петри в культуральной среде RPMI-1640 с добавлением 20% FBS и гентамицином 1 г/л в течение 3-4 недель. Далее производят пассирование клеток с помощью смеси растворов 0,25% трипсина и 0,02% раствора ЭДТА. Клетки центрифугируют при 2000 об/мин в течение 10 минут. Клеточный агрегат культивируют в 6-луночном планшете с питательной средой и 10% FBS.
Через 7 суток в планшетах с сформированным хондротрансплантатом производят замену питательной среды на DMEM F12, содержащую 15% FBS, стрептомицин-пенициллин, амфотеризин B и индукторы остеогенной дифференцировки клеток: 10 милимоль/л β-глицерофосфата, 100 наномоль/л дексометазона и 0,2 милимоль/л аскорбиновой кислоты. Трансплантат культивируется в присутствии индукторов остеогенеза в течение 3-х недель до получения остеотрансплантата.
Способ получения трехмерного остеотрансплантата, заключающийся в остеогенной дифференцировке пластического материала, отличающийся тем, что в качестве пластического материала используют трехмерный хондротрансплантат из культивированных хондробластов и межклеточного матрикса, а остеогенную дифференцировку осуществляют путем направленной дифференцировки трехмерного хондротрансплантата в стандартной питательной среде с добавлением индукторов остеогенной дифференцировки: β-глицерофосфата (10 мМ), аскорбиновой кислоты (0,05 мМ) и дексаметазона (4 мг/мл на 200 мл среды).