Растворимый icam-1 в качестве биомаркера для прогнозирования терапевтического ответа
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для анализа того, будет ли пациент отвечать терапевтически на способ лечения рака, включающий введение иммуногенной композиции. Для этого получают образец крови от пациента и измеряют уровни sICAM-1 в указанном образце крови. При этом низкие уровни sICAM-1, приблизительно меньше 300 нг/мл, свидетельствуют о том, что пациент будет развивать профилактический или терапевтический ответ на иммуногенную композицию. Иммуногенная композиция содержит по крайней мере один рекомбинантный вектор, экспрессирующий in vivo всю или часть по крайней мере одной гетерологичной нуклеотидной последовательности. Также предложен набор для анализа того, что пациент будет отвечать на введение иммуногенной композиции. Группа изобретений обеспечивает отбор по низким начальным уровням sICAM-1 пациентов, страдающих от рака, для которых будет эффективна терапия, включающая введение иммуногенной композиции, в частности вакцины. 2 н. и 17 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Настоящее изобретение относится к области иммунологии и, в частности, к иммунотерапии пациента против заболеваний, вызванных, например, инфекцией или различными видами рака. В частности, изобретение относится к способам для прогнозирования, является или не является ли субъект чувствительным к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа, после такой иммунотерапии. Настоящее изобретение относится к способам и композициям для улучшения иммунного ответа, вызванного in vivo иммуногенной композицией, в частности вакциной.
Традиционные методики вакцинации, вовлекающие введение в животную систему антигена (например, пептидов, белков), которые могут индуцировать иммунный ответ, и таким образом защищать указанное животное от инфекции, например, являются известными уже много лет.Такие методики дополнительно включают разработку как живых, так и инактивированных вакцин. Живые вакцины представляют собой типично аттенуированные непатогенные варианты инфекционного агента, который является способным стимулировать иммунный ответ, направленный против патогенного варианта инфекционного агента.
В последние годы были достигнуты успехи в разработке рекомбинантных вакцин, в частности, рекомбинантных живых вакцин, в которых чужеродные антигены представляющие интерес, кодируются и экспрессируются из вектора. Среди них векторы, основанные на рекомбинантных вирусах, были продемонстрированы как многообещающие и такие, которые играют важную роль в разработке новых вакцин. Многие вирусы были исследованы на их способность экспрессировать белки из чужеродных патогенов или опухолевой ткани и индуцировать специфические иммунологические ответы против этих антигенов in vivo. В общем случае, эти основанные на генах вакцины могут стимулировать мощный гуморальный и клеточный иммунные ответы, а вирусные векторы могут представлять собой эффективную стратегию как для доставки генов, кодирующих антиген, так и способствовать совершенствованию презентации антигена. Для того чтобы использоваться в качестве вакцинного носителя, идеальный вирусный вектор должен быть безопасным и способным к эффективной презентации необходимых, специфических для патогена антигенов иммунной системе. Кроме того, векторная система должна соответствовать критериям, которые позволяют осуществлять ее получение на крупномасштабной основе. Так, на сегодняшний день существует несколько вирусных вакцинных векторов, все они обладают относительными преимуществами и ограничениями в зависимости от предложенного применения (для обзора рекомбинантных вирусных вакцин, смотри, например, Harrop и Carroll, 2006, Front Biosci., 11, 804-817; Yokoyama и др., 1997, J Vet Med Sci., 59, 311-322).
В соответствии с наблюдением, сделанным в ранние 1990-ые, которое касается того, что векторы на основе плазмидной ДНК могут непосредственно трансфицировать животные клетки in vivo, значительные усилия исследователей были предприняты для развития методик вакцинации, основанных на применении ДНК плазмид для индукции иммунного ответа, путем непосредственного введения животным ДНК, кодирующей антигены. Такие методики, которые обычно называются ДНК вакцинацией, в настоящее время используются для того, чтобы вызвать протективный иммунный ответ в большом количестве моделей болезни. Для обзора вакцин на основе ДНК смотри Reyes-Sandoval и Ert1, 2001 (Current Molecular Medicine, 1, 217-243).
Общая проблема в области вакцин, однако, заключалась в идентификации средств индукции достаточно сильного иммунного ответа у вакцинированных индивидуумов для защиты от инфекции и заболевания.
Таким образом, например, основное усилие в последние годы было направлено на открытие новых лекарственных соединений, которые действуют путем стимуляции определенных ключевых аспектов иммунной системы, и которые будут служить для повышения иммунного ответа, индуцированного вакцинами. Большинство из этих соединений, называемых модификаторами иммунного ответа (IRM) или адъювантами, как оказалось, оказывают воздействие посредством основных механизмов иммунной системы с помощью Toll-подобных рецепторов (TLR) для индукции биосинтеза различных важных цитокинов (например, интерферонов, интерлейкинов, фактора некроза опухоли, и т.д., смотри, например, Schiller и др., 2006, Exp Dermatol., 15, 331-341). Эти соединения были продемонстрированы как такие, которые стимулируют быстрое высвобождение определенных цитокинов, имеющих происхождение от дендритных клеток, моноцитов/макрофагов, а также являются способными стимулировать В клетки для секреции антител, которые играют важную роль в антивирусной и противоопухолевой активности IRM соединений.
Альтернативно, были предложены стратегии вакцинации, большинство из которых являются основанными на режиме вакцинации примирования - повторной иммунизации. В соответствии с этими прописями вакцинации "примирования - повторной иммунизации" иммунная система сначала подвергается индукции путем введения пациенту примирующей композиции, а потом подвергается стимуляции путем введения второй композиции для повторной вакцинации (смотри, например, ЕР 1411974 или US 20030191076).
Дополнительно, каждый член популяции может не быть в равной степени чувствительным к частному лечению. Например, новые соединения часто являются неуспешными в поздних клинических опытах, поскольку не обладают эффективностью в исследуемой популяции. В то время как такие соединения могут не быть эффективными в общей популяции, могут существовать субпопуляции, чувствительные к таким неуспешным соединениям по многим причинам, включая наследственные различия в генной экспрессии. Путем идентификации субпопуляции пациентов, чувствительных к соединению, таким образом, является возможным определить способ, который может использоваться для "спасения" неуспешных соединений. Последующие клинические исследования, ограниченные популяцией чувствительных пациентов, могут потом демонстрировать эффективность ранее неуспешного соединения в рамках этой частной субпопуляции пациентов, что приводит к одобрению соединения для применения в этой субпопуляции. В соответствии с этим, другой путь улучшения иммунотерапевтической эффективности может определить популяцию пациентов, чувствительных к указанной терапии.
Внутриклеточная адгезивная молекула 1 (ICAM-1 или CD54) представляет собой связанную с адгезией молекулу, принадлежащую к суперсемейству иммуноглобулинов. Эта молекула обнаруживается на клеточной мембране эндотелиальных клеток. При активации ICAM-1 позволяет осуществлять стабильную адгезию лейкоцитов к поверхности эндотелия. Сначала было показано, что первичная структура ICAM-1 имеет типичный гидрофобный трансмембранный сегмент и представляет собой нерастворимую молекулу, которая выделяется в растворимой форме из клеточных мембран путем лизиса клеток в неионном детергенте (смотри ЕР 0289949). Последующими исследованиями были идентифицированы альтернативные молекулярные виды ICAM-1, обозначенные как sICAM-1 (или sCD54), которые являются растворимыми без прибавления детергента (смотри US 5821341). Растворимая внутриклеточная адгезивная молекула-1 (sICAM-1) представляет собой циркулирующую форму ICAM-1, которая конститутивно экспрессируется или индуцируется на поверхности клеток различных клеточных линий. Растворимая ICAM-1 была обнаружена в таких жидкостях организма, как сыворотка, цереброспинальная жидкость, синовиальная жидкость, мокрота, моча и жидкость бронхо-альвеолярных смывов. Высвобождение растворимой ICAM-1 модулируется несколькими цитокинами и различными факторами (TNF альфа, интерлейкины, интерфероны, и т.д.). Несмотря на то, что роль и функции растворимой ICAM-1 еще полностью не выяснены, факты предполагают их вовлеченность в развитие некоторых заболеваний (например, атеросклероза и воспаления, Hulthe и др., 2002, Clin Sci (Lond)., 103, 123-9). Было предложено, что, по крайней мере, их повышенные уровни могут давать информацию врачу о патологических процессах.
Смотри, например:
US 20060199239 раскрывает способ оценки состояния сердца у пациента путем измерения факторов риска воспаления, включая уровень ICAM-1 (уровень заболевания определяют при значении выше 285,2 нг/мл).
Molla и др. (1989, J Biol Chem., 264, 10589-94) предполагает, что уровни sICAM-1 являются полезными в качестве индексов клинических проявлений атеросклероза.
Dong Soon Kim и др. (1999, Chest, 115, 1059-1065) предполагает применение значения уровня растворимой ICAM-1 в качестве маркера активности при саркоидозе, поскольку у пациентов с активной формой заболевания уровни sICAM-1 в сыворотке (575±221 нг/мл) были выше, чем такие для пациентов с неактивным заболеванием.
Demerath и др. (2001, Ann Hum Biol., 28, 664-78) показал, что концентрация растворимых sICAM-1 и sesel отражает уровень установленных факторов риска CVD у визуально здоровых мужчин и женщин, обеспечивая, таким образом, дополнительное подтверждение, что эти факторы осуществляют свой вклад в CVD посредством их противовоспалительного влияния на сосудистый эндотелий.
Смотри также Witkowska и др., 2004, Eur Cytokine Netw., 15, 91-98, который обеспечивает концентрацию sICAM-1 в жидкостях организма при различных заболеваниях.
Исследования показали, что повышенные уровни растворимых ICAM и VCAM являются связанными с активностью заболевания у пациентов при различных острых и хронических воспалительных заболеваниях (Ilic и др., 2007, Med Pregl., 60 Suppi 2, 128-32).
Dowlati и др., 2008, Clin. Cancer Res., 14, 1407-1412, недавно показал, что уровни ICAM были прогностическими для выживания и предсказания ответа на химиотерапию (то есть, карбоплатин + паклитаксел).
В настоящее время заявителем было идентифицировано новое средство и стратегия вакцинации. В соответствии с первым воплощением настоящее изобретение относится к способу лечения пациента от заболеваний человека путем введения иммуногенной композиции, включающей, по крайней мере, один антиген, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1 (которая также называется sCD54 или растворимой ICAM-1 или растворимой CD54).
Настоящее изобретение, таким образом, относится к способу лечения пациента от болезни человека путем введения иммуногенной композиции, включающей, по крайней мере, один антиген, при этом указанный способ включает следующие этапы:
- выбор пациента в популяции пациентов, состоящей из пациентов, которые имеют низкие уровни sICAM-1,
- введение указанным выбранным пациентам указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу повышения иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1.
В соответствии с другим воплощением настоящее изобретение относится к способу повышения иммунного ответа, по крайней мере, к одному антигену (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным в популяции пациентов, состоящей из пациентов, которые имеют низкие уровни sICAM-1.
В соответствии с другим воплощением настоящее изобретение относится к способу повышения иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1 и где указанный повышенный иммунный ответ представляет собой врожденный иммунный ответ. Врожденный иммунный ответ представляет собой исходную иммунную защиту организма против патогенов и вызывается с помощью разнообразных клеток, включая антиген-презентирующие клетки или "АРС". Эти клетки экспрессируют поверхностные и цитоплазматические рецепторы, которые узнают молекулы чужеродного происхождения (например, бактериальные и вирусные нуклеиновые кислоты, белки, углеводы). При определении этих сигналов дендритные клетки и макрофаги выявляют защитный ответ, который включает высвобождение цитокинов (включая интерфероны, TNF-альфа и IL-12) и хемокинов, которые привлекают клетки, такие, как незрелые дендритные клетки, макрофаги, NK клетки и гранулоциты, к проблемному сайту. Врожденный иммунный ответ, таким образом, обеспечивает неспецифическую защиту, в то время, как организм генерирует адаптивный ответ.
Настоящее изобретение, таким образом, относится к способу повышения иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- выбор пациента в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1,
- введение указанным выбранным пациентам указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу повышения иммунного ответа, по крайней мере, на один антиген (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- выбор пациента в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1,
- введение указанным выбранным пациентам указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу повышения иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции где указанный повышенный иммунный ответ представляет собой врожденнй иммунный ответ, при этом указанный способ включает следующие этапы:
- выбор пациента в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1,
- введение указанным выбранным пациентам указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу для индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней sICAM-1, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент имеет низкие уровни sICAM-1.
В соответствии с другим воплощением настоящее изобретение относится к способу для индукции иммунного ответа, на, по крайней мере, один антиген (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней sICAM-1, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент имеет низкие уровни sICAM-1.
В соответствии с другим воплощением настоящее изобретение относится к способу для индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный повышенный иммунный ответ представляет собой врожденный иммунный ответ, при этом указанный способ включает следующие этапы:
- измерение у пациента уровней sICAM-1, и
- введение пациенту указанной иммуногенной композиции, если указанный пациент имеет низкие уровни sICAM-1.
В соответствии с другим воплощением настоящее изобретение относится к способу для прогнозирования, является ли субъект или не является ли он чувствительным к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа, путем введения иммуногенной композиции, при этом указанный способ включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект прогнозируется как такой, который имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу для отбора субъекта, чувствительного к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа, путем введения иммуногенной композиции, при этом указанный способ включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект обладает повышенной чувствительностью к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу для прогнозирования, является ли субъект или не является ли он чувствительным к тому, чтобы отвечать позитивно на лечение, включающее введение иммуногенной композиций, при этом указанный способ включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект прогнозируется как такой, который имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу для отбора субъекта, чувствительного к тому, чтобы отвечать позитивно на лечение, включающее введение иммуногенной композиции, при этом указанный способ включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект обладает повышенной чувствительностью к развитию профилактического или терапевтического ответа, предпочтительно профилактического или терапевтического иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к ех-vivo способу анализа, будет ли субъект отвечать терапевтически на способ лечения, включающий введение иммуногенной композиции, где способ анализа включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект будет развивать профилактический или терапевтический ответ, предпочтительно профилактический или терапевтический иммунный ответ, на иммуногенную композицию.
В соответствии с другим воплощением настоящее изобретение относится к ех-vivo способу анализа, будет ли субъект отвечать терапевтически на способ лечения рака с помощью введения иммуногенной композиции, где способ анализа включает этапы:
- получение образца крови от субъекта; и
- измерение уровней sICAM-1, где низкие уровни sICAM-1 свидетельствуют о том, что субъект будет отвечать терапевтически на способ лечения рака. Как используется в данном случае по всей заявке, термины "любой" или "какой-либо" используются в смысле того, что они означают "по крайней мере, один", "по крайней мере, первый", "один или более" или "множество" из указанных соединений или этапов, если в контексте не указывается иное. Например, термин "любая клетка" включает множество клеток, включая их смеси. В частности, "по крайней мере, один" и "один или более" означает количество, которое составляет один или более одного, с особым предпочтением для одного, двух или трех.
Термин "и/или" при использовании где-либо в данной заявке включает значение "и", "или" и "все или какая-либо другая комбинация элементов, связанных с указанным термином".
Термин "приблизительно" или "около", как используется в данной заявке, имеет значение в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5%.
Термины "пациент", "субъект" относятся к позвоночному животному, в частности, представителю видов млекопитающих, и включают, но без ограничения, домашних животных, спортивных животных, приматов, включая людей.
Термины "пациент, выбранный в популяции пациентов, которая состоит из пациентов, имеющих низкие уровни sICAM-1", будет пониматься в значении пациента, для которого уровень sICAM-1 был измерен так, как раскрыто в данной заявке, и который имеет низкие уровни sICAM-1 в соответствии с изобретением. Когда количество исследуемых пациентов составляет более 1, то указанные пациенты образуют популяцию пациентов.
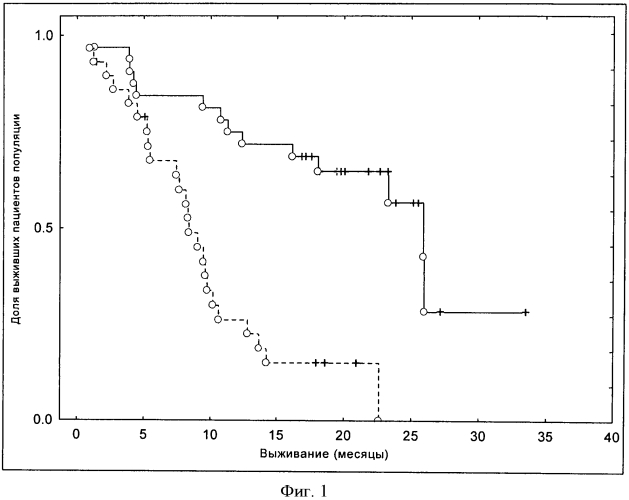
В соответствии со специальными воплощениями термины "пациент будет или является чувствительным к тому, чтобы отвечать терапевтически" означает то, что иммунный ответ указанного пациента после введения иммуногенной композиции в соответствии с изобретением повышается (то есть, повышенный иммунный ответ). В соответствии с предпочтительными воплощениями термины "пациент будет или является чувствительным к тому, чтобы отвечать терапевтически" означает, что указанный пациент имеет повышенный коэффициент выживания (смотри раздел "Примеры").
В соответствии с изобретением повышение коэффициента выживания наблюдают путем сравнения лечения в соответствии с настоящим изобретением со стандартным лечением, то есть, без отбора пациента, основанного на уровнях sICAM-1. В предпочтительном воплощении повышение коэффициента выживания наблюдают тогда, когда подвергнутый лечению пациент все еще остается живым через 5 лет, 2 года, 12 месяцев, 8 месяцев, 6 месяцев, 1 месяц после лечения в соответствии с изобретением.
Как используется в данной заявке, термин "лечение" или "процесс лечения" охватывает профилактику и/или терапию. В соответствии с этим иммуногенные комбинации или способы настоящего изобретения не являются ограниченными терапевтическими применениями и могут использоваться для профилактики. Это охватывается в данной заявке термином "для развития профилактического или терапевтического ответа, предпочтительно иммунного ответа". "Профилактика" не является ограниченной предотвращением немедленного заболевания (например, инфекционного заболевания), этот термин дополнительно охватывает предотвращение долгосрочных последствий этих инфекций, таких, как цирроз или рак.
"Эффективное количество" или "достаточное количество" активного соединения представляет собой количество, достаточное для достижения выгодных или желательных результатов, включая клинические результаты. Эффективное количество может вводиться в один или несколько приемов. "Терапевтически эффективное количество" представляет собой количество, достаточное для достижения выгодных клинических результатов, включая, но без ограничения, ослабление одного или более симптомов, ассоциированных с развитием опухоли, вирусной инфекцией, а также предотвращение заболевания (например, предотвращение одного или более симптомов рака или инфекции), стимуляцию/индукцию/усиление иммунной системы субъекта для облегчения существующего состояния или для защиты от иди для снижения настоящего или будущего вреда или инфекций (включая вирусные, бактериальные, паразитарные инфекции), например, сниженную пролиферацию опухолевых клеток или выждивание, сниженную репликацию патогена или сниженное распространение в организме субъекта, или способное к определению снижение нежелательного(ых) симптома(ов), ассоциированного(ых) с состоянием, продление выживания пациента.
Как используется в данной заявке, термины "sICAM-1" или sCD54 означают растворимую внутриклеточную адгезивную молекулу-1 и представляют циркулирующую форму ICAM-1. Термины sICAM-1 или sCD54 могут использоваться попеременно.
В соответствии с изобретением уровни sICAM-1 могут определяться с помощью любого способа, известного в области техники, например, материалы и способы в соответствии с настоящим изобретением могут использоваться с методикой Luminex (Luminex Corporation, Austin, Тех.) или твердофазными иммуноферментными анализами (ELISA, многочисленные наборы ELISA являются коммерчески доступными, например, от CliniScience, Diaclone, Biosource).
В соответствии с изобретением уровни sICAM-1 могут быть определены в образце общей крови или в плазме крови или сыворотке. В соответствии с этим "получение образца крови от субъекта" будет пониматься как включающее дополнительную обработку указанного образца крови, если уровень sICAM-1 должен определяться в плазме или сыворотке.
В соответствии с одним воплощением изобретения уровень sICAM определяется при использовании антител.
В соответствии с одним специфическим воплощением изобретения указанные антитела представляют собой моноклональные антитела.
В соответствии с одним специфическим воплощением изобретения указанные антитела являются меченными, например, с помощью флуоресцентной метки, радиоактивной метки, фермента, биотина или с помощью любого другого средства, предназначенного для того, чтобы сделать sICAM-1, меченный с помощью указанных антител, способным к обнаружению. Такие методики широко используются и являются известными в области техники.
Анти-С054 моноклональные антитела, в частности, моноклональные антитела, являются широко доступными на коммерческой основе. Смотри, например, антитело 3Н1547 от Anticorps-enligne.fr, антитело 5540-Р (Biocytex).
В соответствии со специальным воплощением термины "низкие уровни sICAM-1" означают уровни, составляющие менее, чем приблизительно 300 нг/мл, предпочтительно менее, чем приблизительно 250 нг/мл, более предпочтительно менее, чем приблизительно 224 нг/мл и более предпочтительно менее, чем приблизительно 200 нг/мл. Указанный уровень может измеряться с помощью Multi-analyte анализа белка плазмы при использовании системы Luminex® (например, Luminex® xMAP™ методики, R&D Systems).
Как используется в данной заявке, термины "иммуногенная композиция" "вакцинная композиция", "вакцина" или подобные термины могут использоваться попеременно и означают агент, приемлемый для стимуляции/индукции/усиления иммунной системы субъекта для облегчения существующего состояния или для защиты от, или для снижения настоящего или будущего вреда или инфекций (включая вирусные, бактериальные, паразитарные инфекции), например, сниженную пролиферацию опухолевых клеток или выживание, сниженную репликацию патогена или распространение в организме субъекта или способное к определению снижение нежелательного(ых) симптома(ов), ассоциированного(ых) с состоянием, продление выживания пациента.
Указанная иммуногенная композиция может содержать (i) весь или часть, по крайней мере, одного целевого антигена и/или (ii) по крайней мере, один рекомбинантный вектор экспрессирующий in vivo всю или часть, по крайней мере, одной гетерологичной нуклеотидной последовательности, в частности, гетерологичной нуклеотидной последовательности, кодирующей весь или часть, по крайней мере, одного целевого антигена. В соответствии с альтернативным воплощением иммуногенная композиция в соответствии с изобретением включает (iii) по крайней мере, один модификатор иммунного ответа, самостоятельно или в комбинации с (i) и/или (ii). Примеры таких модификаторов иммунного ответа (IRM), включают CpG олигонуклеотиды (смотри US 6,194,388; US 2006094683; WO 2004039829, например), липополисахариды, комплексы полиинозиновой:полицитидиловой кислоты (Kadowaki, и др., 2001, J. Immunol. 166, 2291-2295), и полипептиды и белки, известные для индукции продукции цитокинов из дендритных клеток и/или моноцитов/макрофагов. Другие примеры таких модификаторов иммунного ответа (IRM) представляют собой малые органические молекулы, такие как имидазохинолинамины, имидазопиридинамины, 6,7-слитые циклоалкилимидазопиридинамины, имидазонафтиридинамины, оксазолхинолинамины, тиазолхинолинамины и 1,2-соединенные мостиковой связью имидазолхинолинамины (смотри, например, US 4,689,338; US 5,389,640; US 6,110,929 и US 6.331,539).
Как используется в данной заявке, термин "антиген" относится к любому веществу, включая комплексные антигены (например, опухолевых клеток, инфицированных вирусом клеток и т.д.), которые являются способными быть мишенью иммунного ответа. Антиген может быть мишенью, например, для клеточного и/или гуморального иммунного ответа, возникающего у пациента. Термин "антиген" охватывает, например, все или часть вирусных антигенов, специфические для опухоли или связанные с опухолью антигены, бактериальные антигены, паразитарные антигены, аллергены и подобные им:
Вирусные антигены включают, например, антигены из вирусов гепатита А, В, С, D и Е, ВИЧ, вирусов герпеса, цитомегаловируса, вируса ветряной оспы, папилломавирусов, вируса Эпштейна-Барра, вирусов гриппа, вирусов парагриппа, аденовирусов, вирусов коксаки, пикорнавирусов, ротавирусов, респираторно-синцитиальных вирусов, вирусов оспы, риновирусов, вируса краснухи, паповавируса, вируса эпидемического паротита, вируса кори; некоторые неограничивающие примеры известных вирусных антигенов включают следующие: антигены, имеющие происхождение от ВИЧ-1, такие как tat, nef, gpl20 или gpl60, gp40, p24, gag, env, vif, vpr, vpu, rev или их часть и/или комбинации; антигены, имеющие происхождение от вирусов герпеса человека, такие как gH, gL gM gB gC gK gE или gD или их часть и/или комбинации или предранний белок, такой, как asICP27, ICP47, ICP4, ICP36 из HSV1 или HSV2; антигены, имеющие происхождение от цитомегаловируса, в частности цитомегаловируса человека, такие как gB или его производные; антигены, имеющие происхождение от вируса Эпштейна-Барра, такие как gp350 или его производные; антигены, имеющие происхождение от вируса ветряной оспы, такие как gpl, 11, 111 и IE63; антигены, имеющие происхождение от вируса гепатита, такие, как антиген вируса гепатита В, гепатита С или гепатита Е (например, env белок Е1 или Е2, сердцевинный белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, или их части и/или комбинации HCV); антигены, имеющие происхождение от папилломавирусов человека (например, HPV6, 11, 16, 18, например, L1, L2, Е1, Е2, E3, Е4, Е5, Е6, Е7, или их части и/или комбинации); антигены, имеющие происхождение от других вирусных патогенов, таких как респираторно-синцитиальный вирус (например, F и G белки или их производные), вируса парагриппа, вируса кори, вируса эпидемического паротита, флавивирусов (например, вируса желтой лихорадки, вируса Денге, вируса клещевого энцефалита, вируса японского энцефалита) или вируса гриппа (например, НА, NP, NA, или М белки, или их части и/или комбинации).
Специфические для опухоли или родственные антигены включают, но без ограничения, такие карциномы, лимфомы, бластомы, саркомы и лейкемии. В частности, примеры видов рака включают рак молочной железы, рак предстательной железы, рак толстого кишечника, рак чешуйчатых клеток, мелкоклеточный рак легких, немелкоклеточный рак легких, желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак желчного пузыря, гепатому, колоректальный рак, эндометриальную карциному, карциному слюнных желез, рак почки, рак печени, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному и различные типы рака головы и шеи, ренальный рак, злокачественную меланому, ларингеальный рак, рак предстательной железы. Раковые антигены представляют собой антигены, которые могут потенциально стимулировать очевидные специфические для опухоли иммунные ответы. Некоторые из этих антигенов кодируются, несмотря на то, что с необходимостью не экспрессируются, нормальными клетками. Эти антигены могут характеризоваться как такие, которые в норме являются молчащими (то есть, не экспрессируются) в нормальных клетках, такими, которые экспрессируются только на низких уровнях или на определенных стадиях дифференциации, и те, которые экспрессируются временно, такие как эмбриогенные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими как онкогены (например, активированный ras онкоген), супрессорные гены (например, мутант р53), слитые белки, возникающие в результате внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут кодироваться вирусными генами, например, такие как те, которые имеют происхождение от РНК и ДНК опухолевых вирусов. Некоторые неограничивающие примеры специфических для опухоли или связанных с опухолью антигенов включают MART-1/Melan-A, gp100, дипептидилпептидазу IV (DPPIV), белок, связывающий аденозиндезаминазу (ADAbp), циклофилин b, колоректальный ассоциированный антиген (CRC)-C017-1A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и CAP-2, etv6, aml1, специфический антиген простаты (PSA) и его иммуногенные эпитопы PSA-1, PSA-2, и PSA-3, специфический мембранный антиген простаты (PSMA), Т-клеточный рецептор/СО3-дзета цепь, MAGE-семейство опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10. MAGE-А11, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-В3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3. MAGE-C4, MAGE-C5), GAGE-семейство опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE. RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, р53, MUC семейство (например, MUC-1), HER2/neu, p21ras, RCAS1, альфа-фетобелок, Е-кадгерин, альфа-катенин, бета-катенин и гамма-катенин, pl20ctn, gp100.sup.Pmel 117, FRAME, NY-ESO-1, cdc27, белок, характерный для аденоматозного полипоза толстой кишки (АРС), фодрин, коннексин 37, Ig-идиотип, р15, gp75, GM2 и GD2 ганглиозиды, вирусные продукты, такие, как белки вируса папилломы человека, Smad семейство опухолевых антигенов, lmp-1, P1A, кодируемый EBV ядерный антиген (EBNA)-1, гликогенфосфорилаза мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7 и с-erbB-2;
- бактериальные антигены включают, например, антигены, имеющие происхождение от Mycobacteria, которые вызывают ТВ и проказу, пневмококков, аэробных грамм-негативных бацилл, микоплазм, стафилококковых инфекций, стрептококковых инфекций, сальмонеллы, хламидий, нейссерии;
- другие антигены включают, например, антигены, имеющие происхождение от возбудителей малярии, лейшманиоза, трипаносомоза, токсоплазмоза, шистосомоза, филяриоза;
- аллергены относятся к веществам, которые могут индуцировать аллергический или астматический ответ у чувствительного субъекта. Список аллергенов является неисчислимым и может включать пыльцу, яды насекомых, пыль из шерсти животных, споры грибов и лекарственные средства (например, пенициллин). Примеры природных, животных и растительных аллергенов включают, но без ограничения, белки, специфические для следующих родов: Canine (Canis familiaris); Dermatophagoides (например, Dermatophagoides farinae); Felis (Felis domesticus); Ambrosia (Ambrosia artemiisfolia; Lolium (например, Lolium perenne или Lolium multiflorum); Cryptomeria (Cryptomeria japonica); Altemaria (Altemaria altemata); Alder; Ainus (Ainus gultinoasa); Betula (Betula verrucosa); Quercus (Quercus alba); Olea (Olea europa); Artemisia (Artemisia vulgaris); Plantago (например, Plantago lanceolata); Parietaria (например, Parietaria officinalis или Parietaria judaica); Blattella (например, Blattella germanica); Apis (например, Apis multiflorum); Cupressus (например, Cupressus sempervirens, Cupressus arizonica и Cupressus macrocarpa); Juniperus (например, Juniperus sabinoides, Juniperus virginiana, Juniperus communis и Juniperus ashei); Thuya (например, Thuya orientalis); Chamaecyparis (например, Chamaecyparis obtusa); Periplaneta (например, Periplaneta americana); Agropyron (например, Agropyron repens); Secale (например, Secale cereale); Triticum (например, Triticum aestivum); Dactylis (например, Dactylis glomerata); Festuca (например, Festuca elatior); Poa (например, Роа pratensis или Poa compressa); Avena (например, Avena sativa); Holcus (например, Holcus lanatus); Anthoxanthum (например, Anthoxanthum odoratum); Arrhenatherum (например, An-henatherum elatius); Agrostis (например, Agrostis alba); Phleum (например, Phleum pratense); Phalaris (например, Phalaris arundinacea); Paspalum (например, Paspalum notatum); Sorghum (например, Sorghum halepensis); и Bromus (например, Bromus inermis).
В соответствии со специальным воплощением указанный антиген кодируется гетерологичной нуклеотидной последовательностью и экспрессируется in vivo с помощью рекомбинантного вектора.
В особенно предпочтительном воплощении гетерологичная нуклеотидная последовательность в соответствии с настоящим изобретением кодирует один или более из всего или части следующих антигенов HBV-PreS1 PreS2 и поверхностных env белков, сердцевинного и po1HIV-gp120 gp40,gp160, p24, gag, pol, env, vif, vpr, vpu, tat, rev, nef; HPV-E1, E2, E3, E4, E5, E6, E7, E8, LI, L2 (смотри, например, WO 90/10459, WO 98/04705, WO 99/03885); HCV env белка E1 или E2, сердцевинного белка, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7 (смотри, например, WO 2004111082, WO 2005051420).
Muc-1 (смотри, например, US 5,861,381; US 6,054,438; WO 98/04727; WO 98/37095).
В соответствии с вариантами данного изобретения иммуногенная композиция содержит, по крайней мере, два антигена или гетерологичную нуклеотидную последовательность, которая кодирует, по крайней мере, два антигена, или, по крайней мере, гетерологичные нуклеотидные последовательности, которые кодируют, по крайней мере, два антигена, или любую их комбинацию.
В соответствии с другим специальным воплощение