Способ получения бета-функционализированных алифатических сложных эфиров
Иллюстрации
Показать всеИзобретение относится к способу получения β-функционализированных сложных эфиров карбоновых кислот, соответствующих формуле (I), где R означает алкильную группу с числом атомов углерода от одного до восьми, R′ означает атом водорода или алкильную структурную единицу с числом атомов углерода от одного до восьми и n означает ноль или целое число от 1 до 20, и X означает группу Ph-R″, где R″ означает атом водорода или алкильную группу с числом атомов углерода от одного до шести, или означает группу R″″-N-R′′′, где R′′′ и R″″ независимо друг от друга означают линейные или разветвленные или же циклические алкильные группы с числом атомов углерода от одного до восьми, где ненасыщенный сложный эфир, соответствующий общей формуле (II), где n, R и R′ имеют то же самое значение, что и в формуле (I), подвергают взаимодействию в одном реакторе с соединением бора формулы (III), где М означает анион, R″ принимает то же значение, что и в формуле (I), и Ar означает фенил, или с амином R″″-NH-R′′′ (IV), где R′′′ и R″″ имеют представленное выше значение, при этом реакцию проводят в растворителе в присутствии содержащего родий катализатора в бескислородной атмосфере при температурах от 80 до 120°C. Способ позволяет получать продукт в одном реакторе. 6 з.п. ф-лы, 19 пр., 3 табл.
Реферат
Настоящее изобретение относится к способу получения β-функционализированных сложных эфиров карбоновых кислот.
Контролируемая и селективная миграция двойных CC-связей представляет широкие синтетические возможности, поскольку она делает возможным получение in situ определенных изомеров для их функционализации, когда они не могут быть получены другим путем. Ненасыщенные алифатические сложные эфиры карбоновых кислот, включая сложные эфиры жирных кислот, исследовались как субстраты для таких реакций изомеризации уже более шестидесяти лет. Миграция олефиновой двойной связи комбинировалась с некоторыми реакциями функционализации, например с реакцией гидроборирования, бутенолиза, метатезиса, метоксикарбонилирования, гидроформилирования, гидроаминометилирования. В частности, малоизученными оказались сопряженные с изомеризацией реакции функционализации длинноцепочечных ненасыщенных сложных эфиров жирных кислот из возобновляемых источников сырья, при этом общим для примеров таких превращений является то, что целевая реакция протекает по метильному концу алкильной цепи, см., например, публикации K.Y. Ghebreyessus, R.J. Angelici, Organometallics 2006, 25, 3040-3044.
В соответствии с этим существует постоянная потребность в разработке новых или в усовершенствовании известных последовательных реакций, которые приводят к получению β-функционализированных алифатических сложных эфиров. В частности, предпочтительными являются последовательности превращений, которые позволяют получать целевой продукт в одном реакторе, в отличие от тех, в которых используются различные отличающиеся по химизму и по затратам на реализацию стадии реакций.
Было обнаружено, что катализируемая родием изомеризация, сопряженная с присоединением, представляет собой новый ценный способ получения β-функционализированных сложных эфиров.
В соответствии с этим настоящее изобретение относится к способу получения β-функционализированных сложных эфиров карбоновых кислот, представленных формулой (I)
,
где
R означает алкильную группу с числом атомов углерода от одного до восьми,
R′ означает атом водорода или алкильную структурную единицу с числом атомов углерода от одного до восьми и
n означает ноль или целое число от 1 до 20 и
X означает группу Ph-R′′, где R′′ означает атом водорода или алкильную группу с числом атомов углерода от одного до шести или означает группу R′′′′-N-R′′′, где R′′′ и R′′′′ независимо друг от друга означают линейные или разветвленные или же циклические алкильные группы с числом атомов углерода от одного до восьми,
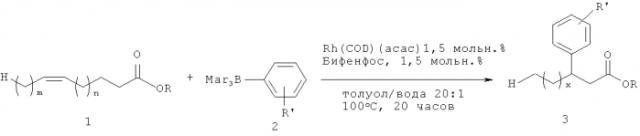
при этом способ отличается тем, что он реализуется в одном реакторе (one-pot) по реакции ненасыщенного сложного эфира, соответствующего общей формуле (II)
,
где n, R и R′ имеют то же самое значение, что и в формуле (I), с соединением бора формулы (III)
где n, R и R′ имеют то же самое значение, что и в формуле (I), с соединением бора формулы (III)
,
где
M означает анион и
R′′ принимает то же значение, что и в формуле (I),
или с амином R′′′′-NH-R′′′ (IV), где R′′′ и R′′′′ имеют представленное выше значение, в присутствии содержащего родий катализатора в бескислородной атмосфере при температурах от 80 до 120°C в растворителе.
Соответствующий настоящему изобретению способ, основанный на принципе термодинамического равновесия изомеров, реализуется в одном реакторе в присутствии катализатора; с его помощью можно проводить превращение удаленных двойных связей в олефиновых сложных эфирах для введения их в реакцию с нуклеофилами и получать β-функционализированные соединения. Из быстро превращающихся друг в друга изомеров, отличающихся положением двойных связей, только α,β-ненасыщенные соединения вступают в сопряженные реакции присоединения, а их расход восполняется другими изомерами, с которыми они находятся в обратимом равновесии. Примером аналогичного превращения служит внутримолекулярная реакция каталитического образования лактонов из ненасыщенных жирных кислот, разработанная ранее этой же группой исследователей. В основу разработки этой новой тандемной реакции положено независимое исследование двух включенных в нее стадий, представляющих собой изомеризацию и сопряженное присоединение.
Субстратом является эфир карбоновой кислоты (II) с одной двойной CC-связью в алкильной части кислоты. Предпочтение отдается сложным эфирам олефиновых кислот (II) с не менее чем пятью атомами углерода в кислотной части и в максимуме до двадцати двух атомов углерода. Эти соединения могут быть получены известными способами или же они могут быть приобретены коммерческим путем. В частности, предпочтение отдается ненасыщенным кислотам из таких натуральных источников, как жиры и масла; в соответствии с этим примерами таких ненасыщенных кислот служат олеиновая кислота или элаидиновая кислота.
Соответствующая настоящему изобретению реакция протекает в растворителе, который в предпочтительном случае выбирают из бензола, толуола, хлорбензола, дифенилового эфира или смесей воды с представленными выше растворителями. Реакцию можно также проводить в безводных условиях. Предпочтение отдается ароматическим растворителям, в частности толуолу. Кроме того, предпочтительно, когда используется органический растворитель в смеси с водой, при этом целесообразно использовать смеси, включающие от 60 до 90% толуола и от 40 до 10% воды. В предпочтительном варианте растворитель выбирают из толуола или из смеси воды и толуола при соотношении масс от 1:25 до 1:10, предпочтительное соотношение составляет 1:20.
Еще одним условием для реализации способа является отсутствие кислорода (O2) при проведении реакции. В соответствии с этим предпочтительно, когда реакцию проводят в атмосфере азота (N2) или аргона (Ar), но при нормальном давлении.
Для протекания реакции требуется повышенная температура в пределах от 80 до 120°C, в более предпочтительном случае от 100 до 110°C. Время реакции определяется используемыми количествами, однако обычно для завершения реакции требуется от 15 до 25 часов.
Используемый катализатор выбирают из катализаторов, включающих родий, в предпочтительном случае они включают атом родия в степени окисления +1. В частности, предпочтение отдается комплексам родия с различными органическими лигандами. В данном случае один из вариантов настоящего изобретения относится к содержащим родий катализаторам, которые в предпочтительном случае выбирают из (i) Rh(acac)(COD), [Rh(OH)(COD)]2 или [Rh(Cl)(COD)]2 и в наиболее предпочтительном случае эти катализаторы используют вместе с (ii) бифенфосом или триаллилфосфитом в качестве лигандов при молярных соотношениях (i):(ii), составляющих от 2:1 до 1:2, предпочтительно, когда это соотношение составляет 1:1.
Второе используемое в реакции соединение представляет собой нуклеофил, выбираемый из соединения бора (III) или из диамина (IV). Предпочтительные соединения бора выбирают из группы, включающей фенилбороновую кислоту (PhB(OH)2), эфир фенилбороновой кислоты (PhB(pin)), фенилборонат MIDA, PhBF3K, КВ(4-ClC6H4)4, NaB(2-нафтил)4, NaB(4-толил)4 и KB(2-тиенил)4. Такие родиевые комплексы широко известны и коммерчески доступны, см. публикацию A. Behr, D. Obst, A. Westfechtel, Eur. J. Lipid Sci. Technol. 2005,107, 213-219.
В качестве аминов используются, в частности, такие циклические амины, как пиррол, пирролины и пирролидины.
Эта реакция может протекать при простом смешивании участвующих в превращении соединений и следующим за этим нагреванием смеси при температуре реакции. После завершения реакции и охлаждения смеси целевой продукт может быть выделен известными способами выделения, при этом предпочтение отдается хроматографическим способам.
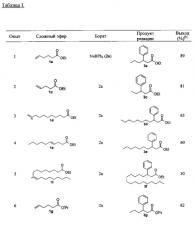
Обзор по β-эфирам, которые были получены в соответствии с настоящим изобретением и в соответствии с представленной схемой реакции
приведен в таблице I.
Условия реакции: 0,5 ммоля еноата 1, 2,0 ммоля тетраарилбората 2, 0,015 ммоля Rh(acac)(COD), 0,015 ммоля бифенфоса, толуол/вода: 3,0 мл/0,15 мл, 100°C, 20 часов, атмосфера аргона.
[a] N соответствует числу возможных изомеров.
[b] Выход после выделения.
[c] Использовалось 0,03 ммолей катализатора.
[d] Добавлено 2,0 эквивалента 18-краун-6.
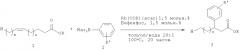
В следующей далее таблице II представлены продукты реакции аминов с олефиновыми сложными эфирами в соответствии со схемой реакции
Условия реакции: 0,5-1,0 ммоля еноата 1, 5,0-10,0 ммолей амина 4, 0,015 эквивалента Rh(acac)(CO)2, 0,015 эквивалента бифенфоса, 2,0 мл/ммоль толуола, 100°C, 20 часов, аргоновая атмосфера.
Распространение этого нового синтетического подхода на эфиры жирных кислот или на триглицериды может иметь практическую ценность при использовании растительных масел в качестве возобновляемого источника сырья.
Полученные соответствующим изобретению способом вещества могут найти применение в составе косметических композиций. В частности, предпочтение отдается использованию масляной фазы в качестве смягчающего средства. Кроме того, эти соединения подходят на роль растворителей для самых разных УФ-фильтров.
Примеры
Примеры получения. Общая методика.
Реакции проводят в азотной атмосфере в стеклянной посуде, высушенной в термошкафу, с покрытой тефлоном мешалкой и сухой мембраной. Для удаления из реакционной среды кислорода растворители перед смешиванием их с реагентами освобождают от газов пропусканием через них аргона в течение 45 минут. Перед использованием растворители очищают стандартными способами. Течение всех реакций контролируют с помощью газовой хроматографии, используя в качестве внутреннего стандарта н-додекан. Факторы отклика продуктов реакций сопоставляют экспериментальным путем с н-додеканом, анализируя известные количества веществ. Анализы с помощью газовой хроматографии проводят с использованием капиллярной колонки НР-5 (фенилметилсилоксан, 30 м×320×0,25, 100/2,3-30-300/3) с программированием по времени, начиная от 2 минут при 60°C, затем с повышением температуры на 30°C в минуту до 300°C и далее в течение 3 минут при этой температуре. Для хроматографирования на колонке используют систему Combi Flash Companion-Chromatography-System (Isco-Systems) и колонки с насадкой RediSep (12 г). Анализы с помощью тонкослойной хроматографии проводят на поступающих в продажу пластинках с силикагелем 60 F254. Спектры ЯМР снимают на приборах Bruker АМХ 200, АМХ 400 или Bruker Avance 600, используя в качестве растворителя дейтерохлороформ; резонансные частоты для протонов и углерода составляют 200, 400 или 600 МГц и, соответственно, 51, 101 или 151 МГц. Масс-спектры получены на приборе GC-MS Saturn 2100 T (Varian). Приобретаемые коммерческим путем субстраты использовались в том виде, в котором они поставляются, если не указано иное. Отсутствующие в каталогах олефиновые сложные эфиры I были синтезированы из соответствующих кислот с использованием стандартных способов этерификации.
Общий способ проведения сопряженных реакций изомеризации-присоединения с участием арилборатов.
В высушенную в термошкафу пробирку объемом 20 мл с утолщенным верхним краем загружают ацетилацетонато(1,5-циклооктадиен)родий(1) (1,5 мол.%), бифенфос (1,5 мол.%), арилборатную соль (2,0 эквивалента) и вносят в пробирку мешалку, закрывают пробирку тефлоновой мембраной и три раза промывают ее аргоном с помощью вакуума. После этого через шприц для подкожного введения прибавляют толуол (3 мл на ммоль сложного эфира), олефиновый сложный эфир 1 (0,5-1,0 ммоль) и воду (150 мкл на ммоль сложного эфира) и перемешивают реакционную смесь в течение 20 часов при 100°C. После охлаждения до комнатной температуры (21°C) удаляют в вакууме растворитель и с помощью флэш-хроматографии на колонке (SiO2, этилацетат - гексан или диэтиловый эфир - гексан) выделяют сложный эфир 3.
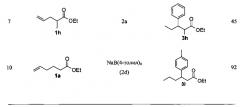
Этиловый эфир 3-фенилгексановой кислоты (3a). Соединение 3а синтезируют в соответствии с общей методикой из этил-5-гексеноата (1a) (75,0 мг, 0,5 ммоля) и тетрафенилбората натрия (2a) (343 мг, 1,0 ммоль). Выделение 3a проводят с помощью флэш-хроматографии на колонке (SiO2, этилацетат - гексан 1:8), выход 3a в виде бесцветной жидкости составляет 98 мг (89%).
CAS-Nr. 99903-38-5. 1H ЯМР (600 МГц, дейтерохлороформ) м.д.: 7,23-7,29 (м., 2Н), 7,14-7,18 (м., 3Н), 4,00 (кв., J=7,1 Гц, 2Н), 3,06-3,11 (м., 1H), 2,51-2,62 (м., 2Н), 1,54-1,64 (м., 2Н), 1,09-1,20 (м., 5Н), 0,80-0,88 (м., 3H). 13С ЯМР (101 МГц, дейтерохлороформ) м.д.: 172,3, 144,1, 128,3, 127,4, 126,3, 60,1, 41,9, 41,8, 38,4, 20,4, 14,0, 13,9. Масс-спектр (ионная ловушка, электроионизация): m/z(%)=221 [М+] (86), 174 (55), 135 (68), 132 (92), 118 (37), 105 (27), 91 (100).
Препаративный синтез этилового эфира 3-фенилгексановой кислоты.
В высушенную в термошкафу пробирку с утолщенным верхним краем объемом 50 мл загружают ацетилацетонато(1,5-циклооктадиен)родий (1) (46,5 мг, 0,15 ммоля), бифенфос (124 мг, 0,15 ммоля), тетрафенилборат натрия (2a) (6,86 г, 19,9 ммоля) и вносят в пробирку мешалку, закрывают пробирку тефлоновой мембраной и три раза промывают ее аргоном с помощью вакуума. После этого через шприц для подкожного введения прибавляют толуол (30 мл), этил-5-гексеноат (1a) (1,48 г, 10,0 ммолей) и воду (1,5 мл) и перемешивают реакционную смесь 20 часов при 100°C. После охлаждения до комнатной температуры удаляют в вакууме растворитель и с помощью флэш-хроматографии на колонке (40 г SiO2, диэтиловый эфир - гексан 1:9) выделяют сложный эфир 3а в виде бесцветной жидкости (1,75 г, 80%). Представленные результаты предназначены только для того, чтобы показать, что выбранный родиевый катализатор приводит к получению целевых β-функционализированных продуктов.
| Таблица 1 | ||||
| Опыт | Катализатор (мол.%) | Лиганд (мол.%) | XnB-Ph2 (экв.) | Выход (%) |
| 1 | [Rh(COD)Cl]2 (0,5) | Бифенфос (1.0) | NaBPh4 (l,5) | 40 |
| 2 | [Rh(COD)Cl]2 (0,5) | Бифенфос (1,0) | NaBPh4 (2,0) | 47 |
| 3 | - | Бифенфос (1,0) | NaBPh4 (l,5) | 0 |
| 4 | [Rh(COD)Cl]2 (0,5) | - | NaBPh4 (1,5) | 0 |
| 5 | [Rh(OH)Cl)]2 (0,5) | Бифенфос (1,0) | NaBPh4 (1,5) | 38 |
| 6 | Rh(COD)(acac) (l,0) | Бифенфос (1,0) | NaBPh4 (1,5) | 57 |
| 7 | Rh(COD)(acac) (l,5) | Бифенфос (1,5) | NaBPh4 1(1,5) | 65 |
| 8 | Rh(COD)(acac) (l,5) | Бифенфос (15) | NaBPh4 (2,0) | 91 |
| pin=пинакол; | ||||
| MIDA=боронат N-метилиминодиуксусной кислоты. |
1. Способ получения β-функционализированных сложных эфиров карбоновых кислот, соответствующих формуле (I) ,где R означает алкильную группу с числом атомов углерода от одного до восьми,R′ означает атом водорода или алкильную структурную единицу с числом атомов углерода от одного до восьми иn означает ноль или целое число от 1 до 20 иX означает группу Ph-R″, где R″ означает атом водорода или алкильную группу с числом атомов углерода от одного до шести, или означает группу R″″-N-R′′′, где R′′′ и R″″ независимо друг от друга означают линейные, или разветвленные, или же циклические алкильные группы с числом атомов углерода от одного до восьми,отличающийся тем, что ненасыщенный сложный эфир, соответствующий общей формуле (II) ,где n, R и R′ имеют то же самое значение, что и в формуле (I),подвергают взаимодействию в одном реакторе с соединением бора формулы (III) ,где М означает анион,R″ принимает то же значение, что и в формуле (I), и Ar означает фенил,или с амином R″″-NH-R′′′ (IV), где R′′′ и R″″ имеют представленное выше значение,при этом реакцию проводят в растворителе в присутствии содержащего родий катализатора в бескислородной атмосфере при температурах от 80 до 120°C.
2. Способ по п. 1, отличающийся тем, что используют ненасыщенный эфир формулы (II), где R′ означает атом водорода и R означает этильную группу.
3. Способ по п. 1, отличающийся тем, что содержащий родий катализатор выбирают из комплексов родия, содержащих атом родия в степени окисления +1.
4. Способ по п. 1, отличающийся тем, что содержащий родий катализатор выбирают из (i) Rh(acac)(COD), [Rh(OH)(COD)]2 или [Rh(Cl)(COD)]2 вместе с (ii) бифенфосом или триаллилфосфитом в качестве лигандов в молярном соотношении (i):(ii) от 2:1 до 1:2, предпочтительно 1:1.
5. Способ по п. 1, отличающийся тем, что растворитель выбирают из бензола, толуола, хлорбензола, дифенилового эфира или смесей воды с представленными выше растворителями.
6. Способ по п. 5, отличающийся тем, что растворитель выбирают из толуола или смеси толуола с водой при соотношении масс от 1:25 до 1:10, предпочтительно 1:20.
7. Способ по одному из пп. 1-6, отличающийся тем, что соединение бора, соответствующее формуле (III), выбирают из группы, включающей Ph4BNa и NaB(4-толил)4.