Способ получения продукта для регенерации воздуха
Иллюстрации
Показать всеИзобретение относится к способам получения продуктов для регенерации воздуха в системах жизнеобеспечения человека при создании локальных дыхательных атмосфер. Способ получения продукта для регенерации воздуха заключается во взаимодействии стабилизированного сульфатом магния раствора пероксида водорода и гидроксидов натрия и калия с последующей дегидратацией полученного щелочного раствора пероксида водорода распылением его в токе сушильного агента. В щелочной раствор пероксида водорода перед добавлением сульфата магния вводят тетрабораты щелочных металлов, в качестве которых используют тетрабораты лития, натрия, калия или их смесь. Мольное соотношение исходных компонентов равно следующим величинам: пероксид водорода/сульфат магния (H2O2/MgSO4) 450÷670; пероксид водорода/тетраборат щелочного металла (H2O2/Me2B4O7) 160÷1000; H2O2/NaOH 7,0÷66,7; H2O2/KOH 1,60÷2,00. Продукт для регенерации воздуха, полученный по изобретению, обладает улучшенными кинетическими параметрами процесса хемосорбции диоксида углерода и обеспечивает большее время защитного действия при его эксплуатации в системах жизнеобеспечения человека. 1 табл., 1 ил.
Реферат
Изобретение относится к способам получения продуктов для регенерации воздуха, используемых в системах жизнеобеспечения человека при создании локальных дыхательных атмосфер.
Известен способ получения продукта для регенерации воздуха [патент РФ №2408403, МПК A62D 9/00, 2011 г.]. Способ заключается в смешении раствора пероксида водорода, предварительно стабилизированного сульфатом магния, с гидроксидами калия и натрия с последующей дегидратацией полученного щелочного раствора пероксида водорода распылением его в токе сушильного агента. Мольное соотношение исходных компонентов составляют следующие величины: H2O2/MgSO4=492-650; H2O2/NaOH=8,0-58,0; H2O2/KOH=1,60-1,88. Гидроксид калия вводят в жидкую фазу примерно через 30 минут после введения всех других компонентов.
Однако продукт для регенерации воздуха, полученный известным способом, характеризуется недостаточно высокой скоростью процесса хемосорбции диоксида углерода при его использовании в системах регенерации воздуха. Этот недостаток особенно отчетливо проявляется при эксплуатации систем жизнеобеспечения человека, снаряженных указанным продуктом для регенерации воздуха, в режиме высоких нагрузок, требующих быстрого удаления из газовой фазы значительного количества диоксида углерода. Низкие скорости поглощения диоксида углерода приводят к его накоплению в регенерируемом газе, что может крайне негативно сказаться не только на физическом состоянии пользователя системами СЖО, но и представлять серьезную опасность для его жизни.
Следует также отметить, что при распаде пероксида водорода выделяется атомарный кислород - один из наиболее сильных окислителей, что при разложении существенных количеств H2O2 (реализации данного способа получения продукта для регенерации воздуха в промышленном масштабе) создает угрозу возникновения «кислородного» пожара, устранить который практически невозможно.
Задачей изобретения является разработка способа получения продукта для регенерации воздуха, имеющего улучшенные эксплуатационные характеристик при его работе в системах жизнеобеспечения человека.
Технический результат заключается в получении продукта для регенерации воздуха, имеющего высокую скорость процесса хемосорбции диоксида углерода за счет интенсификации массообменных процессов на границах газ - жидкость и жидкость - твердая фаза при его эксплуатации в системах жизнеобеспечения человека.
Дополнительным техническим результатом является повышение безопасности и экономичности процесса.
Технический результат достигается тем, что в способе получения продукта для регенерации воздуха, включающем смешение пероксида водорода с сульфатом магния и гидроксидами натрия и калия с последующей дегидратацией полученного щелочного раствора пероксида водорода распылением его в токе сушильного агента, в исходный раствор пероксида водорода перед добавлением сульфата магния вводят тетрабораты щелочных металлов. При этом мольное соотношение исходных компонентов равно следующим величинам: пероксид водорода/сульфат магния (H2O2/MgSO4)=450÷670; пероксид водорода/тетраборат щелочного металла (H2O2/Me2B4O7)=160÷1000; H2O2/NaOH=7,0÷66,7; H2O2/KOH=1,60÷2,00.
Предпочтительно в качестве тетрабората щелочного металла используют тетрабораты лития, натрия, калия или их смесь.
Гидроксид калия предпочтительно вводить в жидкую фазу примерно через 10÷15 минут после введения всех других компонентов.
Изобретение позволяет достигнуть заявленный технический результат по следующим обстоятельствам. Как хорошо известно специалистам, работающим в технике процессов хемосорбции, поглощение из газообразной фазы сорбата происходит в тонком слое жидкой фазы, образующейся на поверхности хемосорбентов. Часто лимитирующей стадией процессов хемосорбции является внутренняя диффузия молекул сорбата в объем жидкой фазы и образование в ней ионизированных молекул, вступающих в химические реакции. Присутствие в жидкой фазе в указанном количестве тетраборатов щелочных металлов приводит к снижению вязкости поверхностной пленки водного раствора, образующейся на поверхности продукта для регенерации воздуха, что приводит к усилению диффузионных процессов на границах раздела фаз, в жидкой фазе и повышению растворимости и ионизации реагирующих веществ в водном растворе поверхностной пленки. В результате за счет интенсификации массообменных процессов на границах газ - жидкость и жидкость - твердая фаза повышается кинетика процесса хемосорбции диоксида углерода продуктом для регенерации воздуха.
Следует также отметить, что полученный щелочной раствор пероксида водорода при температуре 25°C за одинаковый интервал времени теряет меньше активного кислорода, чем щелочной раствор пероксида водорода, приготовленный с использованием технологических приемов и соотношения компонентов, описанных в патенте РФ 2408403. Таким образом, здесь абсолютно уместно говорить об увеличении стабилизирующего влияния присутствующих в щелочном растворе пероксида водорода ионов на химическую устойчивость жидкой фазы и повышении безопасности процесса получения продукта для регенерации воздуха. Механизм стабилизации различных растворов пероксида водорода неизвестен [Г.А. Серышев. Химия и технология перекиси водорода. - Л.: Химия, - 1984. - С. 182]. Поэтому сложно однозначно оценить влияние того или иного иона или их ассоциатов, содержащихся в многокомпонентном растворе, на стабильность системы в целом. Нахождение стабилизатора для конкретной цели - задача, которая решается только эмпирическим путем. Но было отмечено, что в раствор пероксида водорода в первую очередь следует вводить тетрабораты щелочных металлов, а после их растворения вводить в пероксид водорода сульфат магния.
Кроме того, использование тетраборатов щелочных металлов позволяет ускорить процесс приготовления щелочного раствора пероксида водорода, что положительно отражается на экономичности способа получения продукта для регенерации воздуха.
Способ получения продукта для регенерации воздуха осуществляют следующим образом. Готовят исходный щелочной раствор пероксида водорода, для чего в раствор пероксида водорода с концентрацией от 50 до 85% массовых при интенсивном перемешивании вводят тетрабораты щелочных металлов. После их полного растворения (примерно 1,5-3 минуты) в жидкую фазу вводят сульфат магния, гидроксид натрия и гидроксид калия. Гидроксид калия вводят в систему через 10÷15 минут после введения гидроксида натрия. Мольное соотношение исходных компонентов должны составлять следующие величины: пероксид водорода/тетраборат щелочного металла (H2O2/Me2B4O7)=160÷1000; пероксид водорода/сульфат магния (H2O2/MgSO4)=450÷670; пероксид водорода/гидроксид натрия (H2O2/NaOH)=7,0÷66,7; пероксид водорода/гидроксид калия (Н2О2/КОН)=1,60÷2,00.
Для снижения кинетики процесса распада пероксида водорода добавление гидроксидов натрия и калия проводят таким образом, чтобы температура жидкой фазы не превышала 55°C. Далее щелочной раствор пероксида водорода диспергируют форсункой в сушильную камеру в прямотоке предварительно декарбонизированного сушильного агента, где происходит его дегидратация. Используется типовая сушильная камера с форсункой. В качестве сушильного агента используют воздух или любой инертный газ, например азот. Декарбонизация сушильного агента проводится с помощью любого поглотителя диоксида углерода. Для уменьшения расхода сушильного агента его предварительно можно обезвоживать, пропуская через регенерируемые поглотители воды типа цеолита, силикагеля и др. Температуру сушильного агента варьируют в пределах от 120 до 300°C (предпочтительно 180-230°C). По окончании дегидратации твердый продукт отделяют от газовой смеси с помощью обычного батарейного циклона и рукавного фильтра и собирают в специальный контейнер.
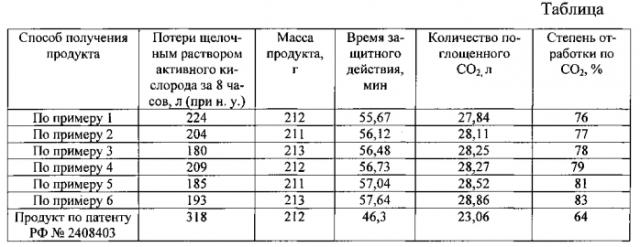
В примерах 1-6 приведены данные о получении заявляемым способом продукта для регенерации воздуха и потере жидкой фазой (щелочным раствором пероксида водорода) активного кислорода за 8 часов при 25°C.
Пример 1
К 56,82 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 202 г тетрабората натрия (H2O2/Me2B4O7=1000). После растворения Na2B4O7 примерно через 1,5 минуты в жидкую фазу вводят 267 г сульфата магния (H2O2/MgSO4=450), 667 г 90% гидроксида натрия (H2O2/NaOH=66,7). Примерно через 10 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (Н2О2/KOH=2,0). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 55°C. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 220°C. Расход раствора через форсунку составляет 145 мл/мин. Расход сушильного агента 960 кг/час. Получают 36,8 кг продукта, содержащего 75,66% KO2, 16,93% KOH, 1,27% Na2O2, 0,41% NaOH, 4,46% H2O, 0,54% Na2B4O7 и 0,73% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 224 л.
Пример 2
К 51,7 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 206 г тетрабората лития (H2O2/Me2B4O7=750). После растворения Li2B4O7 примерно через 1,75 минуты в жидкую фазу вводят 210 г сульфата магния (H2O2/MgSO4=520), 1,334 кг 90% гидроксида натрия (H2O2/NaOH=15,2). Примерно через 12 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (H2O2/KOH=1,82). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 55°С. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 220°С. Расход раствора через форсунку составляет 146 мл/мин. Расход сушильного агента 930 кг/час. Получают 38,2 кг продукта, содержащего 72,12% KO2, 16,52% KOH, 3,75% Na2O2, 1,87% NaOH, 4,54% H2O, 0,51% Li2B4O7 и 0,69% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 204 л.
Пример 3
К 45,45 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 468 г тетрабората калия (H2O2/Me2B4O7=400). После растворения K2B4O7 примерно через 2 минуты в жидкую фазу вводят 160 г сульфата магния (H2O2/MgSO4=600), 4,45 кг 90% гидроксида натрия (H2O2/NaOH=8,0). Примерно через 15 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (H2O2/KOH=1,6). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 55°C. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 225°C. Расход раствора через форсунку составляет 150 мл/мин. Расход сушильного агента 890 кг/час. Получают 40,2 кг продукта, содержащего 66,18% KO2, 18,12% KOH, 7,96% Na2O2, 2,63% NaOH, 3,62% H2O, 1,13% Na2B4O7 и 0,38% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 180 л.
Пример 4
К 27,23 л водного 85% раствора пероксида водорода при непрерывном перемешивании добавляют 1,174 г тетрабората натрия (H2O2/Me2B4O7=160). После растворения Na2B4O7 примерно через 3 минут в жидкую фазу вводят 166,6 г сульфата магния (H2O2/MgSO4=670), 5,911 кг 90% гидроксида натрия (H2O2/NaOH=7,0). Примерно через 14 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (H2O2/KOH=1,86). Добавление КОН производят таким образом, чтобы температура жидкой фазы не превышала 55°C. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 220°C. Расход раствора через форсунку составляет 145 мл/мин. Расход сушильного агента 970 кг/час. Получают 41,9 кг продукта, содержащего 67,24% KO2, 14,31% KOH, 8,76% Na2O2, 3,17% NaOH, 3,43% H2O, 2,75% Na2B4O7 и 0,34% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 209 л.
Пример 5
К 46,88 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 468 г тетрабората калия и 127,5 г тетрабората лития (H2O2/Me2B4O7=300). После растворения тетраборатов калия и лития примерно через 2,5 минуты в жидкую фазу вводят 171 г сульфата магния (H2O2/MgSO4=580), 1,22 кг 90% гидроксида натрия (H2O2/NaOH=30). Примерно через 13 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (H2O2/KOH=1,65). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 55°C. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 215°C. Расход раствора через форсунку составляет 147 мл/мин. Расход сушильного агента 870 кг/час. Получают 37,4 кг продукта, содержащего 76,48% KO2, 14,17% KOH, 2,47% Na2O2, 0,84% NaOH, 3,97% H2O, 1,27% K2B4O7, 0,39% Li2B4O7 и 0,41% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 185 л.
Пример 6
К 48,9 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 170 г тетрабората лития, 202 г тетрабората натрия и 234 г тетрабората калия (H2O2/Me2B4O7=286,7). После растворения тетраборатов лития, натрия и калия примерно через 3 минуты в жидкую фазу вводят 215 г сульфата магния (H2O2/MgSO4=480), 765 г 90% гидроксида натрия (H2O2/NaOH=50). Примерно через 12 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 31,1 кг твердого 90% гидроксида калия (H2O2/KOH=1,72). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 55°C. После этого раствор диспергируют через форсунку в сушильную камеру, в которую подают декарбонизованный обезвоженный воздух, нагретый до температуры 230°C. Расход раствора через форсунку составляет 143 мл/мин. Расход сушильного агента 910 кг/час. Получают 36,8 кг продукта, содержащего 77,64% KO2, 13,77% KOH, 1,38% Na2O2, 0,52% NaOH, 4,59% H2O, 0,44% Li2B4O7, 0,51% Na2B4O7, 0,60% K2B4O7, и 0,55% MgSO4. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 193 л.
Хемосорбционные свойства продукта для регенерации воздуха, полученного по примерам 1-6, были исследованы в динамической трубке диаметром 39±0,5 мм и высотой 220 мм, через которую пропускалась газовоздушная смесь, при следующих условиях:
| объемный расход газовоздушной смеси, л/мин | 7,0±0,3 |
| объемный расход диоксида углерода, л/мин | 0,48±0,05 |
| концентрация диоксида углерода | |
| в газо-воздушной смеси, % объемных. | 7,0±0,2 |
| температура газо-воздушной смеси, °C | 23,0±0,5 |
| относительная влажность газовоздушной смеси, % | 95±3 |
| высота слоя продукта в динамической трубке, мм | 185±5 |
Объемные расходы газовоздушной смеси и CO2 заданы при температуре 20°C и давлении 101,3 кПа.
Для сравнения с продуктом для регенерации воздуха различного состава, изготовленным по примерам 1-6, в тех же условиях испытывался продукт для регенерации воздуха, специально изготовленный по способу, описанному в примере 5 патента РФ №2408403. Все продукты для регенерации воздуха имели форму гранул одинакового размера и плотности. Время защитного действия определяли как время от начала работы продукта для регенерации воздуха до того момента, когда концентрация CO2 в потоке газовоздушной смеси за слоем продукта достигала 1,5±0,1%. Результаты испытаний представлены в таблице и на рисунке. В таблице так же представлены данные о потере жидкой фазой активного кислорода за 8 часов при н.у. в процессе синтеза продукта для регенерации воздуха (данные о 6 этом параметре продукта для регенерации воздуха по примеру 5 патента РФ №2408403 взяты из описания патента).
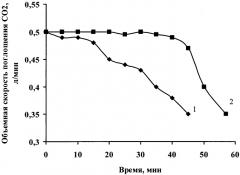
На рисунке представлены кинетические кривые поглощения диоксида углерода различными продуктами для регенерации воздуха. Кривая 1 на рисунке характеризует кинетику поглощения CO2 продуктом для регенерации воздуха, полученным по способу, описанному в примере 5 патента РФ №2408403. Кривая 2 характеризует кинетику поглощения CO2 продуктом для регенерации воздуха по изобретению. Поскольку для всех продуктов для регенерации воздуха, изготовленных по примерам 1-6, разница количества поглощенного диоксида углерода в единицу времени не превышает 5%, на рисунке (кривая 2) представлено изменение среднего значения этого параметра.
Как видно из представленных графических данных, продукт для регенерации воздуха, полученный по изобретению, обладает более высокими кинетическими параметрами процесса хемосорбции диоксида углерода в сравнении с продуктом по патенту РФ №2408403. При этом по таким важным эксплуатационным характеристикам, как время защитного действия и степень отработки по диоксиду углерода, продукт для регенерации воздуха, полученный по изобретению, превосходит аналогичные показатели продукта по патенту РФ №2408403.
Перечисленные выше позитивные аспекты, связанные с процессом хемосорбции диоксида углерода, обусловлены наличием в продукте для регенерации воздуха тетраборатов щелочных металлов и способом их введения в продукт, что приводит к снижению вязкости поверхностной пленки водного раствора, образующейся на поверхности продукта для регенерации воздуха. Это, в свою очередь, приводит к усилению диффузионных процессов на границах раздела фаз, в жидкой фазе и повышению растворимости и ионизации реагирующих веществ в водном растворе поверхностной пленки. В результате за счет интенсификации массообменных процессов на границах газ - жидкость и жидкость - твердая фаза повышается кинетика процесса хемосорбции диоксида углерода продуктом для регенерации воздуха. Это особенно актуально при эксплуатации продукта для регенерации воздуха в системах жизнеобеспечения человека в режиме высоких нагрузок, требующих быстрого удаления из газовой фазы значительного количества CO2.
Кроме того, присутствие в щелочном растворе пероксида водорода тетраборатов щелочных металлов и последовательность введения в жидкую фазу исходных компонентов позволяют сократить время приготовления щелочного раствора пероксида водорода и снизить в течение производственного цикла выделение атомарного кислорода, т.е. повысить безопасность и экономичность процесса.
Способ получения продукта для регенерации воздуха при создании локальных дыхательных атмосфер путем смешения пероксида водорода с сульфатом магния и гидроксидами натрия и калия с последующей дегидратацией полученного щелочного раствора пероксида водорода распылением его в токе сушильного агента, отличающийся тем, что в исходный раствор пероксида водорода перед добавлением сульфата магния вводят тетрабораты щелочных металлов, в качестве которых используют тетрабораты лития, натрия, калия или их смесь, при этом мольное соотношение исходных компонентов равно следующим величинам: пероксид водорода/сульфат магния (H2O2/MgSO4) 450÷670; пероксид водорода/тетраборат щелочного металла (H2O2/Me2B4O7) 160÷1000; H2O2/NaOH 7,0÷66,7; H2O2/КОН 1,60÷2,00, и гидроксид калия вводят в жидкую фазу через 10÷15 минут после введения всех других компонентов.