Вакцины против вируса простого герпеса
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложены дефектный по репликации доминантно-негативный рекомбинантный вирус простого герпеса 2, вакцина и способ иммунизации пациента против инфекции HSV-1 или HSV-2. Рекомбинантный вирус содержит в своем геноме две последовательности, кодирующие гликопротеин D HSV-2, связанные с промоторами ICP4, последние связаны с последовательностями тетрациклиновых операторов, и две последовательности, кодирующие белок UL9-C535C, которые связаны с промоторами hCMV, связанными с последовательностями тетрациклиновых операторов. Причем вирус не содержит последовательность, кодирующую белок ICP0. Вакцина, содержащая указанный рекомбинантный вирус, является безопасной и эффективной против инфекций HSV-1 или HSV-2 за счет экспрессии доминантно-негативной формы полипептида UL9-C535C и использования индуцированного тетрациклином включения и выключения генов. Также предложен способ иммунизации пациентов против HSV-1 или HSV-2 с использованием предложенной вакцины. Предложенные вакцина и способ иммунизации пациентов могут быть использованы в медицине для превращения или подавления вспышки HSV-1 или HSV-2. 3 н. и 14 з.п. ф-лы, 19 ил., 1 табл., 1 пр.
Реферат
Перекрестные ссылки на родственные заявки
По настоящей заявке испрашивается приоритет временной заявки на патент США № 61/288836, поданной 21 декабря 2009 года. Эта временная заявка полностью включена в настоящее описание путем ссылки.
Область техники
Настоящее изобретение в первую очередь относится к вакцинам, которые могут использоваться для иммунизации пациентов против инфекций вирусом простого герпеса типа 2 (Herpex Simplex Virus type 2, HSV-2), ассоциированными с хроническими генитальными язвами. Для вакцины используется дефектный по репликации вирус HSV-2, который в результате генноинженерных изменений экспрессирует антиген гликопротеин D HSV-2 (gD2) на высоком уровне. В предпочтительных вариантах осуществления вирус HSV-2 также экспрессирует один или более иммуномодулирующих генов, таких как IL15 и/или основные антигены HSV-1 или HSV-2, такие как gB или gC.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Вирусы простого герпеса (herpex simplex viruses, HSV) и инфекции HSV
Вирус простого герпеса типа 2 (HSV-2) является основной причиной генитальных язв. Он может вызывать как острую, продуктивную инфекцию, так и длительную латентную инфекцию с непредсказуемыми периодическими рецидивами (66). Инфекция HSV приводит к возникновению рецидивирующих генитальных язв на протяжении всей жизни пациента, а также представляет опасность для пациентов со СПИД. Было показано, что генитальная инфекция HSV-2 утраивает риск заражения ВИЧ половым путем (20), и в Африке этот повышенный риск может служить причиной 25-35% недавних инфекций ВИЧ (1).
Хотя силу и продолжительность наиболее симптоматических первичных инфекций HSV можно снизить с помощью перорального или внутримышечного введения ацикловира, валацикловира или фамцикловира, антивирусная терапия не препятствует переходу первичной инфекции в латентную и не ослабляет последующие рецидивы (66). Исходя из постоянного распространения генитального герпеса в США в течение двух последних десятков лет (19), а также учащения случаев резистентности HSV к современным антивирусным препаратам, очевидно, что в области техники существует потребность в безопасных и эффективных вакцинах против инфекций HSV (31, 60). Кроме того, тот факт, что супрессивная терапия HSV приводит к значительному снижению уровня ВИЧ в слизистых половых органов и плазме крови женщин, инфицированных HSV-2 и ВИЧ (52) позволяет предположить, что эффективная вакцина против HSV может иметь большое значение для контроля инфекции ВИЧ (1, 31).
Гликопротеин D HSV-2 (gD2)
Гликопротеин D HSV (gD) представляет собой один из основных вирусных антигенов, экспрессируемых на поверхности инфицированных клеток (21) и на оболочке вируса (24). gD необходим для проникновения вируса в клетку. Он представляет собой мишень для нейтрализующих антител против инфекции HSV (12, 49, 53). Кроме того, gD является основной вирусной мишенью для CD4+ T-клеток, включая цитотоксичность, опосредованную CD4+ Т-клетками, и CD8+ Т-клеток в человеческих и мышиных моделях инфекции HSV (27, 28, 30, 34, 47, 65, 75). В силу вышеизложенных причин, разработка вакцин против субъединиц HSV сосредоточена на gD (32, 60).
В фазе 3 клинических исследований Stanberry et al. показали, что эффективность защиты в результате вакцинации рекомбинантным gD HSV-2 (gD2) в комбинации с адъювантом AS04 от развития генитального герпеса у HSV-серонегативных женщин достигала 73-74% (62). Для мужчин и пациентов, сероположительных по HSV-1, значительной эффективности показано не было. Несмотря на то, что у иммунизированных хозяев были обнаружены gD2-специфичные гуморальный и CD4+ Т-клеточный ответы, остается неясным, может ли gD2/AS04 эффективно индуцировать CD8+ T-клеточный ответ (31, 32). Исходя из этого исследования, можно сделать вывод, что существует потребность в вакцине против HSV, индуцирующей более широкий гуморальный, а также CD4 и CD8 T-клеточный ответы на gD2 и другие вирусные антигены HSV (29, 31, 32).
Вирусные вакцины
Хорошо известно, что живые вирусные вакцины, способные к синтезу иммуногенов de novo в теле хозяина, индуцируют более широкий и более длительный иммунный ответ, чем вакцины, состоящие только из пептидов или белков. Были получены и протестированы на потенциальную пригодность в качестве вакцин против инфекции HSV различные формы HSV, дефектных по репликации и нейро-аттенуированные мутанты, компетентные по репликации (патент США № 7223411; (18)).
Поскольку вирусы, дефектные по репликации, а также нейро-аттенуированные мутанты способны в ходе ко-репликации с вирусом дикого типа или становиться компетентными по репликации в контексте вируса дикого типа, использование их в качестве человеческих вакцин несет определенный риск, в особенности для пациентов, несущих латентную инфекцию HSV (33). Поскольку было показано, что у мутантов HSV-1, дефектных по репликации, может реактивироваться предранний промотор HSV-1 в мозгу грызунов, существует дополнительный риск индукции такими мутантами продуктивной вирусной инфекции у латентно инфицированных пациентов (63). Таким образом, требуемая рекомбинантная вакцина против HSV, дефектная по репликации, должна быть способной синтезировать широкий спектр антигенов, кодируемых вирусом, а также должна кодировать уникальную функцию, предотвращающую литическую инфекцию HSV дикого типа при нахождении в одних и тех же клетках. Такой защитный механизм сведет к минимуму вероятность возникновения инфекции вирусом вакцины в результате рекомбинации вектора вакцины и вируса дикого типа, присутствующего в теле хозяина.
Сущность изобретения
В общем, настоящее изобретения основано на использовании технологии индуцированного тетрациклином включения и выключения генов (T-REx производства Invitrogen) (73) и доминантно-негативной мутантной формы полипептида UL9 HSV-1, например, UL9-C535C, для разработки безопасной и эффективной вирусной вакцины против инфекции HSV-2.
В своем первом аспекте изобретение направлено на дефектный по репликации доминантно-негативный рекомбинантный вирус Herpes simplex 2 (HSV-2). В геноме этого вируса содержится по меньшей мере первая последовательность, кодирующая первый гликопротеин D HSV-2 (gD2), функционально связанная (operably linked) с первым промотором и предпочтительно вторая последовательность, кодирующая второй HSV-2 gD2, функционально связанная со вторым промотором. Промотор (промоторы) функционально связан с последовательностью тетрациклинового оператора (tet-O) и второй последовательностью tet-O, соответственно, каждая из которых разрешает транскрипцию в отсутствие связанного тетрациклинового репрессора, но блокирует транскрипцию при связывании репрессора. Геном также включает третью последовательность, кодирующую по меньшей мере первую доминантно-негативную мутантную форму белка UL9 HSV-1 или HSV-2, под контролем третьего промотора, и предпочтительно четвертую последовательность, кодирующую вторую доминантно-негативную форму белка UL9 HSV-1 или HSV-2, под контролем четвертого промотора. Как и первый и второй промоторы, третий и четвертый промоторы оба функционально связаны с последовательностями tet-O, блокирующими транскрипцию при связывании tet-репрессора. Кроме того, в геноме вируса отсутствует последовательность, кодирующая функциональный белок ICP0. Для усиления антигенности геном также предпочтительно экспрессирует иммуномодулирующие гены, такие как IL12 или IL15 и/или основные антигены HSV-1 или HSV-2, такие как gB или gC.
Термин “функционально связаны” означает, что геномные элементы соединены вместе таким образом, что они могут выполнять свои нормальные функции. Например, ген функционально связан с промотором, если его транскрипция находится под контролем этого промотора и если в результате транскрипции получается продукт, в норме кодируемый геном. Последовательность tet-оператор функционально связана с промотором, если оператор блокирует транскрипцию с промотора в присутствии связанного tet-репрессора, но разрешает транскрипцию в отсутствие репрессора. Термин “рекомбинантный” означает вирус, чьи нуклеотидные последовательности были получены путем рекомбинации нуклеотидных последовательностей и элементов последовательностей и введения этих рекомбинированных последовательностей в вирус или в вирус-предшественник.
Предпочтительно, используемые промоторы являются такими, которые содержат TATA-элемент и последовательности tet-оператора, связанные с промоторами, содержащими два сайта связывания репрессора op2, соединенные связывающими нуклеотидами, число которых может варьировать от 2 до 20. Положение операторной последовательности важно для достижения эффективного контроля промотора. В частности, первый нуклеотид операторной последовательности должен быть расположен на расстоянии от 6 до 24 нуклеотидов к 3'-концу от последнего нуклеотида ТАТА-элемента. Структурные последовательности, кодирующие, например, gD или доминантно-негативный мутантный полипептид UL9, должны находиться к 3'-концу от оператора. В особенности предпочтительные промоторы включают предранний промотор hCMV и предранние промоторы HSV-1 и HSV-2. В особенности предпочтительны промоторы ICP4 HSV-1 или HSV-2.
В другом аспекте изобретение направлено на вакцину, которую можно использовать профилактически или терапевтически против экспрессии HSV и которая включает один или более вышеописанных рекомбинантных вирусов в стандартной дозировке. Термин “стандартная дозировка” означает однократное введение лекарственного препарата, такое как таблетка или капсула. Предпочтительно, “стандартная дозировка” представляет собой раствор лекарственного препарата с концентрацией, вызывающей терапевтический или профилактический эффект при введении выбранного объема (стандартной дозировки) пациенту путем инъекции, который находится во флаконе для инъекций. На основании эффективной дозы для мышей (2×106 БОЕ), можно сделать вывод, что минимальная эффективная доза для человека должна составлять примерно 1×107 БОЕ. Таким образом, стандартная дозировка должна содержать по меньшей мере такое количество вируса, типичная стандартная дозировка должна содержать 1×107-1×109 БОЕ. Вакцины можно хранить в лиофилизированной форме и восстанавливать в фармацевтически приемлемом носителе перед употреблением. Альтернативно, препарат может храниться непосредственно в носителе. Объем одной дозы вакцины может варьировать, но в общем должен находиться в интервале приблизительно от 0,1 мл до 10 мл и более типично приблизительно от 0,2 мл до 5 мл.
Изобретение также включает способы иммунизации пациентов против инфекции HSV-1 или HSV-2 и состояний, к которым приводят такие инфекции (например, герпетические генитальные язвы) путем введения пациентам вышеописанных вакцин. Вакцины могут вводиться инфицированным пациентам для предотвращения или подавления вспышки вируса. Любой способ введения вакцины пациенту, не приводящий к разрушению вируса, совместим с настоящим изобретением. В общем случае, препарат вводят парентеральным способом, таким как внутримышечная или внутривенная инъекция. Дозировку и график введения вакцин можно определить с помощью способов, стандартных для уровня техники. Препараты можно вводить путем однократных или многократных инъекций.
Краткое описание чертежей
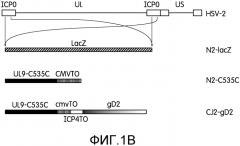
Фиг.1А и 1В: На фиг.1А представлены схематические изображения плазмид, использованных для конструирования доминантно-негативного и дефектного по репликации рекомбинантов HSV-2: N2-C535C и CJ2-gD2. Плазмида pHSV-2/ICP0 представляет собой плазмиду, включающую последовательности HSV-2 ICP0 от 268 п.н. раньше открытой рамки считывания HSV-2 ICP0 (серый прямоугольник) до 40 п.н. после сигнала полиаденилирования последовательностей, кодирующих ICP0. pHSV-2.ICP0-V конструировали путем замещения фрагмента ДНК Xho I-ICP0, содержащего последовательности с множественной клонирующей последовательностью (MCS), включающей Xho I. pHSV-2.ICP0-lacZ получали путем вставки гена LacZ (диагональная штриховка) в область MCS pHSV-2.ICP0-V. p02lacZ-TOC535C конструировали путем замены указанного фрагмента, включающего lacZ, pHSV-2.ICP0-lacZ на последовательности ДНК, кодирующие UL9-C535C (черный прямоугольник) под контролем основного предраннего промотора hCMV, включающего tetO (вертикальная штриховка, CMVTO). p02lacZTO-gD2.C535C конструировали путем замены фрагмента SnaB I/Pst I p02lacZTO-C535C на последовательности ДНК, кодирующие ген gD2 (прямоугольник с градиентной заливкой) под контролем предраннего промотора ICP4 HSV-1, включающего tetO (белый прямоугольник, ICP4TO).
На фиг.1В приведены схематические изображения геномов HSV-2 дикого типа, мутанта HSV-2 ICP0 null (N2-lacZ), N2-C535C и CJ2-gD2. UL и US обозначают уникальную длинную и уникальную короткую область генома HSV-2 соответственно. Эти области фланкированы соответствующими областями обратных повторов (белые прямоугольники). Под развернутыми последовательностями, кодирующими ICP0 генома HSV-2, показана замена обеих копий последовательностей, кодирующих ICP0, на ген lacZ в N2-lacZ и на последовательности ДНК (1) кодирующие UL9-C535C под контролем основного предраннего промотора hCMV, несущего tetO, в N2-535C и (2) кодирующие UL9-C535C и gD2 под контролем указанных промоторов, несущих tetO, в противоположных ориентациях.
Фиг.2А и 2В: На этих фигурах показан высокий уровень экспрессии gD2 и UL9-C535C после инфекции клеток Vero CJ2-gD2. На фиг.2А клетки Vero не инфицировали или инфицировали HSV-2 дикого типа, N2-lacZ, N2-C535C или CJ2-gD2 со множественностью заражения 10 БОЕ на клетку. Эксперимент повторяли дважды. Экстракты инфицированных клеток готовили через 9 часов после инфекции. На фиг.2В клетки Vero инфицировали штаммом KOS HSV-1 дикого типа, CJ9-gD, HSV-2 дикого типа или CJ2-gD2 со множественностью инфекции 10 БОЕ на клетку. Экстракты инфицированных клеток готовили через 9 часов после инфекции. Белки, содержащиеся в экстрактах инфицированных клеток, разделяли с помощью SDS-PAGE и далее проводили иммуноблоттинг с использованием поликлональных антител к gD HSV-1 (R45), UL9, или моноклональных антител, специфичных к ICP27 и gB (Santa Cruz).
Фиг.3: На фиг.3 показана регуляция экспрессии gD2 и UL9-C535C с помощью tetR в клетках VCEP4R-28, инфицированных CJ2-gD2. Клетки VCEP4R-28 рассаживали в количестве 5×105 клеток на чашку диаметром 60 мм. Через 40 ч после рассадки клетки не инфицировали или инфицировали HSV-2 дикого типа или CJ2-gD2 при множественности инфекции 10 БОЕ на клетку в присутствии или в отсутствие тетрациклина. Эксперимент повторяли дважды. Через 9 часов после инфекции готовили экстракты инфицированных клеток. Экстракты исследовали с помощью иммуноблоттинга поликлональными антителами к gD и UL9 HSV и моноклональными антителами к ICP27.
Фиг.4А и 4В: На этих фигурах показан транс-доминантно-негативный эффект CJ2-gD2 на репликацию HSV-2 дикого типа. На фиг.4А клетки Vero инфицировали штаммом 186 HSV-2 дикого типа при множественности инфекции 2 БОЕ на клетку, 186 при множественности инфекции 2 БОЕ на клетку и CJ2-gD2 при множественности инфекции 5 БОЕ на клетку или 186 при множественности инфекции 2 БОЕ на клетку и N2-lacZ при множественности инфекции 5 БОЕ на клетку. Эксперимент повторяли трижды. На фиг.4В клетки Vero инфицировали только HSV-2 дикого типа при множественности инфекции 5 БОЕ на клетку, ко-инфицировали 186 и CJ2-gD2 при множественности инфекции 5 БОЕ на клетку для обоих вирусов или инфицировали только 186 при множественности инфекции 15 БОЕ на клетку и ко-инфицировали 186 при множественности инфекции 15 БОЕ на клетку и CJ2-gD2 при множественности инфекции 5 БОЕ на клетку. Через 18 часов после инфекции собирали инфицированные клетки и определяли титры вирусов на монослоях клеток Vero. Титры вирусов представлены в виде среднее ± стандартное отклонение. Числа сверху графика означают, во сколько раз выход вируса при ко-инфекции меньше выхода вируса при одиночной инфекции.
Фиг.5А и 5В: На этих фигурах показана нейровирулентность штамма 186 HSV-2 дикого типа, N2-lacZ, N2-C535C и CJ2-gD2 у мышей BALB/c после интрацеребральной прививки. Самок мышей BALB/c в возрасте 4-6 недель случайным образом разделяли на 5 групп по 8 мышей в каждой. Животных анестезировали пентобарбиталом натрия и прививали DMEM, 25 БОЕ на мышь штамма 186 HSV-2 дикого типа, 1×106 БОЕ на мышь N2-lacZ, 2,5×106 БОЕ на мышь CJ2-gD2 или N2-C535C путем интрацеребральной инъекции в левую лобную долю мозга в объеме 20 мкл на глубину 4 мм. За развитием у мышей признаков и симптомов болезни наблюдали в течение 35 дней после прививки. На фиг.5А приведены показатели заболевания в различные дни после инфекции, а на фиг.5В приведен процент выживших мышей.
Фиг.6А и 6В: На фиг.6А и 6В показана индукция антител, специфичных к gD2, и ответов, нейтрализующих HSV-2. Самкам мышей BALB/c в возрасте 4-6 недель вводили DMEN (n=7, 6, 8, 8) или иммунизировали CJ2-gD2 (n=7, 6, 8, 8), N2-C535C (n=7, 8, 6) или CJ9-gD (n=6, 8, 6) в дозировке 2×106 БОЕ на мышь, и повторяли иммунизацию через 2 недели. Через 4-5 недель после первичной иммунизации у мышей забирали кровь из хвостовой вены. На фиг.6А сыворотку мышей из отдельной группы объединяли и инактивировали нагреванием. Определяли титры специфических антител, нейтрализующих HSV-2. Результаты приведены в виде средних титров ± стандартная ошибка среднего. На фиг.6В сыворотку контрольных мышей и мышей, иммунизированных CJ2-gD2, N2-C535C или CJ9-gD, инкубировали с клеточным экстрактом, полученным из клеток U2OS, трансфицированных плазмидой p02.4TO-gD2, экспрессирующей gD2. Комплексы gD со специфическими мышиными иммуноглобулинами преципитировали с помощью белка А, разделяли с помощью SDS-PAGE и детектировали поликлональными антителами R45, специфичными к gD.
Фиг.7А-7D: На этих фигурах показана индукция CD4+ и CD8+ Т-клеточных ответов, специфичных к HSV-2, у мышей, иммунизированных CJ2-gD2. Самок мышей BALB/c не иммунизировали или иммунизировали CJ2-gD2 при множественности инфекции 2×106 БОЕ на мышь дважды с промежутком времени 2 недели. На фиг.7А и 7В контрольных и иммунизированных мышей не инфицировали или инфицировали HSV-2 дикого типа подкожно в дозировке 1×104 БОЕ на мышь через 9-10 недель после вторичной иммунизации (n=3). CD4+ и CD8+ T-клеточные ответы анализировали на 5 день после нагрузки с помощью тестов IFNγ ELISPOT на индивидуально очищенных CD4+ и CD8+ Т-клетках, выделенных из селезенки мышей, с использованием наборов реагентов Dynal для выделения мышиных CD4- и CD8- Т-клеток. На фиг.7C и 7D контрольных мышей и мышей, иммунизированных CJ2-gD2, не инфицировали или инфицировали HSV-2 дикого типа через 5-6 недель после вторичной иммунизации и далее проводили тесты IFNγ ELISPOT через 4 дня после инфекции (n=3). Число клеток, образующих пятна IFNγ (spot-forming cells, SFC) выражали в виде среднего ± стандартная ошибка среднего на миллион CD4+ или CD8+ Т-клеток.
Фиг.8: На фиг.8 показано ослабление вагинальной репликации нагрузочного HSV-2 у мышей, иммунизированных CJ2-gD2. Самок мышей BALB/c в возрасте 4-6 недель случайным образом разделяли на 4 группы по 10 мышей в каждой. Мышам BALB/c в возрасте 4-6 вводили DMEM или иммунизировали CJ2-gD2, N2-C535C или CJ9-gD в дозировке 2×106 БОЕ на мышь, и вакцинацию повторяли через 2 недели. Через 5 недель мышам давали медроксипрогестерон и нагружали интравагинально 5×105 БОЕ штамма G HSV-2. Вагинальные мазки брали на 1, 2, 3, 5 и 7 день после нагрузки. Инфекционность вирусов в материале мазков оценивали по стандартному тесту образования бляшек на монослое клеток Vero. Титры вирусов приведены в виде среднего ± стандартная ошибка среднего в индивидуальных вагинальных мазках.
Фиг.9А и 9В: На этих фигурах показано предотвращение заболевания HSV-2 у мышей, иммунизированных CJ2-gD2. После нагрузки HSV-2 дикого типа у индивидуальных мышей, описанных в подписи к фиг.8, наблюдали в течение 21-дневного срока, наблюдали частоту генитального и системного заболевания HSV-2 (фиг.9) и выживаемость (фиг.9В), используя следующую шкалу: 0 = признаки не выражены, 1 = легкое покраснение и отек гениталий, 2 = умеренное воспаление гениталий, 3 = гнойные язвы гениталий и/или системное заболевание, 4 = паралич задних конечностей, 5 = гибель.
Фиг.10: На фиг.10 показана кодирующая последовательность UL9-C535C HSV-1 (SEQ ID NO:2). UL9-C535C состоит из аминокислот 1-10 UL9, трипептида Thr-Met-Gly и аминокислот 535-851 UL9 (смотрите Yao et al. (69)).
Подробное описание изобретения
Настоящее изобретение основано на идее использования технологии включения/выключения генов с помощью тетрациклина, а также доминантно-негативного пептида UL9 HSV-1 с целью получения рекомбинантного вируса HSV, дефектного по репликации и способного ингибировать инфекции HSV дикого типа (доминантно-негативного). CJ9-gD является прототипным доминантно-негативным дефектным по репликации рекомбинантным вирусом HSV-1 с высоким уровнем экспрессии основного антигена HSV-1 - гликопротеина D (gD), независимым от репликации вирусной ДНК HSV (7). В наиболее предпочтительной форме настоящего изобретения используется доминантно-негативный дефектный по репликации рекомбинантный HSV-2 (CJ2-gD2), кодирующий 2 копии гена gD HSV-2 (gD2) под контролем основного предраннего промотора ICP4 HSV-1, несущего tetO. CJ2-gD2 экспрессирует gD2 также эффективно, как и вирус HSV-2 дикого типа, и способен оказывать сильное транс-ингибирующее воздействие на репликацию HSV-2 дикого типа при ко-инфекции в одних и тех же клетках. Иммунизация CJ2-gD2 приводит к выработке эффективных нейтрализующих антител, специфичных к HSV-2, а также индукции Т-клеточных ответов, и обеспечивает полную защиту от интравагинальной инфекции HSV-2 дикого типа у мышей.
CJ2-gD2 представляет собой вакцину, более эффективно защищающую от генитальной инфекции HSV-2 и вызванного им заболевания, чем CJ9-gD. Кроме того, интрацеребральная инъекция большой дозы CJ2-gD2 не приводит к заболеваемости или смертности у мышей. Исходя из совокупности этих наблюдений, можно предположить, что CJ2-gD2 обладает определенными преимуществами перед традиционными вакцинами на основе вируса, дефектного по репликации, и вакцинами на основе субъединиц HSV-2 в защите против генитальной инфекции HSV-2 и вызванного им заболевания у человека.
Система включения/выключения генов Tet оператор/репрессор и рекомбинантная ДНК
Настоящее изобретение направлено inter alia на вирусы, содержащие гены, экспрессию которых регулируется tet-оператором и белком-репрессором. Способы, используемые для получения рекомбинантных молекул ДНК, содержащих эти элементы и последовательности ДНК, были описаны ранее (смотрите патент США № 6444871; патент США № 6251640; и патент США № 5972650), а плазмиды, содержащие индуцируемый тетрациклином переключатель транскрипции, имеются в продаже (T-RExTM производства Invitrogen, США).
Существенным признаком ДНК согласно настоящему изобретению является присутствие генов, функционально связанных с промотором, предпочтительно включающим TATA-элемент. Последовательность tet-оператор располагается между 6 и 24 нуклеотидом к 3'-концу от последнего нуклеотида ТАТА-элемента промотора и к 5'-концу от гена. Для блокирования транскрипции генов и разрешения репликации вируса вирус можно растить в клетках, экспрессирующих tet-репрессор. Сила, с которой tet-репрессор связывается с операторной последовательностью, увеличивается при использовании формы оператора, включающей два сайта связывания рецептора op2 (каждый сайт имеет нуклеотидную последовательность TCCCTATCAGTGATAGAGA (SEQ ID NO:1)), разделенных последовательностью длиной 2-20, предпочтительно 1-3 или 10-13 нуклеотидов. При связывании репрессора с этим оператором транскрипции ассоциированного гена не происходит, или она очень слаба. Если ДНК с такими характеристиками присутствует в клетке, также экспрессирующей тетрациклиновый репрессор, транскрипция гена, который может предотвратить вирусную инфекцию, будет блокироваться репрессором, связывающимся с оператором, и таким образом будет иметь место репликация вируса.
Выбор промоторов и генов
Во время продуктивной инфекции экспрессию генов HSV разделяют на три основных класса в зависимости от времени экспрессии: различают предранние (α), ранние (β) и поздние (γ) гены, причем поздние гены далее разделяют на две группы, γ1 и γ2. Экспрессия предранних генов не требует синтеза вирусных белков de novo и активируется белком VP16, ассоциированным с вирионом, совместно с клеточными факторами транскрипции при попадании вирусной ДНК в ядро. Белковые продукты предранних генов обозначаются ICP0, ICP4, ICP22, ICP27 и ICP47 (от infected cell polypeptides, полипептиды инфицированных клеток); промоторы этих генов предпочтительно используют для контроля экспрессии рекомбинантных генов, обсуждаемых в настоящей заявке.
ICP0 играет важную роль в усилении реактивации HSV из латентного состояния и дает HSV значительное преимущество в росте при низкой множественности инфекции. ICP4 представляет собой основной белковый регулятор транскрипции HSV-1, активирующий экспрессию ранних и поздних генов. ICP27 требуется для продуктивной вирусной инфекции и необходим для эффективной репликации вирусной ДНК и оптимальной экспрессии вирусных генов γ и части вирусных генов β. Считается что функция ICP47 при инфекции HSV заключается в снижении экспрессии белков основного комплекса тканевой совместимости (MHC) I класса на поверхности инфицированных клеток.
Полноразмерная последовательность геномной последовательности HSV-1 области, кодирующей UL9-C535C HSV-1, приведена на фиг.10 (SEQ ID NO:2). Из области техники известны другие последовательности, чье использование в рекомбинантных вирусах было описано ранее. Например, полноразмерная геномная последовательность HSV-1 зарегистрирована в GenBank за номером X14112. Последовательность ICP4 HSV-1 зарегистрирована в GenBank за номером Х06461; последовательность гликопротеина D HSV-1 зарегистрирована в GenBank за номером J02217; последовательность гликопротеина D HSV-2 зарегистрирована в GenBank за номером К01408; и последовательность гена UL9 HSV-1 зарегистрирована в GenBank за номером М19120 (все последовательности полностью включены в настоящую заявку путем ссылки).
Включение tet-репрессора и создание вируса
Последовательности промоторов ICP0 и ICP4 HSV, а также последовательности генов, находящихся под их эндогенным контролем, хорошо известны из уровня техники (43, 44, 56). Процедуры создания вирусных векторов, содержащих эти элементы, также были описаны ранее (смотрите опубликованную заявку на патент США № 2005-0266564). Эти промоторы не только очень активно индуцируют экспрессию генов, но сами специфически индуцируются трансактиваторным белком VP16, высвобождающимся при инфекции клетки HSV-1 или HSV-2.
После получения необходимых конструктов ДНК их можно инкорпорировать в вирус HSV-2, используя способы, хорошо известные из уровня техники (смотрите Yao et al. (68)).
Способы иммунизации
Вирусы, описанные в настоящей заявке, используют для иммунизации пациентов, как правило, путем инъекции, в качестве вакцины. Вакцина может использоваться профилактически для предотвращения инфекции HSV-1 или HSV-2 или терапевтически для ослабления уже существующей инфекции HSV-1 или HSV-2. Для получения вакцины вирусы можно суспендировать в любом фармацевтически приемлемом растворе, включая стерильный физиологический раствор, воду, физиологический раствор на фосфатном буфере, 1,2-пропиленгликоль, полигликоли, смешанные с водой, раствор Рингера и т.д. Точное количество вводимого вируса не является решающим для изобретения, однако должно представлять собой "эффективное количество", т.е. количество, достаточное для индукции иммунологического ответа, достаточно сильного для подавления инфекции HSV. В общем, ожидается, что количество первично вводимого вируса (БОЕ) будет находиться в интервале от 1×107 до 1×1010.
Эффективность дозировки, а также общую эффективность лечения можно оценить, используя стандартные иммунологические способы тестирования на присутствие антител, эффективно борющихся с HSV. Иммунологические инъекции можно повторять требуемое количество раз.
Примеры
В настоящем примере описывается создание рекомбинантного вируса HSV-2 и тесты на определение его иммунологических эффектов.
1. Материалы и способы
Клетки
Клетки почки африканской зеленой мартышки (Vero) и клетки линии остеосаркомы U2OS культивировали в среде Игла, модифицированной Дульбекко (DMEM, производство Sigma Aldrich) с добавлением 10% эмбриональной телячьей сыворотки (FBS) в присутствии 100 ед/мл пенициллина G и 100 мкг/мл стрептомицина сульфата (GIBCO, Карлсбад, штат Калифорния, США) (71). Клетки U2OS способны к функциональной комплементации делеции ICP0 HSV-1 (71). Клетки U2CEP4R11, которые представляют собой клетки U2OS, экспрессирующие tetR, культивировали в DMEM с добавлением 10% FBS и гигромицина B в концентрации 50 мкг/мл (73). Клетки VCEP4R-28, представляющие собой клетки Vero, экспрессирующие tetR, культивировали в DMEM с добавлением 10% FBS и гигромицина B в концентрации 50 мкг/мл (73).
Плазмиды
Плазмида pHSV2/ICP0 представляет собой производную плазмиды pUC19, кодирующую последовательности ICP0 HSV-2, амплифицированные с помощью PCR, от 268 п.н. выше открытой рамки считывания (ORF) ICP0 до 40 п.н. ниже сигнала полиаденилирования последовательностей, кодирующих ICP0. pHSV2.ICP0-V представляет собой плазмиду, клонирующую ICP0 HSV-2, полученную из плазмиды pHSV-2/ICP0 путем замены фрагмента ДНК Xho I-ICP0, содержащего последовательности от 25 п.н. выше кодона инициации ICP0 до 397 п.н. выше стоп-кодона ORF ICP0, на множественную клонирующую последовательность (MCS), содержащую Xho I. Плазмида pHSV2.ICP0-lacZ была получена путем вставки фрагмента HindIII-Not I-, содержащего ген LacZ pcDNA3-lacZ, в pHSV2.ICP0-V по сайтам Hind III-Not I. Плазмида pcmvtetO-UL9C535C представляет собой плазмиду, кодирующую UL9-C535C под контролем предраннего промотора hCMV, содержащего tetO (68). Плазмиду p02lacZ-TOC535C, экспрессирующую UL9-С535С под контролем основного предраннего промотора hCMV, содержащего tetO (фиг.1А), конструировали путем замены фрагмента pHSV2.ICP0-lacZ EcoR I/Age I, содержащего lacZ, на фрагмент pcmvtetOUL9-C535C EcoR I/Hind III, содержащий hcmvtetO-UL9C535C (69).
pAzgD-HSV-2 представляет собой плазмиду, кодирующую gD2 HSV-2, любезно предоставленную д-ром Patricia Spear (Northwestern University). pICP4TO-hEGF экспрессирует человеческий эпидермальный фактор роста под контролем предраннего промотора ICP4 HSV-1, несущего tetO, состоящего из последовательности промотора ICP4 HSV-1 от -377 п.н. до -19 п.н. относительно сайта начала транскрипции гена ICP4. Также, как и основной предранний промотор hCMV, несущий tetO, в плазмиде pcmvtetO-hEGF (73), промотор ICP4, содержащий tetO, включает две тандемные копии tet-операторов на 10 п.н. выше ТАТА-элемента ICP4, TATATGA. Таким образом, как и pcmvtetO-hEGF, pICP4TO-hEGF можно жестко регулировать с помощью тетрациклина в присутствии tetR, но вставка tetO не оказывает никакого влияния на активность промотора ICP4 в отсутствие tetR. Промотор ICP4, несущий tetO, в pICP4TO-hEGF имеет еще одно уникальное свойство - у него отсутствует ДНК-связывающая последовательность ICP4 (ATCGTCCACACGGAG (SEQ ID NO:3), включающая сайт инициации транскрипции гена ICP4 (51) в промоторе ICP4 дикого типа. Таким образом, в отличие от промотора ICP4 дикого типа, авто-регулирующегося ICP4 (16, 57), промотор ICP4, несущий tetO, в pICP4TO-hEGF не супрессируется основным регуляторным белком HSV-1 ICP4.
Чтобы клонировать gD2 под контроль промотора ICP4, содержащего tetO, заявители вначале сконструировали плазмиду p02ICP4-TO путем клонирования Sma I-Bam HI промотора ICP4, содержащего tetO, из pICP4TO-hEGF в pHSV2.ICP0-V в MCS вектора. p02.4TO-gD2 представляет собой плазмиду, производную p02ICP4-TO, кодирующую ген gD2 pAzgD-HSV-2 под контролем промотора ICP4, содержащего tetO.
p02lacZTO-gD2.С535С, плазмиду, кодирующую UL9-C535C под контролем предраннего промотора hCMV, содержащего tetO, с 5'-укорочением на -236 п.н. от промотора hCMV, и ген gD2 под контролем промотора tetO-ICP4 (фиг.1А), получали путем замены фрагмента SnaB I/Pst I p02lacZTO-С535С на фрагмент Hind III/Pst I p02.4TO-gD2, содержащий gD2. В p02lacZTO-gD2.С535С транскрипция гена UL9-С535С и гена gD2 происходит в противоположных направлениях.
Вирусы
HSV-2 дикого типа штаммов 186 и G размножали и оценивали по бляшкам на клетках Vero. N2-lacZ представляет собой мутант HSV-2 ICP0 null, кодирующий ген Lac Z под контролем промотора ICP0 HSV-2, где обе копии гена ICP0 заменены на ген Lac Z в pHSV2.ICP0-lacZ путем гомологичной рекомбинации с помощью трансфекции клеток U2OS линеаризованной Nhe I pHSV2.ICP0-lacZ и последующей суперинфекцией HSV-2 как описано ранее (74). Замену гена ICP0 на ген Lac Z в локусе ICP0 подтверждали с помощью PCR-анализа ДНК вируса N2-lacZ с праймерами, фланкирующими ген ICP0, и праймерами, специфичными для гена lac Z (41, 74).
N2-C535C представляет собой производное N2-lacZ, где обе копии гена Lac Z заменены на последовательности ДНК, кодирующие UL9-C535C под контролем промотора hCMV, содержащего tetO, в плазмиде p02lacZ-TOC535C (фиг.1В). Вкратце, клетки U2CEP4R11 ко-трансфецировали линеаризованной p02lacZ-TOC535C и инфекционной ДНК вируса N2-lacZ с помощью Lipofectamine 2000. Трансфицированные клетки скринировали на рекомбинационную замену генов lacZ N2-lacZ на последовательность ДНК, содержащую cmvtetOUL9-C535C с помощью стандартных тестов на образование бляшек. Бляшки окрашивали 5-бром-4-хлор-3-индолил-b-D-галактопиранозидом (X-Gal) через 96 часов после инфекции. Выделяли белые бляшки, означающие замену обеих копий гена lacZ на последовательность ДНК, кодирующую UL9-C535C. Через четыре раунда очистки бляшек удалось получить один изолят, обозначенный N2-C535C, дающий однородные белые бляшки.
CJ2-gD2 конструировали путем замены обеих копий гена Lac Z в локусе ICP0 в N2-lacZ на последовательности ДНК, кодирующие UL9-C535C под основным предранним промотором hCMV, несущим tetO, и gD2 под контролем промотора ICP4 HSV-1, содержащим tetO (фиг.1В), который состоит из последовательности промотора ICP4 HSV-1 от -377 п.н. до -19 п.н. относительно сайта начала транскрипции гена ICP4 (71).
SDS-PAGE и Вестерн-блот-анализ
Клетки Vero, рассаженные в 60-мм чашки в количестве 7,5×105 клеток на чашку, не инфицировали или инфицировали указанными вирусами со множественностью инфекции 10 БОЕ на клетку. Экстракты клеток готовили через 9 ч или 16 после инфекции (72). Белки экстрактов клеток разделяли с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) (9% акриламида), переносили на поливинилиден-дифторидные (PVDF) мембраны и детектировали с помощью поликлональных антител к gD HSV-1 (R54, любезно предоставлены д-рами Gary H. Cohen и Roselyn J Eisenberg), UL9 (любезно предоставлены Mark Challberg) или моноклональными антителами, специфичными к ICP27 и gB (Santa Cruz Biotechnology, Санта Круз, штат Калифорния, США).
Мыши
Самок мышей BALB/c в возрасте 4-6 недель приобретали у Charles River Laboratories (Уилмингтон, штат Массачусетс, США). Мышей содержали в металлических клетках по 4 мыши на клетку в условиях 12-часового цикла свет/темнота. Мыши акклиматизировались к условиям содержания в течение 1 недели до начала эксперимента. Все эксперименты на животных проводили в соответствии с протоколом, одобренным постоянным комитетом по животным Harvard Medical Area и Американской ассоциацией ветеринарных врачей.
Иммунизация и нагрузки
Мышей BALB/c случайным образом распределяли по нескольким группам. Животным выстригали шерсть на левом боку. Мышей вакцинировали 2×106 БОЕ на мышь CJ2-gD2, N2-C535C, CJ9-gD или вводили DMEM в объеме 30 мкл под кожу левого бока сзади с использованием 1-мл шприца и иглы 27G. Мышей вторично иммунизировали через 2 недели и нагружали HSV-2 дикого типа штамма G через 3 недели после вторичной иммунизации. За 5 дней до нагрузки мышам инъецировали подкожно в загривок медроксипрогестерон (SICOR Pharmaceuticals, Inc., Ирвин, штат Калифорния, США) в количестве 3 мг на мышь в объеме 20 мкл (7, 50). Для интравагинальной нагрузки мышей всех групп анестезировали, наносили альгинат кальция с помощью стерильного уретро-генитального аппликатора с альгинатом кальция производства Puritan Medical Products company LLC, Гилфорд, штат Мэн, США) и прививали интравагинально по 20 мкл культуральной среды, содержащей 5×105 БОЕ (50 LD50) HSV-2 штамма G (50). Животные оставались под анестезией в положении на спине с приподнятым задним концом тела в течение 30-45 минут после инфекции.
Анализ острой инфекции и клинические наблюдения
На 1, 2, 3, 5 и 7 день после нагрузки брали мазок слизистой оболочки влагалища с альгинатом кальция (7). Инфекционность вирусов в материале мазков оценивали с помощью стандартного теста на образования бляшек на монослое клеток Vero. После нагрузки HSV-2 дикого типа у мышей в течение 21-дневного срока наблюдали частоту возникновения генитальных язв и системного заболевания. Для оценки тяжести заболевания использовали следующую шкалу: 0 = признаки герпетической инфекции не выражены, 1 = легкое покраснение и отек гениталий, 2 = умеренное воспаление гениталий, 3 = гнойные язвы гениталий и/или системное заболевание, 4 = паралич задних конечностей, 5 = гибель (8, 50).
Детекция нейтрализующих антител, специфичных к HSV-2
Через 4 недели после первичной иммунизации у иммунизированных и контрольных мышей забирали кровь из хвостовой вены. Титры нейтрализующих антител в сыворотке крови о