Фермент лизосомальной болезни накопления
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой фармацевтический состав для лечения состояний, вызванных дефицитом лизосомальной кислой липазы, включающий выделенную рекомбинантную лизосомальную кислую липазу человека, включающую SEQ ID NO: 2, и фармацевтически приемлемый носитель, растворитель или эксципиент, где фармацевтический состав представляет собой водный раствор, который имеет pH между примерно 5,6 и примерно 6,2 или pH 5,9±0,2, и при этом ЛКЛ является N-присоединенным гликозилированным в положении Asn15, Asn80, Asn140, Asn252 и Asn300 последовательности SEQ ID NO: 2 и включает определенный N-связанный профиль гликозилирования. Изобретение позволяет получить эффективный препарат для лечения состояний, вызванных дефицитом лизосомальной кислой липазы. 19 з.п. ф-лы, 30 ил., 6 табл., 20 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка истребует приоритет перед временной заявкой на патент США No. 61/343177 от 23 апреля 2010 г., временной заявкой на патент США No. 61/396376 от 26 мая 2010 г., временной заявкой на патент США No. 61/403011 от 9 сентября 2010 г., временной заявкой на патент США No. 61/456014 от 29 октября 2010 г., временной заявкой на патент США No. 61/432372 от 13 января 2011 г. Все содержание представленных выше документов включено сюда во всей своей полноте посредством ссылки.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Дефицит лизосомальной кислой липазы (ЛКЛ) является очень редкой лизосомальной болезнью накопления (ЛБН), характеризующейся отсутствием распадов эфиров холестерина (ЭХ) и триглицеридов (ТГ) в лизосомах по причине недостатка фермента. Недостаток ЛКЛ напоминает другие лизосомальные болезни накопления с накоплением субстрата в ряде тканей и клеток различных типов. При недостатке ЛКЛ накопление субстрата наиболее выражено в клетках ретикулоэндотелиальной системы, включая купферовы клетки в печени, гистиоциты в селезенке и клетки собственной пластинки тонкого кишечника. Ретикулоэндотелиальные клетки экспрессируют рецептор маннозы/N-ацетилглюкозамина макрофага (также известен как рецептор маннозы макрофага или MMR, CD206), который опосредует связывание, захват клеток и лизосомальную интернализацию белков с N-гликанами, на конце которых находится манноза или GlcNAc, обеспечивая путь для потенциальной коррекции дефицита фермента в таких ключевых типах клеток.
Дефицит ЛКЛ представлен мультисистемным заболеванием, которое наиболее часто проявляется в виде осложнений со стороны желудочно-кишечного тракта, печени и сердечно-сосудистой системы и связано со значительной смертностью и заболеваемостью. Клинические эффекты дефицита ЛКЛ вызваны массивным накоплением материала липидов в лизосомах в целом ряде тканей, а также значительным нарушением механизмов гомеостаза липидов и холестерина, включая значительное усиление синтеза холестерина в печени. Дефицит ЛКЛ имеет, по меньшей мере, два фенотипа, представленные болезнью Вольмана (БВ) и болезнью накопления эфиров холестерина (БНЭХ).
Болезнь Вольмана является наиболее агрессивным проявлением дефицита ЛКЛ. Этот фенотип характеризуется проявлениями со стороны печени и желудочно-кишечного тракта, включая нарушение роста, нарушение абсорбции, стеаторею, существенную потерю веса и гепатомегалию. Болезнь Вольмана является быстро прогрессирующим и смертельным заболеванием, возникающим обычно в течение первого года жизни. Обзор сообщенных случаев указывает, что показатель выживаемости после 12-месячного возраста крайне необычен для пациентов с нарушением роста, вызванным дефицитом ЛКЛ в течение первого года жизни. В этой более агрессивной форме нарушение роста является предоминирующим клиническим признаком и является ключевым фактором ранней смертности. Вовлечение печени определяют по увеличению печени и повышению уровня трансаминаз, что очень часто отмечается у младенцев. Физические показатели включают вздутие живота, сопровождающееся гепатомегалией и спленомегалией, и рентгенографическое исследование часто выявляет кальцификацию надпочечников. Лабораторные анализы обычно выявляют повышенные уровни трансаминаз в сыворотке и отсутствие или существенное снижение активности фермента ЛКЛ. Также у пациентов отмечают повышенные уровни холестерина и триглицеридов в крови.
Используемые в настоящее время способы лечения болезни Вольмана крайне ограничены. Антибиотики вводят младенцам с пирексией и/или доказанным присутствием инфекции. Может быть назначена заместительная терапия стероидами для лечения недостаточности надпочечников и специализированное парентеральное питание, и при отсутствии доказательств того, что такие вмешательства предотвращают смерть, в настоящее время также неясно об их влиянии на краткосрочную выживаемость. Четыре пациента с дефицитом ЛКЛ были подвергнуты лечению и трансплантации костного мозга: все четыре пациента умерли по причине осложнений от процедуры в течение нескольких месяцев после трансплантации.
У пациентов с дефицитом ЛКЛ позднее могут проявляться предоминирующие поражения печени и сердечно-сосудистой системы, что часто называют болезнью накопления эфиров холестерина (БНЭХ). При БНЭХ в печени отмечают тяжелые нарушения со значительной гепатомегалией, некрозом гепатоцитов, повышением уровня трансаминаз, циррозом и фиброзом. По причине повышенных уровней ЭХ и ТГ, при дефиците ЛКЛ также отмечаются гиперлипидемия и ускоренный атеросклероз. В частности, в раннем возрасте описывают накопление жировых отложений в стенках артерий. Такие отложения сужают артериальный просвет, что может привести к окклюзии сосуда и повышению риска существенных сердечно-сосудистых явлений, включая инфаркт миокарда и инсульт. Проявление БНЭХ сильно варьирует у некоторых пациентов, которым диагноз не был поставлен до момента проявления осложнений во взрослом возрасте, в то время как у других дисфункция печени проявляется уже в раннем детстве. БНЭХ обуславливает короткую продолжительность жизни и по существу слабое здоровье; продолжительность жизни у пациентов с БНЭХ зависит от степени тяжести связанных осложнений.
Используемые в настоящее время способы лечения фенотипа БНЭХ сфокусированы на контроле накопления липидов посредством диеты, исключающей пищу с высоким содержанием холестерина и триглицеридов, супрессией синтеза холестерина и выработки аполипопротеина В посредством введения препаратов, понижающих уровни холестерина. Несмотря на то, что могут отмечаться определенные клинические улучшения, фоновые проявления заболевания сохраняются, и отмечается прогрессирование заболевания.
В большинстве случаев лечение дефицита ЛКЛ требует долгосрочного лечения. Кроме того, по причине высокой стоимости белковых лечебных препаратов, желательно введение минимально эффективного количества препарата для лечения дефицита ЛКЛ. Однако на сегодняшний момент не существует эффективной терапии для лечения дефицита ЛКЛ, в частности, для пациентов, страдающих от болезни Вольмана и БНЭХ. Следовательно, имеется крайняя необходимость в эффективной терапии с минимальной частотой введения для улучшения качества жизни пациентов. Также существует необходимость в создании платформы высокой экспрессии и робастной выработки белка, что может обеспечить выработку белков ЛКЛ, являющихся стабильными и эффективно направленными относительно лизосомального компартмента в клетках пораженных тканей у пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данной заявке описаны композиции с ЛКЛ, которые особенно подходят для использования в лечении, например, состояний, вызванных дефицитом ЛКЛ. Описанные здесь молекулы ЛКЛ содержат отдельные полисахаридные структуры, что обеспечивает эффективный и быстрый захват в лизосомах клеток при введении субъекту, например, субъекту человеку.
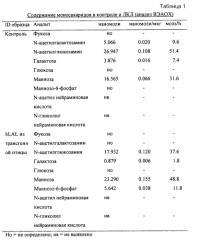
В одном аспекте описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека содержит, по меньшей мере, одну молекулу гликана маннозо-6-фосфат, которая служит в качестве лиганда для интернализации рецептором маннозо-6-фосфата на поверхности клеток, находящихся, например, на гепатоцитах. В одном варианте воплощения изобретения 30% или более, например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, или по меньшей мере 99% ЛКЛ, содержащейся в композиции, содержит, по меньшей мере одну молекулу маннозо-6-фосфата. Молекула маннозо-6-фосфата может находиться, например, на структуре N-гликана, расположенной на одном или более остатках, выбранных из группы, состоящей из Asn15, Asn51, Asn80, Asn140, Asn252 и Asn300 с последовательностью SEQ ID NO:2.
В другом аспекте изобретения описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулу сиалиновой кислоты в любой из своих N-гликановых структур, которые иногда могут влиять на интернализацию ферментов в клетках. В одном варианте воплощения изобретения 15% или менее, например 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одной ЛКЛ, содержащейся в композиции, не содержит молекулу сиалиновой кислоты в любой из своих N-гликановых структур.
В другом аспекте изобретения описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулы фукозы в любой из своих N-гликановых структур. В одном варианте воплощения изобретения 50% или менее, например 40% или менее, 30% или менее, 20% или менее, 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одной ЛКЛ, содержащейся в композиции, не содержат молекулу фукозы в любой из своих N-гликановых структур.
В еще одном аспекте изобретения описаны векторы, клетки-хозяева, системы экспрессии и соответствующие способы, подходящие для выработки композиций, содержащих ЛКЛ.
Как правило, ЛКЛ по изобретению, описанная и обсужденная в тексте данной заявки, представлена ЛКЛ человека. В одном варианте воплощения изобретения композиция, включающая ЛКЛ, включает зрелую ЛКЛ со следующей аминокислотной последовательностью:
SGGKLTAVDPETNMNVSEIISYWGFPSEEYLVETEDGYILCLNRIPHGRKNHSDKGPKPVVFLQHGLLADSSNWVTNLANSSLGFILADAGFDVWMGNSRGNTWSRKHKTLSVSQDEFWAFSYDEMAKYDLPASINFILNKTGQEQVYYVGHSQGTTIGFIAFSQIPELAKRIKMFFALGPVASVAFCTSPMAKLGRLPDHLIKDLFGDKEFLPQSAFLKWLGTHVCTHVILKELCGNLCFLLCGFNERNLNMSRVDVYTTHSPAGTSVQNMLHWSQAVKFQKFQAFDWGSSAKNYFHYNQSYPPTYNVKDMLVPTAVWSGGHDWLADVYDVNILLTQITNLVFHESIPEWEHLDFIWGLDAPWRLYNKIINLMRKYQ (SEQ ID NO:2).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
GKLTAVDPETNMNVSEIISYWGFPSEEYLVETEDGYILCLNRIPHGRKNHSDKGPKPVVFLQHGLLADSSNWVTNLANSSLGFILADAGFDVWMGNSRGNTWSRKHKTLSVSQDEFWAFSYDEMAKYDLPASINFILNKTGQEQVYYVGHSQGTTIGFIAFSQIPELAKRIKMFFALGPVASVAFCTSPMAKLGRLPDHLIKDLFGDKEFLPQSAFLKWLGTHVCTHVILKELCGNLCFLLCGFNERNLNMSRVDVYTTHSPAGTSVQNMLHWSQAVKFQKFQAFDWGSSAKNYFHYNQSYPPTYNVKDMLVPTAVWSGGHDWLADVYDVNILLTQITNLVFHESIPEWEHLDFIWGLDAPWRLYNKIINLMRKYQ (SEQ ID NO:3).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
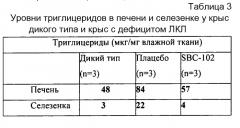
TAVDPETNMNVSEIISYWGFPSEEYLVETEDGYILCLNRIPHGRKNHSDKGPKPVVFLQHGLLADSSNWVTNLANSSLGFILADAGFDVWMGNSRGNTWSRKHKTLSVSQDEFWAFSYDEMAKYDLPASINFILNKTGQEQVYYVGHSQGTTIGFIAFSQIPELAKRIKMFFALGPVASVAFCTSPMAKLGRLPDHLIKDLFGDKEFLPQSAFLKWLGTHVCTHVILKELCGNLCFLLCGFNERNLNMSRVDVYTTHSPAGTSVQNMLHWSQAVKFQKFQAFDWGSSAKNYFHYNQSYPPTYNVKDMLVPTAVWSGGHDWLADVYDVNILLTQITNLVFHESIPEWEHLDFIWGLDAPWRLYNKIINLMRKYQ (SEQ ID NO:4).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
AVDPETNMNVSEIISYWGFPSEEYLVETEDGYILCLNRIPHGRKNHSDKGPKPVVFLQHGLLADSSNWVTNLANSSLGFILADAGFDVWMGNSRGNTWSRKHKTLSVSQDEFWAFSYDEMAKYDLPASINFILNKTGQEQVYYVGHSQGTTIGFIAFSQIPELAKRIKMFFALGPVASVAFCTSPMAKLGRLPDHLIKDLFGDKEFLPQSAFLKWLGTHVCTHVILKELCGNLCFLLCGFNERNLNMSRVDVYTTHSPAGTSVQNMLHWSQAVKFQKFQAFDWGSSAKNYFHYNQSYPPTYNVKDMLVPTAVWSGGHDWLADVYDVNILLTQITNLVFHESIPEWEHLDFIWGLDAPWRLYNKI INLMRKYQ (SEQ ID NO:19).
В другом варианте воплощения изобретения зрелая ЛКЛ представляет собой смесь из, по меньшей мере, двух полипептидов, выбранных из группы, состоящей из: SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:19.
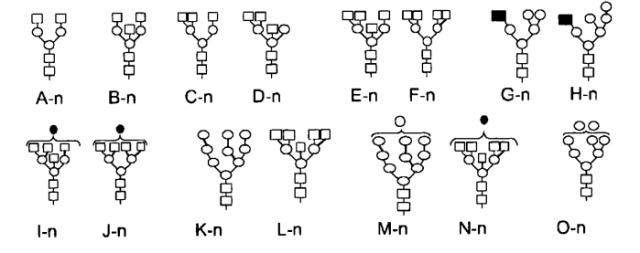
Изобретение также описывает композиции, которые содержат выделенные смеси полезных белковых молекул индивидуального типа, таких как описанных здесь белков, при этом одна или более белковых молекул, содержащихся в смеси, имеет специфическую олигосахаридную структуру, присоединенную, в частности, к описанной здесь олигосахаридной структуре. Например, изобретение описывает выделенные смеси молекул ЛКЛ, например молекулы ЛКЛ человека, которые содержат молекулу ЛКЛ, гликозилированную одной или более следующими структурами от A-n до O-n:
Квадрат=N-ацетилглюкозамин
Черный квадрат =маннозо-6-фосфат
Круг=манноза
Черный круг=галактоза
Черный треугольник=фукоза
Согласно одному аспекту данного изобретения, композиция включает любой выделенный отдельный или комбинацию описанных выше полипептидов. В одном варианте воплощения изобретения композиция может быть представлена фармацевтической композицией, например, композицией, которая дополнительно включает фармацевтически приемлемые носители, такие как композиция, например, подходящая для введения субъекту (например, человеку, в частности, пациенту, страдающему или имеющему диагноз определенного состояния). Композиция может быть введена с использованием целого ряда путей, включая внутривенное введение. В другом варианте воплощения изобретения композиция может дополнительно включать второй агент. Такой агент может быть представлен медикаментом или агентом, который может влиять или модифицировать биологический процесс при введении субъекту. Например, второй агент может быть представлен иммуномодулятором. Такие агенты-иммуномодуляторы могут включать любой агент, который при введении вместе (т.е. введении в одно и то же время или незадолго до или после) с любой из композиций ЛКЛ, описанных в тексте данной заявки, может влиять или снижать иммуногенность композиции ЛКЛ у субъекта (например, ритуксимаб или любое антитело, снижающее число В-клеток).
В финальном аспекте изобретения описаны способы и композиции для лечения симптомов, связанных с дефицитом ЛКЛ.
Дополнительные объекты и аспекты данного изобретения станут более очевидными после обзора детального описания, представленного ниже, в сочетании с сопроводительными фигурами и последовательностями.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 отображает аминокислотные последовательности ЛКЛ человека. Аминокислотная последовательность рекомбинантной чЛКЛ на 100% гомологична последовательности ЛКЛ человека, встречающейся в природе. Подчеркнута зрелая форма чЛКЛ.
Фиг. 2 отображает нуклеотидную последовательность рекомбинантной чЛКЛ, трансгена рчЛКЛ pALVIN-OVRl-I-hLAL-dSA.
Фиг. 3А и 3В отображают диаграммы pALVIN-OVRl-I-hLAL-dSA и провирусного участка. Фиг. 3А отображает диаграмму ретровирусного вектора экспрессии ЛКЛ человека, используемого в выработке трансфицированных частиц (последовательность ДНК плазмиды приводится в Приложении А). Фиг. 3 отображает провирусный участок pALVIN-OVRl-I-hLAL-dSA, который был интегрирован в геном. SIN LTR - самоинактивирующийся длинный терминальный повтор; OV DHSIII - энхансер; DNase - гиперчувствительный участок III гена яичного альбумина; OV - интрон; 5' нетранслируемый участок яичного альбумина и интрон 1; hLAL - кДНК ЛКЛ человека; OV 3' UTR - 3' нетранслируемый участок гена яичного альбумина; partial gag - частичный ген gag; LTR - длинный концевой повтор.
Фиг. 4 отображает нуклеотидную последовательность pALVIN-OVRl-I-hLAL-dSA.
Фиг. 5 отображает нуклеотидную последовательность провирусного участка pALVIN-OVRl-I-hLAL-dSA, который был интегрирован в геном.
Фиг. 6 отображает нуклеотидную последовательность вектора pALVIN-OV-l.l-I.
Фиг. 7 отображает нуклеотидную последовательность адаптора rhLAL.
Фиг. 8 отображает нуклеотидную последовательность rhLAL, включая частичный промотор яичного альбумина.
Фиг. 9 отображает нуклеотидную последовательность промотора OVR1.
Фиг. 10 отображает схематически этапы, используемые для построения вектора pALVIN-OVR1 -I-hLAL-dSA.
Фиг. 11 отображает анализ ПЦР в режиме реального времени образцов ДНК крови, полученных из гемизиготного трансгенного потомства G1 XLL109. Сигналы от дупликатных образцов ДНК прогена гемизиготных G1 1LL7466 указаны кривыми линиями, которые инициируют повышение дельта Rn перед циклом 22. Показаны кривые для двух нетрансгенных генов; такие кривые остаются на уровне или возле исходной линии в течение, по меньшей мере, 34 циклов.
Фиг. 12A-D отображают Саузерн анализ цыплят G1, несущих трансген ALVIN-OVRl-I-hLAL-dSA. Фиг. 12А иллюстрирует схему интегрированного трансгена и фланкирующие геномные участки с известным положением сайта трансгена BlpI и прогнозируемым положением фланкирующих геномных сайтов BlpI. Положение зонда промотора OV и зонда кодирующей последовательности hLAL (зонда hLAL) указаны черными полосами. Положения полос 4.3 kb и 10.6 kb, определенных в ходе анализа по Саузерну, представлены наравне с прогнозируемыми размерами геномных и трансгенных участков полос 4.3 kb и 10.6 kb. Фиг. 12В отображает Саузерн-блоттинг геномной ДНК, расщепленной BlpI, и зондированной зондом OV. WT CTRL является геномной ДНК, выделенной у нетрансгенного цыпленка. ID номера трансгенов G1 указаны выше полос. Положение и размер (kb) молекулярного веса маркеров представлен с левой стороны блоттинга. Положение и размер определенного фрагмента трансгена (4.3 kb) и гена эндогенного яичного альбумина (4.1 kb) представлены в правой стороне от блоттинга. Фиг. 12С отображает Саузерн-блоттинг с зондом hLAL. Положение и размер определенного фрагмента трансгена (10.6 kb) представлен справа от блоттинга. Фиг. 12D отображает участок изображения с Фиг. 12В в большем масштабе для представления присутствия полос 4.1 и 4.3 kb.
Фиг. 13А отображает схему трансгена ALVIN-OVRl-I-hLAL-dSA. Также представлен размер полос ApaLI, которые, как прогнозируется, должны определяться зондом OV и зондом hLAL. Фиг. 13В отображает схему анализа Саузерн-блоттинга трансгена ALVIN-OVRl-I-hLAL-dSA для подтверждения размера трансгена.Саузерн-блоттинг геномной ДНК, расщепленной ApaLI, с использованием зонда OV (левая панель) или зонда hLAL (правая панель). WT CTRL является геномной ДНК, выделенной у нетрансгенного цыпленка. Над каждой полосой приводится номер ID для Gl. Положение и размер (kb) молекулярного веса маркеров представлен с левой стороны блоттинга. Положение и размер определенного фрагмента трансгена (зонд промотора OV, 3,6 kb; зонд hLAL, 3,8 kb) и гена эндогенного яичного альбумина (7,7 kb) представлены в правой стороне от блоттинга.
Фиг. 14 отображает клеточную линию трансгенных цыплят. Для каждого цыпленка указаны номер поколения (G0, G1 или G2), идентификационный номер, пол и дата вылупления. Все цыплята, кроме поколения G1, принадлежат к другим линиям.
Фиг. 15 отображает этапы очистки hLAL от яичного белка.
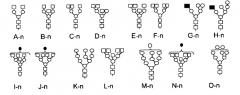
Фиг. 16 отображает N-гликаны, находящиеся в составе N-присоединенной гликозилированной структуры в ЛКЛ, полученной в соответствии с данным изобретением. Квадрат - N-ацетилглюкозамин; черный квадрат - маннозо-6-фосфат; круг - манноза; черный круг - галактоза; черный треугольник - фукоза.
Фиг. 17 отображает относительное положение прогнозируемых N-гликановых сайтов, указанных для полипептида ЛКЛ (стрелка) с последовательностью SEQ ID NO:1. Представлены N-гликаны, являющиеся структурными представителями, определенными для каждого сайта. Квадрат - N-ацетилглюкозамин; черный квадрат - маннозо-6-фосфат; круг - манноза; черный круг - галактоза; черный треугольник - фукоза.
Фиг. 18 отображает фосфорилированные N-гликаны, полученные с помощью ПНГазы и проанализированные с помощью MALDI-TOF. Указаны структуры.
Фиг. 19 отображает влияние дефосфорилирования ЛКЛ на время ретенции HPAEC-PAD относительно N-гликанов. ЛКЛ, полученная согласно изобретению, была дефосфорилирована бактериальной щелочной фосфатазой (верхняя панель) или не подвергалась воздействию (нижняя панель). Полученные N-гликаны были проанализированы с использованием HPAEC-PAD.
Фиг. 20 отображает солокализацию рекомбинантной ЛКЛ человека (SBC-102) и лизосомального маркера в лизосомах клеток, исследованных с помощью конфокальной флуоресцентной микроскопии и режима последовательного сканирования.
Фиг. 21 отображает специфичность связывания рекомбинантной ЛКЛ человека (SBC-102) с рецептором GlcNAc/маннозы, что было оценено в ходе анализов конкурентного связывания с использованием клеточной линии макрофагов NR8383.
Фиг. 22 отображает активность рекомбинантной ЛКЛ человека в клетках с нормальным содержанием ЛКЛ и дефицитом ЛКЛ in vitro.
Фиг. 23 отображает влияние лечения рекомбинантной ЛКЛ человека (SBC-102) на массу внутренних органов у крыс с дефицитом ЛКЛ. Размер органов представлен в виде процента от массы тела, определенной в возрасте 8 недель у крыс ЛКЛ-/- и ЛКЛ+/+ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг в течение 4 недель.
Фиг. 24 отображает массу тела у крыс дикого типа и крыс с дефицитом ЛКЛ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг-1 в течение 4 недель. Введение дозы указано на оси Х в виде ромбиков, начиная с 4 недели.
Фиг. 25 отображает уровни холестерина в печени, эфиров холестерина и триглицеридов в возрасте 8 недель у крыс WT и крыс с дефицитом ЛКЛ после еженедельного введения носителя или рекомбинантной ЛКЛ человека (SBC-102) в дозе 5 мг/кг-1 в течение 4 недель.
Фиг. 26 отображает процентное повышение массы тела у крыс с дефицитом ЛКЛ после 4-недельного введения рекомбинантной ЛКЛ человека (SBC-102) при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 27 отображает вес печени в виде процента от массы тела у крыс с дефицитом ЛКЛ после 4-недельного введения SBC-102 при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 28 отображает уровни эфира холестерина в тканях у крыс с дефицитом ЛКЛ после 4-недельного введения SBC-102 при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 29 отображает ежедневный прогресс в наборе массы тела у крыс, которым было введено 1 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ один раз в две недели.
Фиг. 30 отображает полное анатомо-патологическое исследование подвергшихся лечению животных, показывающее по существу нормализацию размера печени и цвет при рассечении (верхняя часть), а также гистопатологический анализ ткани печени на предмет ЛКЛ у крыс, подвергнутых лечению, который показал нормальные гистологические параметры печени в разительном контрасте относительно существенного накопления пенистых макрофагов у животных, подвергнутых лечению плацебо (нижняя часть).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В тексте данной заявки приводятся определенные термины для иллюстрации и определения значения и объема различных понятий, используемых для описания данного изобретения.
В контексте данного изобретения термин «приемлемый» относительно композиции, состава или ингредиента обозначает отсутствие какого-либо постоянного губительного действия на общее состояние здоровья субъекта, подвергнутого лечению.
В контексте данного изобретения термин «введение» или «вводить» обозначает предоставление рекомбинантной лизосомальной кислой липазы по изобретению субъекту, нуждающемуся в лечении.
Термин «нуклеиновая кислота или полинуклеотидная последовательность» включает, но не ограничивается, последовательности эукариотической мРНК, кДНК, геномной ДНК, синтезированной ДНК и РНК, включающие встречающиеся в природе нуклеотидные основания, такие как аденин, гуанин, цитозин, тимидин и урацил. Термин также включает последовательности с одним или несколькими модифицированными основаниями.
Термин «птица» в контексте данного изобретения обозначает любой вид, подвид или расу организма из таксономического класса птицы, такие как, но не ограничиваясь, курица, индейка, утка, гусь, перепел, фазаны, попугаи, зяблики, ястребы, вороны и бескилевые птицы, такие как страусы, эму и казуары. Термины включают различные известные породы Gallus gallus, или кур (например, белый леггорн, коричневый леггорн, полосатый плимутрок, суссекс, нью-гэмпширская, род-айлендская, австралорп, минорка, амрокс, калифорнийская серая), а также породы индеек, фазанов, перепелов, уток, страусов и другой домашней птицы, которую разводят на коммерческой основе. Они также включают отдельный организм птицы на всех стадиях развития, включая стадии эмбриона и плода.
Термин «терапевтические белки» или «фармацевтические белки» включают аминокислотную последовательность, которая в целом или частично составляет препарат.
Термин «кодирующая последовательность» или «открытая рамка считывания» обозначает полинуклеотид или последовательность нуклеиновых кислот, которая может быть транскрибирована и транслирована (в случае ДНК) или транслирована (в случае мРНК) в полипептид in vitro или in vivo при контроле соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются старт-кодоном трансляции на 5'-(амино) конце и стоп-кодоном трансляции на 3'-(карбоксильном) конце. Последовательность терминации транскрипции обычно располагается на 3'-конце кодирующей последовательности. Кодирующая последовательность может быть фланкирована на 5'- и/или 3'-концах нетранслируемыми участками.
Термин «экзон» обозначает часть гена, которая, при транскрибировании в ядерном транскрипте, «экспрессируется» в цитоплазматической мРНК после удаления интронов или вставочных последовательностей путем ядерного сплайсинга.
Термины «контрольные последовательности» или «регуляторные последовательности» нуклеиновых кислот обозначают последовательности промотора, старт и стоп-кодонов трансляции, сайты связывания рибосом, сигналы полиаденилирования, последовательности терминации транскрипции, «левые» регуляторные домены, энхансеры и т.п., как это необходимо и достаточно для транскрипции и трансляции отдельной кодирующей последовательности в определенной клетке-хозяине. Примеры контрольных последовательностей, подходящие для эукариотических клеток, представлены промоторами, сигналами полиаденилирования и энхансерами. Необязательно, чтобы все такие контрольные последовательности присутствовали в рекомбинантном векторе, поскольку они необходимы для транскрипции и трансляции определенного присутствующего гена.
Термин «функционально или оперативно связанный» обозначает конфигурацию кодирующей и контрольной последовательностей для выполнения требуемой функции. Таким образом, контрольные последовательности, функционально связанные с кодирующей последовательностью, способны влиять на экспрессию кодирующей последовательности. Кодирующая последовательность функционально связана или находится под контролем участка регуляции транскрипции в клетку, когда ДНК полимераза связывается с последовательностью промотора и транскрибирует кодирующую последовательность в мРНК, которая может транскрибироваться в кодируемый белок. Контрольные последовательности не обязательно должны прилегать к кодирующей последовательности, поскольку они действуют как регулятор экспрессии. Таким образом, например, между последовательностью промотора и кодирующей последовательностью могут находиться нетранслируемые, но транскрибируемые последовательности, и последовательность промотора может считаться «функционально связанной» с кодирующей последовательностью.
Термины «гетерологичный» и «экзогенный» относительно последовательностей нуклеиновых кислот, таких как кодирующие последовательности и контрольные последовательности, обозначают последовательности, которые не связаны обычным образом с участком рекомбинантного вектора или с отдельным локусом хромосомы, и/или не связаны обычным образом с отдельной клеткой. Таким образом, «экзогенный» участок нуклеиновой кислоты вектора представлен идентифицируемым сегментом нуклеиновой кислоты в пределах или присоединен к другой молекуле нуклеиновой кислоты, которая в природе не находится во взаимосвязи с другой молекулой. Например, экзогенный участок вектора может включать кодирующую последовательность, фланкируемую последовательностями, не связанными с кодирующей последовательностью в природе. Другой пример экзогенной кодирующей последовательности представлен вектором, в котором кодирующая последовательность не представлена в природе (например, представлена синтетической последовательностью с кодонами, отличающимися от нативного гена). Подобным образом, клетка-хозяин, трансформированная вектором или нуклеиновой кислотой, не встречающейся обычно в клетке-хозяине, будет считаться экзогенной в целях данного изобретения.
В контексте данного изобретения термины «N-гликан», «олигосахарид», «олигосахаридная структура», «схема гликозилирования», «профиль гликозилирования» и «структура гликозилирования» имеют по существу одно и то же значение и каждый термин обозначает одну или более структур, которые образованы из остатков сахаров и присоединены к гликозилированным белкам.
Термин «экзогенный белок» в контексте данного изобретения обозначает белок, не присутствующий естественным образом в отдельной ткани или клетке, и такой белок является продуктом экспрессии вектора экзогенной экспрессии или трансгена, или представлен белком, который не присутствует естественным образом в заданном количестве в отдельной ткани или клетке. Белок, являющийся экзогенным в яйце, представлен белком, который не присутствует обычным образом в яйце. Например, белок, экзогенный для яйца, может быть представлен белком, который присутствует в яйце в результате экспрессии кодирующей последовательности, присутствующей в трансгене животного, откладывающегося яйцо.
«Эндогенный ген» обозначает встречающийся в природе ген или его фрагмент, который обычно связан с отдельной клеткой.
Термин «ЛКЛ» обозначает «лизосомальная кислая липаза человека», «SBC-102» или «молекула лизосомальной кислой липазы человека», и такие термины в тексте данной заявки используются взаимозаменяемым образом.
Описанные здесь продукты экспрессии могут состоять из белкового материала с определенной химической структурой. Однако точная структура зависит от ряда факторов, в частности химических модификаций, свойственных белкам. Например, поскольку все белки содержат ионизируемые амино и карбоксильные группы, белок может быть получен в форме кислой или основной соли, или в нейтральной форме. Первичная аминокислотная последовательность может быть получена с использованием молекул сахаров (гликозилирования) или других химических способов, включая ковалентное или ионное присоединение, например, липидов, фосфатных, ацетильных групп и т.п., что часто встречается при соединении с сахаридами. Такие модификации могут возникать in vitro или in vivo, причем последнее возникает в клетке-хозяине посредством посттрансляционных систем процессинга. Такие модификации могут повышать или снижать биологическую активность молекулы, и такие модифицированные химическим образом молекулы также включены в объем данного изобретения.
Для специалистов в данной области станут очевидными альтернативные способы клонирования, амплификации, экспрессии и очистки. Репрезентативные способы описаны в Sambrook, Fritsch, and Maniatis, Molecular Cloning, a Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory (1989).
Термин «вектор» обозначает полинуклеотид, включающий одноцепочечную, двухцепочечную, кольцевую или сверхспиральную ДНК или РНК. Типичный вектор может состоять из следующих элементов, которые функционально связаны на соответствующих расстояниях для обеспечения экспрессии функционального гена: точка начала репликации, промотор, энхансер, 5' лидерная последовательность мРНК, сайт связывания рибосом, кассета нуклеиновой кислоты, сайты терминации и полиаденилирования и последовательности избирательных маркеров. Один или более таких элементов могут быть описаны в отдельных заявках на изобретение. Кассета нуклеиновых кислот может включать сайт рестрикции для вставки экспрессируемой последовательности нуклеиновой кислоты. В функциональном векторе кассета нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, которую необходимо экспрессировать, включая сайты начала и терминации трансляции. В вектор в некоторых случаях может быть включен интрон, например, с конца 5' относительно кодирующей последовательности. Вектор конструируют таким образом, что отдельная кодирующая последовательность расположена в векторе с соответствующими регуляторными последовательностями, а расположение и ориентирование кодирующей последовательности относительно контрольных последовательностей выполнено таким образом, что контрольная последовательность транскрибируется под «контролем» контрольной или регуляторной последовательностей. Модификация последовательностей, кодирующих отдельный белок, может оказаться желательной для достижения указанного конца. Например, в некоторых случаях может оказаться необходимым модифицировать последовательность таким образом, чтобы она была присоединена к контрольной последовательности с соответствующей ориентацией; или для поддержания рамки считывания. Контрольные последовательности и другие регуляторные последовательности могут быть лигированы с кодирующей последовательностью перед вставкой в вектор. С другой стороны, кодирующая последовательность может быть клонирована непосредственно в вектор экспрессии, который уже содержит контрольные последовательности и соответствующий сайт рестрикции, находящийся в пределах рамки считывания и под контролем контрольных последовательностей.
Термин «промотор» обозначает участок на ДНК, с которым связывается РНК-полимераза для инициации транскрипции гена. В некоторых вариантах воплощения изобретения промотор может быть модифицирован путем добавления или делеции последовательностей, или замены альтернативными последовательностями, включая встречающиеся в природе или синтезированные последовательности, а также последовательности, которые могут быть представлены комбинацией синтезированных и встречающихся в природе последовательностей. Большая часть эукариотических промоторов включает два типа последовательностей распознавания: ТАТА-бокс и «левые» элементы промотора. Первые располагаются кверху от сайта инициации транскрипции и задействованы в направлении РНК-полимеразы для инициации транскрипции в правильном месте, в то время как вторые определяют скорость транскрипции и находятся выше относительно ТАТА-бокса. Элементы энхансера могут также стимулировать транскрипцию от присоединенных промоторов, однако большинство функционирует эксклюзивно в клетке отдельного типа. Много элементов энхансера/промотора, полученных из вирусов, например, промотор SV40, промотор цитомегаловируса (CMV), промотор вируса саркомы Рауса (RSV) и промотор вируса мышиного лейкоза (MLV), активны в целом ряде клеточных типов и называются «вездесущими». С другой стороны, неконститутивные промоторы, такие как промотор вируса опухоли молочной железы у мыши (MMTV), также могут использоваться в данном изобретении. Последовательность нуклеиновой кислоты, вставленной в сайт клонирования, может иметь любую открытую рамку считывания, кодирующую интересующий полипептид, с условием, что кодирующая последовательность кодирует интересующий полипептид и в ней отсутствуют сплайс-сайты, которые могут блокировать выработку соответствующих молекул мРНК и/или продуцировать аберрантным образом соединенные или аномальные молекулы мРНК.
В контексте данного изобретения термин «фармацевтическая композиция» обозначает смесь описанных здесь соединений с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, разрыхлители и/или вспомогательные вещества.
Термин «полученный из домашней птицы» или «полученный из птицы» обозначает композицию или вещество, полученное или произведенной птицей. Термин «домашняя птица» обозначает птиц, разводимых в домашних условиях, включая, но не ограничиваясь, кур, уток, индеек, перепелов и бескилевых. Например, термин «полученный от домашней птицы» может обозначать происхождение от кур, индеек и/или перепелов.
Термин «ретровирусная частица», «передающая частица» или «частица трансдукции» обозначает вирус, дефективный для репликации или компетентный для репликации, который способен переносить невирусную ДНК или РНК в клетку. В отдельном варианте воплощения изобретения ретровирусные частицы, используемые для получения трансгенных птиц в соответствии с изобретением, получают согласно описанию, представленному в патенте США No. 7524626 от 28 апреля 2009 г., описание которого включено сюда во всей своей полноте посредством ссылки.
Термины «трансформация», «трансдукция» и «трансфекция» обозначают введение полинуклеотида в бластодермальную клетку птицы. Термин «магнум» обозначает часть яйцевода между воронкой и местом сужения, содержащую клетки трубчатой железы, которые синтезируют и секретируют белок яичного белка.
Термин «трансген» обозначает гетерологичную последовательность нуклеотида, вставленную в геном птицы согласно изобретению. Термин «трансген» может специфическим образом обозначать экзогенную кодирующую последовательность, присоединенную к экзогенному промотору или другой регуляторной последовательности, полной нуклеотидной последовательности между двумя