Способ улучшения каталитических свойств пенициллинацилазы
Иллюстрации
Показать всеИзобретение относится к генной инженерии, конкретно к инженерной энзимологии, и может быть использовано для проведения биокаталитических превращений и получения химических соединений. Для стереоселективного ацилирования первичных аминоспиртов и стереоселективного гидролиза N-ацильных производных первичных аминоспиртов используют мутантную пенициллинацилазу из E. coli, в которой аминокислотный остаток 71 бета-цепи заменен на лейцин или аргинин, или аминокислотный остаток 145 альфа-цепи заменен на лейцин. Изобретение позволяет улучшить каталитические свойства пенициллинацилазы, в частности, каталитическую активность и стереоселективность, а также повысить способность фермента катализировать реакции ацилирования первичных аминоспиртов. 6 табл., 5 пр.
Реферат
В настоящее время биокатализаторы широко используются в промышленности для проведения в мягких условиях химических превращений с высокой хемо-, регио- и стереоизбирательностью [Industrial enzymes. Eds. J. Polaina and A.P. MacCabe. Springer: Dordrecht, The Netherlands, 2007.]. Пенициллинацилаза из разных источников используется в фармацевтической промышленности при получении полусинтетических β-лактамных антибиотиков [A. Bruggink et al. Org. Process Res. Dev. 1998, 2, P. 128.]. Широкая субстратная специфичность и стереоселективность могут дать возможность применения пенициллинацилазы в тонком органическом синтезе для получения энантиомеров α-, β-, γ-аминокислот и их элементоорганических аналогов [ V.K. et al. Annal N.Y. Acad. Sci. 1996, 799, P. 659.], для высокоэффективного стереоселективного ацилирования аминосоединений в водной среде и получения энантиомерно чистых соединений [WO 02/20820, 14-03-2002; WO 02/20821, 14-03-2002; D.T. Guranda et al. Tetrahedron: Asymm. 2004, 15, P. 2901.]. Однако, каталитические свойства природных ферментов ограничены.
Принимая во внимание высокий биокаталитический потенциал, пенициллинацилаза является объектом биоинженерии с целью создания биокатализаторов с улучшенными свойствами. Для улучшения каталитических свойств фермента используют методы, основанные на изменение его первичной структуры посредством введения мутаций или рекомбинации генов. В ряде работ было показано, что методами генной инженерии можно изменить субстратную специфичность и каталитические свойства пенициллинацилазы. В частности, в результате многоточечных мутаций была изменена архитектура участка связывания ацильной группы субстрата в активном центре фермента и, таким образом, впервые был получен рекомбинантный препарат пенициллинацилазы, активный по отношению к цефалоспорину С [В. Oh et al. Biochem. Biophys. Res. Commun. 2004, 319, P. 486.]. Принципиальным достижением последних лет, открывающее новые возможности улучшения каталитических свойств фермента, является конструирование пермутированной одноцепочечной пенициллинацилазы, экспрессия которой не зависит от автокаталитического расщепления [G. Flores et al. J. Protein Science. 2006, 13, P 1677.].
В то время как большинство случайных мутаций практически не сказываются на каталитические свойства пенициллинацилазы, отдельные мутации аминокислотных остатков могут существенно повлиять на субстратную специфичность и каталитические свойства фермента. Показательными являются примеры, когда методом направленной эволюции были получены мутантные варианты пенициллинацилазы из E.coli и K. Citrophila по положению Pheβ71, с измененной специфичностью по отношению к ацильной части субстратов, впервые способные катализировать гидролиз адипил- и глутарил-L-лейцина [L.J. Forney et al. Appl. Environ. Microbiol. 1989, 55(10), P. 2550.; A. Roa et al. Biochem. J. 1994, 303, P. 869.]. Результаты этих работ свидетельствуют о том, что «оборотной стороной» такой мутации в пенициллинацилазе является драматическое снижение активности по отношению к природным субстратам пенициллину G и V по сравнению с диким типом фермента.
В литературе большее число работ направлено на получение вариантов фермента с большей каталитической активностью в реакции гидролиза по отношению к ограниченному кругу природных и цветных высокоспецифических субстратов, которые традиционно используются для слежения за ферментативной активностью. Между тем, пенициллинацилаза является высоко активным и стабильным ферментом в водной среде [V.K. Svedas et al. FEBS Lett. 1997, 417, P. 414.; Д.Ф. Гуранда и др. Биохимия. 2004, 69(12), С. 1700.], поэтому задача увеличения гидролитической активности фермента по отношению к природным и цветным высокоспецифическим субстратам на наш взгляд не является принципиальной. Более ценным считаем биоинженерию пенициллинацилазы с целью увеличения активности по отношению к неприродным и неспецифическим субстратам, увеличения стереоселективности, а также увеличения способности фермента катализировать ацилирование различных аминосоединений.
Несмотря на высокий синтетический потенциал пенициллинацилазы, известно всего несколько научных трудов по получению вариантов фермента с увеличенной способностью катализировать реакции ацилирования, где показано, что варианты пенициллинацилазы из E.coli по положениям Argα145 и Pheα146 в 2-4 раза эффективнее катализируют синтез пенициллина и ампициллина методом ацильного переноса по сравнению с диким типом [W.B.L. Alkema et al. Protein Engineering. 2000, 13(12), P. 857.; W.B.L. Alkema et al. Biochem. J. 2002, 365, P. 303.].
В научной литературе нет сведений относительно влияния мутаций на стереоселективность пенициллинацилазы.
Патентная литература по вопросам биоинженерии пенициллинацилазы ограничивается несколькими патентами одной группы авторов. В патенте [WO 9605318, 22-02-1996] заявлено изменение субстратной специфичности и активности пенициллинацилазы мутацией аминокислотных остатков по значительному числу сайтов альфа цепи (α139-152) и бета цепи (β20-27, β31, β32, β49-52, β56, β57, β65-72, β154-157, β173-179, β239-241, β250-263, β379-387, β390, β455, β474-480), хотя патент основан на нескольких примерах влияния мутаций по отдельным положениям Metα143, Pheα147, Leuβ56, Alaβ67, IIeβ177 в пенициллинацилазе из Alcaligenes faecalis на способность фермента катализировать гидролиз природных пенициллинов G и V, а также синтез ампициллина. В следующих патентах [WO 9820120, 14-05-1998; US 6403356, 11-06-2002] круг вариантов пенициллинацилазы существенно сужен и ограничен мутациями по сайтам Metα142, Pheα146, Pheβ24, Valβ56, IIeβ177. Приоритетные права данных патентов ограничиваются способом получения 6-аминопенициллановой и 7-аминодезацетоксицефалоспорановой кислот ферментативным гидролизом их ацилированных форм, а также способом получения β-лактамов ферментативным ацилированием 6-аминопенициллиновой и 7-аминодезацетцефалоспорановой кислот.
Таким образом, за исключением случая улучшения каталитической активности по отношению к природным субстратам, ранее заявленные способы не затрагивают такие ключевые свойства пенициллинацилазы как стереоселективность и способность ацилирования различных классов аминосоединений, а также способов применения таких препаратов с целью получения энантиомерно чистых соединений.
Технической задачей настоящего изобретения является создание пенициллинацилазы с повышенной каталитической активностью и стереоселективностью в реакциях ацилирования широкого круга аминосоединений и гидролиза их N-ацильных производных, а также их применение для проведения биокаталитических превращений, в частности с целью получения энантиомерно чистых соединений. Зачастую, настоящее изобретение не имеет отношение к способам получения 6-аминопенициллановой и 7-аминодезацетоксицефалоспорановой кислот ферментативным гидролизом их ацилированных форм, а также способы получения β-лактамных антибиотиков ферментативным ацилированием 6-аминопенициллиновой и 7-аминодезацетцефалоспорановой кислот.
Технический результат заявленного способа является создания препаратов пенициллинацилазы с увеличенной каталитической эффективностью и стереоизбирательностью в реакциях ацилирования широкого круга аминосоединений и гидролиза их N-ацильных производных, а также их применения для проведения биокаталитических превращений, в том числе для получения функционализированных и энантиомерно чистых соединений.
Поставленная задача достигается путем изменения структуры пенициллинацилазы из Escherichia coli в результате замены аминокислотного остатка в положении 145 альфа-цепи на лейцин или заменой аминокислотного остатка в положении 71 бета-цепи фермента на лейцин или аргинин. Здесь имеется в виду нумерация аминокислотных остатков согласно общепринятым методам выравнивания аминокислотной последовательности пенициллинацилаз из разных источников, например, [R.M.D. Verhaert et al. Appl. Environ. Microbiol. 1997, 63(9), P. 3412.]
Наиболее близкими к заявленному решению является способ улучшения свойств пенициллинацилазы, описанный в рассмотренных выше патентах [WO 9605318, 22-02-1996; WO 9820120, 14-05-1998; US 6403356, 11-06-2002].
В научной и патентной литературе не известны примеры повышения каталитических свойств пенициллинацилазы по отношению к неприродным субстратам, в частности, каталитической эффективности и стереоизбирательности в реакциях ацилирования широкого круга аминосоединений и гидролиза их N-ацильных производных, включающие изменение структуры фермента путем замены аминокислотных остатков в положении 71 бета-цепи и 145 альфа-цепи ПА из Escherichia coli, а новая функция и предлагаемое назначение не вытекают с очевидностью из его известной структуры, принятого назначения или как следствие ранее известных свойств.
Таким образом, настоящее изобретение относится к инженерной энзимологии, молекулярной биологии и биотехнологии, а именно, к получению и применению вариантов пенициллинацилазы из Escherichia coli, полученных из предшественника фермента посредством замены одного или нескольких остатков альфа и бета-цепи фермента, соответствующие сайтам α145 и β71 пенициллинацилазы из E.coli, любыми доступными методами генной инженерии, направленной эволюции или селекции.
Наиболее предпочтительным является получение и применение варианта пенициллинацилазы β71.
Субстратами в ферментативных реакциях гидролиза могут быть соответствующие эфиры и амиды карбоновых кислот, в частности фенилуксусной и феноксиуксусной кислоты и их замещенных производных в α-положении и в ароматическом кольце. Предпочтительным является использование амидов и эфиров фенилуксусной, п-гидрокси-фенилуксусной, феноксиуксусной, R- и S-миндальной кислоты, R- и S-фенилглицина.
В качестве ацильных доноров могут быть использованы карбоновые кислоты, в частности фенилуксусная и феноксиуксусная кислота и их замещенные производные в α-положении и в ароматическом кольце, а также их амиды и эфиры.Предпочтительным является использование амидов и эфиров фенилуксусной, п-гидроксифенилуксусной, феноксиуксусной, R- и S-миндальной кислоты, R- и S-фенилглицина.
Пенициллинацилаза по изобретению может быть получена и использована в виде гомогенного препарата, раствора с содержанием других химических соединений или белков, мицелл, агрегатов, или в твердом состоянии в виде кристаллов или иммобилизованных в геле, на различных подложках и носителях препаратах, или применяется в виде культуры клеток.
Препараты биокатализаторов на основе пенициллинацилазы по изобретению могут применяться с целью:
- проведения биокаталитических превращений, в том числе протекающих хемо-, регио- и стереоизбирательно;
- проведения ацилирования первичных аминосоединений, в частности, для ацилирования аминов, аминоспиртов, аминокислот, их амидов и эфиров, пептидов и пептидомиметиков, а также их элементоорганических аналогов;
- проведения гидролиза амидной и эфирной связи, в частности, для гидролиза амидов и эфиров, О- или N-ацилированных производных спиртов, аминов, аминоспиртов, аминокислот, их амидов и эфиров, пептидов и пептидомиметиков, а также их элементоорганических аналогов;
- получения химических соединений, в том числе энантиомерно чистых соединений, в частности спиртов, аминов, аминоспиртов, аминокислот, их амидов, эфиров и ацильных производных, пептидов и пептидомиметиков, а также их элементоорганических аналогов.
Способ применения реализуется приведением в контакт препарата пенициллинацилазы и реакционной смеси. В качестве реакционной среды может быть использована вода, однофазные и многофазные водно-органические смеси, растворы с содержанием органических и неорганических соединений, в частности солей, кислот, оснований. В качестве реакционной среды более предпочтительным является использование воды или водных растворов с содержанием не более 40% (по объему) органических растворителей.
Способ применения препарата пенициллинацилазы по изобретению может быть как независимым, так и в комбинации с другими катализаторами и биокатализаторами.
Некоторые примеры реализации способа улучшения каталитических свойств пенициллинацилазы и способа их применения по изобретению приведены ниже. Варианты пенициллинацилазы из E.coli получали путем конструирования мутантного гена методом сайт-специфического мутагенеза по методикам описанных в статьях [V. Picard et al. Nucleic Acids Res. 1994, 22, P. 2587.; W.B.L. Alkema et al. Protein Eng. 2000, 13, P. 857]. После процедур клонирования, культивирования, выделения и очистки были получены гомогенные препараты мутантов пенициллинацилазы.
Пример 1. Увеличение каталитической активности пенициллинацилазы.
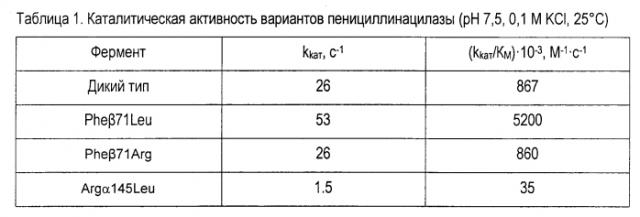
Каталитическую активность пенициллинацилазы измеряли с использованием удобного для регистрации цветного субстрата 6-нитро-3-(фенилацетамид)бензойной кислоты. Количественной мерой каталитической активности являются каталитическая константа (kkaт) и константа специфичности (kkaт/KM), значения которых в случае варианта βPhe71Leu в 2 и в 6 раз выше соответствующих значений для пенициллинацилазы дикого типа (табл. 1).
Пример 2. Увеличение стереоселективности пенициллинацилазы по отношению к N-ацильным производным аминосоединений.
Сравнение стереоизбирательности пенициллинацилаз по отношению к N-ацильным производным аминосоединений проводили на основании значений стереоселективности (Е) ферментативного гидролиза ряда N-ацильных производных аминосоединений. В случае варианта Pheβ71Leu значение стереоселективности гидролиза производных фенилуксусной и миндальной кислот примерно в 2-4 раза выше, чем в случае пенициллинацилазы дикого типа (табл. 2 и 3). В случае варианта Argα145L наблюдается увеличение стереоселективности примерно в 1,5 раза относительно пенициллинацилазы дикого типа (табл. 3). Следует отметить значительное влияние структуры ацильной части субстрата на стереоселективность ферментативной реакции.
Пример 3. Увеличение стереоселективности и синтетической способности пенициллинацилазы в реакциях ацильного переноса.
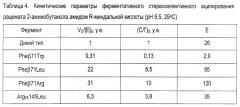
Сравнение стереоизбирательности и синтетической способности вариантов пенициллинацилазы проводили на примере ацилирования рацемата 2-аминобутанола амидом (R)-миндальной кислоты. В рассмотренном ряду варианты пенициллинацилазы по положению Pheβ71 характеризуются предельными значениями скорости синтеза, соотношением начальных скоростей накопления продуктов синтеза и гидролиза (С/Г)0 и стереоселективности (Е). С одной стороны, в случае вариантов Pheβ71Leu и Pheβ71Arg наблюдаемое увеличение по каждому из показателей составляет примерно 5-30 раз в сравнении с диким типом (табл. 4). И напротив, в случае варианта Pheβ71Trp происходит обратный эффект.
Пример 4. Получение энантиомеров соединений при использовании вариантов пенициллинацилазы методом ферментативного гидролиза.
Энантиомеры аминосоединений получали в результате ферментативного гидролиза рацемата N-ацильного производного до 50% конверсии, как описано в экспериментальной части. Продукты наиболее высокой энантиомерной чистоты (S)-аминобутанола и (R)-фенилаланинола были получены в случае применения вариантов пенициллинацилазы по положению Pheβ71.
Пример 5. Получение энантиомерно чистых соединений при использовании вариантов пенициллинацилазы методом ацильного переноса.
Энантиомерно чистые амиды (диастереомеры) получали в результате ферментативного ацилирования рацемата аминосоединения при использовании амида (R)-миндальной кислоты в качестве ацильного донора, как описано в экспериментальной части. Наибольшие значения энантиомерного избытка продукта синтеза наблюдаются в случае применения вариантов пенициллинацилазы Pheβ71.
Описание экспериментальной части
Определение ферментативной активности. Активность мутантных форм пенициллинацилазы определяли спектрофотометрически по накоплению хромофора в процессе гидролиза 1 мМ раствора цветного субстрата 6-нитро-3-(фенилацетамид)бензойной кислоты при 400 нм на спектрофотометре Shimadzu UV-1601 (Япония). Реакцию проводили при 25°C в 0,01 М фосфатном буфере, рН 7,5, 0,1 М KCl.
Определение концентрации активных центров. Абсолютную концентрацию активных центров каждой из мутантных форм пенициллинацилазы определяли титрованием активных центров фермента необратимым ингибитором фенилметилсульфонилфторидом по методике [В.К. Швядас и др. Биоорг. химия. 1977, 3, С. 546.]. Остаточную ферментативную активность определяли спектрофотометрически по гидролизу цветного субстрата, как описано выше.
Определение кинетических параметров. Кинетические параметры ферментативного превращения (КМ и kкат) определяли общепринятым методом путем анализа зависимости начальных скоростей гидролиза от концентрации субстрата. Реакции проводили в рамках схемы Михаэлиса-Ментен (S0>>E0) в 0,01 М фосфатном буфере (рН 7,5, 0,1 М KCl) при 25°C.
ВЭЖХ анализ. Количественное определение компонентов реакционной смеси проводили методом обращенно-фазовой высокоэффективной жидкостной хроматографии на хроматографической системе Perkin Elmer 200 Series (США); колонка Luna С18 (Phenomenex, США), 250×4.6 мм, размер частиц 5 µм; подвижная фаза CH3CN/вода 40:60, 0,78 г/л KH2PO4, 0,5 г/л додецилсульфата натрия, рН 3,0; скорость потока 0,8 мл/мин; объем вкола 10 мкл; УФ детектирование при 210 нм.
Определение энантиомерного избытка первичных аминосоединений определяли методом предколоночной модификации о-фталевым альдегидом и хиральным тиолом по методике [D.T. Guranda et al J. Chromatogr. A. 2005, 1095. P. 89.].
Проведение стереоселективного гидролиза. Реакцию стереоселективного ферментативного гидролиза рацемата N-ацильного производного аминосоединения проводили в термостатируемой ячейке рН-стата Titrino 719 (Metrohm, Швейцария) при 25°C, рН 7,5 при постоянном перемешивании до достижения 50% степени конверсии. Начальные концентрации реагентов: 10 мМ субстрата, активных центров пенициллинацилазы 0,1 мкМ, объем реакционной смеси 5 мл. Время проведения эксперимента не превышала 5 ч. По ходу протекания реакции из реакционной смеси отбирали аликвоты, разбавляли их мобильной фазой и анализировали методом ВЭЖХ. Затем реакционную смесь подкисляли до рН 1,5 6н. HCl и экстрагировали этилацетатом (3×5 мл). Аминосоединение, высвободившееся в ходе ферментативного гидролиза, распределялось в водном слое. Для определения энантиомерного избытка аминосоединения аликвоту полученного водного раствора анализировали методом ВЭЖХ с предколоночной дериватизацией. Стереоселективность ферментативного гидролиза определяли по значению энантиомерного избытка образующегося аминосоединения при 50% степени конверсии.
Проведение стереоселективного ацильного переноса. Реакцию стереоселективного ферментативного ацилирования рацемата первичного аминосоединения, катализируемого пенициллинацилазой, проводили в водной среде методом ацильного переноса от амида (R)-миндальной кислоты. Начальные концентрации реагентов: 100 мМ ацильного донора, 100 мМ рацемата аминосоединения, концентрация активных центров пенициллинацилазы 10 мкМ. Реакцию проводили в термостатируемой ячейке рН-стата Titrino 719 (Metrohm, Швейцария) при 25°C, рН 9,5 при постоянном перемешивании. Время проведения эксперимента составляло от 30 мин. Затем реакционную смесь подкисляли до рН 3,0 6н. HCl и экстрагировали этилацетатом (3×5 мл). Продукт синтеза распределялся в органическом слое. Органический слой выпаривали, а остаток растворяли в 5 мл водно-этанольного раствора. Для определения энантиомерного избытка продукта синтеза аликвоту полученного раствора анализировали методом ВЭЖХ. По ходу протекания реакции из реакционной смеси отбирали аликвоты, разбавляли их мобильной фазой и анализировали методом ВЭЖХ. Эффективность ацильного переноса определяли как соотношение начальных скоростей накопления продуктов синтеза (С) и гидролиза (Г). Стереоселективность ацильного переноса определяли как соотношение начальных скоростей накопления продуктов ацилирования двух энантиомеров аминосоединения.
Применение мутантной пенициллинацилазы из Escherichia coli, в которой аминокислотный остаток 71 бета-цепи заменен на лейцин или аргинин, или аминокислотный остаток 145 альфа-цепи заменен на лейцин для стереоселективного ацилирования первичных аминоспиртов и стереоселективного гидролиза N-ацильных производных первичных аминоспиртов.