Композиция для лечения аутоиммунных заболеваний и способы, связанные с ней
Иллюстрации
Показать всеИзобретение относится к композиции для лечения аутоиммунных заболеваний. Указанная композиция состоит из тригонеозида Ib и виценина-1, при необходимости вместе по меньшей мере с одним наполнителем, где концентрация тригонеозида Ib находится в диапазоне от 40 до 90 мас.%, а концентрация виценина-1 находится в диапазоне от 1 до 20 мас.%. Также изобретение относится к способу приготовления указанной композиции и способу лечения аутоиммунных заболеваний, включающему введение указанной композиции. Изобретение характеризуется высокой эффективностью в отношении различных аутоиммунных заболеваний. 3 н. и 14 з. п. ф-лы, 6 ил., 8 табл., 14 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей тригонеозид Ib и виценин-1, и к способу получения такой композиции. Кроме того, настоящее изобретение относится к применению композиции для лечения и контроля аутоиммунных заболеваний, таких как болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системная красная волчанка и идиопатическая тромбоцитопеническая пурпура.
Предшествующий уровень техники
Аутоиммунные заболевания, такие как болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системная красная волчанка и идиопатическая тромбоцитопеническая пурпура, демонстрируют избыточную продукцию аутоантител и вызывают тяжелое поражение клеток, тканей, органов и т.д. Эти заболевания характеризуются потерей толерантности организма к аутоантигенам и последующей активацией иммунного ответа, приводящей к повреждению. Наследственная предрасположенность и факторы окружающей среды являются преобладающими причинами этих заболеваний.
Болезнь Гудпасчера и гломерулонефрит характеризуются отложением антител вдоль базальной мембраны клубочков (БМК) в почках, приводящим к экстракапиллярному гломерулонефриту. Эти болезни обычно обозначают как заболевания с образованием антител к базальной мембране клубочков (анти-БМК). У пациентов, страдающих анти-БМК заболеваниями, шанс выживания почек составляет только 10%. Болезнь Гудпасчера является редким заболеванием с частотой один случай на миллион человек. Повреждение почек, опосредованное аутоантителами, является основной проблемой при болезни Гудпасчера. У некоторых пациентов развивается легочная геморрагия, однако повреждение, вызванное в легких анти-БМК антителами, не является постоянным и реже приводит к летальному исходу, по сравнению с повреждением почек.
Существующие методы лечения болезни Гудпасчера или гломерулонефрита включают процедуры плазмафереза или обмена плазмы, позволяющие удалить циркулирующие анти-БМК антитела из крови. Риск, связанный с применением препаратов крови, гематома, реакция на трансфузию и заболевания, передаваемые при трансфузии, являются основными осложнениями, связанными с плазмаферезом. Другие виды лечения включают применение иммуносупрессивных агентов, таких как кортикостероиды и циклофосфамид, предназначенных для контроля прогрессирования почечной недостаточности и кровотечения в легких. Эти лекарства подавляют иммунный ответ неспецифическим путем и увеличивают вероятность развития оппортунистических инфекций у пациентов. Современное направление лечения анти-БМК заболеваний не позволяет полностью контролировать заболевание. Прогрессирование заболевания до конечной стадии органной недостаточности повышает риск смертности.
Ревматоидный артрит (РА) является хроническим прогрессирующим заболеванием, поражающим примерно 1% населения мира, опосредованным аутоантителами. Подобно болезни Гудпасчера, РА характеризуется утратой толерантности организма к аутоантигенам и последующей активацией иммунного ответа, ведущей к повреждению тканей. Продукция аутоантител, направленных к синовиальной мембране, хрящу, и подлежащим суставам, определяет патогенез РА. Деформация суставов приводит к тяжелой инвалидности и снижает качество жизни. Общие симптомы включают боль в суставах, нарушение гибкости и отек суставов, нарушение подвижности, слабость мышц, жар и общее недомогание. Повышенные уровни С-реактивного белка и ревматоидного фактора в крови являются диагностическими индикаторами РА. Существующие методы лечения РА включают базовые противоревматические препараты, модифицирующие лечение болезни (БПРП), такие как гидроксихлорохин; иммуносупрессанты, такие как азатиоприн, кортикостероиды, селективные ингибиторы ЦОГ-2, НПВС и анальгетики для облегчения симптомов. Хроническое применение анальгетиков и НПВС вызывает язвы и плохо переносится большинством пациентов, в селективные ингибиторы ЦОГ-2 связаны с кардиотоксичностью.
Иммуносупрессанты являются основным направлением лечения РА. Как обсуждалось выше, эти лекарства подавляют иммунный ответ неспецифическим путем и повышают вероятность осложнений, опасных для жизни. Биологические лекарства, такие как ингибиторы ФНО, а именно адалимунаб, этанерцепт, инфликсимаб и т.д.; антагонисты рецептора ИЛ-1, а именно анакинра, и антагонисты рецептора ИЛ-6, а именно тоцилизумаб, широко применяются в лечении РА. Эти лекарства предназначены для влияния на биохимические пути, вызывающие воспаление сустава и повреждение сустава, путем действия в качестве антагонистов цитокиновых рецепторов. Одним главным недостатком биологических лекарств является то, что при хроническом применении пациенты теряют восприимчивость к этим лекарствам, и эффективность лечения снижается. Из-за профиля токсичности многие из этих лекарств рекомендуются только для пациентов, не отвечающих на другие виды лечения РА.
Системная красная волчанка (СКВ) является генерализованным аутоиммунным заболеванием, клинический диагноз которого ставят на основе таких признаков, как боль в суставах, жар, утомляемость, поражения кожи, фоточувствительность, боль в груди, потеря волос, стоматит и т.д., при наличии аутоантител в крови и избыточного сывороточного белка в моче. Поражение почек является основным осложнением СКВ. У более 50% больных СКВ развивается почечная недостаточность из-за отложения антител в клубочках, и для них требуется диализ или трансплантация почки. Другие осложнения, опосредованные аутоантителами, включают повреждения легких, сердца, гемолитическую анемию, тромбоцитопению, церебральную дисфункцию и т.д. Существующие методы лечения СКВ включают НПВС, противомалярийные агенты, кортикостероиды и метотрексат для облегчения скелетно-мышечных и кожных проявлений. В соответствии с данными Управления по контролю за продуктами питания и лекарственными средствами США, современное направление лечения СКВ сталкивается с такими проблемами, как неполный контроль заболевания, прогрессирование до терминальной органной недостаточности и ослабляющие побочные эффекты (Guidance for Industry: Systemic Lupus Erythematosus - Developing Medical Products for Treatment, June 2010 («Руководство для промышленности: системная красная волчанка - разработка медицинских продуктов для лечения», июнь 2010)).
Идиопатическая тромбоцитопеническая пурпура (ИТП) является заболеванием, сопровождающимся кровотечениями, вызванными резким снижением количества тромбоцитов. ИТП может быть индуцирована инфекциями, нарушениями функции иммунной системы, такими как СКВ, приемом некоторых лекарств, беременностью и т.д. Хотя точный механизм патогенеза ИТП остается неясным, ИТП связывают главным образом с разрушением тромбоцитов антитромбоцитарными антителами, поскольку более чем у 50% больных с ИТП отмечены положительные результаты анализа антител, направленных к тромбоцитам (Gernsheimer, 2009). Существующие методики лечения ИТП включают: (i) применение таких лекарств, как кортикостероиды и иммуноглобулин для внутривенного введения, которые препятствуют выведению антител, покрытых тромбоцитами; (ii) проведение неспецифической Т-клеточной иммуносупрессии такими лекарствами, как азатиоприн, циклофосфамид, циклоспорин; (iii) применение микофенолата мофетила и биологических агентов, таких как ритуксимаб, препятствующих синтезу антител; (iv) проведение процедур спленэктомии и плазмафереза, обеспечивающих очистку от циркулирующих антитромбоцитарных антител; (v) повышение количества тромбоцитов путем трансфузии тромбоцитов и трансплантации костного мозга и т.д. Все вышеуказанные методики лечения связаны с потенциальными побочными эффектами, такими как угнетение иммунитета, реакции, связанные с применением продуктов крови, такие как реакции на трансфузию и/или заболевания, передаваемые при трансфузии, и гематома.
С учетом недостатков существующих методик лечения аутоиммунных заболеваний, таких как болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системная красная волчанка, идиопатическая тромбоцитопеническая пурпура и т.д., фармацевтическим компаниям необходимо разработать более эффективное лечение с меньшими побочными эффектами, для применения при этих хронических, угрожающих жизни заболеваниях.
Патент США №6080401, Malireddy S. Reddy et al., описывает применение композиции, состоящей из смесей некоторых трав, одной из которых является пажитник сенной (Trigonella foenum-graecum), вместе со смесью некоторых препаратов пробиотиков, для лечения широкого ряда заболеваний, в частности, анемии, артрита, запора, депрессии, диабета, диспепсии, геморроя, гепатита, гипертензии, импотенции, избыточного веса, пародонтоза и их комбинаций.
Патент США №5707631, Chaim Lieberman, раскрывает рецептуру травяной композиции, состоящей из пажитника сенного (Trigonella foenum-graecum), плодов гвоздичного дерева (Syzygium aromatium), луковиц чеснока (Allium sativum), коры корицы цейлонской (Cinnamon zeylanicum), корня костуса (Saussurea costus) и бутонов молочая чины (Euphorbia lathyrus), для применения с целью снижения уровня холестерина, лечения артрита, снижения кровяного давления и лечения болезни Альцгеймера. Однако этот патентный документ не приводит какого-либо доказательства, пригодного для понимания и осуществления специалистом в области техники, касающегося какого-либо эффекта данной композиции при артрите у этих пациентов.
Недавно опубликованы данные Chopra et al. (2010), касающиеся композиции из нескольких трав, содержащей экстракт Trigonella foenum-graecum (пажитника сенного) вместе с экстрактами Boswellia serrata (босвеллии пильчатой), Linum usitatissimum (льна), Camellia sinensis (зеленого чая), Curcuma longa (куркумы), Tribulus terrestris (якорцев стелющихся) и Pipernigrum (черного перца), применяемой для лечения ревматоидного артрита.
В публикации Khan et al. (2011) проведена клиническая оценка травяной композиции, содержащей Nigella sativa (чернушку посевную), Withania somnifera (витанию снотворную), Smilax china (сарсапарель китайский), Apium graveolens (сельдерей душистый), Trigonella foenum-graecum (пажитник сенной), Zingiber officinale (имбирь аптечный) и Colchicum autumnale (безвременник осенний), для лечения ревматоидного артрита.
Во всех обсуждаемых документах из предшествующего уровня техники раскрывается композиция, состоящая из нескольких трав, и трудно установить, что пажитник сенной (Trigonella foenum-graecum) вносит вклад в заявленные благоприятные эффекты.
Пажитник сенной или Trigonella foenum-graecum наиболее часто применяют в традиционной медицине. Экстракты семян пажитника исследовали при лечении различных заболеваний, таких как диабет, подагра, язвы желудка, диарея, запор, и т.д. В работе Ahmadiani et al. (2001) изучена противовоспалительная и антипиретическая активность пажитника. В работе Vyas et al. (2008) показано, что экстракт семян пажитника обладает анальгезирующей и противовоспалительной активностью. Эти исследования не иллюстрируют и не раскрывают специфических компонентов или химического состава семян пажитника, вносящих вклад в заявленную активность.
Семена пажитника содержат много химических веществ, в частности, алкалоидов, таких как тригонеллин, гентианин, карпаин, холин; аминокислот, таких как 4-гидроксиизолейцин, гистидин, лизин, аргинин; флавоноидов, таких как лютеолин, кверцетин, витексин, изовитексин, ориентин, изоориентин, виценин-1, виценин-2; фуростаноловых сапонинов, таких как тригонеллозид С, тригофенозиды, тригонеозиды, фенугрин В; спиростаноловых сапонинов, таких как грекунины, фенугрекин; сапониногенов, таких как диосгенин, ямогенин, юккагенин, лилагенин, тигогенин, неотигогенин, гитогенин, неогитогенин, сарсасапогенин, смилагенин; антоцианинов; волокон, таких как камедь; других фенольных компонентов, таких как тригокумарин, скополетин, хлорогенная, кофейная и п-кумариновая кислоты; липидов; витаминов и следовые количества неорганических элементов.
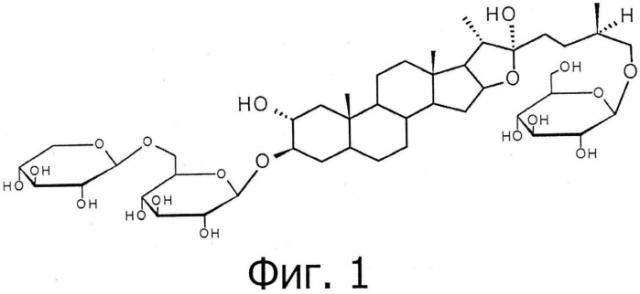
Главным вариантом осуществления настоящего изобретения является композиция, содержащая тригонеозид Ib и виценин-1 для лечения аутоиммунных заболеваний, таких как болезнь Гудпасчера, гломерулонефрит и ревматоидный артрит. Новизна и изобретательский уровень данной заявки состоят в уникальной композиции из тригонеозида Ib и виценина-1. Отмечалось, что тригонеозид Ib является одним из главных фуростаноловых сапонинов, присутствующих в семенах пажитника. Структура тригонеозида Ib показана на фигуре 1. В работах Yoshikawa et al. (1997) и Murakami et al. (2000) охарактеризованы все тригонеозиды, присутствующие в пажитнике, и приведены данные 13С ЯМР, 1Н ЯМР и [α]D для этих молекул. Тригонеозиды Ia, Ib и XIb являются структурными изомерами с молекулярной массой 906, с сопоставимыми данными ЯМР и различными данными а]п.Идентификацию специфического изомера можно провести с применением кислотного гидролиза, при котором тригонеозид Ia образует неогитогенин, тригонеозид Ib образует гитогенин, а тригонеозид XIb образует L-рамнозу.
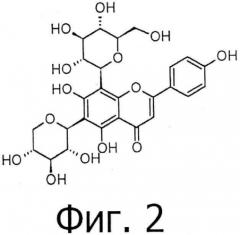
В семенах пажитника присутствует много флавоноидных гликозидов, в частности, витексин, изовитексин, ориентин, изоориентин, виценин и т.д. Для этих флавоноидов были исследованы разные виды физиологической активности, такие как антиоксидантная, анти-тиреоидная, анти-апоптотическая, противовоспалительная, анти-ноцицептивная, анксиолитическая активность и т.д. Настоящее описание относится к одному из флавоноидных гликозидов виценину-1. Присутствие виценина-1 в пажитнике отмечено Wagner et al. (1973). Структура виценина-1 показана на фигуре 2. Другими видами растений, содержащими виценин-1, являются Linum usitatissimum (лен обыкновенный), Tragopogon porrifolius (козлобородник пореелистный) и Triticum aestivum (пшеница мягкая). Sato et al. (2010) описывает способ синтеза виценина-1 и приводит сравнительные данные 13С ЯМР для синтетического и натурального виценина-1.
Сущность изобретения
Соответственно, настоящее изобретение относится к композиции, содержащей тригонеозид Ib и виценин-1, при необходимости вместе по меньшей мере с одним наполнителем; к способу приготовления композиции, содержащей тригонеозид Ib и виценин-1, при необходимости вместе по меньшей мере с одним наполнителем; где указанный способ включает этапы: (а) получения хлопьев из семян пажитника, (b) экстракции хлопьев семян пажитника смесью растворителей с последующей фильтрацией и концентрированием до получения полутвердой массы, (с) растворения массы до получения прозрачного раствора, (d) противоточной экстракции прозрачного раствора n-бутанолом до получения раствора, содержащего водный слой и слой бутанола, (е) пропускание водного слоя через ионообменную смолу и колонку с адсорбентом, до получения элюата, содержащего тригонеозид Ib и виценин-1, (f) очистки элюата до получения легко сыпучего порошка, и (g) при необходимости, добавление по меньшей мере одного наполнителя до получения композиции; и к способу лечения аутоиммунных заболеваний, включающему применение композиции, содержащей тригонеозид Ib и виценин-1, при необходимости вместе по меньшей мере с одним наполнителем, у субъекта, нуждающегося в лечении.
Краткое описание чертежей
На фигуре 1 показана структура тригонеозида Ib.
На фигуре 2 показана структура виценина-1.
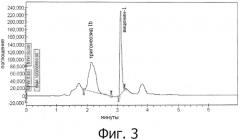
На фигуре 3 показана ВЭЖХ хроматограмма 46% тригонеозида Ib и 6% виценина-1.
На фигуре 4 показана ВЭЖХ хроматограмма 76% тригонеозида Ib и 15% виценина-1.
На фигуре 5 показана ВЭЖХ хроматограмма 91% тригонеозида Ib и 5% виценина-1.
На фигуре 6 показаны изображения, полученные при гистопатологическом исследовании у крыс с индуцированным гломерулонефритом. Справа - БМК -контрольная группа; слева - группа с применением БМК + экспериментальная композиция (75 мг/кг); (1) пространство образования мочи; (2) разрушение клубочков; (3) набухание канальцев; (4) почечные цилиндры; (5) клеточная инфильтрация; (6) иммунологическая реакция гломерулонефрита.
Подробное описание изобретения
Настоящее описание относится к композиции, содержащей тригонеозид Ib и виценин-1, при необходимости вместе по меньшей мере с одним наполнителем.
В одном варианте осуществления настоящего изобретения тригонеозид Ib находится в диапазоне концентрации примерно от 40 масс.% до 90 масс.%, а виценин-1 находится в диапазоне концентрации примерно от 1 масс.% до 20 масс.%.
В другом варианте осуществления настоящего изобретения тригонеозид Ib и виценин-1 получены из растения пажитника сенного (Trigonella foenum-graecum).
В еще одном варианте осуществления настоящего изобретения наполнитель выбрано из группы, включающей гранулирующие агенты, связующие агенты, любриканты, дезинтегрирующие агенты, подсластители, красящие агенты, вкусоароматические агенты, агенты для образования оболочки, пластификаторы, консерванты, суспендирующие агенты, эмульгирующие агенты, целлюлозные материалы и агенты для сферонизации, или любую их комбинацию.
В другом варианте осуществления настоящего изобретения композиция составлена в виде лекарственных форм, выбранных из группы, включающей таблетку, капсулу, пастилки, леденцы от кашля, порошок, сироп, раствор, аэрозоль, суспензию, диспергируемые порошки или гранулы, эмульсию в твердых или мягких гелевых капсулах, сиропы, эликсиры, линименты, мази, кожный пластырь, фитоцевтики, нутрацевтики и пищевые продукты.
Настоящее описание также относится к способу приготовления композиции, содержащей тригонеозид Ib и виценин-1, при необходимости по меньшей мере с одним наполнителем, включающему этапы:
(a) получения хлопьев из семян пажитника,
(b) экстракции хлопьев семян пажитника смесью растворителей с последующей фильтрацией и концентрированием до получения полутвердой массы,
(c) растворения массы до получения прозрачного раствора,
(d) противоточной экстракции прозрачного раствора n-бутанолом до получения раствора, содержащего водный слой и слой бутанола,
(e) пропускание водного слоя через ионообменную смолу и колонку с адсорбентом, до получения элюата, содержащего тригонеозид Ib и виценин-1,
(f) очистки элюата до получения легкосыпучего порошка, и
(g) при необходимости, добавление по меньшей мере одного наполнителя до получения композиции.
В одном варианте осуществления настоящего изобретения хлопья из семян получают с размером в диапазоне примерно от 1 мм до 5 мм, более предпочтительно 2 мм.
В другом варианте осуществления настоящего изобретения смесь растворителей содержит алифатический спирт и воду в отношении примерно 1:1 до 9:1, более предпочтительно 4:1.
В еще одном варианте осуществления настоящего изобретения алифатический спирт выбран из группы, содержащий метиловый спирт, этиловый спирт, пропиловый спирт и изопропиловый спирт, или любую их комбинацию.
В еще одном варианте осуществления настоящего изобретения массу растворяют в деионизированной воде.
В другом варианте осуществления настоящего изобретения очистку проводят до получения тригонеозида Ib с чистотой в диапазоне примерно от 90 до 95%, и виценина-1 с чистотой в диапазоне примерно от 90 до 95%.
В еще одном варианте осуществления настоящего изобретения очистка включает этапы обработки буферным раствором с последующей обработкой спиртом или кислотой, и концентрирование до получения очищенного легкосыпучего порошка.
В еще одном варианте осуществления настоящего изобретения концентрирование проводят при температуре в диапазоне примерно от 40°C до 80°C, более предпочтительно около 50°C.
В еще одном варианте осуществления настоящего изобретения композиция содержит тригонеозид Ib в диапазоне концентрации примерно от 40 масс.% до 90 масс.%, и виценин-1 в диапазоне концентрации примерно от 1 масс.% до 20 масс.%.
В еще одном варианте осуществления настоящего изобретения наполнитель выбран из группы, включающей гранулирующие агенты, связующие агенты, любриканты, дезинтегрирующие агенты, подсластители, красящие агенты, вкусоароматические агенты, агенты для образования оболочки, пластификаторы, консерванты, суспендирующие агенты, эмульгирующие агенты, целлюлозные материалы и агенты для сферонизации или любую их комбинацию.
Настоящее изобретение также относится к способу лечения аутоиммунных заболеваний, включающему применение композиции, содержащей тригонеозид Ib и виценин-1, при необходимости по меньшей мере с одним наполнителем, у субъекта, нуждающегося в лечении.
В одном варианте осуществления настоящего изобретения аутоиммунное заболевание выбрано из группы, включающей болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системную красную волчанку и идиопатическую тромбоцитопеническую пурпуру.
В другом варианте осуществления настоящего изобретения субъект является животным или человеком.
В еще одном варианте осуществления настоящего изобретения, композицию применяют с суточной дозировкой в диапазоне примерно от 1 мг/кг до 100 мг/кг у животного, и примерно от 1 мг/кг до 50 мг/кг у человека.
Настоящее изобретение также относится к применению композиции, содержащей 40-90 масс.% тригонеозида Ib и 1-20 масс.% виценина-1, в лечении болезни Гудпасчера, гломерулонефрита, ревматоидного артрита, системной красной волчанки и идиопатической тромбоцитопенической пурпуры, путем предотвращения опосредованного аутоантителами повреждения органов. Способ получения специфической композиции, содержащей тригонеозид Ib и виценин-1, из семян пажитника, не известен в данной области техники. Уникальность способа, раскрытого в настоящем изобретении, заключается в экстракции композиции, специфически содержащей тригонеозид Ib и виценин-1. Дополнительную очистку проводят до получения тригонеозида Ib со степенью очистки 90-95% и виценина-1 со степенью очистки 90-95% для определения структуры и стандартизации композиции.
В другом варианте осуществления настоящего изобретения тригонеозид Ib имеет молекулярную массу 906 и химическую формулу С44Н74О19.
В еще одном варианте осуществления настоящего изобретения виценин-1 имеет молекулярную массу 564 и химическую формулу С26Н28О14.
В еще одном варианте осуществления настоящего изобретения указанную композицию получают из растения пажитника сенного (Trigonella foenum-graecum).
В другом варианте осуществления настоящего изобретения композиция находится в форме, выбранной из группы, включающей таблетку, капсулу, пастилки, леденцы от кашля, порошок, сироп, раствор, аэрозоль, суспензию, диспергируемые порошки или гранулы, эмульсию в твердых или мягких гелевых капсулах, сиропы, эликсиры, линимент, мазь, кожный пластырь, фитоцевтики, нутрацевтики и пищевые продукты.
Настоящее изобретение также относится к способу экстракции и очистки композиции, содержащей тригонеозид Ib и виценин-1 из пажитника сенного, и к этапам способа, включающим:
(a) экстракцию прозрачного раствора путем обезжиривания и удаления азотистых соединений, таких как алкалоиды, аминокислоты; и
(b) пропускание прозрачного раствора через катионообменную макропористую смолу и колонку с адсорбентом для элюции тригонеозида Ib и виценина-1; концентрирование элюата и дополнительную очистку.
В одном варианте осуществления настоящего изобретения композиция находится в диапазоне 40-90 масс.% тригонеозида Ib и 1-20 масс.% виценина-1.
В другом варианте осуществления настоящего изобретения, поскольку тригонеозид Ib и виценин-1 экстрагируют из семян пажитника, подразумевается, что композиция может содержать целлюлозный материал, содержащий полезные молекулы из семян пажитника в малых пропорциях, как видно по результатам ВЭЖХ (фигуры 3-5).
В другом варианте осуществления настоящего изобретения экстракция прозрачного раствора из пажитника сенного на этапе (а) включает следующие этапы:
(i) получение хлопьев из семян пажитника;
(ii) экстракция хлопьев из семян растворителем;
(iii) фильтрация экстракта до получения прозрачного раствора;
(iv) концентрирование прозрачного раствора под вакуумом до получения полутвердой массы;
(v) растворение концентрированной массы до получения прозрачного раствора;
(vi) противоточная экстракция прозрачного раствора n-бутанолом для удаления жирных веществ.
В одном варианте осуществления настоящего изобретения растворитель, используемый на этапе (b), является смесью воды и спирта, выбранного из группы, включающей метиловый спирт, этиловый спирт, пропиловый спирт и изопропиловый спирт, в диапазоне отношений от 1:1 до 9:1, и предпочтительно 4:1.
В еще одном варианте осуществления настоящего изобретения экстракцию проводят в течение периода времени примерно от 8 часов до 12 часов, и предпочтительно около 10 часов.
В другом варианте осуществления настоящего изобретения экстракцию проводят в температурном диапазоне примерно от 30°C до 40°C и предпочтительно около 35°C.
В еще одном варианте осуществления настоящего изобретения экстракт концентрируют под вакуумом в диапазоне температуры примерно от 45°C до 55°C и предпочтительно около 50°C.
В другом варианте осуществления настоящего изобретения концентрированную массу растворяют в деионизированной воде.
В другом варианте осуществления настоящего изобретения композицию, содержащую тригонеозид Ib и виценин-1, получают из прозрачного раствора на этапе (b) с применением следующих этапов:
(i) пропускание прозрачного водного слоя через катионообменную макропористую смолу и колонку с адсорбентом для элюции тригонеозидаШ и виценина-1;
(ii) концентрирование элюата и распылительной сушки.
В другом варианте осуществления настоящего изобретения колонка с адсорбентом выбрана из группы, включающей кислую катионообменную макропористую смолу, Сефадекс LH-20, Dowex Optipore L493 или их эквивалент.
В еще одном варианте осуществления настоящего изобретения элюцию колонки с адсорбентом проводят водой и этиловым спиртом в исходном отношении 30:70, с последующим сдвигом до отношения 5:95.
В еще одном варианте осуществления настоящего изобретения элюцию колонки с адсорбентом проводят в течение примерно от 1 часа до 4 часов, предпочтительно около 2 часов.
В другом варианте осуществления настоящего изобретения концентрированную массу сушат распылительной сушкой при температуре примерно от 110°C до 130°C, предпочтительно около 120°C.
Другой вариант осуществления настоящего изобретения относится к способу очистки тригонеозида Ib и к этапам способа, включающим:
(i) растворение концентрированного элюента в буферном растворе и удаление нерастворенных веществ фильтрацией;
(ii) промывание буферного раствора n-бутанолом;
(iii) концентрирование n-бутанольных фракций;
(iv) повторное растворение концентрированной фракции в растворителе; и
(v) пропускание полученного раствора через колонку с адсорбентом.
В другом варианте осуществления настоящего изобретения буферный раствор выбран из группы, включающей калия дигидрофосфат и соляную кислоту.
В другом варианте осуществления настоящего изобретения раствором, используемым для повторного растворения, является этиловый спирт.
Другой вариант осуществления настоящего изобретения относится к способу очистки виценина-1 из n-бутанольного слоя, содержащего другие флавоноидные гликозиды, и к этапам способа, включающим:
(i) концентрирование под вакуумом;
(ii) промывание концентрата буферным раствором для удаления нерастворенных веществ;
(iii) концентрирование полученного раствора до половины объема и перемешивание;
(iv) фильтрация для извлечения неочищенных кристаллов; и
(v) дефлегмация неочищенных кристаллов с растворителем и фильтрация до получения виценина-1 со степенью очистки 95%.
В другом предпочтительном варианте осуществления настоящего изобретения перемешивание концентрированной массы проводят в течение от 1 часа до 48 часов, предпочтительно в течение 24 часов.
В еще одном варианте осуществления настоящего изобретения перемешивание концентрированной массы проводят при 30-40°C, предпочтительно при 35°C.
В другом варианте осуществления настоящего изобретения растворитель, используемый при дефлегмации, является метанолом и метилендихлоридом в отношении 1:1.
Настоящее изобретение также относится к способу получения медикамента, содержащего композицию из 40-90 масс.% тригонеозида Ib и 1-20 масс.% виценина-1, при необходимости вместе по меньшей мере с одним наполнителем, и к способу применения эффективного количества указанной композиции для лечения и контроля аутоиммунных заболеваний, выбранных из группы, включающей болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системную красную волчанку и идиопатическую тромбоцитопеническую пурпуру.
Настоящее изобретение также относится к способу лечения и контроля аутоиммунных заболеваний, выбранных из группы, включающей болезнь Гудпасчера, гломерулонефрит, ревматоидный артрит, системную красную волчанку и идиопатическую тромбоцитопеническую пурпуру.
В одном варианте осуществления настоящего изобретения субъект выбран из группы, состоящей из животных и людей.
Далее настоящее изобретение разъясняется с помощью следующих примеров. Однако примеры не должны рассматриваться как ограничивающие объем изобретения.
Пример 1
Из 1000 г семян пажитника с содержанием влаги менее 5% готовили хлопья толщиной 2 мм в вальцовке для изготовления хлопьев. Хлопьевидный материал экстрагировали в смеси растворителей (8 литров), содержащей этиловый спирт и воду в отношении 80:20, и пропускали через слой в течение периода 10 часов при 40°C с рециркуляцией элюента. Спустя 10 часов экстракт фильтровали через ткань с размером ячеек 200 меш для получения прозрачного раствора. Прозрачный раствор концентрировали до полутвердой массы под вакуумом при 50°C. Концентрированную массу растворяли в 5 литрах деионизированной воды до получения прозрачного раствора. Прозрачный водный раствор подвергали противоточной экстракции n-бутанолом. Прозрачный водный слой пропускали через колонку, содержащую 200 мл сильнокислотной катионообменной макропористой смолы в течение 2 часов. Прозрачную жидкость, выходящую с колонки, не содержащую аминокислот, белков, тригонеллина и других амфотерных соединений, концентрировали при 50°C и сушили распылительной сушкой при 120°C до получения легкосыпучего порошка, имеющего состав примерно 40-46 масс.% тригонеозида Ib и 1-6 масс.% виценина-1. Вариации в диапазоне состава связаны с сезонными изменениями. Выход составил примерно 60 г. ВЭЖХ анализ проводили при следующих условиях: колонка - длина 250 мм, диаметр 4,6 мм, Kromasil С18 RP 5 мкм; мобильная фаза - градиент воды: ацетонитрила в течение периода 20 мин, начиная от 75:25 до 65:35; скорость потока 1 мл/мин; длина волны детектора - 210 нм УФ. Результаты ВЭЖХ, показанные на фигуре 3, демонстрируют пик тригонеозида Ib на 2,2 мин и виценина-1 на 3,2 мин. Состав устанавливали посредством метода внешней стандартизации с применением очищенных образцов тригонеозида Ib, полученного в примере 4, и виценина-1 из примера 5.
Пример 2
Из 1000 г семян пажитника с содержанием влаги менее 5% готовили хлопья толщиной 2 мм в вальцовке для изготовления хлопьев. Хлопьевидный материал экстрагировали в смеси растворителей(8 литров), содержащей этиловый спирт и воду в отношении 70:30, и пропускали через слой в течение периода 10 часов при 35°C с рециркуляцией элюента. Спустя 10 часов экстракт фильтровали через ткань с размером ячеек 200 меш для получения прозрачного раствора. Прозрачный раствор концентрировали до полутвердой массы под вакуумом при 50°C. Концентрированную массу растворяли в 5 литрах деионизированной воды до получения прозрачного раствора. Прозрачный водный раствор подвергали противоточной экстракции n-бутанолом. Прозрачный водный слой пропускали через колонку, содержащую 200 мл сильнокислотной катионообменной макропористой смолы в течение 2 часов. Прозрачную жидкость, выходящую с колонки, не содержащую аминокислот, белков, тригонеллина и других амфотерных соединений, вновь пропускали через слой смолы, содержащий Dowex Optipore L493 или ее эквивалент, в течение 2 часов, и контролировали процесс адсорбции с помощью системы тонкослойной хроматографии, содержащей толуол, этилацетат, метанол и воду в отношении 6:3:6:1. Биоактивные соединения, контролируемые системой тонкослойной хроматографии, элюировались, когда в процессе элюции применяли 95% этиловый спирт. Эти фракции собирали, фильтровали и объединяли вместе, и концентрировали при 50°C до концентрации 65 масс.% тригонеозида Ib и 8-12 масс.% виценина-1. Вариации в диапазоне состава вызваны сезонными изменениями. Выход составил примерно 15 г. ВЭЖХ анализ проводили способом, описанным в примере 1. Состав устанавливали посредством метода внешней стандартизации с применением очищенных образцов тригонеозида Ib, полученного в примере 4, и виценина-1 из примера 5.
Пример 3
Из 1000 г семян пажитника с содержанием влаги менее 5% готовили хлопья толщиной 2 мм в вальцовке для изготовления хлопьев. Хлопьевидный материал экстрагировали в смеси растворителей (8 литров), содержащей этиловый спирт и воду в отношении 80:20, и пропускали через слой в течение 10 часов при 35°C с рециркуляцией элюента. Спустя 10 часов экстракт фильтровали через ткань с размером ячеек 200 меш для получения прозрачного раствора. Прозрачный раствор концентрировали до полутвердой массы под вакуумом при 50°C. Концентрированную массу растворяли в 5 литрах деионизированной воды до получения прозрачного раствора. Прозрачный водный раствор подвергали противоточной экстракции n-бутанолом. Прозрачный водный слой пропускали через колонку, содержащую 200 мл сильнокислотной катионообменной макропористой смолы в течение 2 часов. Прозрачную жидкость, выходящую с колонки, не содержащую аминокислот, белков, тригонеллина и других амфотерных соединений, вновь пропускали через слой смолы, содержащий DowexOptiporeL493 или ее эквивалент, в течение 2 часов, и контролировали процесс адсорбции с помощью системы тонкослойной хроматографии, содержащей толуол, этилацетат, метанол и воду в отношении 6:3:6:1. Биоактивные соединения, контролируемые системой тонкослойной хроматографии, элюировались, когда в процессе элюции применяли смесь этилового спирта и воды в отношении 70:30. Эти фракции собирали, фильтровали и объединяли вместе, и концентрировали при 50°C до концентрации 70-76 масс.% тригонеозида Ib и 15-18 масс.% виценина-1. Вариации в диапазоне состава вызваны сезонными изменениями. Выход составил примерно 9 г. ВЭЖХ анализ проводили способом, описанным в примере 1, и итоговая хроматограмма показана на фигуре 4. Состав устанавливали посредством метода внешней стандартизации с применением очищенных образцов тригонеозида Ib, полученного в примере 4, и виценина-1 из примера 5.
Очищенные стандарты тригонеозида Ib и виценина-1 не поставляются в качестве контрольных стандартов. Поэтому с целью выяснения структуры и стандартизации состава проводили пример 4 и пример 5 для выделения очищенных образцов тригонеозида Ib и виценина-1.
Пример 4
Композиции из примеров 1-3 растворяли в 300 мл 50 мМ буферного раствора калия дигидрофосфата, и отделяли фильтрацией нерастворенные вещества. Буферный раствор трижды промывали n-бутанолом (75 мл × 3), и каждую из трех фракций концентрировали независимо. Фракции 1, 2 и 3 показали чистоту 85, 68 и 40% тригонеозида Ib, соответственно. Порошковый тригонеозид Ib с чистотой 85%, составивший около 10% исходной массы, растворяли в этиловом спирте и пропускали через слой сефадекса LH-20, с объемом слоя 125 мл; и фракции собирали, и анализировали в них содержание чистого тригонеозида Ib. Фракцию чистого тригонеозида Ib. концентрировали до получения примерно 90-95%) чистоты, благоприятной для определения структуры. Выход составил примерно 0,2% исходной массы, с получением кристаллического грязно-белого порошка. ВЭЖХ анализ проводили с помощью способа, описанного в примере 1, и итоговая хроматограмма показана на фигуре 5.
Точка плавления составила 220°C, и ЖХ-МС анализ подтвердил массу 906 (M+Na=929). Присутствие фуростаноловой сапониновой структуры было подтверждено с помощью тонкослойной хроматографии (ТСХ) со смесью толуол, этилацетат, метанол и вода в отношении 6:3:6:1, последующее распыление 5% анизальдегида - серной кислоты и нагревание до 110°C в течение 15 минут показало единственное зеленовато-коричневое пятно. 13С ЯМР анализ в CD3OD (100 МГц): δС (имп./мин) 440,43(С-1), 710,6(С-2), 850,8(С-3), 340,9(С-4), 440,4(С-5), 280,4(С-6), 300,78(С-7), 340,1(С-8), 510,7(С-9), 360,9(С-10), 220,0(С-11), 390,6(С-12), 410,8(С-13), 570,8(С-14), 320,8(С-15), 820,4(С-16), 650,06(С-17), 160,9(С-18), 120,08(С-19), 400,8(С-20), 160,3(С-21), 1140,0(С-22), 380,5(С-23), 280,9(С-24), 340,9(С-25), 760,0(С-26