Способ модулирования антагонистической активности моноклонального антитела
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предложен способ повышения антагонистической активности моноклонального антитела, содержащего константную область IgG1 человека и направленного против специфической молекулы-мишени, включающий модификацию аминокислотной последовательности шарнирной области. Кроме того, рассмотрен способ скрининга антагонистического моноклонального антитела, основанный на использовании способа повышения антагонистической активности по изобретению, моноклональное антитело, полученное способом по изобретению, и кодирующая его нуклеиновая кислота. Данное изобретение позволяет модулировать антигенсвязывающую активность путем изменения только шарнирного участка константной области антитела. 4 н. и 9 з.п. ф-лы, 17 ил., 3 табл., 12 пр.
Реферат
Данное изобретение относится к области разработки антител и, более конкретно, к способу скрининга антител и/или модуляции агонистической/антагонистической активности антител. Более конкретно изобретение касается способа модуляции антагонистической активности моноклонального антитела, или двухвалентного функционального фрагмента, или его производного с помощью генной инженерии. Изобретение также относится к полипептидам, используемым для такого способа модуляции, и к полученным антителам.
Термины «антитело», «антитела» или «иммуноглобулин» используются как синонимы в самом широком смысле и включают моноклональные антитела (например, моноклональные антитела полной длины или интактные), поликлональные антитела, мультивалентные антитела или мультиспецифические антитела (например, биспецифические антитела до тех пор, пока они проявляют требуемую биологическую активность).
В частности, такая молекула является гликопротеином, содержащим по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные друг с другом дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области (или домена) тяжелой цепи (сокращенной здесь как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенной здесь как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL также можно разделить на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), которые перемежаются более консервативными областями, называемыми каркасными областями (framework regions, FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе с различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента.
Тяжелые цепи иммуноглобулинов можно разделить на три функциональные области: область Fd, шарнирную область, область Fc (фрагмент, способный к кристаллизации), которые соединены гибкой шарнирной областью. Область Fd включает домены VH и СН1 и, в сочетании с легкой цепи, образует Fab - антиген-связывающий фрагмент. Fc-фрагмент отвечает за эффекторные функции иммуноглобулина, к которым относятся, например, связывание комплемента и связывание с родственными Fc-рецепторами эффекторных клеток. Шарнирная область, имеющаяся в иммуноглобулинах классов IgG, IgA и IgD, выступает в качестве гибкого разделителя, который позволяет Fab-части свободно перемещаться в пространстве по отношению к Fc-области. В отличие от константных областей, шарнирный домен может быть разнообразным по структуре, различаясь среди классов и подклассов иммуноглобулинов и по последовательности, и по длине.
По данным кристаллографических исследований шарнирную область иммуноглобулина можно также разделить структурно и функционально на три области: верхнюю, ядерную и нижнюю (Shin et al., Immunological Reviews 130: 87, 1992). Верхняя шарнирная область включает аминокислоты с карбоксильного конца СН1 до первого остатка шарнирной области, который ограничивает подвижность, как правило, первого цистеинового остатка, который формирует межцепочечную дисульфидную связь между двумя тяжелыми цепями. Длина верхней шарнирной области коррелирует с сегментарной гибкостью антитела. Ядро шарнирной области содержит дисульфидные мостики между тяжелыми цепями. Нижняя шарнирная область присоединяется к амино-концу домена СН2 и включает его остатки. Ядро шарнирной области человеческого IgG1 содержит последовательность Cys-Pro-Pro-Cys, что при димеризации путем образования дисульфидных связей приводит к образованию циклического октапептида, который, по-видимому, выступает в качестве точки опоры, таким образом обеспечивая подвижность. Конформационные изменения, разрешенные структурой и подвижностью полипептидной последовательности шарнирной области иммуноглобулина, могут влиять на эффекторные функции Fc-части антитела.
Как правило, для получения моноклональных антител мышиного происхождения или их функциональных фрагментов можно сослаться на способы, которые описаны, в частности, в руководстве «Antibodies» (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp.726, 1988), или на методики получения из гибридом, описанные Kohler и Milstein (Nature, 256: 495-497, 1975). Затем моноклональные антитела могут, например, быть очищены на аффинных колонках, на которых был заранее иммобилизован рецептор, представляющий интерес, или один из его фрагментов, содержащих эпитоп, который специфически распознается указанными моноклональными антителами. В частности, указанные моноклональные антитела могут быть очищены с помощью хроматографии на белке А и/или G, после чего следует или не следует ионообменная хроматография, направленная на ликвидацию остаточных загрязнений белком, а также ДНК и ЛПС, следует или не следует эксклюзионная хроматография на сефарозном геле с целью устранения потенциальных агрегатов в связи с наличием димеров или других мультимеров. Еще более предпочтительным образом все эти методики могут быть использованы одновременно или последовательно.
Под функциональным фрагментом антитела в соответствии с изобретением понимается, в частности, фрагмент антитела, такой как фрагменты Fv, scFv (sc обозначает одну цепь), Fab, F(ab')2, Fab', scFv-Fc, или димеры антител или любой фрагмент, время полужизни которого было увеличено в результате химической модификации, такой как добавление поли(алкилен)гликоля, такого как полиэтиленгликоль («пегилирование») (пегилированные фрагменты называются Fv-ПЭГ, scFv-ПЭГ, Fab-ПЭГ, F(ab')2-ПЭГ или Fab'-ПЭГ) («ПЭГ» означает полиэтиленгликоль), либо путем включения в липосому; при этом указанный фрагмент имеет по меньшей мере один характерный CDR исходного антитела.
Предпочтительно этими функциональными фрагментами будут фрагменты типа Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc или димерные антитела, которые обычно имеют такую же специфичность связывания, как и антитело, из которого они получены. В соответствии с данным изобретением фрагменты антитела изобретения могут быть получены из антител описанными выше способами, такими как расщепление ферментами, такими как пепсин или папаин, и/или расщепление дисульфидных мостиков путем химического восстановления. В другом случае фрагменты антитела могут быть получены с помощью методик генетической рекомбинации, также известных специалистам в данной области, или путем пептидного синтеза, например с помощью автоматических пептидных синтезаторов, например поставляемых компанией Applera, и т.д.
Термин «антагонист», используемый в данном документе, относится к молекуле, которая способна ингибировать одну или более биологическую активность молекулы-мишени, например внеклеточного или трансмембранного рецептора. Антагонисты могут действовать, влияя на связывание рецептора с лигандом и, наоборот, путем уменьшения фосфорилирования рецептора и/или путем выведения или уничтожения клеток, которые были активированы лигандом. Антагонист может полностью блокировать взаимодействия рецептор-лиганд, или могут существенно снизить такие взаимодействия за счет конкуренции, изменения конформации, выпадения или понижающей регуляции. Все такие точки воздействия антагониста рассматриваются как эквивалент для целей данного изобретения.
Термин «агонист», используемый в данном документе, относится к любому соединению, в том числе белку, полипептиду, пептиду, антителу, фрагменту антитела, конъюгату, большой молекуле, небольшой молекуле, способной активировать одну или более среди биологических активностей молекулы-мишени.
В исследовании терапевтических антител часто ожидается присутствие антител в качестве антагонистов, если это возможно.
Классическими примерами антагонистических антител являются антитела герцептин, пертузумаб, цетуксимаб, анти-VEGFR или анти-IGF-1R.
В качестве частного примера можно отметить анти-с-Met-антитело 5D5, созданное Genentech [WO 96/38557], которое проявляет себя на различных моделях как мощный агонист при введении его в одиночку. Для того чтобы решить эту техническую проблему, это антитело было разработано как Fab-фрагмент или как моновалентное антитело (5D5 с одной ветвью), имеющее антагонистическую активность. Как следствие, такое антитело может рассматриваться не как антитело, но как фрагмент, и оно не представляет все преимущества формата «полного антитела» (нет эффекторных функций, снижен клиренс и период полужизни [в два раза быстрее, чем традиционные двухвалентные антитела, описанные на плакате 411 на 20-м симпозиуме EORTC-NCI-AACR, Женева, 21-24 октября, 2008]).
Специалисту в данной области будет понятно, что эффекторные функции включают, например, C1q-связывание; комплемент-зависимую цитотоксичность (complement dependent cytotoxicity, CDC), Fc-рецепторное связывание; антитело-зависимую клеточную цитотоксичность (antibody-dependent cell-mediated cytotoxicity, ADCC); фагоцитоз; и отрицательную регуляцию рецепторов клеточной поверхности (например, В-клеточный рецептор, BCR) и удлинение периода полужизни посредством включения «лиганда связывания спасательного рецептора» (FcRn), описанного, например, в патенте США №5739277 от 14 апреля 1998.
Одним из предлагаемых аспектов данного изобретения является решение таких технических проблем, т.е. усиление антагонистической активности антитела при сохранении «полного двухвалентного» формата.
Здесь следует отметить, что изобретение можно применить к модуляции агонистической/антагонистической активности человеческих антител, полученных путем иммунизации «очеловеченных мышей» (генетически модифицированных мышей, которые продуцируют иммуноглобулины человека) или с использованием методик фагового дисплея для создания целых антител из выбранных scFv, Fab или любых других эквивалентных фрагментов.
Другая классическая техническая проблема может быть решена в ходе химеризации и/или гуманизации мышиного антитела. Специалистам в данной области хорошо известно, что если процесс химеризации и/или гуманизации мышиного антитела в теории очень прост, то не так легко управлять химеризацией и/или гуманизацией такого мышиного антитела без потери всех или части первоначальных свойств. Химерное или гуманизированное антитело может потерять часть его ADCC, CDC, антагонистической/агонистической, связывающей, (ТВС) … активности. Данное изобретение касается, в частности, модификации агонистической/антагонистической активности мышиного антитела после процесса химеризации и/или гуманизации.
В качестве конкретного примера приведен ряд анти-cMet антител, описанных ниже как 224G11, 2274Н1 и 11Е1, которые ведут себя как мощные антагонистические мышиные антитела и которые стали частичными агонистами после химеризации по формату человеческого IgG1. Этот переход от мощных антагонистов к частичным агонистам привел к полной потере активности in vivo на моделях с ксенотрансплантатом.
Данное изобретение предназначено для решения этих проблем и относится, в частности, к способу повышения антагонистической активности моноклонального антитела, направленного против специфической молекулы-мишени, или двухвалентного функционального фрагмента или его производного, при этом указанное антитело способно ингибировать одну или более биологическую активность указанной молекулы-мишени, где указанный способ включает стадию реконфигурации шарнирной области, состоящую в модификации аминокислотной последовательности указанной шарнирной области путем удаления, добавления или замены по меньшей мере одной аминокислоты.
Понятно, что выражение «усиление антагонистической активности» следует понимать в его самом широком смысле, т.е. как желаемый результат. Механистически, такой результат может быть получен путем усиления внутренней антагонистической активности и/или снижения внутренней агонистической активности антитела.
В частности, основные определения терминов в количественной фармакологии основаны на обновленных рекомендациях, предоставленных Комитетом по номенклатуре рецепторов Международного союза фармакологии (IUPHAR) (см. Neubig et al., 2003).
Термин «агонист» обозначает лиганд (любой тип молекул), который связывается с рецептором и изменяет состояние рецептора, что приводит к стимулированию или повышенной биологической реакции. Агонисты могут действовать как полные агонисты или как частичные агонисты:
- Полный агонист: когда рецепторный стимул, индуцированный агонистом, достигает максимального реагирования системы, то он вызывает системную максимальную реакцию и становится полным агонистом в этой системе. Несколько агонистов могут вызвать такой же максимальный ответ, все они являются полными агонистами в этой экспериментальной системе.
- Частичный агонист: молекула, которая в той или иной ткани при определенных условиях не может вызвать такой большой эффект (даже тогда, когда применяется в высокой концентрации, так что все рецепторы должны быть заняты), какой может вызвать полный агонист, воздействующий через те же рецепторы в той же системе. Частичные агонисты, как правило, являются также частичными антагонистами, так как в одновременном присутствии полного агониста они снижают максимальную реакцию указанного полного агониста до их собственного максимального ответа. Это обозначение полного и частичного агониста зависит от системы, и полный агонист для одной системы или измерения может быть частичным агонистом для другой.
Термин «антагонист» обозначает молекулу, которая уменьшает действие другого лекарственного препарата, как правило, агониста. Многие антагонисты действуют на ту же рецепторную макромолекулу, что и агонист.
- Эффективность антагонизма может быть полным антагонизмом, где реакция системы при одновременном присутствии антагониста и агониста соответствует базальной (без какого-либо лиганда) активности системы.
- Антагонист может действовать как частичный антагонист, когда максимальное ингибирование (даже тогда, когда применяется в высокой концентрации, так что все рецепторы должны быть заняты антагонистом), вызванное одновременным присутствием антагониста и агониста, выше базальной активности системы.
- Антагонизм может быть конкурентным, когда связывание агониста и антагониста является взаимоисключающим. Это может быть из-за того, что агонист и антагонист конкурируют за один и тот же сайт связывания или объединяются со смежными сайтами, которые перекрываются. Третья возможность состоит в том, что участвуют различные сайты, но они влияют на рецепторные макромолекулы таким образом, что агонистические и антагонистические молекулы не могут быть связаны одновременно.
- Неконкурентный антагонизм наблюдается, когда агонист и антагонист могут быть связаны с рецептором одновременно; связывание с антагонистом уменьшает или предотвращает действие агониста с или без какого-либо влияния на связывание агониста.
Удаление, добавление или замена может быть проведена классически любым способом, известным специалистам.
Некоторые способы могут быть применены специалистом для выполнения добавления, удаления или вставки в данную последовательность ДНК. Без ограничений можно отметить частичное расщепление ДНК поджелудочной ДНКазой I, частичное расщепление ДНК ферментами рестрикции, основанные на линкере инсерционные мутанты, вложенные наборы делеционных мутантов с помощью нуклеазы BAL31, ДНКазы I или экзонуклеазы III. Эти способы широко описаны в лабораторных пособиях, таких как Molecular Cloning, A laboratory manual (Sambrook, Fritsch and Maniatis). Для выполнения удаления, вставки или сайт-направленного мутагенеза в молекуле ДНК также может быть использовано несколько основанных на ПЦР способов, таких как ПЦР с перекрывающимися праймерами (overlap extension PCR) (Wurch et al., 1998), но не ограничиваясь им. Для выполнения сайт-направленного мутагенеза могут быть использованы некоторые другие методики, например, но не ограничиваясь ими, можно упомянуть мутагенез с помощью олигонуклеотидов на основании одного или двух праймеров, способ Кункеля, основанный на встраивании урацила (Kunkel, 1985). Эти способы широко описаны в лабораторных пособиях, таких как Molecular Cloning, A laboratory manual (Sambrook, Fritsch and Maniatis).
В качестве неограничивающего примера добавления можно отметить добавление пролина в шарнирную область или рядом с ней.
В предпочтительном воплощении способа изобретения указанная модификация выбрана среди:
i) удаления по меньшей мере одной аминокислоты из указанной аминокислотной последовательности шарнирной области, и/или
ii) добавления по меньшей мере одного дисульфидного мостика в указанную шарнирную область.
Для того чтобы внести ясность в изобретение, вначале будет подробно описан первый аспект (i), а затем второй аспект (ii). Следует понимать, что это упорядочение сделано только для написания данной заявки, и что оба эти аспекта, как будет очевидно далее, имеют одинаковую важность.
В частном воплощении способ изменения аминокислотной последовательности шарнирной области будет состоять в удалении не более 2, 3 или 4 аминокислот из указанной аминокислотной последовательности шарнирной области.
Частным аспектом изобретения является то, что указанное моноклональное антитело является двухвалентным антителом. Действительно, как показано ниже, можно модулировать агонистическую/антагонистическую активность антитела, изменяя структуру указанного антитела. В первый раз изобретатели представляют оригинальный способ модуляции такой агонистической/антагонистической активности при сохранении двухвалентной формы антител, направленный на сохранение благоприятных свойств, таких как длительный период полужизни или эффекторные функции.
Здесь также можно упомянуть, что если об изменении шарнирой области моноклонального антитела с целью повышения эффекторных функций уже сообщалось на данном уровне техники, то, напротив, никогда не сообщалось, что такое изменение в шарнирной области может представлять интерес для модуляции агонистической/антагонистической активности моноклонального антитела. Это, несомненно, является предметом данного изобретения, который является новым и изобретенным в отношении существующего уровня техники.
В качестве аспекта в соответствии со способом изобретения моноклональное антитело является химерным антителом.
Под «химерным антителом» понимается антитело, которое содержит природный вариабельный участок (легкой цепи и тяжелой цепи), полученный из антитела данного вида, в сочетании с константными участками легкой цепи и тяжелой цепи антитела вида, гетерологичного указанному данному виду (например, мыши, лошади, кролика, собаки, коровы, курицы и т.д.).
Антитела или их фрагменты химерного типа в соответствии с изобретением могут быть получены с помощью методик генетической рекомбинации. Например, химерное антитело может быть получено путем клонирования рекомбинантной ДНК, содержащей промотор и последовательность, кодирующую вариабельную область нечеловеческого, особенно мышиного, моноклонального антитела в соответствии с изобретением, и последовательность, кодирующую константный участок человеческого антитела. Химерное антитело изобретения, закодированное таким рекомбинантным геном, будет, например, химерой мыши и человека, при этом специфичность этого антитела будет определяться вариабельным участком, полученным из мышиной ДНК, а его изотип будет определяться константным участком, полученным из человеческой ДНК. Для способов получения химерных антител можно сослаться, например, на Verhoeyn et al. (BioEssays, 8: 74, 1988), Morrison et al. (Proc. Natl. Acad. Sci. USA 82: 6851-6855, 1984) или на патент США №4816567.
В качестве другого аспекта в соответствии со способом изобретения моноклональное антитело является гуманизированным антителом.
Под «гуманизированным антителом» понимается антитело, которое содержит CDR-участки, полученные из антитела нечеловеческого происхождения, при этом другие части молекулы антитела получены из одного (или нескольких) человеческих антител или зародышевых последовательностей. Кроме того, некоторые остатки сегментов скелета (называемые FR, каркасные участки) могут быть изменены в целях сохранения аффинности связывания (Jones et al., Nature, 321: 522-525, 1986; Verhoeyen et al., Science, 239: 1534-1536, 1988; Riechmann et al., Nature, 332: 323-327, 1988).
Гуманизированные антитела в соответствии с изобретением или их фрагменты могут быть получены с помощью методик, известных специалистам в данной области (например, таких, которые описаны в документах Singer et al., J. Immun. 150: 2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10: 1-142, 1992; и Bebbington et al., Bio/Technology, 10: 169-175, 1992).
Другим способом гуманизации, также известным специалистам в данной области, является, например, способ «CDR-прививки», описанный Protein Design Lab (PDL) в патентных заявках ЕР 0451261, ЕР 0682040, ЕР 09127, ЕР 0566647 или US 5530101, US 6180370, US 5585089 и US 5693761. Также можно отметить следующие патентные заявки: US 5639641; US 6054297; US 5886152 и US 5877293.
В качестве другого аспекта в соответствии со способом изобретения моноклональное антитело является человеческим антителом.
Термин «человеческое антитело» включает в себя все антитела, которые имеют одну или более вариабельную и константную область, полученную из человеческих иммуноглобулиновых последовательностей. В предпочтительном воплощении все вариабельные и константные домены (или области) получены из человеческой иммуноглобулиновой последовательности (полного человеческого антитела). Другими словами, он включает любое антитело, в котором вариабельные и константные области (если имеются) получены из человеческих зародышевых иммуноглобулиновых последовательностей, т.е. которое обладает аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого человеком и/или сделанного с помощью любых методик получения человеческих антител, известных специалистам в данной области.
В одном воплощении человеческие моноклональные антитела продуцируются гибридомой, которая содержит В-клетку, полученную из трансгенного животного (не человека), например трансгенной мыши, имеющей геном с трансгеном человеческой тяжелой цепи и трансгеном легкой цепи, слитую с иммортализованной клеткой.
В качестве примера такой трансгенной мыши можно отметить XENOMOUSE™, которая является разработанной мышиной линией, которая состоит из крупных фрагментов человеческих иммуноглобулиновых локусов и является дефицитной по продукции мышиного антитела (Green at al., 1994, Nature Genetics, 7: 13-21). XENOMOUSE™ продуцирует набор полных антител взрослого человека, а также образует антиген-специфические человеческие моноклональные антитела. Второе поколение XENOMOUSE™ содержит примерно 80% репертуара антител человека (Green & Jakobovits, 1998, J. Exp. Med., 188: 483-495).
Для создания человеческого антитела в соответствии с изобретением также может быть использована любая другая методика, известная специалистам в данной области, такая как методика фагового дисплея.
Способ в соответствии с изобретением может быть использован для любого типа иммуноглобулина, содержащего шарнирную область, т.е. для IgA, IgD и IgG.
В качестве примера, для изотипа IgA шарнирная область IgA1 содержит аминокислотную последовательность PSTPPTPSPSTPPTPSPS (SEQ ID №8), а шарнирная область IgA2 содержит аминокислотную последовательность РРРРР (SEQ ID №9).
Таким же образом шарнирная область IgD содержит аминокислотную последовательность
SPKAQASSVPTAQPQAEGSLAKATTAPATTRNTRGGEEKKKEKEKEEQEERETKTP (SEQ ID №10).
В качестве частного воплощения изобретения предпочтительно применять IgG, в том числе, например, IgG1, IgG2, IgG3 или IgG4.
Аминокислотные последовательности, соответствующие шарнирным областям различных изотипов IgG, представляют собой:
PKSCDKTHTCPPCP (SEQ ID №11) для IgG1,
RKCCVECPPCP (SEQ ID №7) для IgG2,
LKTPLFTGDTTHTCPRCPEPKSCDTPPPCPRCPEPKSCDTPPPCPRCPEPKSCDTPPPCPRCP (SEQ ID №12) для IgG3, и
SKYGPPCPSCP (SEQ ID №13) для IgG4.
Еще более конкретно, предпочтительно использовать IgG1. Действительно, в области терапевтических антител и, в частности, в лечении рака предпочтительным является создание IgG1 для получения эффекторных функций, таких как ADCC и CDC, в дополнение к функциям, связанным со специфическим связыванием целевого антигена.
Способ изобретения характеризуется тем, что указанное моноклональное антитело представляет собой IgG1.
Понятие «молекула-мишень» в рамках изобретения относится к любой молекуле, с которой моноклональное антитело способно специфически связываться или модулировать активность. Как правило, такая молекула-мишень может быть названа «антигеном».
В качестве неограничивающего примера молекулы-мишени, которая может стать мишенью моноклонального антитела, можно упомянуть растворимые лиганды, рецепторы, такие как трансмембранные рецепторы, мембранные опухолевые маркеры и т.д.
В предпочтительном воплощении указанная молекула-мишень является трансмембранным рецептором.
Выражение «трансмембранный рецептор» относится к белку, который проходит через плазматическую мембрану клетки, с внеклеточным доменом белка, способным связываться с лигандом, и внутриклеточным доменом с активностью (такой как протеинкиназная), которая может измениться (увеличиться или уменьшиться) при связывании лиганда. Другими словами, трансмембранные рецепторы являются интегральными мембранными белками, которые находятся и обычно работают в клеточной плазматической мембране, а также в мембранах некоторых субклеточных компартментов и органелл. Связываясь с сигнальной молекулой или иногда с парой таких молекул с одной стороны мембраны, трансмембранные рецепторы вызывают ответ на другой стороне. Таким образом, они играют уникальную и важную роль в связывании клеток и передаче сигнала.
Многие трансмембранные рецепторы состоят из двух или более белковых субъединиц, которые действуют совместно и могут диссоциировать, отпадать, когда связывают лиганды или на другом этапе их циклов «активации». Они часто классифицируются на основе их молекулярной структуры или, из-за того что структура детально неизвестна для всех рецепторов, кроме нескольких, классифицируются на основе их предположительной (а иногда и экспериментально проверенной) мембранной топологии. Полипептидные цепи самых простых, вероятно, пересекают билипидный слой только один раз, тогда как другие пересекают его большее количество раз, например семь раз (так называемые рецепторы, связанные с G-белком, или GPCR) или более.
Как и любой интегральный мембранный белок, трансмембранный рецептор может быть разделен на три части или домена, внеклеточный домен, трансмембранный домен и внутриклеточный домен.
Внеклеточный домен является частью рецептора, которая торчит из мембраны на внешней стороне клетки или органеллы. Если полипептидная цепь рецептора пересекает бислой несколько раз, внешний домен может состоять из нескольких «петель», торчащих из мембраны. По определению, основной функцией рецептора является распознавание и ответ на специфический лиганд, например медиатор или гормон (хотя некоторые рецепторы отвечают также на изменения трансмембранного потенциала), и во многих рецепторах эти лиганды связываются с внеклеточным доменом.
В большинстве рецепторов, для которых доказана структура, трансмембранные альфа-спирали составляют большую часть трансмембранного домена. В некоторых рецепторах, таких как никотиновый ацетилхолиновый рецептор, трансмембранный домен формирует связанную с белком пору через мембрану или ионный канал. После активации внеклеточного домена путем связывания соответствующего лиганда пора становится доступной для ионов, которые затем проходят через нее. В других рецепторах трансмембранные домены предположительно подвергаются конформационному изменению при связывании, что оказывает влияние внутриклеточно. В некоторых рецепторах, таких как члены надсемейства 7ТМ, трансмембранный домен может содержать лиганд-связывающий карман.
Внутриклеточный (или цитоплазматический) домен рецептора взаимодействует с внутренней частью клетки или органеллы, ретранслируя сигнал. Есть два принципиально разных способа этого взаимодействия: а) Внутриклеточный домен осуществляет связь посредством специфических белок-белковых взаимодействий с эффекторными белками, которые в свою очередь посылают сигнал по сигнальной цепи к месту назначения; и б) у фермент-связанных рецепторов внутриклеточный домен имеет ферментативную активность. Часто это тирозинкиназная активность. Ферментативная активность также может быть расположена на ферменте, связанном с внутриклеточным доменом.
У клетки есть несколько способов регулировать активность трансмембранного рецептора. Большинство из них работает через внутриклеточный домен. Наиболее важными способами являются фосфорилирование и интернализация (см. убиквитин) или активация каскадов вторичных посредников, таких как цАМФ, IP, Ca2+ или цГМФ.
Все мембранные белки, демонстрирующие ферментативную активность, также могут быть мишенью для антител с модификацией, описанной в данном изобретении. Можно упомянуть в качестве примеров, но без ограничений, семейство матричных металлопротеиназ (ММР), семейство «дезинтегринов в комплексе с металлопротеазамипротеазными доменами» (ADAM), аденилатциклазы, …
Все мембранные белки, действующие как ионные каналы, поры и переносчики, также могут быть мишенью для антител с модификацией, описанной в данном изобретении. Можно упомянуть в качестве примеров, но без ограничений, семейство натриевых каналов, семейство калиевых каналов, семейство никотиновых ацетилхолиновых рецепторов, сигма-рецепторы, семейство транспортеров моноаминов.
В более широком смысле все мембранные белки, идентифицированные как специфические маркеры для данного заболевания, также могут быть мишенью для лечения антителом, при этом антитело также может быть улучшено путем модификаций, описанных в данном изобретении.
В предпочтительном воплощении изобретения указанный трансмембранный рецептор выбран из группы, состоящей из тирозинкиназных рецепторов, тетраспанина и GPCR.
В более предпочтительном воплощении указанный трансмембранный рецептор представляет собой тирозинкиназный рецептор, выбранный преимущественно из группы, состоящей из IGF-1R, c-Met, RON, AxI, VEGF, VEGFR, Ee-2neu, гомодимеров и гетеродимеров семейства ErbB и т.д.
В данной заявке и, в частности, в следующем описании последовательности будут определены в соответствии с определением IMGT. Уникальная нумерация IMGT была создана для сравнения вариабельных доменов независимо от антигенного рецептора, типа цепи или вида [Lefranc M.-P., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommie, С., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда занимают одну и ту же позицию, например цистеин 23 (1-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT предусматривает стандартизированное разграничение каркасных участков (FR1-IMGT: позиции 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 и FR4-IMGT: 118-128) и участков, определяющих комплементарность: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 и CDR3-IMGT: 105-117. Т.к. разрывы представляют собой незанятые позиции, то длины CDR-IMGT (показаны в скобках и разделены точками, например [8.8.13]) становятся важной информацией. Уникальная нумерация IMGT используется в 20-графическом представлении, обозначенном как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D-структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
Для специалиста в данной области будет легко перевести изобретение, описанное в соответствии с системой IMGT, в любую другую систему нумерации, такую как, например, система нумерации Кабата.
Уникальная нумерация IMGT для всех IG и TR V-областей всех видов основывается на высокой консервативности структуры вариабельной области. Эта нумерация, созданная после выравнивания более 5000 последовательностей, учитывает и сочетает определение каркасной (FR) и определяющей комплементарность областей (CDR), структурные данные исследований рентгеновской дифракции и характеристику гипервариабельных петель. Было проведено установление границ областей FR-IMGT и CDR-IMGT. Точно так же уникальная нумерация IMGT была применена для С-домена и позволила точно разграничить Ig-подобные домены. С-домен соответствует полной С-области, большей части С-области или только части С-области в зависимости от типа иммуноглобулина (IG).
Нумерация IMGT для С-домена (IG и TR) была получена как уникальная нумерация IMGT для V-области по принципам уникальной нумерации IMGT для V-области до позиции 104. Таким образом, можно легко сравнить аминокислотные позиции в С-домене и V-домене.
Чтобы точно определить шарнирную область, нумерация IMGT С-домена была применена для точной локализации доменов СН1 и СН2. Шарнирная область включает все аминокислотные остатки между последним остатком IMGT-CH1 и первым остатком IMGT-CH2.
Все остальные схемы нумерации иммуноглобулинов, например Кабата или А.Онеггера, для того же шарнирного домена, включены в данное изобретение.
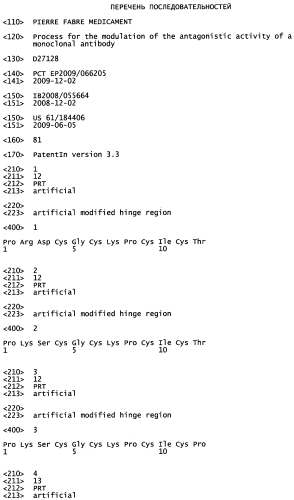
В качестве предпочтительного примера изобретения, основанного на описанной выше системе нумерации IMGT, аминокислотная последовательность шарнирной области IgG1 включает остатки Н1-Н14 с сегментом Н1-Н9, соответствующим верхней шарнирной области, и с сегментом Н10-Н14, соответствующим ядру шарнирной области. Более конкретно, человеческая IgG1 шарнирная область состоит из аминокислотной последовательности PKSCDKTHTCPPCP (SEQ ID №11), а мышиная IgG1 шарнирная область состоит из аминокислотной последовательности PRDCGCKPCICT (SEQ ID №14).
| Таблица 1 | |||||
| Шарнирная область | нумерация | Hu-IgG1 (SEQ ID №11) | Mu-IgG1 (SEQ ID №14) | Hu-IgG2 (SEQ ID №7) | Hu-IgG4 (SEQ ID №11) |
| Верхняя | Н1 | Р | Р | - | - |
| Н2 | K | R | R | S | |
| Н3 | S | D | K | K | |
| Н4 | С | С | С | Y | |
| Н5 | D | G | - | - | |
| Н6 | K | - | - | - | |
| Н7 | Т | С | С | G | |
| Н8 | H | K | V | P | |
| Н9 | T | Р | Е | P | |
| Ядерная | Н10 | C | С | С | С |
| Н11 | Р | I | Р | P | |
| Н12 | Р | - | Р | S | |
| Н13 | С | С | C | C | |
| Н14 | Р | Т | Р | Р |
В предпочтительном воплощении изобретения рассматривается модификация, направленная на уменьшение длины белковой последовательности, кодирующей шарнирную область двухвалентного антитела. В частности, способ в соответствии с изобретением включает этап удаления по меньшей мере одной аминокислоты в шарнирной области.
Как упоминалось ранее, предпочтительным является удаление не более двух аминокислот указанной шарнирной области.
Как упоминалось ранее, предпочтительным является удаление не более трех аминокислот указанной шарнирной области.
Как упоминалось ранее, предпочтительным является удаление не более четырех аминокислот указанной шарнирной области.
В частном применении способа изобретения модификация состоит по меньшей мере в удалении аминокислоты, выбранной среди аминокислот в позициях Н1, Н2, Н3, Н5, Н6, Н7, Н8, Н9, Н11, Н12 или Н14.
Более конкретно, авторы изобретения продемонстрировали включение конкретного остатка, и конкретный аспект изобретения состоит в выборе определенных остатков.
В предпочтительном случае IgG1 аминокислота в позиции Н1 является пролином; аминокислота в позиции Н2 является лизином в человеческой версии и аргинином в мышиной версии; аминокислота в позиции Н3 является серином в человеческой версии и аспартатом в мышиной версии; аминокислота в положении Н5 является аспартатом в человеческой версии и глицином в мышиной версии; аминокислота в позиции Н6 является лизином; аминокислота в позиции Н8 является гистидином в человеческой версии и лизином в мышиной версии; аминокисло