Гуманизированные антитела, которые распознают альфа-синуклеин
Иллюстрации
Показать всеПредложенное изобретение относится к иммунологии. Предложено антитело, которое специфически связывается с альфа-синуклеином человека, содержащее зрелые вариабельные области тяжелой и легкой цепей с соответствующими аминокислотными последовательностями. Раскрыта фармацевтическая композиция для лечения или профилактики заболевания с тельцами Леви, содержащая эффективное количество антитела. Использование изобретения обеспечивает новое антитело, которое специфично связывается с человеческим альфа-синуклеином и может быть использовано для иммунотерапии заболевания с тельцами Леви. 2 н. и 3 з.п. ф-лы, 6 ил., 4 табл., 4 пр.
Реферат
Перекрестные ссылки на родственные заявки
По данной заявке испрашивается приоритет по предварительной патентной заявке США №61/553131, поданной 28 октября 2011 года; и предварительной патентной заявке США №61/711208, поданной 8 октября 2012 года, содержание каждой из которых включено в настоящий документ путем отсылки в полном объеме в отношении всех целей.
Ссылка на перечень последовательностей
Перечень последовательностей, записанный в файле 424859SEQLIST.txt, составляет 34 килобайта и был создан 24 октября 2012 года. Информация, содержащаяся в этом файле, включена в настоящий документ путем отсылки.
Предпосылки создания изобретения
Синуклеинопатии, также известные как заболевания с тельцами Леви (Lewy body diseases, LBD), характеризуются дегенерацией дофаминергической системы, нарушениями моторных функций, когнитивным расстройством и формированием телец Леви (LB), и/или нейритов Леви (McKeith et al., Neurology (1996) 47:1113-24). Синуклеинопатии включают болезнь Паркинсона (включая идиопатическую болезнь Пакринсона), болезнь с диффузными тельцами Леви (Diffuse Lewy Body Disease, DLBD), также известную как деменция с тельцами Леви (Dementia with Lewy Bodies, DLB), вариант болезни Альцгеймера с тельцами Леви (Lewy body variant of Alzheimer′s disease, LBV), сочетание болезни Альцгеймера и болезни Паркинсона, идиопатическую ортостатическую гипотензию и множественную системную атрофию (MSA; например, оливопонтоцеребеллярную атрофию, стрионигральную дегенерацию и синдром Шая-Дрейджера). Некоторые немоторные признаки и симптомы считаются предвестниками синуклеинопатий в продромальной фазе заболеваний (то есть предсимптоматический, субклинический, предклинический или премоторный период). Такие ранние признаки включают, например, расстройство поведения в REM-стадии сна (RBD), утрату способности ощущать запахи и констипацию (Mahowald et al., Neurology (2010) 75:488-489). Заболевания с тельцами Леви продолжают оставаться общей причиной нарушений моторных функций и когнитивных расстройств у пожилых людей (Galasko et al., Arch. Neurol. (1994) 51:888-95).
Альфа-синуклеин является частью большого семейства белков, включая бета- и гамма-синуклеин, и синоретин. Альфа-синуклеин экспрессируется в нормальном состоянии, связанном с синапсами и, как полагают, играет роль в нервной пластичности, обучении и памяти. Некоторые исследования показали, что альфа-синуклеин играет центральную роль в патогенезе болезни Паркинсона (PD). Белок может агрегировать с образованием нерастворимых фибрилл в патологических условиях. Например, синуклеин накапливается в тельцах Леви (LB) (Spillantini et al., Nature (1997) 388:839-40; Takeda et al., J. Pathol. (1998) 152:367-72; Wakabayashi et al., Neurosci. Lett. (1997) 239:45-8). Мутации в гене альфа-синуклеина являются причиной редких семейных форм паркинсонизма (Kruger et al., Nature Gen. (1998) 18:106-8; Polymeropoulos, et al., Science (1997) 276:2045-7). Гиперэкспрессия альфа-синуклеина у трансгенных мышей (Masliah et al., Science (2000) 287:1265-9) и у мух вида Drosophila (Feany et al., Nature (2000) 404:394-8) имитирует некоторые патологические аспекты заболевания с тельцами Леви. Кроме того, было сделано предположение о том, что растворимые олигомеры синуклеина могут быть нейротоксическими (Conway ΚΑ, et al., Proc Natl Acad Sci USA (2000) 97:571-576; VollesMJ, Lansbury PT, Jr Biochemistry (2003) 42:7871-7878). Накопление альфа-синуклеина со сходными морфологическими и неврологическими изменениями в таких биологических видах и моделях животных, как человек, мыши и мухи, позволяет предположить, что эта молекула способствует развитию заболевания с тельцами Леви.
Краткое описание заявленного изобретения
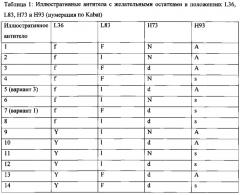
Изобретение обеспечивает антитела, содержащие гуманизированную зрелую вариабельную область тяжелой цепи, содержащую три CDR по Kabat SEQ ID NO:11, и являющуюся по меньшей мере на 90% идентичной SEQ ID NO:11, и гуманизированную легкую цепь, содержащую три CDR по Kabat SEQ ID NO:4, и являющуюся по меньшей мере на 90% идентичной SEQ ID NO:4. В некоторых антителах зрелая вариабельная область тяжелой цепи, по меньшей мере, на 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO:11, и зрелая вариабельная область легкой цепи, по меньшей мере, на 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO:4. В некоторых антителах положение L36 (нумерация по Kabat) может быть занято Υ или F, положение L83 (нумерация по Kabat) может быть занято F или L, положение Н73 (нумерация по Kabat) может быть занято N или D, и положение Н93 (нумерация по Kabat) может быть занято А или S. В некоторых таких антителах аминокислотная последовательность зрелой вариабельной области тяжелой цепи отличается от аминокислотной последовательности SEQ ID NO: 11, и аминокислотная последовательность зрелой вариабельной области легкой цепи отличается от аминокислотной последовательности SEQ ID NO: 4.
В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 8, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 3. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 8, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 4. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 8, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 5. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 9, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 3. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 9, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 4. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 9, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 5. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 10, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 3. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 10, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 4. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 10, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 5. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 11, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 3. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 11, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 4. В некоторых антителах зрелая вариабельная область тяжелой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 11, и зрелая вариабельная область легкой цепи имеет аминокислотную последовательность, обозначенную SEQ ID NO: 5.
Кроме того, изобретение обеспечивает антитело, содержащее гуманизированную тяжелую цепь, содержащую три CDR по Kabat SEQ ID NO: 11, и гуманизированную легкую цепь, содержащую по Kabat три CDR SEQ ID NO: 4, при условии, что положение L36 (нумерация по Kabat) занято F или Y, и/или положение L83 (нумерация по Kabat) занято L или F, и/или положение Н73 (нумерация по Kabat) занято D или N, и/или положение Н93 (нумерация по Kabat) занято S или А. В некоторых таких антителах положение L36 (нумерация по Kabat) занято F и положение Н73 (нумерация по Kabat) занято D, и положение Н93 (нумерация по Kabat) занято S. В некоторых таких антителах положение L36 занято F. В некоторых таких антителах положение L83 занято L. В некоторых таких антителах положение Н73 занято D. В некоторых таких антителах положение Н93 занято А. В некоторых таких антителах положение L36 занято F и положение L83 занято L. В некоторых таких антителах положение L36 занято F и положение Н73 занято D. В некоторых таких антителах положение L36 занято F и положение Н93 занято А. В некоторых таких антителах положение L36 занято F, положение L83 занято L и положение Н73 занято D. В некоторых таких антителах положение L36 занято F, положение L83 занято L и положение Н93 занято А. В некоторых таких антителах положение L 36 занято F, положение L83 занято L, положение Н73 занято D и положение Н93 занято А. В некоторых таких антителах остатки в положениях L36, L83, Н73 и Н93 (нумерация по Kabat) заняты аминокислотами, как указано в Таблице 1, занято F, и положение Н73 (нумерация по Kabat) занято D, и положение Н93 (нумерация по Kabat) занято А. В некоторых таких антителах положение L36 (нумерация по Kabat) занято F и положение Н93 (нумерация по Kabat) занято S. В некоторых таких антителах положение Н73 (нумерация по Kabat) занято D и положение Н93 (нумерация по Kabat) занято S. В некоторых таких антителах положение Н73 (нумерация по Kabat) занято D и положение Н93 (нумерация по Kabat) занято А. В некоторых таких антителах положение Н93 (нумерация по Kabat) занято S. В некоторых таких антителах положение Н73 (нумерация по Kabat) занято N. В некоторых таких антителах положение L36 (нумерация по Kabat) занято F, положение L83 (нумерация по Kabat) занято L, положение Н73 (нумерация по Kabat) занято D, и положение Н93 (нумерация по Kabat) занято S. В некоторых таких антителах положение L36 (нумерация по Kabat) занято F, положение L83 (нумерация по Kabat) занято L и положение Н93 (нумерация по Kabat) занято S.
В любом из указанных выше антител зрелая вариабельная область тяжелой цепи может быть слита с константной областью тяжелой цепи, и зрелая константная область легкой цепи может быть слита с константной областью легкой цепи.
В любом из указанных выше антител константная область тяжелой цепи может представлять собой мутантную форму природной константной области человека, которая имеет пониженный уровень связывания с Рсу-рецептором по сравнению с природной константной областью человека.
В любом из указанных выше антител константная область тяжелой цепи может быть изотипа IgGl человека. В некоторых антителах аллотип представляет собой Glm3. В некоторых антителах аллотип представляет собой Glml.
Кроме того, изобретение обеспечивает нуклеиновую кислоту, кодирующую любую из указанных выше зрелых вариабельных областей тяжелой цепи и/или любую указанную выше зрелую вариабельную область легкой цепи, например, SEQ ID NO: 15, 17, 18,19 и 20.
Кроме того, изобретение обеспечивает клетку хозяина, содержащую вектор, содержащий любую из нуклеиновых кислот, описанных выше.
Кроме того, изобретение обеспечивает способ лечения пациента, имеющего или имеющего риск развития заболевания с тельцами Леви, включающий введение пациенту эффективного количества любого из указанных выше антител. В некоторых способах заболевание представляет собой болезнь Паркинсона. В некоторых способах ухудшение когнитивной функции у пациента является ингибированным. В некоторых способах количество нейритных и/или аксональных агрегатов альфа-синуклеина является уменьшенным. В некоторых способах нейритная дистрофия у пациента является уменьшенной. В некоторых способах синаптическая и/или дендритная плотность является сохраненной. В некоторых способах, способ сохраняет синаптофизин и/или МАР2 у пациента.
Кроме того, изобретение обеспечивает способ лечения пациента, имеющего или имеющего риск развития синуклеинопатии, включающий введение пациенту эффективного количества любого из указанных выше антител. В некоторых способах заболевание представляет собой болезнь Паркинсона. В некоторых способах, заболевание представляет собой расстройство поведения в REM-стадии сна (RBD). В некоторых способах, заболевание представляет собой деменцию с тельцами Леви (DLB) или множественную системную атрофию (MSA). В некоторых способах ухудшение когнитивной функции у пациента является ингибированным. В некоторых способах количество нейритных и/или аксональных агрегатов альфа-синуклеина является уменьшенным. В некоторых способах нейритная дистрофия у пациента является уменьшенной. В некоторых способах синаптическая и/или дендритная плотность является сохраненной. В некоторых способах, способ сохраняет синаптофизин и/или МАР2 у пациента.
Кроме того, изобретение обеспечивает способы обнаружения телец Леви у пациента, имеющего или имеющего риск развития заболевания с тельцами Леви, включающие введение пациенту эффективного количества любого из указанных выше антител, при этом антитело связывается с тельцами Леви и связанное антитело детектируется. В некоторых способах заболевание представляет собой болезнь Паркинсона. В некоторых способах заболевание представляет собой деменцию с тельцами Леви (DLB) или множественную системную атрофию (MSA). В некоторых способах антитело является меченым.
Кроме того, изобретение обеспечивает способ уменьшения формирования телец Леви у пациента, имеющего или имеющего риск развития заболевания с тельцами Леви, включающий введение пациенту эффективного количества любого из указанных выше антител. В некоторых способах заболевание представляет собой болезнь Паркинсона. В некоторых способах заболевание представляет собой деменцию с тельцами Леви (DLB) или множественную системную атрофию (MSA). В некоторых способах ухудшение когнитивной функции у пациента является ингибированным. В некоторых способах количество нейритных и/или аксональных агрегатов альфа-синуклеина является уменьшенным. В некоторых способах нейритная дистрофия у пациента является уменьшенной. В некоторых способах синаптическая и/или дендритная плотность является сохраненной. В некоторых способах, способ сохраняет синаптофизин и/или МАР2 у пациента.
Кроме того, изобретение обеспечивает способ ингибирования агрегации синуклеина, или очистки телец Леви или агрегатов синуклеина у пациента, имеющего или имеющего риск развития заболевания с тельцами Леви, включающий введение пациенту эффективного количества любого из указанных выше антител. В некоторых способах заболевание представляет собой болезнь Паркинсона. В некоторых способах заболевание представляет собой деменцию с тельцами Леви (DLB) или множественную системную атрофию (MSA). В некоторых способах ухудшение когнитивной функции у пациента является ингибированным. В некоторых способах количество нейритных и/или аксональных агрегатов альфа-синуклеина является уменьшенным. В некоторых способах нейритная дистрофия у пациента является уменьшенной. В некоторых способах синаптическая и/или дендритная плотность является сохраненной. В некоторых способах, способ сохраняет синаптофизин и/или МАР2 у пациента.
Кроме того, изобретение обеспечивает фармацевтическую композицию, содержащую любое из указанных выше антител.
Кроме того, изобретение обеспечивает способ получения антитела, включающий культивирование клеток, трансформированных нуклеиновыми кислотами, кодирующими тяжелые и легкие цепи антитела таким образом, что клетка секретирует антитело; и очистку антитела из клеточной культуральной среды; при этом антитело представляет собой любое из антител, описанных выше.
Кроме того, изобретение обеспечивает способ получения клеточной линии, продуцирующей антитело, включающий введение в клетки вектора, кодирующего тяжелые и легкие цепи антитела, и селектируемого маркера; размножение клеток в условиях, обеспечивающих отбор клеток, имеющих увеличенное число копий вектора; изолирование отдельных клеток из отобранной клетки; и консервацию клеток, клонированных из отдельной клетки, выбранной на основе выхода антитела; при этом антитело представляет собой любое из антител, описанных выше. Некоторые такие способы дополнительно включают размножение клеток в селективных условиях и скрининг на клеточные линии, природным образом экспрессирующие и секретирующие, по меньшей мере, 100 мг/л/106 клеток/24 ч.
Краткое описание фигур
Фиг. 1 показывает выравнивание аминокислотных последовательностей родительского мышиного mAb (называемого m9Е4) со зрелой вариабельной областью тяжелой цепи гуманизированного 9Е4. 1791009Hu9E4VHFr (SEQ ID NO: 7) представляет собой человеческую акцепторную последовательность VH. CDR-участки согласно определению Kabat подчеркнуты и выделены жирным шрифтом.
Фиг. 2 показывает выравнивание аминокислотных последовательностей родительского мышиного mAb (называемого m9Е4) со зрелой вариабельной областью легкой цепи гуманизированного 9Е4. 63102889Hu9E4VLFr (SEQ ID NO: 2) представляет собой человеческую акцепторную последовательность VL. CDR-участки согласно определению Kabat подчеркнуты и выделены жирным шрифтом.
Фиг. 3 показывает результаты воздействия пассивной иммунотерапии 9Е4 на характеристики памяти в пробной части теста в водном лабиринте Морриса.
Фиг. 4 показывает результаты воздействия пассивной иммунотерапии 9Е4 на скорость и ошибки в тесте на перекладине (round beam test).
Фиг. 5 показывает иммунопреципитацию различных вариантов гуманизированных антител 9Е4 в отношении его антигена, полученного из пораженной ткани. Ch9E4: химерное 9Е4; H1L3: Hu9E4VHv1 - Hu9E4VLv3; H3L2: Hu9E4VHv3 - Hu9E4VLv2; H3L3: Hu9E4VHv3 - Hu9E4VLv3; N.S.=неспецифическое.
Фиг. 6 показывает Вестерн-блоттинг рекомбинантного человеческого суниклеина с мышиными химерными и гуманизированными антителами 9Е4.
Краткое описание последовательностей
SEQ ID NO: 1 представляет собой аминокислотную последовательность вариабельной области m9E4VL.
SEQ ID NO: 2 представляет собой аминокислотную последовательность вариабельной области 63102889Hu9E4VLFr.
SEQ ID NO: 3 представляет собой аминокислотную последовательность вариабельной области Hu9E4VLv1.
SEQ ID NO: 4 представляет собой аминокислотную последовательность вариабельной области Hu9E4VLv2.
SEQ ID NO: 5 представляет собой аминокислотную последовательность вариабельной области Hu9E4VLv3.
SEQ ID NO: 6 представляет собой аминокислотную последовательность вариабельной области m9E4VH.
SEQ ID NO: 7 представляет собой аминокислотную последовательность вариабельной области 1791009Hu9E4VHFr.
SEQ ID NO: 8 представляет собой аминокислотную последовательность вариабельной области Hu9E4VHv1.
SEQ ID NO: 9 представляет собой аминокислотную последовательность вариабельной области Hu9E4VHv2.
SEQ ID NO: 10 представляет собой аминокислотную последовательность вариабельной области Hu9E4VHv3.
SEQ ID NO: 11 представляет собой аминокислотную последовательность вариабельной области Hu9E4VHv4.
SEQ ID NO: 12 представляет собой аминокислотную последовательность природного человеческого альфа-синуклеина дикого типа.
SEQ ID NO: 13 представляет собой аминокислотную последовательность константной области легкой цепи гуманизированного 9Е4 с аргинином на N-конце.
SEQ ID NO: 14 представляет собой аминокислотную последовательность константной области тяжелой цепи гуманизированного 9Е4.
SEQ ID NO: 15 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VLvl.
SEQ ID NO: 16 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VLv2.
SEQ ID NO: 17 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VLv3.
SEQ ID NO: 18 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VHv1.
SEQ ID NO: 19 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VHv2.
SEQ ID NO: 20 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VHv3.
SEQ ID NO: 21 представляет собой нуклеотидную последовательность вариабельной области Hu9E4VHv4.
SEQ ID NO: 22 представляет собой аминокислотную последовательность сигнального пептида Hu9E4VL.
SEQ ID NO: 23 представляет собой нуклеотидную последовательность сигнального пептида Hu9E4VL.
SEQ ID NO: 24 представляет собой аминокислотную последовательность сигнального пептида Hu9E4VH.
SEQ ID NO: 25 представляет собой нуклеотидную последовательность сигнального пептида Hu9E4VH.
SEQ ID NO: 26 представляет собой консенсусную аминокислотную последовательность Hu9E4VL.
SEQ ID NO: 27 представляет собой консенсусную аминокислотную последовательность Hu9E4VH.
SEQ ID NO: 28 представляет собой аминокислотную последовательность константной области легкой цепи гуманизированного 9Е4 без аргинина на N-конце.
SEQ ID NO: 29 представляет собой аминокислотную последовательность варианта 3 легкой цепи гуманизированного 9Е4, содержащую (а) вариабельную область и (b) константную область с аргинином на N-конце.
SEQ ID NO: 30 представляет собой аминокислотную последовательность варианта 3 легкой цепи гуманизированного 9Е4, содержащую (а) вариабельную область и (b) константную область без аргинина на N-конце.
SEQ ID NO: 31 представляет собой аминокислотную последовательность варианта 3 тяжелой цепи гуманизированного 9Е4, содержащую вариабельную область и константную область.
SEQ ID NO: 32 представляет собой аминокислотную последовательность BIP версии константной области тяжелой цепи аллотипа Glm3 гуманизированного 9Е4.
Определения
Как правило, моноклональные антитела представлены в изолированной форме. Это означает, что антитело является в типичном случае чистым по меньшей мере на 50% масса/масса от белков и других макромолекул, образующихся в результате его выработки или очистки, но не исключает возможности комбинирования моноклонального антитела с избыточным количеством фармацевтически приемлемого носителя(ей) или другого наполнителя для облегчения его применения. В некоторых случаях моноклональные антитела являются, по меньшей мере, на 60%, 70%, 80%, 90%, 95 или 99% масса/масса чистыми от белков и других макромолекул, образующихся в результате выработки или очистки.
Специфическое связывание моноклонального антитела с его целевым антигеном означает аффинность, составляющую, по меньшей мере, 106, 107, 108, 109 или 1010 М-1. Специфическое связывание заметно выше по величине и отличается от неспецифического связывания, возникающего, по меньшей мере, с одной неродственной мишенью. Специфическое связывание может быть результатом образования связей между конкретными функциональными группами или конкретного пространственного соответствия (например, по типу «ключ-замок»), тогда как неспецифическое связывание обычно является результатом взаимодействия ван-дер-ваальсовых сил. Однако специфическое связывание не обязательно подразумевает, что моноклональное антитело связывается с одной и только одной мишенью.
Основным структурным элементом антитела является тетрамер, состоящий из субъединиц. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая из которых имеет одну «легкую» цепь (примерно 25 кДа) и одну «тяжелую» цепь (примерно 50-70 кДа). Аминоконцевая часть каждой цепи содержит вариабельную область примерно из 100-110 или более аминокислот, ответственных главным образом за распознавание антигена. Эта вариабельная область первоначально экспрессируется связанной с отщепляемым сигнальным пептидом. Вариабельная область без сигнального пептида иногда называется зрелой вариабельной областью. Таким образом, например, зрелая вариабельная область легкой цепи означает вариабельную область легкой цепи без сигнального пептида легкой цепи. Карбокси-концевая часть каждой цепи определяет константную область, ответственную главным образом за эффекторную функцию.
Легкие цепи классифицируются как каппа- или лямбда-цепи. Тяжелые цепи классифицируются как гамма-, мю-, альфа-, дельта- или эпсилон-цепи, и определяют изотип антитела, такой как IgG, IgM, IgA, IgD и IgE, соответственно. В пределах легких и тяжелых цепей вариабельные и константные области связаны «J «-областью, состоящей из 12 или более аминокислот, при этом тяжелая цепь также включает «D»-область, состоящую примерно из 10 или более аминокислот. (Смотри, в общих чертах, Fundamental Immunology (Paul, W., ed., 2nd ed. Raven Press, N.Y., 1989, Ch. 7, полное содержание которого включено путем отсылки для всех целей).
Зрелые вариабельные области каждой пары легкой/тяжелой цепи образуют связывающий сайт антитела. Таким образом, интактное антитело имеет два связывающих сайта. За исключением бифункциональных или биспецифических антител эти два сайта связывания являются одинаковыми. Все цепи демонстрируют одинаковую общую структуру из относительно консервативных каркасных участков (FR), соединенных посредством трех гипервариабельных участков, также называемых участками, определяющими комплементарность, или CDR. CDR из двух цепей каждой пары соединяются посредством каркасных участков, обеспечивая связывание со специфическим эпитопом. От N-конца до С-конца легкая и тяжелая цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Присвоение аминокислот каждому домену осуществляется в соответствии с нумерацией по Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD, 1987 and 1991) или Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987); Chothia et al., Nature 342:878-883 (1989). Кроме того, Kabat обеспечивает широко используемую систему нумерации (нумерацию по Kabat), в которой соответствующим остаткам между различными тяжелыми цепями или между различными легкими цепями присвоены одинаковые номера (например, Н83 означает положение 83 по нумерации Kabat в зрелой вариабельной области тяжелой цепи; аналогично, положение L36 означает положение 36 по нумерации Kabat в зрелой вариабельной области легкой цепи).
Термин «антитело» включает интактные антитела и их связывающие фрагменты. Как правило, фрагменты конкурируют с интактным антителом, из которого они получены, за специфическое связывание с мишенью, включая отдельные тяжелые цепи, легкие цепи Fab, Fab′, F(ab′)2, F(ab)c, диатела, Dabs, нанотела и Fv. Фрагменты могут быть получены методами рекомбинантных ДНК или путем ферментативного или химического расщепления интактных иммуноглобулинов. Термин «антитело» также относится к биспецифическому антителу и/или гуманизированному антителу. Биспецифическое или бифункциональное антитело представляет собой искусственное гибридное антитело, обладающее двумя различными парами тяжелой/легкой цепи и двумя различными сайтами связывания (смотри, например, Songsivilai and Lachmann, Clin. Exp.Immunol., 79:315-321 (1990); Kostelny et al., J. Immunol. 148:1547-53 (1992)). В некоторых биспецифических антителах две различные пары тяжелой/легкой цепи включают пару тяжелой цепи/легкой цепи гуманизированного 9Е4, и пару тяжелой цепи/легкой цепи, специфическую для эпитопа на альфа-синуклеине, отличного от эпитопа, связанного 9Е4. Гуманизированные антитела в целом описаны ниже в Разделе IV В.
Термин «эпитоп» относится к участку антигена, с которым связывается антитело. Эпитоп может быть сформирован из смежных или несмежными аминокислот, которые накладываются друг на друга при образовании третичной структуры одного или более белков. Эпитопы, сформированные смежными аминокислотами, обычно устойчивы при воздействии денатурирующих растворителей, в то время как эпитопы, образованные при формировании третичной белковой структуры, обычно разрушаются при обработке денатурирующими растворителями. Эпитоп обычно включает по меньшей мере 3 или более, чаще не менее 5 или 8-10 аминокислот в уникальной пространственной конформации. Методы определения пространственной конформации эпитопов включают, например, рентгеновскую кристаллографию и двумерный ядерный магнитный резонанс. Смотри, например, Epitope Mapping Protocols, in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996).
Антитела, которые распознают одинаковые или перекрывающиеся эпитопы, могут быть идентифицированы с помощью обычного иммунного анализа, выявляющего способность одного антитела блокировать связывание другого антитела с антигеном-мишенью. Эпитоп антитела может быть также определен с помощью рентгеновской кристаллографии антитела, связанного с его антигеном, для идентификации контактных остатков. Альтернативно, два антитела обладают одним и тот же эпитопом, если все аминокислотные мутации в антигене, которые уменьшают или элиминируют связывание одного антитела, также уменьшают или элиминируют связывание другого антитела. Два антитела имеют перекрывающиеся эпитопы, если мутации некоторых аминокислот, которые уменьшают или элиминируют связывание одного антитела, уменьшают или элиминируют связывание другого антитела.
Конкуренцию между антителами определяют с помощью исследования, в котором тестируемое антитело ингибирует специфическое связывание контрольного антитела с известным антигеном (смотри, например, Junghans et al., Cancer Res. 50:1495, 1990). Тестируемое антитело конкурирует с контрольным антителом, если избыток тестируемого антитела (например, по меньшей мере, 2-кратный, 5-кратный, 10-кратный, 20-кратный или 100-кратный) ингибирует связывание контрольного антитела по меньшей мере на 50%, но предпочтительно на 75 %, 90 % или 99 % по результатам измерения в тесте на конкурентное связывание. Антитела, идентифицированные с помощью методов конкурентного связывания (конкурирующие антитела), включают антитела, связывающиеся с тем же эпитопом, что и контрольное антитело, и антитела, связывающиеся со смежным эпитопом, расположенным проксимально по отношению к эпитопу, с которым связывается контрольное антитело, для поддержания стерического барьера.
Термин «пациент» относится к человеку или другому субъекту-млекопитающему, получающему профилактическое или терапевтическое лечение.
С целью классификации аминокислотных замен на консервативные и неконсервативные, аминокислоты сгруппированы следующим образом: Группа I (гидрофобные боковые цепи): met, ala, val, leu, ile; Группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; Группа III (кислые боковые цепи): asp, glu; Группа IV (основные боковые цепи): asn, gin, his, lys, arg; Группа V (остатки, влияющие на ориентацию цепи): gly, pro; и Группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замены включают замены между аминокислотами одного класса. Неконсервативные замены представляют собой замены аминокислот одного класса на аминокислоты другого класса.
Процентные идентичности последовательностей определяют с помощью последовательностей антител, максимально выровненных с использованием системы нумерации Kabat. После выравнивания область представляющего интерес антитела (например, полной зрелой вариабельной области тяжелой или легкой цепи) сравнивают с той же областью контрольного антитела, процентная идентичность последовательностей между областями представляющего интерес и контрольного антитела представляет собой количество положений, занятых одинаковыми аминокислотами в областях как представляющего интерес, так и контрольного антитела, деленное на общее количество выровненных положений двух областей, без подсчета разрывов, умноженное на 100 для преобразования в процентное количество.
Композиции или способы, «содержащие» один или более указанных элементов, могут включать другие элементы, специально не указанные. Например, композиция, которая содержит антитело, может содержать антитело отдельно или в комбинации с другими ингредиентами.
Указание диапазона значений включает все целые значения внутри или в пределах указанного диапазона и все поддиапазоны, определенные целыми значениями внутри диапазона.
Если очевидным образом не вытекает из контекста, термин «примерно» охватывает значения в пределах SEM (стандартной ошибки среднего значения) от установленной величины.
Индивидуум имеет повышенный риск развития заболевания, если субъект имеет, по меньшей мере, один известный фактор риска (например, генетический, биохимический, семейный анамнез, воздействие ситуационных факторов), подвергающий индивидуумов с данным фактором риска статистически значимому большему риску развития заболевания по сравнению с индивидуумами без фактора риска.
Термин «симптом» относится к субъективному проявлению заболевания, такому как измененная походка, выявленному пациентом. «Признак» относится к объективному проявлению заболевания, наблюдаемому терапевтом.
Статистическая значимость означает p≤0.05.
«Когнитивная функция» относится к психическим процессам, таким как любой или все из внимания, памяти, воспроизведения и восприятия устной речи, разрешения проблем, и проявления интереса к окружающему и заботы о себе.
«Усиленная когнитивная функция» или «улучшенная когнитивная функция» относится к улучшению относительно исходного состояния, например, постановки диагноза или начала лечения. «Ухудшение когнитивной функции» относится к понижению функции относительно такого исходного состояния.
В системах экспериментальных животных, таких как крысы или мыши, когнитивную функцию можно оценить с помощью способов с использованием лабиринта, в котором субъекты используют пространственную информацию (например, водный лабиринт Морриса (Morris water maze), тест Барнеса с циркулярной платформой (Barnes circular maze), приподнятый радиальный лабиринт (elevated radial arm maze), Т-образный лабиринт (Τ maze) и другие), выработки условного рефлекса в связи с переживанием чувства страха, активного избегания, освещенного «открытого поля», измерения активности в темноте, приподнятого крестообразного лабиринта, двухкамерного экспериментального теста (two-compartment exploratory test) или теста принудительного плавания.
У человека когнитивную функцию можно оценить с применением одного или более из нескольких стандартизированных тестов. Примеры тестирования или оценки когнитивной функции были описаны (Ruoppila, 1. and Suutama, Т. Scand. J. Soc. Med. Suppl. 53,44-65, 1997) и включают стандартизированные психометрические тесты (например, шкалу памяти Векслера (Wechsler Memory Scale), шкалу интеллекта взрослых Векслера (Wechsler Adult Intelligence Scale), стандартные прогрессивные матрицы Равена (Raven's Standard Progressive Matrices), тест умственных способностей взрослых Шайе-Терстона (Schaie-Thurstone Adult Mental Abilities Test), нейропсихологические тесты (например, тест Лурии-Небраска (Luria-Nebraska)), самооценки метакогнитивных способностей (например, опросник функционирования мета-памяти (Metamemory Questionnaire)), тесты зрительно-пространственных фильтраций (например, фигур Поппелрейтера, распознавания часов, рисования и вычеркивания сот), тесты когнитивной фильтрации (например, краткая шкала оценки психического статуса Фолыптейна (Folstein's Mini Mental State Test)) и тесты времени реагирования. Другие стандартные тесты для оценки когнитивных функций включают шкалу оценки когнитивных функций при болезни Альцгеймера (ADAS-cog); шкалу общего впечатления врача о происходящих изменениях, включая информацию лица, осуществляющего уход за больным (CIBIC-плюс); шкалу оценки повседневной деятельности при болезни Альцгеймера в ходе совместного исследования (ADCS-ADL); краткую шкалу оценки психического статуса (MMSE); психоневрологический опросник (NPI); клиническую рейтинговую шкалу деменции (CDR); Кембриджскую автоматизированную нейропсихологическую батарею тестов (CANTAB) или гериатрическую шкалу клинической оценки фирмы Сандоз (SCAG), тест Струпа (Stroop Test), тест на зрительно-моторную координацию (Trail Making), тест интеллекта Векслера (Wechsler Digit Span) и компьютерный тест на когнитивные функции CogState. Кроме того, когнитивную функцию можно оценить с использованием методов визуализации, таких как позитронно-эмиссионная томография (PET), функциональная магнитно-резонансная томография (fMRI), однофотонная эмиссионная компьютерная томография (SPECT) или любая другая технология изображения, которая позволяет измерить функцию мозга.
Подробное описание изобретения
I. Общие положения
Изобретение обеспечивает гуманизированные антитела 9Е4. Антитела являются полезными для лечения и диагностики заболевания с тельцами Леви.
II. Целевые молекулы
Природный человеческий альфа-синуклеин дикого типа представляет собой пептид из 140 аминокислот, имеющий следующую аминокислотную последовательность:
MDVFMKGLSK AKEGVVAAAE KTKQGVAEAA GKTKEGVLYV GSKTKEGVVH GVATVAEKTK EQVTNVGGAV VTGVTAVAQK TVEGAGSIAA ATGFVKKDQL GKNEEGAPQE GILEDMPVDP DNEAYEMPSE EGYQDYEPEA (SEQ ID NO:12) (Ueda et al., Proc. Natl. Acad. Sci. USA (1993) 90:11282-6).; GenBank accession number: P37840). Белок имеет три идентифицированных домена, повторяющийся домен КТКЕ, охватывающий аминокислоты 1-61, NAC-домен (неамилоидный компонент, Non-amyloid component) расположенный между аминокислотами примерно 60-95, и кислый С-концевой домен, расположенный между аминокислотами примерно 98 и 140.
Если из контекста явно не следует иное, ссылка на альфа-синуклеин или его фрагменты включае