Полисахарид и его производные с активностью к фиколину-3, способ получения и применения
Иллюстрации
Показать всеПредложен полисахарид или его производное. Полисахарид обладает сродством к фиколину-3 и характеризуется наличием олигосахаридного повторяющегося блока общей формулы (I). Причем в формуле (I) n является целым числом от 0 до 100, предпочтительно менее 50; PDt обозначает повторяющийся олигосахаридный блок PD1t формулы (II), повторяющийся олигосахаридный блок PD2t формулы (III) или повторяющийся олигосахаридный блок PD3t формулы (IV); PD обозначает повторяющийся олигосахаридный блок PD1 формулы (V), повторяющийся олигосахаридный блок PD2 формулы (VI) или повторяющийся олигосахаридный блок PD3 формулы (VII); [Hep]-Kdo обозначает повторяющийся олигосахаридный блок формулы (VIII). Способ получения предложенного полисахарида предусматривает культивирование штамма Н. alvei и выделение бактериального липополисахарида. Полученный липополисахарид расщепляют и отделяют полисахаридную фракцию. Выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа. Необязательно полученные полисахариды восстанавливают, в частности в присутствии NaBH4, и предпочтительно конъюгируют с известным белком-носителем или хроматографической средой. Изобретение позволяет получить лиганды, которые специфично связываются с фиколином-3, и тем самым определить концентрацию активных форм фиколина-3 и их активности в организме человека. 4 н. и 10 з.п. ф-лы, 10 ил., 3 табл., 13 пр.
PDt-(PD)n-[Hep]-Kdo (I),
, (II),
, (III),
, (IV),
, (V),
, (VI),
, (VII)
(VIII).
Реферат
Изобретение относится к бактериальному липополисахариду и его фрагментам, в частности к нативным и химически модифицированным полисахаридам, выделенных из липополисахаридов Hafnia alvei, конъюгатам таких липополисахаридов с носителями и применению полисахаридов в отдельности, а также их конъюгатов в качестве лигандов для фиколина-3 человека (фиколин-H, антиген Hakata) в оценочных тестах. Полисахариды, выделенные из липополисахаридов H. alvei, и их конъюгаты с носителями также можно применять в качестве лигандов для рекомбинантных форм человеческого фиколина-3, гомологов и аналогов человеческого фиколина-3, присутствующих в других видах, рекомбинантных форм гомологов и аналогов человеческого фиколина-3, присутствующих в других видах.
Липополисахариды (ЛПС, эндотоксин), состоящие из полисахаридной и липидной части, представляют собой амфифильные молекулы, находящиеся на поверхности грамотрицательных бактериальных клеток (Rietschel et al., 1996). Липополисахариды являются неотъемлемыми компонентами наружной мембраны оболочки клеток бактерий, которые уникальны и необходимы для функции и выживания грамотрицательных бактерий. Липополисахариды важны как факторы вирулентности грамотрицательных бактерий в случае сепсиса и септического шока (Hoist et al., 1996). Благодаря их биологической активности, ЛПС также называют эндотоксинами.
Вне зависимости от происхождения липополисахаридов, молекула, изолированная из бактерий гладкой (S) формы, характеризуется наличием следующих общих строительных блоков, включающих три области: (1) O-специфическую цепь (O-специфический полисахарид) - полимер, состоящий из повторяющихся олигосахаридных блоков, демонстрирующих высокую структурную изменчивость и определяющих серологического специфичность ЛПС (O-антигенная специфичность); (2) коровый олигосахарид - область с ограниченной структурной межвидовой изменчивостью, которая может быть разделена на сегменты: дистальный - называемый внешним кором, участок гексозы и проксимальный сегмент, называемый внутренним кором, участок гептозы, относящийся к липиду A; (3) липид A - участок, заякоривающий ЛПС в наружной мембране оболочки грамотрицательных бактерий и большинства энтеробактерий, построенный из дисахарида β-D-GlcpN-(1→6)-α-D-GlcpN, замещенного жирными кислотами, фосфатными группами и сахаридом или несахаридными заместителями (Rietschel, Brade et al., 1996). Липид A замещается коровым олигосахаридом через кетозидную связь (ketosidic linkage) между молекулой Kdo корового олигосахарида и остатком β-D-GlcN на невосстанавливающем конце углеводного остова липида A. Биологическая активность, приписываемая липополисахариду, строго связана со структурными особенностями этого участка, который представляет собой центр токсичности липополисахарида.
Аналогично бактериальной ДНК, вирусной РНК, микобактериальным гликолипидам, тейхоевым кислотам, дрожжевым маннанам и липопротеинам грамположительных бактерий, липополисахариды представляют собой так называемый патоген-ассоциированный молекулярный паттерн, ПАМП (pathogen-associated molecular pattern, PAMP). Эти молекулы представляют собой типичные структуры, присутствующие на поверхности патогенов, они не встречаются у высших организмов, но для микроорганизмов они являются важными до такой степени, что они достаточно консервативны в процессе эволюции (Aderem i Ulevitch, 2000). В клетках иммунной системы сформировалась универсальная система рецепторов, способных распознавать такие структуры и запускать быструю защитную реакцию (рецепторы включают в себя Toll-подобные рецепторы, фагоцитарные рецепторы, рецептор маннозы, а также разнообразные растворимые молекулы, узнающие молекулярные паттерны (ПАМП), включающие компоненты системы комплемента, коллектины и антибактериальные пептиды).
Основным участком, ответственным за биологическую активность липополисахаридов, является липид A, участок с низкой структурной изменчивостью. Основным рецептором, вовлеченным в механизмы врожденного иммунитета и в связывание с липидом A, является рецепторный комплекс CD14/TLR4/MD-2, присутствующий на поверхности макрофагов, моноцитов, нейтрофилов и B-лимфоцитов (Aderem i Ulevitch, 2000). Вслед за активацией сигнального пути происходит выработка провоспалительных медиаторов клетками-мишенями ЛПС.
Другие участки ЛПС, O-специфический полисахарид и коровый олигосахарид, представляют собой участки, модулирующие активность липида A после взаимодействия ЛПС с CD14/TLR4/MD-2. Благодаря свойственной им высокой структурной изменчивости, O-специфический полисахарид и коровый олигосахарид активируют механизмы врожденного иммунитета в меньшей степени. Однако, среди всех структур ЛПС, проанализированных на сегодняшний день, были идентифицированы молекулы, способные активировать факторы врожденного иммунитета, помимо описанных выше. Структуры некоторых O-специфических цепей и коровых олигосахаридов могут узнаваться такими компонентами, как, например: маннан-связывающий лектин (МСЛ) и другие человеческие лектин-подобные белки. Пектины связываются со специфическими углеводными структурами на поверхности патогена, а затем они активируют соответствующие эффекторные механизмы, такие как: активация или ингибирование системы комплемента, агглютинация, опсонизация (облегчение эндоцитоза), ингибирование роста микроорганизмов и модуляция провоспалительного или аллергического ответа. Селективность и способность лектинов различать чужеродные и хозяйские структуры основана на пространственных различиях между узнаваемыми углеводами (Thiel, 2007).
Помимо МСЛ, в активацию комплемента, в один из механизмов врожденного иммунитета, вовлечена недавно открытая группа лектинов, называемых фиколинами, лиганды которых охарактеризованы в недостаточной степени. У людей эта группа включает фиколин-1 (M), фиколин-2 (L) и фиколин-3 (H), а у мышей - фиколины A и B (Тиль, 2007).
Система комплемента представляет собой группу из нескольких десятков взаимозависимых белков, присутствующих в крови и других жидкостях организма. Активность комплемента основана на активации каскада ферментов, запускающего серию реакций, которые играют важную роль в возникновении иммунного ответа и провоспалительных реакций. Были выявлены три способа активации комплемента: классический путь, лектиновый путь и альтернативный путь. Они отличаются, прежде всего, по стадиям активации. Активация каждого пути происходит как каскад событий, в конечном счете, приводящих к: (I) опсонизации микроорганизмов (облегчению фагоцитоза), (II) хемотаксису макрофагов к сайту воспаления, (III) элиминации модифицированных или поврежденных клеток-хозяев, (IV) прямому лизису бактериальных клеток, вирусов, паразитов и грибов, и (V) началу воспалительной реакции.
При активации каскада комплемента через лектиновый путь ключевыми молекулами, распознающими патоген-ассоциированный молекулярный паттерн (ПАМП), являются МСЛ, фиколин-1 (M), фиколин-2 (L), фиколин-3 (H). Все эти белки имеют сходную структурную организацию. Они имеют олигомерную структуру, состоящую из базовой субъединицы из трех полипептидных цепей. Каждая цепь включает N-домен, содержащий большое число остатков цистеина, коллаген-подобную область и лиганд-узнающий домен. Для белка МСЛ характерен типичный лектиновый углевод-узнающий домен (англ. - carbohydrate-recognition domain, CRD). Для фиколина характерен фибриноген-подобный домен (англ. - fibrinogen-like region, FBG), который может иметь различную структуру (Thiel, 2007).
Среди перечисленных лектинов в настоящее время лучше всего охарактеризованы белок МСЛ и лиганды, полученные от патогенов, с которыми связывается этот белок. Известно, что МСЛ демонстрирует специфичность в отношении следующих моносахаридов: D-манноза, L-фукоза, N-ацетил-O-глюкозамин, D-глюкоза, которые, как правило, являются компонентами поверхностных структур патогенов, таких как грамотрицательные и грамположительные бактерии, дрожжи, паразиты, микобактерии и вирусы (Degn et al., 2009).
В отличие от молекулярных механизмов активации МСЛ-зависимого лектинового пути, активация комплемента через лектиновый путь фиколинами и, в частности, ее начальные стадии, т.е. взаимодействие фиколинов с ПАМП, является наименее охарактеризованным механизмом в системе комплемента. С точки зрения сывороточных концентраций, фиколины составляют доминирующую долю молекул, ответственных за активацию лектинового пути. В сыворотке средняя концентрация фиколина-3 (H), фиколина-2 (M) и фиколина-1 (L) составляет 25 мкг/мл, 5 мкг/мл и 0,1 мкг/мл, соответственно, а уровень МСЛ составляет около 1-3 мкг/мл (Garred et al., 2009). Специфичность фиколинов к лигандам мало изучена. Знания в этой области ограничиваются наблюдением того, что потенциальными лигандами для фиколинов могут являться N-ацетильные группы природных сахаров, таких как GlcNAc, GalNAc, а также N-ацетилированный глицин. Лиганды для фиколинов также включают искусственно полученные лиганды, такие как N-ацетилированный бычий сывороточный альбумин (BSA-NAc), BSA-GlcNAc и N-ацетилированный липопротеин низкой плотности (LDL-NAc). Было показано, что фиколины также способны связываться с C-реактивным белком (C-reactive protein, CRP) (Thiel, 2007). Все фиколины, а также МСЛ, связываются с сериновыми протеазами MASP (MBL-associated serine proteases, MBL-ассоциированные сериновые протеазы), и это позволяет им запускать активацию комплемента через лектиновый путь. В этом процессе ключевую роль играет фермент MASP-2. Из молекулярных паттернов, ассоциированных с патогенами, узнаваемыми человеческими фиколинами, в литературе описано лишь несколько примеров, которые являются довольно разнообразными по химической структуре. Больше известно о лигандах для фиколина M и L. Среди лигандов для фиколина-1 (M) выявлены липотейхоевые кислоты грамположительных бактерий, бактериальные поверхностные антигены Staphylococcus aureus и Salmonella typhimurium, 1,3-β-O-глюкан грибов, сиаловые кислоты и их производные, O-ацетилированные в положении 9 (Le Gout et al., 2009). Этот лектин обладает сродством к N-ацетил-D-глюкозамину (GlcNAc), N-ацетил-D-галактозамину (GalNAc), и сиаловой кислоте (Neu5Ac), связываясь с их ацетильными группами (Garlatti et al.; Liu et al., 2005; Matsushita, 2007; Runza et al., 2008).
Такая особенность, которая является типичной для фиколинов, облегчает связывание с несахаридными лигандами, такими как N-ацетил-L-цистеин и ацетилированный альбумин (Wittenborn et al., 2010). Сайт связывания, расположенный в фибриногеновом домене, гомологичен сайту S1 тахилектина. Фиколин M узнает поверхностные структуры некоторых штаммов стрептококков, стафилококков, E. coli и S. enterica (Runza, Schwaeble et al., 2008). Фиколин-2 (L) показывает сродство к N-ацетил-D-глюкозамину, N-ацетил-D-галактозамину и сиаловой кислоте, но он также может связываться с несахариными лигандами, такими как N-ацетилцистеин, N-ацетилглицин, ацетилхолин, эластин и некоторые кортикостероиды, а также окисленные и ацетилированные формы ЛНП или ДНК (Matsushita, 2007; Thiel, 2007; Runza, Schwaeble et al., 2008; Garred, Honore et al., 2009; Garred et al., 2010; Matsushita, 2010). Было показано, что фиколин L узнает некоторые из липополисахаридов, капсульные полисахариды, A-1-3-D-глюканы грибов и липотейхоевые кислоты. Благодаря этому он связывается с некоторыми штаммами S. enterica и E. coli, но в первую очередь со стафилококками и стрептококками: Staphylococcus aureus, Streptococcus pneumoniae, S. pyogenes и S. agalactiae (Matsushita, 2007). Возможно, связывание с бета-гемолитическими стрептококками группы B (Streptococcus agalactiae) является особенно важным, поскольку эти бактерии являются наиболее частой причиной менингита и сепсиса у новорожденных. Среди лигандов для этого лектина также описаны трисахариды и тетрасахариды, содержащие на конце LacNAc-(β-Gal[3-O-SO3][6-O-SO3]-(1→4)-(β-GlcNAc-носитель) или GlcNAc, гепарин (его фибриногенный домен) и высоко сульфатированные гликозаминогликаны (Gout, Garlatti et al., 2009).
Фиколин H (также известный как фиколин 3 или антиген Hakata, первоначально описанный как термолабильный макроглобулин β2) синтезируются в гепатоцитах, клетках эпителия желчных протоков, альвеолярных клетках II типа, в эпителии бронхов и глиальных клетках. Низкий уровень экспрессии был выявлен в клетках сердца, почек, поджелудочной железы, селезенки и плаценты. Белок высвобождается в кровь, желчные протоки и слизь, покрывающую дыхательные пути. Поскольку количество фиколина H, синтезируемого в легких, выше, чем в печени, вероятно, этому лектину можно приписать не только системную (поскольку он высвобождается в кровь), но и локальную защитную роль в дыхательных путях. Его концентрация в сыворотке крови здоровых взрослых людей является относительно высокой. Согласно первоначальной широко цитируемой работе (Yae et al., 1991), такая концентрация колеблется от 7 до 23 мкг/мл (в среднем около 18 мкг/мл). Последние данные, опубликованные Андерсеном и соавторами (Andersen et al., 2009) указывают на то, что она может быть даже выше (в среднем выше 32 мкг/мл, в диапазоне от 10 до более 80 мкг/мл). Среди лигандов фиколина-3 (H) был выявлен полисахарид, выделенный из бактерий Aerococcus viridans 86965 (вероятно, капсульный полисахарид) (Tetta et al., 1998; Matsushita et al., 2002), BSA-NAC (Lacroix et al., 2009; Munthe-Fog et al., 2009), BSA-Gal, D-фукозы и D-галактозы (Gout, Garlatti et al., 2009), поверхностные антигены клеточной линии лимфомы T-лимфоцитов (клеточная линия Jurkat) (Gout, Garlatti et al., 2009).
Как показано в тестах на агглютинацию и анализе ингибирования агглютинации человеческих эритроцитов (Sugimoto, Yae et al., 1998), фиколин-3 связывается с ЛПС из Salmonella Minnesota и Typhimurium, а также E. coli. В процитированном выше исследовании Gout и соавторов (Gout, Garlatti et al., 2009) предприняты наиболее точные попытки определить специфичность фиколинов к сахаридным лигандам. В этом исследовании был использован матрикс (гликоматрикс), содержащий 377 родственных гликанов. Анализируемые гликаны как природные, так и синтетические, представляли собой компоненты, встречающиеся в клетках млекопитающих.
Как показано, специфичность фиколина-3 (H) по отношению к лигандам очень слабо охарактеризована. Кроме того, по последовательности аминокислот фиколин-3 (H) существенно отличается от других фиколинов, демонстрируя лишь 45% гомологии с фиколином-1 и фиколином-2 и 58% гомологии с доменом FGB. Что касается различных типов синтетических соединений, недавно было показано, что фиколин-3 также связывается с BSA-NAc (Munthe-Fog, Hummelshoj et al., 2009). Лиганд BSA-NAc был использован в упомянутом исследовании для индукции активации лектинового пути сывороткой крови человека. Взаимодействие фиколина-3 как с BSA-NAc, так и с бактериями штамма A. viridans 86965 и их полисахаридами не были охарактеризованы на молекулярном уровне (Tsujimura et al., 2002). Как уже отмечалось, специфичность фиколинов очень плохо изучена и в настоящее время продолжаются споры о природе химических лигандов, которые они признают. Химическая структура некоторых ПАМП или наличие специфичных антител в крови подтверждает предположение, что они могут активировать систему комплемента одновременно через все пути: классический путь, лектиновый путь и альтернативный путь. Кроме того, эти пути активации системы комплемента взаимозависимы на определенных этапах. На настоящий момент описан механизм усиления классического и лектинового пути через активацию альтернативного пути (Degn, Hansen et al., 2009).
Для исследований, направленных на выяснение механизмов, лежащих в основе таких процессов, проводимых in vitro, in vivo или с использованием изолированных модельных систем типа лиганд-белок, требуется широкий ассортимент экспериментальных инструментов, позволяющих выделять и очищать ключевые белки, определять их уровень в жидкостях организма и тестировать их активность с использованием иммунохимических методов и блокирования их активности. Как показано в большинстве исследований механизмов иммунной системы, комплемент представляет собой сложную систему в отношении применяемых методов исследований.
В настоящее время основной упор делается на получении таких экспериментальных инструментов, которые позволяют оценивать различные способы активации комплемента независимо, в условиях, приближенных к физиологическим (Herpers et al., 2009; Inoshita et al., 2009). В таких тестах важное значение имеет выбор адекватного лиганда, и эта задача является чрезвычайно трудной в случае фиколинов из-за отсутствия соответствующих данных. Был описан конъюгат BSA-NAc, и он используется как лиганд для фиколина-3 (H). Однако он не встречается в природе и был получен в результате химического синтеза.
Определение уровня фиколина, активности и способности активировать систему комплемента является важным в отношении диагностики и определения характеристик иммунодефицитов, связанных с комплементом, что часто связано с полиморфизмом в генах, кодирующих лектин. Как было показано с помощью достаточно хорошо охарактеризованного примера МСЛ человека, последствия мутации могут включать нарушения структуры и функции, более короткий период полужизни и снижение концентрации в сыворотке крови. Для МСЛ последствия такой недостаточности наиболее критичны для людей с незрелой или неисправной иммунной системой, и чаще всего они включают повышенную восприимчивость к инфекции (иногда угрожающую жизни). Можно предположить, что в результате дальнейших исследований значения фиколинов, их роль в иммунном ответе и клинические эффекты, связанные с их дефицитом, будут выяснены и документально подтверждены. Так, по-прежнему крайне мало опубликованных данных о потенциальных рисках, которые могут быть обусловлены недостатком фиколина-2 (L). Более высокая распространенность такой недостаточности (определенная количественно) наблюдается у женщин с рецидивами самопроизвольных выкидышей (Kilpatrick et al., 1999). Значительно более низкие концентрации фиколина L также наблюдались у беременных женщин с преэклампсией, по сравнению со здоровыми беременными женщинами (Wang et al., 2007). В будущем исследование одиночных нуклеотидных полиморфизмов в гене FCN2, кодирующем фиколин-2, и концентрации белка может быть полезным диагностическим инструментом. У детей с недостатком фиколина L наблюдается более высокая частота мутаций в положениях 64 и 6424, по сравнению с детьми с высоким содержанием этого белка. Напротив, частота вариантов аллелей пары -4 и 6359 значительно ниже у детей с недостатком фиколина L (Cedzynski et al., 2007). Также у детей с повторяющимися респираторными инфекциями, сопровождающимися астмой и аллергическим ринитом, наблюдается более высокий показатель распространения дефицита количества фиколина, по сравнению со здоровыми детьми (но без исключения детей с повторяющимися инфекциями и аллергическими заболеваниями) (Atkinson et al., 2004; Cedzynski et al., 2009).
Было показано, что дефицит фиколина L увеличивает риск преждевременных родов, низкого веса при рождении и врожденные инфекции (Swierzko et al., 2009). Физиологическая роль фиколина Н и клиническое значение его недостаточности изучены в незначительной степени. Показано, что у лиц с саркоидозом наблюдаются значительно более низкие концентрации этого лектина, по сравнению с контрольной группой (Svendsen et al., 2008). Попытки выявить, влияет ли дефицит этого фактора на риск возникновения вспышки заболевания, влияет ли заболевание на регуляцию экспрессии гена FCN3, происходит ли потребление активного белка, не увенчались успехом. Более низкие концентрации фиколина H также выявлены у пациентов с системной красной волчанкой, и, как упоминалось ранее, это связано с выработкой аутоантител, направленных против этого белка, но не с генетически детерминированными нарушениями синтеза (Yae, Inaba et al., 1991; Andersen, Munthe-Fog et al., 2009). Концентрация в сыворотке фиколина H резко повышается во время беременности, что может указывать на его важную защитную роль. Однако, как отмечалось выше, значительно более низкие концентрации фиколина L наблюдались у беременных женщин с преэклампсией, по сравнению со здоровыми беременными женщинами. В синцитиотрофобластах из плаценты больных женщин было обнаружено значительное количество фиколина H, что предположительно связано с местным воспалительным процессом и указывает на вероятное участие белка в патологии (Wang, Yim et al., 2007). Недавно Шлапбах с соавторами показал, что низкая концентрация фиколина Н в сыворотке крови детей, перенесших противоопухолевую химиотерапию, увеличивает риск нейтропенической лихорадки и сепсиса (Schlapbach et al., 2009). Фукутоми с соавторами отметил, что концентрация фиколина Н также снижается с развитием цирроза печени, поэтому его концентрация может служить диагностическим маркером, указывающим на уровень дисфункции этого органа (Fukutomi et al., 1996).
Лечение некоторых иммунодефицитов основано на доставке (замещении) соответствующего фактора, полученного от здоровых доноров или его рекомбинантной формы. Рекомбинантный или нативный белок МСЛ в настоящее время проходит клинические испытания как потенциальное лекарственное средство в случаях недостаточности этого лектина.
Отправной точкой для диагностики недостаточности, мониторинга терапии такой недостаточности, а также объяснения ее механизмов являются методы определения концентрации и активности в жидкостях организма. Первым шагом в лечении этого типа недостаточности является получение активных, очищенных препаратов этого белка в нативной или рекомбинантной форме.
Для определения концентрации фиколина-3 в жидкостях организма в основном используются два метода. Один из них («сэндвич»-ИФА) основан на применении моноклональных антител против человеческого фиколина-3 (H), используемых как в качестве так называемых «антител захвата», так и в качестве детектирующих антител для детекции белков. Во втором методе используется бычий альбумин, который химически модифицирован путем N-ацетилирования (BSA-NAc). В настоящее время доступен коммерческий тест, разработанный компанией Hycult, который позволяет определить общую концентрацию фиколина-3 (H) с использованием «сэндвич»-ИФА. Что касается второго способа, в котором используется в качестве лиганда конъюгат BSA-NAc, недавно была описана возможность его применения на практике для оценки активности комплексов фиколина-3-MASP (Munthe-Fog, Hummelshoj et al., 2009).
Первый метод позволяет определить уровень белка в сыворотке, который не обязательно отражает уровень активной формы фиколина-3. Второй метод отличается недостаточно описанным молекулярным механизмом взаимодействия фиколина-3 (H) с N-ацетильными группами. Кроме того, BSA-NAc не является природным лигандом.
Целью в соответствии с настоящим изобретением является предоставление лигандов, которые специфично связываются с фиколином-3, и способа их получения, которые можно применять для определения концентрации активных форм фиколина-3 и их активности. Неожиданно, эта цель была достигнута в настоящем изобретении.
Предметом в соответствии с настоящим изобретением является полисахарид со сродством к фиколину-3 или его производное, отличающийся тем, что его структура описывается общей формулой:
PDt-(PD)n-[Hep]-Kdo
где n является целым числом от 0 до 100, предпочтительно менее 50, более предпочтительно менее 40, а в случае полисахаридов бактериального происхождения обычно менее 30,
PDt обозначает:
- повторяющийся олигосахаридный блок (repeating oligosaccharide unit) PD1t, имеющий формулу:
- повторяющийся олигосахаридный блок PD2t, имеющий формулу:
- повторяющийся олигосахаридный блок PD3t, имеющий формулу:
PD обозначает:
- повторяющийся олигосахаридный блок PD1, имеющий формулу:
,
- повторяющийся олигосахаридный блок PD2, имеющий формулу:
или
- повторяющийся олигосахаридный блок PD3, имеющий формулу:
- [Hep]-Kdo обозначает дисахарид, имеющий формулу:
Предпочтительно, полисахарид в соответствии с настоящим изобретением отличается тем, что он содержит соединения, выбранные из полисахаридов общей формулы: PD1t-PD1-[Hep]-Kdo, PD2t-PD2-[Hep]-Kdo or PD3t-PD3-[Hep]-Kdo.
В равной мере предпочтительным является производное полисахарида в соответствии с настоящим изобретением, который характеризуется тем, что оно выбрано из группы, включающей восстановленный полисахарид PDt-(PD)n-[Hep]-Kdo, его конъюгат с известным белком-носителем или хроматографическим носителем.
В соответствии с настоящим изобретением фраза «восстановленный полисахарид PDt-(PD)n-[Hep]-Kdo» обозначает соединение, в котором остаток Kdo присутствует в виде линейного полиспирта, 1-карбокси-3-дезоксиоктитола, в котором первый и третий атом углерода заменен карбоксильной и дезокси-группой, соответственно. Такое производное образуется в результате восстановления, в частности с применением боргидрида натрия.
Известные белки-носители, применяемые для получения конъюгата в соответствии с настоящим изобретением, могут представлять собой сывороточный альбумин позвоночных, оваальбумин.
Известные хроматографические носители, которые можно применять для получения конъюгатов в соответствии с настоящим изобретением, предпочтительно представляют собой модифицированную агарозу, целлюлозу или полиакриламид.
Кроме того, изобретение относится к способу получения полисахаридов и их производных со сродством к фиколину-3, отличающийся тем, что:
а) выделяют бактериальный липополисахарид, предпочтительно из штамма H. alvei,
б) полученный липополисахарид расщепляют и отделяют полисахаридную фракцию,
в) выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа,
г) как альтернатива, полученные полисахариды восстанавливают, в частности, в присутствии NaBH4 и, предпочтительно, конъюгируют с известным белком-носителем или хроматографическим носителем.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что культивирование штамма H. alvei осуществляется на этапе (а), и такой штамм H. alvei выбран из штаммов: H. alvei 981, 1200, 1203, 1205, и 1208. Эти штаммы были депонированы 07 июня 2010 г. в Польской коллекции микроорганизмов (Институт иммунологии и экспериментальной терапии Польской академии наук, Вроцлав) в соответствии с Будапештским договором, под номерами, представленными в следующей Таблице:
| Штамм | Номер доступа в Польской коллекции микроорганизмов (PCM) |
| H. alvei 981 | B/00030 |
| H. alvei 1200 | B/00031 |
| H. alvei 1203 | B/00032 |
| H. alvei 1205 | B/00033 |
| H. alvei 1208 | B/00034 |
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что экстрагирование липополисахарида из бактериальной массы осуществляют на этапе (а) в течение примерно 15 минут при температуре около 65°C в водном растворе фенола, предпочтительно растворе фенола в концентрации около 45%, с последующим восстановлением липополисахарида из отделенной водной фазы.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что отделенный полисахарид гидролизуют на этапе (б) в примерно 1-1.5% растворе уксусной кислоты, примерно от 15 до 60 мин при температуре 100°C.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что полисахаридную фракцию разделяют с помощью хроматографии на этапе (в) для отделения O-специфических цепей от более коротких цепей полисахаридов и коровых олигосахаридов, при этом хроматографию предпочтительно проводят на колонке, заполненной полиакриламидным гелем, таким как коммерчески доступный Bio-Gel P-10, уравновешенной буфером, содержащим 0,05 М пиридин/уксусная кислота/вода в соотношении 10/4/986 при pH около 5,6.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что полученные полисахариды восстанавливают и конъюгируют с белком-носителем на этапе (г), при этом такой белок-носитель может, в частности, представлять собой бычий сывороточный альбумин или хроматографический носитель, и особенно предпочтительным является модифицированная агароза, такая как коммерчески доступная сефароза Sepharose ®.
Еще одним аспектом в соответствии с настоящим изобретением является применение бактериального липополисахарида или полисахарида, содержащегося в нем, или их производных в качестве лиганда для фиколин-3, в частности для очистки или детекции фиколина-3 или его производных.
Как используется в настоящей заявке, термин «фиколин-3» или «его производные» относится к человеческому фиколину-3, который может представлять собой природный белок или белок, полученный искусственным путем, в частности рекомбинантный белок, в том числе возможные мутантные формы и другие производные, имеющие по существу активность природного фиколина-3.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что применяют липополисахарид, полученный из штаммов: H. alvei 981, 1200, 1203, 1205, 1208, или полисахарид, содержащийся в нем или его производное. Как описано выше, все штаммы, относящиеся к данной заявке, были депонированы в Польской коллекции микроорганизмов.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что применяют полисахарид или его производное в соответствии с настоящим изобретением, которые определены выше или получены способом в соответствии с настоящим изобретением, как описано выше.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что производное фиколина-3 представляет собой комплекс фиколина-3 с сывороточными или полученными из плазмы сериновыми протеазами, MASP (МСЛ-ассоциированными сериновыми протеазами).
Также предпочтительное применение в соответствии с настоящим изобретением отличается тем, что для определения активности и/или уровня фиколина-3 или его производных в сыворотке крови и других жидкостях организма осуществляют очистку.
Кроме того, предпочтительное применение в соответствии с настоящим изобретением отличается тем, что очистка проводится с целью получения сыворотки или плазмы, лишенной фиколина-3.
В начале подробного описания выбранных предпочтительных вариантах осуществления в соответствии с настоящим изобретением следует отметить, что отправной точкой настоящего изобретения послужило открытие с помощью дот-блот анализа сильного взаимодействия между человеческим фиколином-3 (H) и бактериальными липополисахаридами, в частности, ЛПС, изолированными из штаммов Н. alvei 2, 23, 37, 38, 981, 1200, 1203, 1205 и 1208. Пара ЛПС-фиколин представляет собой еще один пример ключевого взаимодействия, которое является важным для врожденного иммунитета. Липополисахарид (ЛПС) представляет собой один из молекулярных паттернов ПАМП, а также основной поверхностный антиген и фактор вирулентности грамотрицательных бактерий, а фиколин-3 (H) является компонентом системы комплемента (ключевой механизм врожденного иммунитета), который связывается с ЛПС и активирует каскад комплемента через лектиновый путь.
В ходе исследований, которые привели к настоящему изобретению, авторы изобретения идентифицировали и выделили бактериальные лиганды, в которых специфично и прочно связываются, в частности, с человеческим фиколином-3 (H). В предпочтительном варианте реализации в соответствии с настоящим изобретением, лиганды представляют собой полисахаридные фрагменты липополисахаридов Н. alvei, которые получают путем химической деградации липополисахарида. В результате скрининга ЛПС H. alvei было выявлено девять ЛПС, составляющих область, с которой связывается человеческий фиколин-3 (H): ЛПС 2, 23, 37, 38, 981, 1200, 1203, 1205 и 1208. Полная структура этих липополисахаридов на сегодняшний день не была определена и не была опубликована. Единственно доступными были данные, касающиеся структуры повторяющихся блоков O-специфических цепей, присутствующих в ЛПС 2, 23, 38, 1200, 1203, 1205, 1208 (Gamian et al., 1991, Katzenellenbogen et al., 1992, Katzenellenbogen et al., 1999; Dag et al., 2004). Эти структуры были определены с помощью инструментальных и химических анализов высокомолекулярных фракций O-специфических полисахаридов, имеющих число повторяющихся блоков, большее или равное 4. Такие фракции были получены путем кислого гидролиза липополисахарида в присутствии детергента (1,5% CH3COOH, 2% SDS) в течение 15 мин при 100°C. Такие условия обеспечили гидролиз кислотолабильной кетозидной связи между липидом M и сахаром в ЛПС (коровый олигосахарид, замещенный O-специфической цепью). После отделения липида А полученную смесь поли- и олигосахаридов разделяли с помощью гель-фильтрационной хроматографии. Учитывая современные представления об общей структуре липополисахаридов энтеробактерий, наличие гликозидной связи между коровым олигосахаридом и O-специфической цепью, которая не разрушается при таких условиях, как правило, должно приводить к образованию продуктов, включающих коровый олигосахарид и полисахаридные фракции, образованные коровым олигосахаридом, замещенным с помощью различного числа повторяющихся блоков O-специфической цепи. В ходе последующих исследований липополисахаридов H. alvei, которые привели к настоящему изобретению, авторы настощего изобретения выявили необычный структурный элемент, отличающийся от известных ЛПС энтеробактерий: наличие остатка Kdoll в дистальной области корового олигосахарида (Lukasiewicz et al., 2009). Был выделен фрагмент ЛПС H. alvei 32, содержащий сахарную часть липида A, замещенного коровым олигосахаридом, содержащий на конце трисахаридный фрагмент L-α-D-Hepp-(1→4)-[α-D-Galp6OAc-(1→7)]-α-Kdop-(2→]. Наличие двух областей Kdo внутри молекулы ЛПС существенно изменяет состав смеси поли- и олигосахаридов, полученных в результате кислого гидролиза ЛПС. Для ЛПС H. alvei гидролиз связи кетозидной связи происходит в двух местах: (I) между липидом A и остатком Kdol, который замещает липид A, и (II) между остатком Kdoll, присутствующим во внешней части коровой области олигосахарида, и остальной частью коровой области. Для липополисахарида, фрагменты которого представляют предмет одного из аспектов в соответствии с настоящим изобретением, было показано, что остаток Kdoll представляет собой место замещения O-специфической цепи. Таким образом, было возможно получить полисахариды, лишенные почти всей коровой области, с мотивом Hep-Kdo на его восстанавливающих концах в результате кислого гидролиза ЛПС H. alvei 23, 1200, 1203, и 1205. Таким образом, данное сообщение является первым раскрытия присутствия этого элемента в O-специфических полисахаридных фракциях, выделенных из ЛПС H. alvei 1200, 1203 и 1205. Эти полисахариды построены из одного, двух и больше углеводных повторяющихся блоков. Кроме того, настоящее изобретение представляет собой первое сообщение о строении биологических повторяющихся блоков O-специфического полисахарида H. alvei ЛПС 1200, 1203 и 1205. Что касается структурного анализа повторяющихся блоков O-специфических цепей ЛПС H. alvei, структурный элемент Hep-Kdo, описанный в настоящей заявке, не был выявлен в процитированных выше публикациях (Jachymek et al. 1995; Sunday et al., 1996, Petersson et al., 1997; Jachymek et al., 1999, Dag et al., 2004). Эти исследования были проведены для фракций, содержащих полимеры с числом повторяющихся единиц больше чем 4-5. Мотив Hep-Kdo не был обнаружен в связи с преобладанием компонентов повторяющихся блоков. Фрагмент O-специфической цепи, содержащий от 4 до 8 сахарных остатков, характерных для O-специфической цепи и дисахаридом Hep-Kdo на восстанавливающем конце был выделен только в том случае ЛПС H. alvei 2 (Gamian, Romanowska et al., 1991).
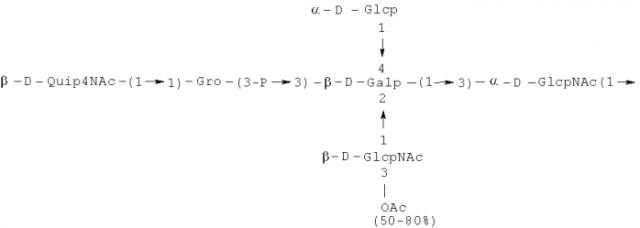
Примерами лигандов фиколина-3, раскрытых в настоящей заявке, являются полисахаридные фрагменты липополисахаридов H. alvei 1200, 1203, 1205, в частности ЛПС 1200, которые получают путем химической деградации липополисахарида. Эти полисахариды имеют структуру общей формулы:
PS1: PD1t-(PD1)n-[Hep]-Kdo,
PS2: PD2t(PD2)n-[Hep]-Kdo,
PS3: PD3t(PD3)n-[Hep]-Kdo,
где символ PD обозначает субъединицу О-специфических цепей, изолированных из липополисахаридов H. alvei 1200 (PD1), 1203 (PD2) и 1205 (PD3), соответственно.
Кроме того, все полисахариды дополнительно O-ацетилированы (Фиг.1). Число n является целым числом, большим или равным 0. Дисах