Способ идентификации соединений для лечения рака
Иллюстрации
Показать всеИзобретение относится к области онкологии и касается комплекса, включающего сочетания полиинозинполицитидиловой кислоты (pIC) и полиэтиленимина (PEI), и его применения в качестве средства для лечения рака, в частности меланомы. Изобретение включает фармацевтическую композицию, содержащую комплекс для применения в лечении меланомы, где указанный комплекс индуцирует аутофагию в клетках меланомы или в клеточной линии, полученной из клеток меланомы, и указанный комплекс включает сочетание pIC и линейного PEI с соотношением N/P 1 к 5. 4 н. и 6 з.п. ф-лы, 1 табл., 13 пр., 15 ил.
Реферат
Область техники
Настоящее изобретение относится к области онкологии, и оно главным образом направлено на идентификацию соединений, которые можно использовать для лечения различных видов рака, например: меланомы, рака поджелудочной железы, толстой кишки, мочевого пузыря, глиомы, молочной железы, предстательной железы, легкого и яичника.
Кроме того, настоящее изобретение также охватывает соединения, определенные таким способом, например, соединение BO-110 (см. ниже), которое способно вызывать отчетливую гибель опухолевых клеток во всех указанных выше видах рака.
Уровень техники
Меланома остается прототипом солидных видов рака с ростом числа заболеваний и крайне неблагоприятным прогнозом на поздних стадиях (Jemal et al., 2008). Значительные усилия были посвящены идентификации молекулярных детерминант, лежащих в основе химической и иммунной резистентности меланомы. Единственными средствами, одобренными Управлением по контролю за продуктами и лекарствами США (FDA) для лечения метастатической меланомы, являются алкилирующий агент дакарбазин (DTIC) и иммуномодулятор IL-2 (Tawbi and Kirkwood, 2007). Тем не менее, надежный и полный ответ на лечение при метастатической меланоме редко встречается более чем у 5% пациентов, и вторичная токсичность может быть очень серьезной. В результате, в настоящее время средняя продолжительность жизни больных с метастатической меланомой составляет от 6 до 10 месяцев и, следовательно, разработка более совершенных способов лечения является приоритетной при данном заболевании (Jemal et al., 2007).
Первоначально, синтетический аналог вирусной дсРНК, называемый pIC (полиинозин-полицитидиловая кислота), соединение, которое используется уже более четырех десятилетий для стимуляции иммунной системы независимо от интерферона (IFN) (Field et al., 1967), считался перспективным терапевтическим средством против меланомы. К сожалению, клинические исследования с «голой» pIC выявили ее низкую стабильность, низкую степень индукции интерферона и отсутствие противоопухолевого эффекта при меланоме (Robinson et al., 1976). Таким образом, в качестве монотерапии pIC считается малоэффективным лекарственным средством против меланомы.
Высокопроизводительный гистогенетический анализ и систематические функциональные исследования значительно расширили наше понимание возникновения и прогрессирования меланомы и сложных механизмов, связанных с неэффективностью лечения (Fecher et al., 2007; Gray-Schopfer et al., 2007). Были идентифицированы соответствующие дефекты и изменения в сигнальных каскадах реакций BRAF/MAPK; PI3K/AKT, NF-κB или NOTCH, составившие многообещающую платформу для рациональной разработки лекарственных средств (Gray-Schopfer et al., 2007). Однако направленная терапия до сих пор не доказала свою эффективность в испытаниях на меланоме (Flaherty, 2006). Программы клеточной гибели, контролируемые митохондриями и/или эндоплазматическим ретикулумом, также проходят апробацию, хотя неизменно являются неэффективными in vivo (Hersey and Zhang, 2008). Следовательно, используемые в настоящее время противораковые лекарственные средства либо не достигают своей цели(лей) продуктивно, либо должны быть введены в дозировках, которые приводят к непереносимой токсичности для нормальных клеточных компартментов (Tawbi and Kirkwood, 2007). Важно отметить, что в процессе лечения могут активизироваться компенсаторные механизмы, приводящие к отбору клеточных популяций с еще большей устойчивостью к химическим препаратам (Lev et al., 2004; Shatton et al., 2008; Wolter et al., 2007).
В сущности, считается, что меланома обладает сильной способностью избегать апоптоза через различные пути, что дает меланоме возможность прогрессировать, образовывать метастазы и не поддаваться лечению различными терапевтическими методами (обзор Ivanov et al., 2003).
В отличие от стандартной химиотерапии, направленной на уничтожение опухолевых клеток в основном «изнутри» (то есть, путем активации внутренней программы клеточной гибели), в иммунотерапии традиционно задействованы непрямые каскады межклеточных взаимодействий. При меланоме основные усилия были сосредоточены на повышении содержания или функциональной эффективности двух составляющих: антиген-презентирующих клеток и цитотоксических Т-клеток (Wilcox and Markovic, 2007). Вакцины, а также антитела, направленные против ингибиторных иммуномодуляторов (например, CTL4), также проходят испытания, хотя и с разочаровывающими результатами в фазе IV клинических испытаний (Kirkwood et al., 2008). В последнее время проводятся исследования стимуляции иммунной системы посредством активации Toll-подобных рецепторов (TLR)-3, -4, -7 и -9 для обеспечения цитотоксического разрушения клеток меланомы при помощи натуральных киллеров (NK), дендритных клеток (DC) и Т-клеток (Kirkwood et al., 2008, и Tormo et al., 2007). Тем не менее, многочисленные исследования, включая исследования авторов изобретения, продемонстрировали присущую клеткам способность обходить иммунологическую терапию путем понижающей регуляции (корректировки) иммунореактивных поверхностных маркеров. Меланомы также могут оказывать подавляющее действие на хозяина (например, ингибирование созревания антиген-презентирующих клеток или блокада полной активации Т-клеток) (Tormo et al., 2006; Ilkovitch and Lopez, 2008; Verma et al., 2008). Таким образом, меланомы демонстрируют присущую им способность избегать противоопухолевого эффекта иммуномодуляторов.
В области иммунотерапии одной из молекул, увеличение числа которых изучается как потенциальный положительный фактор для лечения меланомы, является MDA-5 (ассоциированный с дифференциацией меланомы ген 5), продукт, изначально описанный как ген, связанный с дифференциацией меланомы (Kang et al., 2002). MDA-5 представляет собой геликазу, которая узнает и активируется длинной двухцепочечной РНК (дсРНК) (Yoneyama et al., 2005). Другими РНК геликазами являются RIG-1 (индуцируемый ретиноевой кислотой белок 1, также называемый Dsx58), который узнает голые 3-фосфаты короткой дсРНК, и LGP2 (также называемый Dhx58), являющийся отрицательным регулятором при опознавании дсРНК.
До тех пор, пока дсРНК могут создаваться в результате и в процессе вирусных инфекций, MDA-5 выступает в качестве первой линии врожденного иммунитета против вирусных патогенов (Akira et al., 2006). Кроме того, MDA-5 имеет домены рекрутинга активации каспазы (CARD). Геликаза и домены CARD совместно активируют NF-κB и другие факторы транскрипции, вовлеченные в регуляцию цитокинов (Kawai et al., 2005). Таким образом, наиболее известной функцией MDA-5 является иммунная стимуляция.
С терапевтической точки зрения известно, что как IFN-β, так и дсРНК индуцируют транскрипцию гена Mda-5. Вследствие этого, было высказано предположение, что дсРНК играет роль в увеличении экспрессии Mda-5 при индуцированном IFN ингибировании роста. Кроме того, показано (Kang et al., 2002), что индукция эндогенной MDA-5 с помощью IFN-β является цитостатической (другими словами, останавливает клеточный цикл). Таким образом, для активации гибели опухолевых клеток MDA-5 должна быть избыточно экспрессирована эктопически на высоких уровнях (Kovacsovics et al., 2002). Более того, данная проапоптотическая активность эктопической экспрессии MDA-5 не эффективна в опухолевых клетках с гиперактивным путем RAS/MEK/ERK (Lin et al., 2006), как в случае с меланомами (Chin et al., 2006). Таким образом, нерешенным вопросом в этой области было то, как активировать эндогенную MDA-5 с помощью химиотерапевтических средств исключительно применительно к области опухоли (не вызывая вторичную токсичность в нормальных клетках).
В патентной заявке US 2007/0259372 предложена идентификация агонистов или антагонистов IFN-β, IFN-α или IFN-γ с помощью соединений, способных усиливать экспрессию MDA-5. В этом патенте также высказано предположение, что индукторы экспрессии гена Mda-5 (с помощью его промотора) можно рассматривать как соединения-кандидаты для индукции терминальной дифференциации опухолевых клеток. Также там высказано предположение о возможной роли MDA-5 в генерации апоптотических сигналов через ее домен CARD. Однако до настоящего времени не было известно, какие мишени MDA-5 способны запускать апоптоз, и как активировать ее отслеживаемым и избирательным для опухолевых клеток образом. Кроме того, поскольку клетки меланомы имеют активный путь RAS/MEK/ERK (который ингибирует MDA-5), а также выраженную способность избегать апоптотической клеточной гибели, не было очевидно, что апоптотические сигналы, опосредованные MDA-5, могут быть действующим механизмом для терапии против меланомы. Вследствие этого, на основании предыдущей информации о регуляции и функции MDA-5 данный белок не считался убедительной целью для методов по идентификации кандидатов в терапевтические средства против меланомы.
Аутофагия становится альтернативной стратегией для активизации эндогенного механизма гибели раковых клеток.
Этот процесс включает сложный каскад событий, которые в конечном итоге приводят к секвестрации цитозольных компонентов для последующей деградации лизосомами (Xie and Klionsky, 2007). В зависимости от механизма поглощения и природы груза, доставляемого в аутолизосомы, описано множество механизмов аутофагии. В контексте противоракового лечения, макроаутофагия или массовая деградация клеточных органелл и белковых агрегатов, вызывает интерес из-за ее способности ставить под угрозу жизнеспособность клеток за счет дисфункции или избыточного истощения основных органелл (например, эндоплазматического ретикулума или митохондрий) (Hoyer-Hansen, 2008).
Однако неизвестно, каким образом регулируется аутофагия, и ее терапевтический потенциал не является ясным и простым (Hippert et al., 2006). С другой стороны, макроаутофагия (которая далее в данном документе будет называться просто «аутофагией») продемонстрировала значительный потенциал для защиты клеток от различных агрессивных внутриклеточных и внеклеточных сигналов, включая противораковые лекарственные средства. За счет этой активности аутофагия может стимулировать развитие опухоли (Mizushima et al., 2008; Kroemer and Levine, 2008).
Как ни парадоксально, аутофагия также связана с гибелью клеток (Kromer et al., 2009). Таким образом, чрезмерная или постоянная аутофагия может способствовать гибели клеток вследствие истощения основных органелл (то есть, эндоплазматического ретикулума или митохондрий), изменения сигналов выживания, дерегулирования лизосомальных ферментов, и/или активации зависимых от каспаз программ апоптоза (Xie and Klionsky, 2007).
Следовательно, неясно, будет ли аутофагия усиливать химическую и иммунную резистентность меланомы вместо улучшения результатов лечения. Кроме того, ни один из более чем 20 генов аутофагии, описанных в настоящее время в клетках млекопитающих, не был охарактеризован подробно в случае меланомы. Вследствие этого, неизвестно, регулируется ли аутофагия различным образом в клетках меланомы и нормальных клетках, что могло бы обеспечить возможность для терапевтического вмешательства. Аналогичная ситуация имеет место в случае агрессивных видов рака, таких как те, что затрагивают поджелудочную железу, мочевой пузырь, предстательную железу и мозг.
В данной ситуации сохраняется потребность в выявлении терапевтических средств для лечения рака, альтернативных тем, которые уже официально применяются, и, в частности тех, которые подходят для лечения пациентов с ослабленным иммунитетом. Также остается необходимость в обнаружении возможных новых терапевтических мишеней для разработки методов идентификации терапевтических средств-кандидатов для лечения рака среди соединений, способных воздействовать на эти мишени.
Таким образом, настоящее изобретение предлагает решение для обеих проблем.
Описание изобретения
Как указано выше, настоящее изобретение прежде всего направлено на идентификацию терапевтических мишеней, маркеров или параметров, которые создают основу для разработки способа, полезного для идентификации соединений (среди тех, которые способны воздействовать на эти терапевтические мишени, маркеры или параметры), способных лечить рак.
Одним из маркеров, определенных в настоящем изобретении, который полезен для идентификации соединений, способных лечить рак, является уровень активации геликазы семейства MDA-5. Этот параметр можно определять, проверяя наличие протеолитического расщепления белка, которое приводит к разделению геликазных и каспазных доменов: для того, чтобы быть терапевтическим средством для лечения рака, соединение-кандидат должно приводить к протеолитическому расщеплению, что является свидетельством того, что оно может вызывать активацию аутофагии и механизмов апоптоза, приводящих к гибели раковых клеток. Возможной методикой данного теста является иммуноблоттинг (вестерн-блоттинг) белковых экстрактов культуры клеток и проверка сигнальных полос, соответствующих целому белку и фрагментам, соответствующим геликазным доменам и каспазным доменам. В частности, как показано в примере 3, появление полосы 30 кДа свидетельствует о наличии протеолитического расщепления. Альтернативно, это может также указывать на активацию других геликаз семейства MDA-5, таких как RIG-I или LGP2.
Другим маркером, определенным в настоящем изобретении, также полезным для идентификации соединений, способных лечить рак, является уровень экспрессии NOXA. Обоснованием является увеличение уровней экспрессии соответствующих генов, когда механизмы аутофагии и апоптоз активированы. Определение уровней экспрессии этих белков можно проводить, например, определяя концентрацию соответствующей матричной РНК (это можно осуществлять, например, методами нозерн-блоттинга или ОТ-ПЦР) или концентрацию самого белка в белковом экстракте соответствующей культуры клеток (например, посредством переноса, подобного вестерн-блоттингу). Кроме того, NOXA можно определять in situ (в образцах тканей) иммуногистохимическими методами.
В предпочтительном варианте осуществления настоящего изобретения определяют и MDA-5 и NOXA, как подтверждение того, что механизмы аутофагии и апоптоза активированы, поскольку MDA-5 считается связующим звеном между ними.
Кроме того, изобретение может включать стадию определения индукции аутофагии соединением-кандидатом, предназначенным для применения против рака. Индукцию аутофагии можно определять несколькими методами, которые включают:
• Мониторинг посттрансляционной модификации белка, экспрессированного геном 8 аутофагии (называемым ATG8 или LC3). Белок LC3 процессируется и липидируется при включении в аутофагосомы, которые представляют собой мембранные структуры, в которые клеточные компоненты захватываются в процессе аутофагии. Вследствие того, что конформация и электрофоретическая подвижность этого белка меняется при липидировании, одним из возможных методов для проверки индукции аутофагии является использование метода иммуноблоттинга с антителами, направленными против этого белка. Этот метод позволяет убедиться, что после проведения электрофореза полоса, соответствующая белку, отличается в контрольных образцах по сравнению с образцами, в которых, предположительно, соединение индуцировало аутофагию. Альтернативно, если антитело специфически узнает форму аутофагосом, связывание антитела подтвердит индукцию аутофагии в образце, обработанном соединением-кандидатом.
• Мониторинг изменений во внутриклеточном распределении белка LC3, поскольку другой отличительной чертой аутофагии является перемещение LC3 из цитозоля во вновь образованные аутофагосомы (Xie and Klionsky, 2007). Таким образом, образование белковых очагов можно считать показателем образования аутофагосом, особенно на ранних стадиях. Обнаружение можно проводить, контролируя эндогенный LC3 методами иммунофлуоресценции или иммунохимии на фиксированных клетках или фиксированных тканях. Альтернативно, аутофагию можно визуализировать в живых клетках, определяя клеточную локализацию флуоресцентного производного LC3. В качестве флуоресцентного белка принято использовать GFP (зеленый флуоресцентный белок) или RFP (красный флуоресцентный белок), которые позволяют отслеживать аутофагию с помощью флуоресцентной микроскопии: изменения клеточного распределения флуоресценции от диффузной картины к очаговому окрашиванию свидетельствуют об индукции аутофагии. В настоящем изобретении данная методика предполагает использование либо клеток, которые были трансфицированы вектором, делающим возможной временную экспрессию слитого белка (таким, как плазмида или рекомбинантный вирус), либо клеток, в которые фрагмент ДНК, способный экспрессировать слитый белок, образованный репортерным белком и LC3, интегрирован в геном стабильно. Пример такой стратегии приведен ниже в примере 1, когда клетки предварительно трансфицировали рекомбинантным ретровирусом. Это привело к вставке в клеточный геном фрагмента ДНК, содержащего вместе кодирующие части белков GFP и LC3, таким образом, что это приводит к образованию слитого белка в клеточной геномной ДНК. Таким образом, можно проводить тесты на изменения внутриклеточного распределения со стабильно трансфицированными клетками.
• Использование трансмиссионной электронной микроскопии для обнаружения проникновения соединения-кандидата в клетку. Эта ситуация управляет образованием аутофагосом на более поздних стадиях процесса аутофагии. Визуализации накопления плотных структур (связанных с мембраной) считается характерной особенностью образования аутофагосом. Процесс аутофагии можно подтверждать на более поздних стадиях процесса (то есть, через 24 или 30 часов после обработки тестируемым соединением), во время которых в электронный микроскоп можно увидеть образование крупных фагоцитарных вакуолей, свидетельствующих о гибели клеток.
Учитывая изложенное выше, первый вариант осуществления настоящего изобретения относится к способу (далее в данном документе называемому способом по изобретению) идентификации соединений, используемых для лечения рака, включающему стадии:
a) приведения соединения-кандидата в контакт с культурой раковых клеток или линией раковых клеток, происходящей из раковых клеток;
b) определения, по меньшей мере, одного из следующих параметров:
i. уровня активации геликазы семейства MDA-5;
ii. уровня экспрессии NOXA;
iii. либо их сочетание;
c) сравнения данных, полученных на стадии b), с данными, наблюдаемыми в контроле из тех же клеток, обработанных аналогичным образом, но в отсутствие соединения-кандидата;
d) выбора соединений, которые привели к значительному увеличению параметра или параметров, определенных в пункте b), по сравнению с контролем.
Следует отметить, что разница между данными, полученными от клеточной культуры, обработанной соединением-кандидатом, и от необработанного контроля, будет считаться статистически значимой, если при анализе получена величина p<0,05.
В предпочтительном варианте осуществления способ по изобретению также определяет, индуцирует ли соединение-кандидат аутофагию в раковых клетках, в клеточной линии, происходящей из раковых клеток, или на мышиной модели рака. Как объяснялось выше, определение индукции аутофагии можно проводить путем проверки уровня экспрессии, наличия посттрансляционной модификации или внутриклеточной локализации белка аутофагии. Более конкретно, индукцию аутофагии определяют методом, выбранным из: изменения электрофоретической подвижности белка LC3 или обнаружения образования очагов белка LC3. Альтернативно, индукцию аутофагии определяют путем проверки наличия аутофагосом с помощью микроскопического исследования, например, используя трансмиссионную электронную микроскопию.
В следующем предпочтительном варианте осуществления вышеописанный способ по изобретению включает три стадии: определение уровня активации MDA-5, уровня экспрессии NOXA и индукции аутофагии.
Способ по изобретению можно использовать для идентификации соединений, используемых в качестве терапевтических средств для лечения различных видов рака, например: меланомы, рака поджелудочной железы, толстой кишки, мочевого пузыря, молочной железы, предстательной железы, легкого и яичника.
Вследствие этого, если настоящее изобретение направлено на идентификацию соединений для применения в качестве терапевтических средств для лечения меланомы, то она будет включать следующие стадии:
a) приведение соединения-кандидата в контакт с культурой клеток меланомы или клеточной линией, полученной из клеток меланомы;
b) определение, по меньшей мере, одного из следующих параметров:
i. уровень активации геликазы семейства MDA-5;
ii. уровень экспрессии NOXA;
iii. либо их сочетание;
c) сравнение данных, полученных на стадии b), с данными, наблюдаемыми в контроле из тех же клеток, обработанных аналогичным образом, но в отсутствие соединения-кандидата;
d) выбор соединений, которые привели к значительному увеличению параметра или параметров, определенных в пункте b), по сравнению с контролем.
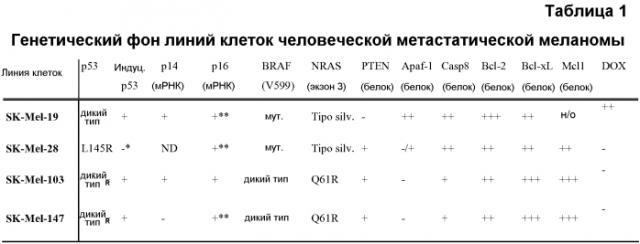
Что касается подходящих клеточных линий, то можно использовать любую линию клеток меланомы, предпочтительно человеческую. Примерами подходящих клеточных линий, используемых в примерах по изобретению, являются человеческие клеточные линии SK-Mel-19, SK-Mel-28, SK-Mel-103 и SK-Mel-147, а также мышиные клетки B16. Нормальными контрольными клетками являются меланоциты или другие клетки кожи, а также клетки иммунной системы, которые, как правило, представляют собой центры вторичной токсичности при лечении рака.
Альтернативно, способ по изобретению может быть направлен на идентификацию соединений для применения в качестве терапевтических средств для лечения, по меньшей мере, одного из следующих видов рака: карциномы поджелудочной железы, толстой кишки, мочевого пузыря, молочной железы, предстательной железы, легкого и яичника. В этом случае способ по изобретению будет включать следующие стадии:
a) приведение соединения-кандидата в контакт с культурой раковых клеток, по меньшей мере, одного из перечисленных выше видов рака, или клеточной линией, полученной из клеток, по меньшей мере, одного из перечисленных выше видов рака;
b) определение, по меньшей мере, одного из следующих параметров:
i. уровень активации геликазы семейства MDA-5;
ii. уровень экспрессии NOXA;
iii. либо их сочетание;
c) сравнение данных, полученных на стадии b), с данными, наблюдаемыми в контроле из тех же клеток, обработанных аналогичным образом, но в отсутствие соединения-кандидата;
d) выбор соединений, которые привели к значительному увеличению параметра или параметров, определенных в пункте b), по сравнению с контролем.
В этом случае клеточную линию будут выбирать из группы линий клеток рака поджелудочной железы: IMIMPC2, MiaPaCa2, Aspc1, A6L, SKPC1 и Panc-1; или из группы линий клеток рака толстой кишки: CACO, SW480 и SW1222; или из группы линий клеток рака мочевого пузыря: RT112, MGHu4, 639V, 253J, MGHu3 и SW1170; или из группы линий клеток глиомы: U87MG, U251 и T98G; или из группы линий клеток рака молочной железы: MDA231, MCF7 и T47D; или из группы линий клеток рака предстательной железы: LNCaP, PC3 и DU145; или из группы линий клеток рака легкого: H1299 и NCI H460; или из группы линий клеток рака яичника: NCI H23, CHQK1 и SK-OV-3.
Предпочтительный вариант осуществления способа по изобретению описан ниже в примерах изобретения. В таком случае способ по изобретению осуществляют, используя сочетание определения активации MDA-5, анализа генной экспрессии (наблюдение увеличения экспрессии NOXA) и подтверждения активации аутофагии тремя возможными методами, описанными ранее: мониторингом посттрансляционных модификаций белка LC3 при помощи иммуноблоттинга, отслеживанием изменений в клеточном распределении LC3 путем детекции флуоресценции за счет флуоресцентного белка GFP (с клетками, предварительно трансфицированными рекомбинантным ретровирусом, содержащим структуру, способную экспрессировать слитый белок GFP-LC3), подтверждением образования аутофагосом методом электронной трансмиссионной микроскопии через 5 часов обработки соединением-кандидатом и подтверждением наличия фагоцитарных вакуолей через 30 часов обработки.
Следует отметить, что описанный выше способ по изобретению позволяет идентифицировать новое соединение, представляющее собой сочетание двухцепочечной РНК (дсРНК) или ее аналога и поликатиона. В предпочтительном варианте осуществления изобретения указанное соединение представляет собой BO-110 (pICPEI), являющееся сочетанием полиинозин-полицитидиловой кислоты (pIC) и полиэтиленимина (PEI).
Как показано ниже в примерах и фигурах по настоящему изобретению, BO-110 можно эффективно применять для лечения различных видов рака, например: меланомы, рака поджелудочной железы, толстой кишки, мочевого пузыря, молочной железы, предстательной железы, легкого и яичника.
Вследствие этого, настоящее изобретение также относится к фармацевтической композиции, содержащей BO-110, для применения в лечении рака, например: меланомы, рака поджелудочной железы, толстой кишки, мочевого пузыря, молочной железы, предстательной железы, легкого и яичника. Эта фармацевтическая композиция также полезна для лечения пациентов с ослабленным иммунитетом.
Удивительно, но при функциональном взаимодействии pIC и PEI достигается синергетический технический эффект, в результате которого улучшается и изменяется сумма технических эффектов отдельных составляющих. Таким образом, BO-110 проникает в клетки и действует иным образом, чем его компоненты PEI и pIC. В частности, в то время как PEI не имеет заметного клеточного эффекта, а сигналы выделенной pIC временно вызывают иммунные ответы, которые в конечном счете не оказывают биологического воздействия in vivo, BO-110 обладает способностью избирательно уничтожать опухолевые клетки. Вследствие этого, BO-110 иллюстрирует концепцию синтетической летальности, описанной для генов или соединений, которые в виде отдельных веществ не имеют активности, однако в сочетании обладают отличающимся и терапевтически применимым противораковым эффектом.
Поэтому одним из наиболее важных пунктов настоящего изобретения является неожиданное открытие, что миметик вирусной дсРНК полиинозин-полицитидиловая кислота (pIC) меняет свой маршрут проникновения и доставки в опухолевые клетки. От стандартного узнавания TLR-3 (Toll-подобным рецептором 3), pIC может быть направлена на семейство сенсоров дсРНК (отличных от TLR3), если эта дсРНК объединена с семейством носителей, которые специфически делают возможной доставку в цитозоль. Такая активность изменяет механизм действия дсРНК от несущественного иммуномодулятора до масштабного убийцы опухолевых клеток. Противораковая активность была продемонстрирована с полиэтиленимином (PEI), а также с липофектамином, полифектом или суперфектом. Хотя эти носители сами по себе не были биологически активными в качестве терапевтических средств, в настоящем изобретении показано, что они способны защищать молекулу pIC, поддерживая ее в стабильной форме, что позволяет активировать аутофагию. Таким образом, сочетание дсРНК/поликатион, примером которого является BO-110, представляет собой новое молекулярное образование с противораковой активностью. Более того, механизм действия BO-110 оказался неожиданным. Это соединение способствует двойной индукции апоптоза и аутофагии, ведущих к скоординированному и избирательному уничтожению опухолевых клеток, в частности, но не исключительно, клеток меланомы, не влияя на жизнеспособность нормальных компартментов. Механизм апоптоза запускался при помощи белка NOXA. В отличие от других NOXA-индуцирующих химиотерапевтических средств, BO-110 не требует белка-супрессора опухолевого роста p53. Это является важным преимуществом, так как р53 мутирован, отсутствует или инактивирован в подавляющем большинстве раковых опухолей человека. Эффект явно превосходит классические ответы на «голую» вирусную РНК, что объясняет плохие результаты клинических исследований «голой» pIC в лечении меланомы.
Таким образом, BO-110, но не одиночная дсРНК, обладал способностью стимулировать саморазрушение раковых клеток и блокировать раковый метастаз in vivo, даже у мышей с ослабленным иммунитетом. Генетический, функциональный и ультраструктурный анализ, описанный далее в данном изобретении, показывает, что индукция аутофагии запускается pIC не для защиты клеток, а для избирательного уничтожения опухолевых клеток. В качестве дальнейшего подтверждения данных результатов, хотя pIC рассматривалась как индуктор иммунитета, контролируемого IFN, наблюдаемый эффект не зависит от активации пути для продукции и секреции IFN-α. В соответствии с этим наблюдением, активация пути аутофагии имеет место даже у животных с ослабленным иммунитетом. В совокупности, эти данные показывают, что BO-110 намечает и определяет новые точки приложения усилий для клинического использования собственных программ узнавания патогена, аутофагии и гибели опухолевых клеток.
Генетические и функциональные исследования определили эндогенную MDA-5 как связующее звено между путями аутофагии и апоптоза, обусловленными BO-110. Это также отличается от предыдущего раскрытия информации в отношении MDA-5, которое было ограничено апоптозной гибелью клеток, вызванной экзогенными компонентами. Также новым оказалось взаимодействие MDA-5/NOXA.
Таким образом, MDA-5 представлена в качестве подходящей терапевтической мишени для скрининга веществ для лечения рака с особенностью запуска самоуничтожения опухоли при помощи ауто/лизосомальных и характерных для апоптоза протеаз. Как упоминалось ранее, эта стратегия имеет преимущества по сравнению со стандартными терапевтическими средствами, которые задействуют любой из этих механизмов независимо.
Аналогично, образование, позволившее открыть данный путь, поскольку способно его активировать, представляет собой комплекс BO-110 или другие сочетания аналога дсРНК и катионного носителя. Вследствие этого, данные вещества являются хорошими кандидатами для применения в производстве лекарственных средств для лечения рака.
В данном изобретении термин «длинный фрагмент двухцепочечной РНК» используют в противоположность фрагментам РНК, известным как короткие РНК или интерферирующие РНК (киРНК). Вследствие этого, считается, что двухцепочечная РНК (дуплекс) является «длинной», если фрагмент двухцепочечной РНК содержит, по меньшей мере, 25 нуклеотидов в цепи. Предпочтительно, если используемый фрагмент равен по длине промежуточным продуктам двухцепочечной РНК, появляющимся в клетках в процессе клеточного цикла большинства РНК вирусов, которые, очевидно, являются естественным субстратом MDA-5 семейства геликаз, так что двухцепочечная РНК по изобретению считается «длинной», особенно, если она содержит, по меньшей мере, 100 нуклеотидов в цепи и, более конкретно, если она содержит, по меньшей мере, 1000 нуклеотидов в цепи.
Фрагменты двухцепочечной РНК, которые встречаются в природе и могут быть полезными для применения по изобретению, могут представлять собой промежуточные продукты двухцепочечной РНК, образующиеся в процессе клеточного цикла парамиксовируса (такого, как вирус болезни Ньюкасла, NDV, вирус Сендай (SDV)), рабдовируса (вирус везикулярного стоматита (VSV)); флавовируса (вирус гепатита C (HCV)), ортомиксовируса (вирус гриппа) и пикорнавируса (вирус миокардита мозга (EMCV).
Что же касается аналогов двухцепочечной РНК, помимо полиинозин-полицитидиловой кислоты (pIC), для изобретения могут быть полезными другие мимики дсРНК: a) те, скелет которых образован соединением, похожим на рибозу, например, те, которые основаны на LNA (закрытая нуклеиновая кислота: устойчивость к гидролизу), морфолино и ПНК (пептидная нуклеиновая кислота), b) те, в которых, по меньшей мере, одно из типичных азотистых оснований нуклеотидов РНК заменено аналогами, что также может приводить к отличающимся от естественных вариантам спаривания, таким как диаминопурин (который образует пару с урацилом за счет трех водородных связей), пара ксантин/диаминпиримидин (в которой форма кето/кето пурина, ксантин, образует три водородные связи с формой амин/амин пиримидина), или пара изогуанин/изоцитозин (в которой форма амин/кето пурина, изогуанин, образует три водородные связи с формой кето/амин пиримидина, изоцитозином).
Что касается поликатионного носителя, для целей изобретения подходящими являются все те, которые способны изменять проницаемость плазменной мембраны и/или индуцировать эндоцитоз, стимулируя проникновение в клетку двухцепочечной РНК или ее аналогов и высвобождая их в цитозоль, тем самым повышая активацию цитозольных сенсоров двухцепочечной РНК, таких как геликаза MDA-5. Помимо полиэтиленимина (PEI) и липофектамина, под это определение попадают поли-L-лизин, полисилазан, полидигидроимидазолиний, полиалиламин и этоксилированный полиэтиленимин (ePEI).
Далее изобретение иллюстрируется более подробно посредством примеров и фигур.
Краткое описание фигур
Фигура 1. Индукция макроаутофагии с помощью BO-110 приводит к гибели клеток меланомы
На панели A представлена визуализация с помощью эпифлуоресценции аутофагосома-подобного очагового окрашивания eGFP-LC3 в клетках меланомы SK-Mel-103, обработанных в течение 12 ч 1 мкг/мл pIC в комплексе с PEI (BO-110). Клетки, обработанные только PEI, приведены в качестве контроля.
На панели B представлено зависящее от времени накопление клеток SK-Mel-103, демонстрирующих точечную флуоресцентную эмиссию eGFP-LC3 при обработке BO-110 или контрольным плацебо. Рапамицин использовали в качестве классического индуктора аутофагии.
На панели C представлены иммуноблоты суммарных клеточных экстрактов, выделенных из клеток SK-Mel-103, обработанных, как указано. Способы обработки указаны над каждой полосой: контроль (без обработки: клеточные популяции инкубировали только в присутствии растворителя), обработанные pIC или BO-110 клетки. Проанализированные белки указаны в левой части панели: немодифицированный ATG8 (LC3 I), липидированный ATG8 (LC3 II) и контроль нагрузки (β-актин). В правой стороне панели указаны молекулярные веса, в кДа.
На панели D представлены электронные микрофотографии клеток SK-Mel-103, обработанных BO-110 или контролем PEI. Стрелки указывают на связанные с мембранами аутофагосомы и аутолизосомы.
На панели E представлены микрофотографии при сильном (верх) и слабом (низ) увеличении клеток SK-Mel-103 через 5 часов после инкубации с растворителем (левая колонка) или BO-110 (правая колонка).
На панели F представлены типичные микрофотографии в светлом поле (слева и в центре) и под электронным микроскопом (справа) клеточных колоний после 30 часов обработки, как показано на снимках.
Фигура 2. Микроскопия через временные интервалы индукции аутофагии с помощью BO-110 в клетках меланомы
Последовательность микрофотографий, полученных через указанные интервалы времени после обработки PEI (контроль) или BO-110 экспрессирующих eGFP-LC3 клеток меланомы SK-Mel-103. Очаговые агрегаты свидетельствуют об образовании аутофагосом. Стрелками отмечены разрушающиеся и открепляющиеся клетки (гибнущие клетки) в процессе обработки.
Фигура 3. Доставка в цитозоль pIC благодаря присутствию PEI избирательно вызывает гибель клеток меланомы
На панели A приведена диаграмма, на которой гибель клеток в процентном выражении, определенная в тесте на исключение трипанового синего, представлена через 24 и 48 часов обработки, как указано (NT: белые столбики, обработка PEI: темно-серые столбики, обработка pIC: светло-серые столбики, BO-110: черные столбики). Данные представлены в виде средних величин ± SEM из трех независимых экспериментов с различными клеточными линиями, указанными сверху над диаграммой. Как видно, только популяции клеток меланомы, обработанные BO-110, гибнут эффективно.
Панель B: микрофотографии под электронным микроскопом клеток SK-Mel-28 и SK-Mel-103, обработанных растворителем (контр.), PEI, pIC или BO-110, и визуализированные через 12 ч после обработки. Для каждой клеточной линии приведены фотографии, полученные при двух различных увеличениях. Стрелками отмечены аутолизосомы, наблюдаемые только в клетках, обработанных BO-110.
Фигура 4. Избирательная цитотоксическая активность BO-110 в отношении опухолевых клеток
На панели A представлены типичные изображения в светлом поле меланоцитов, выделенных из крайней плоти человека (верхний ряд), клеток меланомы человека SK-Mel-103 (средний ряд) и линии