Композиция, содержащая экстракт растений, для предотвращения или лечения нейродегенеративных нарушений
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к композиции для предотвращения или лечения нейродегенеративных нарушений. Фармацевтическая композиция для предотвращения или лечения нейродегенеративных нарушений, содержащая в качестве активного ингредиента смешанные растительные экстракты корневища Dioscorea batatas Decaisne, Dioscorea japonica Thunberg, или Dioscorea opposita Thunberg, и корневища Dioscorea nipponica, в определенном массовом отношении, и фармацевтически приемлемый носитель. Функциональный оздоровительный пищевой продукт для предотвращения или улучшения состояния нейродегенеративных нарушений, содержащая смешанные растительные экстракты корневища Dioscorea batatas Decaisne, Dioscorea japonica Thunberg, или Dioscorea opposita Thunberg, и корневища Dioscorea nipponica, в определенном массовом отношении. Вышеописанные средства эффективны для предотвращения или лечения или улучшения состояния нейродегенеративных нарушений. 2 н. и 5 з.п. ф-лы, 1 ил., 8 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей экстракт растений, для предотвращения или лечения нейродегенеративных нарушений, где композиция содержит Dioscorea Rhizoma и Dioscorea nipponica, смешанные в массовом отношении 3,5:1 (масс./масс.).
Благодарности
Эта работа получила поддержку в рамках программы Global Leading Technology департамента стратегических исследований и планирования развития (OSP), финансируемой Министерством инновационной экономики, республики Корея (№10039303).
Предшествующий уровень техники
Нейродегенеративные нарушения означают постепенную структурную и функциональную утрату нервных клеток (нейрона). Как правило, они поражают конкретный отдел нервной системы, сопровождая симптомами, такими как деменция, экстрапирамидное расстройство, мозжечковые нарушения, дисестезия или дискинезия. Комплексные симптомы можно выявлять при одновременном поражении различных отделов. Диагноз устанавливают по клиническим признакам у пациента. Однако в этом случае постановка диагноза является затруднительной, т.к. выявляют множественные симптомы, и различные заболевания имеют общие клинические признаки (Soc. Sci. Med., Vol. 40. No. 6, pp.847-585, 1995).
Признаки начала развития нейродегенеративных нарушений возникают постепенно и преимущественно появляются с возрастом. После начала нейродегенеративные нарушения прогрессируют в течение нескольких лет или десятилетий до момента смерти. Известно, что значительными являются генетические эффекты в соответствии с семейным анамнезом. В соответствии с клиническими симптомами дегенеративные нарушения классифицируют на паралитическую деменцию (болезнь Альцгеймера и т.д.), неврологическое нарушение (болезнь Пика и т.д.), нарушение позы и движений (болезнь Паркинсона и т.д.), прогрессирующую атаксию, мышечную атрофию и слабость и нарушения чувствительности и движения (International Journal of Engineering and Technology, Vol. 2, No. 4, August 2010, Classification of Neurodegenerative Disorders Based on Major Risk Factors Employing Machine Learning Techniques).
В 1980 гг. появились данные о том, что нейротрофические факторы обладают потенциалом для лечения нейродегенеративных нарушений, таких как экспериментальная болезнь Альцгеймера (Nature, 1987, Sep 3-9, 329 (6134): 65-8. Amelioration of cholinergic neuron atrophy and spatial memory impairment in aged rats by nerve growth factor). Потерю нейронов в базальных отделах переднего мозга, известную как болезнь Альцгеймера, восстанавливают введением фактора роста нервов (NGF) в боковой желудочек головного мозга. Вследствие того, что описывают улучшение памяти тестируемых животных, исследования в отношении лечения нейродегенеративных нарушений проводят с использованием нейротрофического фактора. Хорошим результатом также является то, что функция мотонейронов, повреждаемых нейротрофическим фактором головного мозга (BDNF), нейротрофином-3 (NT-3), нейротрофином-4 (NT-4) и цилиарным нейротрофическим фактором (CNTF) как семейство нейротрофических факторов, восстанавливается в исследовании после повреждения функции мотонейронов рассечением лицевых нервов и седалищных нервов при катамнестическом исследовании (Nature, 1992 Dec 24-31, 360(6406):757-9. Brain-derived neurotrophic factor prevents the death of motor neurons in newborn rats after nerve section). В эксперименте с использованием генно-рекомбинантных мышей ("танцующих"), которые страдали от потери мотонейронов и постепенно функций, функцию повышали введением BDNF и CNTF с увеличением числа мотонейронов (Science, 1994 Aug 19, 265 (5175):1107-10. Arrest of motor neuron disease in wobbler mice cotreated with CNTF and BDNF). Наряду с указанными экспериментами нейротрофические факторы увеличивают число нейронов и их функцию на модели патологии мотонейронов и различных чувств, таким образом, показано улучшение состояния нарушения в отношении памяти, восприятия и поведения у лабораторных животных.
На основании результатов доклинических экспериментов в 1990 гг. проводили испытания по применению нейротрофического фактора для лечения болезни Лу Герига. Болезнь Лу Герига представляет собой нейродегенеративное заболевание, при котором избирательно гибнут только мотонейроны, и которое приводит к гибели человека вследствие нарушения функции органов дыхания с параличом всего тела. BDNF вводили подкожно или субарахноидально, однако были выявлены боль в участке инъекции и побочный эффект со стороны пищеварительной системы. Таким образом, не оставалось выбора, как вводить меньшее количество BDNF, чем в доклиническом эксперименте. Вследствие этого регенерация и улучшение состояния мотонейрона и его функции имели минимальный эффект (Ехр. Neurol., 1993 Nov, 124 (1):64-72, Review. Experimental rationale for the therapeutic use of neurotrophins in amyotrophic lateral sclerosis). Аналогично, симптомы, такие как лихорадка, боль в участке инъекции или потеря аппетита, которые являлись наиболее тяжелыми неблагоприятными реакциями в случае введения BDNF, выявляли, когда CNTF инъецировали пациенту, страдающему болезнью Лу Герига, таким образом, CNTF вводили в ограниченном количестве. Вследствие этого регенерация и улучшение состояния мотонейрона и его функции являлись незначительными (Neurobiol. Aging, 1994 Mar-Apr, 15(2):249-51. Review Neurotrophic growth factors and neurodegerenative diseases: therapeutic potential of the neurotrophins and ciliary neurotrophic factor). В способе, в котором нейротрофический фактор, такой как BDNF, CNTF и т.д., в форме рекомбинантного белка достигает центральной и периферической нервной системы посредством инъекции in vivo, использовали ограниченное количество инъецируемого белка. В случае эксперимента, в котором проводили попытку лечения пациента с болезнью Альцгеймера с использованием NGF, невозможно было выявить значимого результата, вследствие наличия побочных эффектов, ограничения инъецируемого количества, доставки лекарственного средства и неясной фармакодинамики.
Несмотря на неутешительный результат клинического эксперимента, существует много экспериментальных данных, которые подтверждают возможность лечения нейродегенеративных нарушений с использованием нейротрофических факторов. Как правило, в случае болезни Хантингтона, симптомами которой являются аномальные движения, изменения личности, снижение когнитивной способности и ранняя смерть, обусловленными увеличением поли-Q в белке хантингтине, во многих исследованиях BDNF отмечали как основную мишень аномального белка хантингтина. Эту теорию подтверждало снижение количества BDNF в стриатуме лабораторных животных с патологией и пациента с болезнью Хантингтона (Science, 2001 Jul 20, 293 (5529):493-8, Epub 2001 Jun 4, Loss of Huntington-mediated BDNF gene transcription in Huntington's disease).
Кроме того, когда выбирали способ введения нейротрофического фактора подкожно или субарахноидально in vivo в форме рекомбинантного белка для лечения нейродегенеративных нарушений, так же как и в существующем способе вследствие побочного эффекта повторяли уменьшение количества введения, и повторялось уменьшение его эффекта. Таким образом, в 2000 гг. проводили исследования усилителя нейротрофического фактора, который представляет собой опосредованный способ увеличения количества нейротрофического фактора, биосинтезируемого in vivo (Hum. Gene Ther., 1999, Dec. 10, 10(18):2987-97, Brain-derived neurotrophic factor-mediated protection of striatal neurons in an excitotoxic rat model of Huntington's disease, as demonstrated by adenoviral gene transfer).
Dioscorea Rhizoma, растение, принадлежащее к Dioscoreaceae, представляет собой термин для свежего корневища Dioscorea batatas Decaisne или Dioscorea japonica Thunberg, лишенного перидермы, или для корневища, получаемого после того, как свежее корневище пропарили и высушили в лекарственное средство из растительного сырья. Оно широко распространено в Корее, Китае и Японии и использовалось в качестве лекарственного средства. Оно обладает лечебными действиями в отношении тонизирующего питания, нарушения пищеварения, диабета, кашля, легочного заболевания, усиления функции почек и т.д., и часто не выявляет токсичность и побочные эффекты. Кроме того, Dioscorea nipponica представляет собой корневище Dioscorea nipponica Makino, вьющегося многолетнего растения Dioscoreaceae. Оно широко распространено в Корее, Китае и Японии и использовалось в качестве лекарственного средства. Оно оказывает действие в отношении лучшей циркуляции крови, расслабления мышц, устранения несварения, keeping ones urine open, удаления мокроты и предотвращения приступов малярии, и часто не выявляет токсичность и побочные эффекты.
В патенте Кореи №854621 описана композиция для предотвращения и лечения периферической нейропатии, содержащая экстракт из растения, выбранного из числа Dioscorea nipponica, Dioscorea quinqueoloba, Dioscorea batatas, Dioscorea japonica и Dioscorea tokora, в котором описано, что композиция индуцирует рост нейритов и повышает секрецию эндогенного фактора роста нервов, таким образом являясь эффективной для предотвращения или лечения периферической нейропатии.
Авторы настоящего изобретения подтвердили, что действием экстракта из растения, выбранного из числа Dioscorea nipponica, Dioscorea quinquoloba, Dioscorea batatas, Dioscorea japonica и Dioscorea tokora, являлась индукция значительного роста нейритов и увеличение секреции эндогенного NGF, как описано в патенте Кореи №854621. На основании этого осуществили настоящее изобретение после выявления, что Dioscorea Rhizoma и Dioscorea nipponica в выбранном конкретном отношении проявляют очень выраженный синергизм, несмотря на то что каждые указанные растения или их смешанные растительные экстракты неожиданно индуцируют почти аналогичный рост нейритов, а также увеличивают секрецию эндогенного фактора роста нервов при исследовании растительного экстракта, который обладает эффектом в отношении пролиферации нейрональных клеток, активации образования нейритов и повышения когнитивных способностей, увеличивая содержания фактора роста нервов у лабораторных животных in vivo.
Описание изобретения
Техническая проблема
Таким образом, целью настоящего изобретения является предоставление необязательной растительной композиции, которая проявляет синергизм в отношении увеличения когнитивных способностей посредством увеличения пролиферации нейрональных клеток и активации образования нейритов после стимуляции продукции и секреции факторов роста нервов, из растений, описанных в патенте Кореи №854621, увеличения регенерации и предотвращения апоптоза нейронов.
Другой целью настоящего изобретения является предоставление фармацевтической композиции и функциональных оздоровительных пищевых продуктов для предотвращения или лечения нейродегенеративных нарушений, содержащих в качестве активного ингредиента указанную растительную композицию.
Решение проблемы
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтической композиции и функциональным оздоровительным пищевым продуктам для предотвращения или лечения нейродегенеративных нарушений, содержащим смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.).
Далее в настоящем описании более подробно описано настоящее изобретение.
Настоящее изобретение относится к фармацевтическому препарату для предотвращения или лечения нейродегенеративных нарушений, содержащему смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.).
Смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.) от общей массы представляет собой неочищенный экстракт, который представляет собой экстракт, предпочтительно экстрагированный 50% этанолом.
Экстракты Dioscorea Rhizoma и Dioscorea nipponica можно получать, как указано ниже. Сначала подготавливали растения, нарезая сухие растения после промывания и сушки Dioscorea Rhizoma и Dioscorea nipponica, соответственно. Затем смешанные растительные экстракты Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.) можно получать концентрированием при пониженном давлении после однократной холодной экстракции в течение 48 часов при комнатной температуре 50% этанолом массой в 5 раз больше, чем общая масса указанных нарезанных растений.
Настоящее изобретение относится к применению растительных экстрактов, смешанных с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.), для получения фармацевтической композиции для предотвращения или лечения нейродегенеративных нарушений.
Примеры нейродегенеративных нарушений по настоящему изобретению включают болезнь Альцгеймера, болезнь Крейтцфельдта-Якоба, болезнь Хантингтона, рассеянный склероз, синдром Гийена-Барре, болезнь Паркинсона, болезнь Лу Герига, паралитическую деменцию, вызываемую постепенной гибелью нервных клеток, и заболевания, обусловленные прогрессирующим недержанием.
По настоящему изобретению фармацевтический препарат для предотвращения или лечения нейродегенеративные нарушения можно формулировать добавлением фармацевтически приемлемого носителя, разбавителя или разбавляющего средства к смешанным растительным экстрактам Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.).
Растительные экстракты, необходимые для составления фармацевтического препарата по настоящему изобретению, содержат от 0,01 до 80% указанных экстрактов, предпочтительно от 1 до 50% масс. от общей массы.
Носитель, разбавитель или разбавляющее средство, которое можно вводить в композицию по настоящему изобретению, может представлять собой лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритритол, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния или минеральное масло.
Кроме того, композицию по настоящему изобретению можно формулировать и применять общепринятым способом в формах перорального средства, такого как порошок, гранулы, таблетки, капсулы, суспензия, эмульсия, сироп или аэрозоль, препарата для наружного применения, суппозитория или стерильного инъекционного раствора.
Конкретно, фармацевтический препарат можно получать с использованием разбавителей или разбавляющих средств, таких как фильтр, наполнитель, связывающее средство, увлажнитель, дезинтегрирующее средство или поверхностно-активное вещество, которые широко используются. Твердый фармацевтический препарат для перорального введения включает таблетки, пилюли, порошок, гранулы и капсулы. Твердый фармацевтический препарат можно формулировать, добавляя по меньшей мере одно или более разбавляющих средств, таких как крахмал, карбонат кальция, сахароза, лактоза или желатин, к указанной смеси растений. Кроме того, кроме указанных разбавляющих средств можно добавлять смазочные средства, такие как стеарат магния или тальк. Жидкий фармацевтический препарат включает суспензию, жидкое лекарственное средство для внутреннего применения, эмульсию или сироп. Он может содержать различные разбавляющие средства, такие как увлажнитель, подсластитель, освежитель воздуха или консервирующее средство наряду с простыми разбавителями, такими как вода и парафиновое масло, которые широко используются. Фармацевтический препарат для парентерального введения включает стерильный раствор, неводный растворитель, суспензию, эмульсию, лиофилизированное средство или суппозиторий. Для неводного растворителя или суспензии можно использовать пропилгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, или инъецируемый сложный эфир, такой как этилолат. Для суппозитория можно использовать витепсол, полиэтиленгликоль, Tween 61, масло какао, лауриновое масло или глицерин-желатин.
По другому аспекту настоящее изобретение относится к способу лечения нейродегенеративных нарушений, где фармацевтическую композицию, содержащую в качестве активного ингредиента растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, вводят в фармацевтически активном количестве млекопитающим, включая человека.
Дозирование фармацевтической композиции, содержащей растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, зависит от возраста, пола и массы пациента, однако ее можно вводить в количестве от 0,01 до 10 г/кг, предпочтительно 1 до 5 г/кг, которое вводят один раз в сутки или раздельными дозами несколько раз в сутки. Также дозирование можно увеличивать или уменьшать в зависимости от пути введения, степени заболевания, пола, массы, возраста, состояния здоровья, рациона питания, времени инъекции, способа инъекции или скорости экскреции. Таким образом, не подразумевается, что дозирование каким-либо образом ограничивает объем настоящего изобретения.
Фармацевтическую композицию, содержащую растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1 (масс./масс.), по настоящему изобретению можно вводить млекопитающим, таким как крысы, мыши, крупный рогатый скот или человек, различными путями. Могут быть предусмотрены все пути введения, например пероральный, ректальный или внутривенные, внутримышечные, подкожные, внутриматочные или интрацеребровентрикулярные инъекции.
Растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, по настоящему изобретению практически никогда не обладают токсичностью или побочными эффектами, таким образом, прием дозы в течение длительного периода времени с целью предотвращения является безопасным.
Авторы изобретения исследовали эффекты на пролиферацию нейрональных клеток, активацию образования нейритов и увеличение когнитивных способностей путем увеличения количества факторов роста нервов у лабораторных животных с использованием растительных экстрактов, смешанных с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1. Затем авторы выявили значительный синергизм по сравнению с одним экстрактом Dioscorea Rhizoma и Dioscorea nipponica и другим их отношением путем испытаний на модели на лабораторных животных или клетках.
Кроме того, настоящее изобретение относится к функциональным оздоровительным пищевым продуктам для предотвращения или улучшения состояния нейродегенеративных нарушений.
В рамках изобретения термин "функциональные оздоровительные пищевые продукты" предназначен включать такие продукты, как определенные в "2002 Law for health functional foods", такие как диетические пищевые продукты, встречающиеся в списке установленных веществ или ингредиентов для функциональных оздоровительных пищевых продуктов, верифицированных в отношении функциональности и безопасности для людей, в соответствии со статьей KFDA №2004-12 Управления по контролю качества продуктов и лекарств Кореи.
Более конкретно, настоящее изобретение относится к функциональным оздоровительным пищевым продуктам для предотвращения или улучшения состояния нейродегенеративных нарушений, содержащим растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, и ситологически приемлемую пищевую добавку.
Композицию, содержащую растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, можно применять для лекарственных средств, пищевых продуктов и напитков для уменьшения симптомов нейродегенеративных нарушений. Например, пищевые продукты, к которым можно добавлять растительный экстракт по настоящему изобретению, включают напитки, жевательную резинку, чаи, витаминные комплексы и пищевые добавки. Для применения в лекарственных средствах растительный экстракт может находиться в форме пилюль, порошков, гранул, таблеток, капсул или жидкостей.
Когда применяют для твердых пищевых продуктов, растительный экстракт по настоящему изобретению можно использовать в количестве пищевого продукта от 0,1 до 15% масс. от общей массы пищевого продукта и предпочтительно в количестве от 0,2 до 10% масс. В жидкой форме диетического пищевого продукта растительный экстракт по настоящему изобретению может находиться в количестве в диапазоне от 0,1 до 30 г на 100 мл жидкости и предпочтительно от 0,2 до 5 г.
За исключением конкретного отношения, указанного для нежелательных ингредиентов растений, не предусматривают конкретных ограничений для жидкой композиции диетического пищевого продукта. Как характерные напитки, жидкая композиция диетического пищевого продукта может дополнительно содержать различные ароматизаторы, природные углеводы или другие добавки.
Предпочтительные примеры природных углеводов включают моносахариды, такие как глюкоза, фруктоза и т.д., дисахариды, такие как мальтоза, сахароза и т.д., полисахариды, такие как декстрин, циклодекстрин и т.д., и сахарные спирты, такие как ксилит, сорбит, эритритол и т.д. Пригодные в настоящем изобретении ароматизаторы могут быть природными (тауматин, экстракт стевии, например, ребаудиозид А, глициризин) или синтетическими (сахарин, аспартам). Природные углеводы можно использовать в количестве приблизительно от 1 до 20 г на 100 мл жидкой композиции диетического пищевого продукта и предпочтительно в количестве приблизительно от 5 до 12 г.
Кроме того, композиция по настоящему изобретению может содержать различные питательные вещества, витамины, минералы (электролиты), синтетические и/или природные ароматизаторы, красители, наполнители (сыр, шоколад и т.д.), пектиновую кислоту и ее соли, альгиновую кислоту и ее соли, органические кислоты, защитные коллоидные загустители, регуляторы pH, стабилизаторы, консерванты, глицерин, спирты и карбонизирующие средства для карбонатных напитков. Для применения в натуральном фруктовом соке, напитках на основе натуральных фруктовых соков или овощных напитках, композиция по настоящему изобретению может дополнительно содержать мякоть фруктов. Эти добавки можно использовать отдельно или в сочетании. Как правило, но необязательно, количества добавок находятся в порядке от 0 до 20 массовых частей на 100 массовых частей композиции.
Полезные эффекты изобретения
Растительные экстракты, смешанные с Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, обладают синергическим действием в отношении увеличения количества фактора роста нервов (NGF) in vivo, увеличения пролиферация нейрональных клеток, активации образования нейритов и увеличения когнитивных способностей. Таким образом, растительные экстракты по настоящему изобретению можно использовать для фармацевтической композиции и диетического пищевого продукта для предотвращения или улучшения состояния нейродегенеративных нарушений.
Краткое описание чертежей
Фигура 1 представляет собой фотоснимок гиппокампальной области ткани головного мозга, иллюстрирующий результат оценки эффекта секреции фактора роста нервов с использованием иммуногистохимии для NGF в соответствии с примером 1.
Способ осуществления изобретения
Настоящее изобретение далее описано более подробно посредством примеров. Специалистам в данной области будет очевидно, что предполагают, что эти примеры являются в большей степени конкретно иллюстративными, и объем настоящего изобретения, как установлено в прилагаемой формуле изобретения, не ограничен примером или посредством примера.
Пример 1. Получение смешанных растительных экстрактов Dioscorea Rhizoma и Dioscorea nipponica
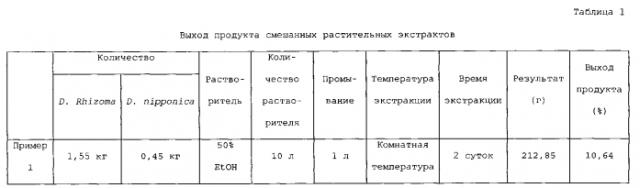
Dioscorea Rhizoma и Dioscorea nipponica в сухом состоянии приобретали в магазине лекарственных трав на рынке Kyoungdong, Корея. Затем из них удаляли примеси, растения измельчали с использованием устройства для нарезания и смешивали в массовом отношении Dioscorea Rhizoma:Dioscorea nipponica 3,5:1. К 2 кг смеси добавляли 10 л 50% раствора этанола с последующей инкубацией при комнатной температуре в течение 48 часов при перемешивании. Смесь растений удаляли фильтрованием и концентрировали фильтрат в вакууме и сушили сублимацией с получением смешанного растительного экстракта (неочищенного экстракта) (см. таблицу 1).
Сравнительные примеры 1 и 2. Получение неочищенных растительных экстрактов
1. Получение неочищенного экстракта Dioscorea Rhizoma
2 кг той же самой Dioscorea Rhizoma, используемой в примере 1, и перемешанных 2 кг той же самой Dioscorea Rhizoma, используемой в примере 1 и перемешанной с 10 л раствора 50% этанола, добавляли в течение 48 часов при комнатной температуре. В дальнейшем получали экстракт неочищенного экстракта Dioscorea Rhizoma посредством лиофилизации после экстракции, фильтрации и концентрирования при пониженном давлении (см. таблицу 2)
2. Получение неочищенного экстракта Dioscorea nipponica
10 л 50% раствора этанола добавляли к 2 кг той же самой Dioscorea nipponica, используемой в примере 1, и перемешивали в течение 48 часов при комнатной температуре. В дальнейшем получали экстракт Dioscorea nipponnica (неочищенный экстракт) посредством лиофилизации после экстракции, фильтрования и концентрирования при пониженном давлении (см. таблицу 3)
Сравнительные примеры 3-10. Получение смешанного растительного экстракта Dioscorea Rhizoma и Dioscorea nipponica
Использовали аналогичные растения Dioscorea Rhizoma и Dioscorea nipponica, как используют в примере 1. Dioscorea Rhizoma и Dioscorea nipponica измельчали с использованием устройства для нарезания и смешивали в массовых отношениях, указанных в таблице 4. К 2 кг каждой смеси добавляли 10 л 50% раствора этанола с последующей инкубацией при комнатной температуре в течение 48 часов при перемешивании. Смеси растений удаляли фильтрованием и концентрировали фильтрат в вакууме, и сушили сублимацией с получением смешанных растительных экстрактов (неочищенных экстрактов) (см. таблицу 4)
Экспериментальный пример 1. Эффект растительных экстрактов в отношении увеличения секреции фактора роста нервов
Эффекты в отношении увеличения и усиления секреции NGF примера 1 определяли с использованием клеток С6 глиомы, клеточной линии нейроглиомы крысы, продуцирующей NGF. Сравнительные примеры 1-10 представляли собой контрольные группы этого эксперимента.
Клетки С6 культивировали в 24-луночных планшетах для клеточных культур со средой DMEM (с добавлением 5% FBS, 2 мМ L-глутамина, 10 мМ HEPES, 1 мМ пирувата натрия, 50 мкг стрептомицина, 100 Ед/мл пенициллина) при 37°C и 5% CO2. После доведения культивируемых клеток до концентраций 2×105 клеток/лунку пример 1, сравнительные примеры 1-10 обрабатывали 100, 250 и 500 мкг/мл. В аналогичных условиях культивирования клетки культивировали в течение 2 суток, а затем измеряли концентрацию NGF в среде с использованием ELISA (см. таблицу 5)
Как продемонстрировано в таблице 5, концентрация NGF увеличивалась в соответствии с концентрацией Dioscorea Rhizoma и Dioscorea nipponica. Также показано, что концентрация NGF в Dioscorea Rhizoma (сравнительном примере 1) являлась в большей степени повышенной, чем в Dioscorea nipponica (сравнительном примере 2), таким образом, для первого показан более достоверный эффект.
Несмотря на то что в примере 1 [D. Rhizoma: D. nipponica=155:45) концентрацию Dioscorea Rhizoma инъецировали на 25% меньше, чем в сравнительном примере 1 (D. Rhizoma 200), содержание NGF повышалось от 8,9 до 15,5% при аналогичной концентрации.
Кроме того, концентрация NGF в примере 1 являлась в большей степени повышенной приблизительно от 4,2 до 16,4%, чем в сравнительном примере 5 (D. Rhizoma: D. nipponica=167:33, 5:1), в котором Dioscorea Rhizoma инъецировали на 7,7% больше, и она являлась в большей степени повышенной от 8,9 до 16,4%, чем в сравнительном примере 6 (D. Rhizoma:D. nipponica=182:18, 10:1), в котором Dioscorea Rhizoma инъецировали на 17,4% больше. Количество NGF в примере 1 являлось в большей степени повышенным приблизительно от 4,4 до 12,9%, чем в сравнительном примере 4 (D. Rhizoma:D. nipponica=133:67, 2:1), в котором Dioscorea Rhizoma инъецировали на 14,2% меньше. Продемонстрировано значительное увеличение содержания NGF, чем в других сравнительных примерах.
Таким образом, выявлено, что фармацевтическая композиция по настоящему изобретению, содержащая смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, может эффективно увеличивать концентрацию NGF по сравнению с другим отношением смеси. Таким образом, ее можно использовать при лечении или предотвращении нейродегенеративных нарушений.
Далее в настоящем описании проводили сравнительное испытание эффектов увеличения в отношении клеточной пролиферации, образования нейритов и когнитивных способностей в зависимости от содержаний NGF в растительных экстрактах Dioscorea Rhizoma и Dioscorea nipponica. Таким образом, рассматривают пригодность для предотвращения или лечения нейродегенеративных нарушений.
Экспериментальный пример 2. Эффект растительных экстрактов в отношении улучшения когнитивных способностей
Мышей ICR (самцов, в возрасте 6 недель, 25-28 г), предоставленных от Daehan Biolink (Chungbuk, Korea), использовали через 7 суток после содержания и адаптации в чистой клетке в фармакологическом колледже университета Киенг Хи (Kyunghee). Мышей не ограничивали в корме (Daehan Biolink, Chungbuk, Korea) и воде. Температуру (22±2°C), влажность (53±3%) и цикл день и ночь (12 часов) контролировали автоматически.
В каждую группу распределяли по 10 мышей. Мышам в контрольной группе вводили перорально физиологический раствор 5 мл на кг массы. Мышам в группе, получающей обработку, вводили перорально 10, 100 мг/кг примера 1, сравнительных примеров 1-10, соответственно, растворенных в физиологическом растворе. Пероральное введение проводили один раз в сутки и через 1 час после последнего перорального введения проводили тест пассивного избегания, как указано ниже.
Тест пассивного избегания проводили в модифицированном ящике с двумя, соединяющимися (7×7 см раздвижная дверца, встроенная в разделяющую стенку) отделениями равного размера, и использовали решетчатый пол из нержавеющей стали. Отделение правого рукава (шоковое отделение) было окрашено в черный цвет для получения темной камеры. Отделение левого рукава освещали лампой (24 В, 5 Вт), установленной на крышке из оргстекла. На первые сутки свет включали в светлой комнате и выключали в темной комнате. И авторы изобретения открывали гильотинную дверцу после того, как мыши оставались в светлой комнате в течение 10 секунд, затем измеряли время до момента, пока мыши не заходили в темную комнату. Когда мыши заходили в темную комнату, гильотинную дверцу закрывали и проводили 0,3 мА электростимуляцию в течение 3 секунд. Через 24 часа проводили тест пассивного избегания аналогичным способом и определяли латентное время пребывания в светлой комнате. Результаты приведены в таблице 6.
Как продемонстрировано в таблице 6, сохранение латентного периода в группе введения Dioscorea Rhizoma являлось увеличенным по сравнению с сохранением латентного периода группы введения Dioscorea nipponica, увеличенное сохранение латентного периода примера 1 (D. Rhizoma: D. nipponica=155:45) от 8,9 до 22,2% по сравнению со сравнительным примером 1 (D. Rhizoma 200), хотя в примере 1 вводили на 25% меньше Dioscorea Rhizoma, чем в сравнительном примере 1 (D. Rhizoma 200).
Также в примере 1 сохранение латентного периода являлось увеличенным от 4,2 до 19% по сравнению со сравнительным примером 5 (D. Rhizoma: D. nipponica=161:33, 5:1), в котором Dioscorea Rhizoma инъецировали на 7,7% больше, и оно являлось в большей степени увеличенным от 7,3 до 2 5,6% по сравнению со сравнительным примером 6 (D. Rhizoma: D. nipponica=182:18, 10:1), в котором Dioscorea Rhizoma инъецировали на 17,4% больше. Сохранение латентного периода в примере 1 являлось увеличенным от 8,9 до 19% по сравнению со сравнительным примером 4 (D. Rhizoma: D. nipponica=133:67, 2:1), в котором Dioscorea Rhizoma инъецировали на 14,2% меньше. Это демонстрирует, что память являлась значительно увеличенной по сравнению со сравнительными примерами.
Таким образом, было выявлено, что фармацевтическая композиция по настоящему изобретению, содержащая смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, оказывает действие в отношении улучшения когнитивных способностей по сравнению с другим отношением смеси.
Экспериментальный пример 3. Эффект растительных экстрактов в отношении увеличения образования нейронов
После проведения теста экспериментального примера 2 у мышей из каждой группы выделяли гиппокамп. После осушения выделенного гиппокампа пероксидом водорода проводили реакцию с 5-бром-2-дезоксиуридином (BrdU, Santa Cruz, от крысы 1:500) в качестве первого антитела в течение одной ночи. А затем в качестве второго антитела использовали биотинилированные антитела против крысы (Vector, от козы) и проводили окрашивание с использованием диаминобензидина после реагирования с ABC (набор ABC, Vector). Эффект в отношении увеличения образования нервных клеток определяли подсчетом BrdU-положительных клеток в области зубчатой извилины в гиппокампе. Результаты представлены в таблице 7.
Как показано в таблице 7, для Dioscorea Rhizoma (пример 1) продемонстрировали увеличение числа BrdU-положительных клеток по сравнению с Dioscorea nipponica (сравнительный пример 2) при подсчете BrdU-положительных клеток в области зубчатой извилины в гиппокампе. Хотя в примере 1 количество Dioscorea Rhizoma инъецировали на 25% меньше, чем в сравнительном примере 1, число BrdU-положительных клеток являлось повышенным приблизительно на 25%.
Кроме того, число BrdU-положительных клеток являлось повышенным приблизительно на 25% в примере 1 по сравнению со сравнительным примером 5, в котором Dioscorea Rhizoma инъецировали на 7,7% больше, чем в примере 1, и сравнительным примером 6, в котором Dioscorea Rhizoma инъецировали на 17,4% больше, чем в примере 1. Число BrdU-положительных клеток являлось повышенным приблизительно на 20% в примере 1 по сравнению со сравнительным примером 4, в котором Dioscorea Rhizoma инъецировали на 14,2% меньше, чем в примере 1. Это демонстрировало значительное увеличение числа BrdU-положительных клеток по сравнению с другими сравнительными примерами.
Таким образом, выявлено, что фармацевтическая композиция по настоящему изобретению, содержащая смешанный экстракт Dioscorea Rhizoma и Dioscorea nipponica в массовом отношении 3,5:1, оказывает действие в отношении увеличения образования нервных клеток в области зубчатой извилины по сравнению с другим отношением смеси.
Экспериментальный пример 4. Эффект растительных экстрактов в отношении дифференцировки нервных клеток и усиления роста нейритов
После проведения теста экспериментального примера 2 у мышей из каждой группы выделяли гиппокамп. После осушения выделенного гиппокампа пероксидом водорода проводили реакцию с даблкортином (DCX, Santa Cruz, от козы 1:500) в качестве первого антитела в течение одной ночи. А затем в качестве второго антитела использовали биотинилированные антитела против козы (Vector, от лошади) и проводили окрашивание с использованием диаминобензидина после реагирования ABC (набор ABC, Vector). Эффект в отношении клеточной дифференцировки и усиления роста нейритов определяли подсчетом DCX-положительных клеток в области зубчатой извилины в гиппокампе. Результаты представлены в таблице 8.
Как представлено в таблице 8, в области зубчатой извилины в гиппокампе для Dioscorea Rhizoma (пример 1) продемонстрировали увеличение числа DCX-положительных клеток и длины DCX-положительных нейритов по сравнению с Dioscorea nipponica (сравнительный пример 2). Хотя в примере 1 количество Dioscorea Rhizoma инъецировали на 25% меньше, чем в сравнительном примере 1, количество DCX-положительных клеток и длина DCX-положительных нейритов являлась увеличенной приблизительно на 25-40% и 1,6-17,3%, соответственно.
Кроме того, количество DCX-положительных клеток и длина DCX-положительных нейритов являлись увеличенными приблизительно на 18-27% и 3,3-9,2%, соответственно, в примере 1 по сравнению со сравнительным примером 5 (Dioscorea Rhizoma инъецировали на 7,7% больше, чем в примере 1). Число DCX-положительных клеток и длина DCX-положительных нейритов являлись увеличенными приблизительно на 22,8-32,6% и 3,3-10%, соответственно, в примере 1 по сравнению со сравнительным примером 6 (Dioscorea Rhizoma инъецировали на 17,4% больше, чем в примере 1). Количество DCX-положительных клеток и длина DCX-положительных нейритов являлись увеличенными приблизительно на 20-30% и 1-8%, соответственно, в примере 1 по сравнению со сравнительным примером 4 (Dioscorea Rhizoma инъецировали на 14,2% меньше, чем в примере 1). Это демонстрировало значительно увеличенное число DCX-положительных клеток и длины DCX-положительных нейритов по сравнению с другими сравнительными примерами.
Таким образом, выявлено, что фармацевтическая композиция по настоящему изобретению, содержащая смешанный экстракт Dioscorea Rhizoma и Dioscorea nipp