Способ проведения иммунохроматографического анализа, основанный на обратимой иммобилизации иммунореагентов в магнитном поле
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу проведения иммунохроматографического анализа. Способ включает регистрацию окрашенных коллоидным маркером специфических комплексов антиген-антитело на поверхности рабочей мембраны. Используют обратимую иммобилизацию иммунореагентов в аналитических зонах рабочей мембраны, для чего иммуноспецифические реагенты конъюгируют с магнитными наноразмерными носителями и удерживают в аналитических зонах наложением магнитного поля, что дает возможность снять ограничения по иммобилизации реагентов на рабочих мембранах и проводить специфическую реакцию вне тест-полоски. Предложенное изобретение позволяет обеспечить наилучшее детектирование и оценку результата, а также повысить чувствительность метода. 2 ил., 1 табл., 1 пр.
Реферат
Иммунохроматографический анализ нашел широкое распространение в различных областях медицины (тест-системы на антигены ряда патогенов и маркеры заболеваний), контроля качества пищевых и кормовых продуктов (тест-системы на микотоксины, антибиотики, пестициды), в решении ряда социальных проблем (определение наркотических соединений). Данный подход используется для анализа широкого круга антигенов различной природы (Koppen, R., М. Koch, et al. (2010). "Determination of mycotoxins in foods: current state of analytical methods and limitations." Applied Microbiology and Biotechnology 86(6):1595-1612; Maragos, С.M. and M. Busman (2010). "Rapid and advanced tools for mycotoxin analysis: a review." Food Additives and Contaminants: Part A 27(5): 688-700; Meulenberg, E. P. (2012). "Immunochemical methods for ochratoxin A detection: a review." Toxins 4(4): 244-266; Ngom, В., Y. Guo, et al. (2010). "Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants: a review." Analytical and Bioanalytical Chemistry 397(3): 1113-1135).
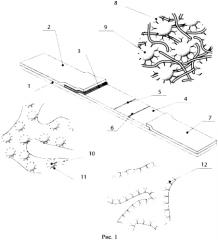
Типичная иммунохроматографическая тест-система представляет собой мультимембранный композит с предварительно нанесенными реагентами (Рис. 1 А.Е. Урусов, С.Н. Костенко, П.Г. Свешников, А.В. Жердев, Б.Б. Дзантиев. Журнал аналитической химии. 2011, Том 66, №8, С.884-890). На поверхности рабочей мембраны иммобилизованы иммунореагенты (антитела либо антигены), отвечающие за формирование окрашенных контрольной и аналитических зон. Однако процесс иммобилизации иммунореагентов ограничен по объему реагентов, чувствителен к внешним факторам (природе и структуре реагента, присутствия примесей, среды и температурного режима иммобилизации). Сам анализ протекает исключительно на поверхности тест-полоски, из-за чего лимитирован как по объему реагентов (обычно менее 100 мкл), так и по времени взаимодействия.
Нами было предложено использовать схему иммобилизации специфических реагентов за счет магнитных наночастиц. Это позволит легко и точно задавать необходимую концентрацию целевых соединений в контрольной и аналитических зонах, не зависимую от условий иммобилизации и природы иммунореагентов. При этом не используется какое-либо специальное оборудование, кроме постоянного магнита (добавление которого несильно отразится на стоимости готового продукта). Использование магнитных носителей дает возможность проводить анализ вне тест-полоски, а за счет магнитного концентрирования задействовать большие объемы пробы. Отсутствие модификации поверхности мембраны дает возможность ее неоднократного использования.
Аналогом подобного решения может быть аналитическая система на основе микрофлюидики, когда на стадии специфического взаимодействия смесь магнитных частиц удерживается в микроканале, а детекция проводится на основании образующегося окрашенного продукта ферментативной реакции (Tekin Н.С., Gijs М.А.М. Ultrasensitive protein detection: a case for microfluidic magnetic bead-based assays. Lab on a Chip. - 2013. DOI: 10.1039/C3LC50477H). Однако такое решение, хотя и является более простым по части регенерации (вымывание из канала проходит проще, чем из пористой мембраны), требует сложного оборудования, ряда дополнительных реагентов и специальных детекторов для регистрации окраски жидкости в протоке микроканала. При этом микрофлюидная ячейка стоит на несколько порядков дороже тест-полоски (без нанесенных реагентов), что делает ее малодоступной для широкого использования.
Предлагаемая процедура анализа включает:
1) подготовку аналитической зоны тест-полоски;
2) измерение содержания целевого антигена в пробе;
3) (при необходимости) регенерацию тест-полоски.
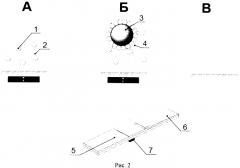
Для подготовки аналитической зоны тест-полоску помещаем в штатив с зафиксированным постоянным магнитом (см. Рис. 2). В комплектацию тест-полоски не входят мембрана под образец и мембрана под конъюгат, а вместо них используются растворы конъюгата коллоидного маркера со специфическими антителами.
На нижний край мембраны наносим раствор магнитных частиц, конъюгированных с иммунореагентами (специфическими антителами или антигенами). Под действием капиллярных сил магнитные частицы движутся по тест-полоске, а под действием магнитного поля в аналитической зоне прекращают свое движение. Добавление избытка буфера позволяет сконцентрировать коллоидную суспензию в аналитической зоне. Процедура подготовки мембраны к первому определению может быть выполнена заранее, а готовые тест-системы - храниться в высушенном состоянии при комнатной температуре.
Для проведения анализа предварительно проводится инкубация конъюгата (окрашенный коллоидный маркер-специфические антитела) с анализируемой пробой. Аналитическая зона тест-полоски фиксируется магнитным полем, а на нижний край рабочей мембраны наносится приготовленный раствор анализируемой пробы с коллоидным маркером.
В зависимости от схемы реализуемого анализа происходит взаимодействие специфических реагентов в аналитической зоне с образованием окрашивания.
Данное методическое решение обладает существенными преимуществами по сравнению с традиционными подходами:
1) Значительно упрощается изготовление тест-системы, так как конъюгат магнитных частиц представляет собой отдельный легко характеризуемый реагент.
2) Проще контролировать количество и качество специфических компонентов в аналитической зоне тест-системы.
3) Использование смеси иммунореагентов позволяет проводить групп-специфичный анализ, исключая сложные задачи получения групп-специфичных антител или нанесения нескольких антител в одну контрольную зону.
Аналогами предлагаемой аналитической системы являются подходы по использованию крупных магнитных наночастиц в качестве метки (Xu Q., Xu Н., Gu Н., Li J., Wang Y., Wei M. Development of lateral flow immunoassay system based on superparamagnetic nanobeads as labels for rapid quantitative detection of cardiac troponin I. 2009. V. 29. №3. P. 702-707). Однако используемая в этой работе схема проведения анализа ничем не отличается от традиционной иммунохроматографии, за исключением использования в качестве маркера магнитных наночастиц. По интенсивности окраски описанное Xu и соавт. решение уступает традиционным подходам, а сами полоски используются однократно, в отличие от предлагаемой нами аналитической системы.
Эффективность предложенного в патенте подхода подтверждается представленным ниже примером.
Пример 1. Определение афлатоксина В1 иммунохроматографическим методом.
В аналитический набор, помимо тест-полоски, входят следующие компоненты:
- промывочный раствор (20 мМ раствор HCl с детергентом);
- рабочий буферный раствор (фосфатный буфер с детергентом);
- конъюгат коллоидного золота с антителами к афлатоксину В1;
- конъюгат магнитных частиц оксида железа с комплексом афлатоксин В1 - БСА;
- постоянный магнит размером 10×2×2 мм.
Тест-полоска представляет из себя расположенную на подложке рабочую мембрану и соприкасающуюся с ней впитывающую мембрану.
Анализ проводится следующим образом:
- анализируемая проба смешивается с конъюгатом специфические антитела-коллоидное золото и инкубируется в течение 5 минут. За это время происходит взаимодействие антигена в пробе с центрами связывания антител;
- тест-полоска устанавливается так, чтобы под аналитической зоной располагался постоянный магнит;
- на нижний край тест-полоски наносится раствор магнитных частиц и инкубируется в течение 2 минут;
- на нижний край тест-полоски наносится рабочий буферный раствор и инкубируется еще 5 минут, в результате на поверхности формируется различимая контрольная зона (слабое светло-коричневое окрашивание за счет магнитных наночастиц) - происходит обратимая иммобилизация магнитных сорбентов;
- на нижний край тест-полоски наносится смесь пробы с конъюгатом специфических антител и инкубируется еще 5 минут;
- на нижний край наносится рабочий буферный и инкубируется еще 7 минут;
- проводится детекция окрашивания;
- на нижнюю часть тест-полоски наносится промывочный раствор и инкубируется 3 минуты, процедура отмывки повторяется 3 раза.
Для количественной оценки связывания маркера тест-полоски сканировали на сканере Lide 90 (Canon) с разрешением 600 dpi, без автоматического контрастирования и цветокоррекции. На полученных цифровых изображениях выделяли прямоугольную область, захватывающую не менее чем 90% окрашенной зоны, и с помощью программы Total Lab (Nonlinear Dynamics, Великобритания) получали численное значение интенсивности окрашивания.
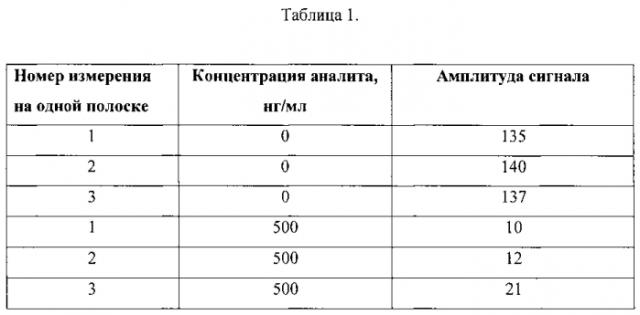
Результаты иммунохроматографического определения приведены в таблице 1. Как видно, предложенное решение позволяет проводить ряд измерений на одной тест-полоске без значительных изменений аналитического сигнала.
Технический результат:
1. упрощение процедуры нанесения и иммобилизации специфических реагентов в аналитических зонах тест-полоски (исключение использования сложного прецизионного оборудования для нанесения или подбора особых условий);
2. перемещение специфического комплекса в любое место мембраны для обеспечения наилучшего детектирования и оценки результата;
3. регулирование размера аналитической зоны (возможность концентрирования ее в узком диапазоне), что обеспечивает повышение чувствительности метода;
4. возможность проведения анализа в растворе (с участием всех иммунореагентов - аналита, окрашенного маркера и конъюгата магнитных частиц) и последующего детектирования образованных иммунных комплексов на мембране.
Краткое описание чертежей
На рис. 1 представлена схема организации тест-полоски для проведения конкурентного иммунохроматографического анализа. 1 - пластиковая основа, 2 - мембрана, адсорбирующая образец, 3 - подложка под конъюгат, 4 - рабочая мембрана, 5 - аналитическая зона, 6 - контрольная зона, 7 - конечная адсорбирующая мембрана, 8 - специфические антитела, 9 - частицы коллоидного золота, 10 - белок-носитель, 11 - антиген, 12 - антивидовые антитела.
На рис. 2 представлена схема иммунохроматографического анализа с использованием магнитного поля для формирования аналитической зоны. А - формирование аналитической зоны, Б - конкурентное взаимодействие, В - регенерация. 1 - магнитные частицы, 2 - конъюгат микотоксина с бычьим сывороточным альбумином (БСА), 3 - коллоидное золото, 4 - специфические антитела, 5 - рабочая мембрана, 6 - впитывающая мембрана, 6 - постоянный магнит.
Способ проведения иммунохроматографического анализа, включающий регистрацию окрашенных коллоидным маркером специфических комплексов антиген-антитело на поверхности рабочей мембраны, отличающийся обратимой иммобилизацией иммунореагентов в аналитических зонах рабочей мембраны, для чего иммуноспецифические реагенты конъюгируют с магнитными наноразмерными носителями и удерживают в аналитических зонах наложением магнитного поля, что дает возможность снять ограничения по иммобилизации реагентов на рабочих мембранах и проводить специфическую реакцию вне тест-полоски.