Трехблочные полимеры вав, обладающие улучшенными характеристиками высвобождения
Иллюстрации
Показать всеИзобретение относится к биологически разлагаемым блоксополимерам. Описан блочный сополимер BAB, включающий: (a) приблизительно от 60 до 85 мас.% биоразлагаемого гидрофобного блока A, включающего биоразлагаемый сложный полиэфир; и (b) приблизительно от 15 до 40 мас.% биоразлагаемого гидрофильного блока B, включающего полиэтиленгликоль, причем средневесовая молекулярная масса каждого блока B находится в пределах от 300 до 1000 Да; при этом значение средневесовой молекулярной массы Mw блочного сополимера BAB составляет от 5000 до 8000 Да и соотношение блока A к блоку B выбрано из группы, включающей 2,45, 2,50, 2,60 и 2,70; причем указанный блочный сополимер характеризуется способностью к обратному тепловому гелеобразованию при образовании в водном растворе. Также описана композиция указанного выше блоксополимера для введения лекарственного средства, а также способ ее получения. Описана водная композиция указанного выше блоксополимера. Также описан способ введения по меньшей мере одного лекарственного средства теплокровному животному в контролируемо высвобождающейся форме, включающий: (а) обеспечение водной композиции сополимера BAB, включающей: (i) приблизительно 60-85 мас.% биологически разлагаемого гидрофобного блока A, содержащего биологически разлагаемый сложный полиэфир; и (ii) приблизительно 15-40 мас.% биологически разлагаемого гидрофильного блока B, содержащего полиэтиленгликоль, причем средневесовая молекулярная масса каждого блока B находится в пределах от 300 до 1000 Да; где значение средневесовой молекулярной массы Mw блочного сополимера BAB составляет от 5000 до 8000 Да и соотношение блока A к блоку B выбрано из группы, включающей 2,45, 2,50, 2,60 и 2,70, при этом указанный блочный сополимер BAB проявляет свойства обратного теплового гелеобразования; и (b) введение указанного состава теплокровному животному. Технический результат - получение блоксополимеров низкой молекулярной массы, обладающих свойствами обратного теплового гелеобразованию и улучшенными характеристиками высвобождения лекарства. 5 н. и 10 з.п. ф-лы, 2 ил., 2 табл., 4 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
(a) Область техники
Изобретение относится к биологически разлагаемым и биологически поглощаемым блочным сополимерам BAB, которые демонстрируют свойства обратного теплового гелеобразования под действием повышенных температур, в частности под воздействием температуры тела в момент введения или непосредственно перед этим. Раскрываемые полимеры успешно используются, например, при парентеральном введении лекарств.
(b) Описание ближайших аналогов
Биологически разлагаемые блочные сополимеры, демонстрирующие обратное тепловое гелеобразование раскрыты в Патентах США №№6201072; 6117949; и 6004573, выданных Рати (Rathi) и др., и 5702717, выданном Ча (Cha) и др., каждый из которых включен в настоящий патент посредством ссылки. Эти полимерные составы существуют в виде жидкого раствора при низких температурах, затем обратимо образуют гель при физиологически значимых температурах и обеспечивают хорошие характеристики высвобождения лекарства. Эти составы включают биологически разлагаемые блочные сополимеры типа ABA или BAB, имеющие средневесовую молекулярную массу приблизительно от 2000 до 4990, а также включают приблизительно от 51 до 83 мас.% гидрофобного полимерного блока A, содержащего биологически разлагаемый сложный полиэфир и приблизительно от 17 до 49 мас.% гидрофильного полимерного блока B, состоящего из полиэтиленгликоля. В Патентах США №№7018645 и 7135190, выданных Пиао (Piao) и др., раскрываются смеси трехблочных сополимеров, демонстрирующих аналогичные свойства обратного теплового гелеобразования.
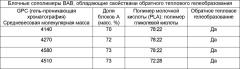
В Патентах Рати раскрываются блочные сополимеры BAB, обладающие свойствами обратного теплового гелеобразования. В соответствии с Патентом ′949 трехблочные сополимеры BAB были синтезированы с использованием того же самого блока B полиэтиленгликоля (ПЭГ) с любого конца (Mw=550), но с переменным содержанием поли(лактидов) и/или поли(гликолидов). ПЭГ и сополимер молочной и гликолевой кислот (PLGA) были связаны друг с другом звеньями сложного эфира, уретана или комбинации сложного эфира и уретана. Прежние блочные сополимеры BAB, описанные в патентах Рати, имели средневесовую молекулярную массу Mw в диапазоне от 2000 до 4990. В приведенной ниже таблице перечислены характеристики трехблочных сополимеров BAB, раскрытые в патентах Рати.
Все трехблочные сополимеры ПЭГ-PLGA-ПЭГ, перечисленные в приведенной выше таблице, обладали свойствами обратного теплового гелеобразования. Температуры перехода раствор/гель для вышеперечисленных трехблочных полимеров составляли 36, 34, 30 и 26°C соответственно. Несмотря на то, что патенты Рати демонстрировали хорошие характеристики высвобождения лекарства для трехблочных сополимеров ABA, имеющих средневесовую молекулярную массу М w в диапазоне от 2000-4990 Да, в патентах Рати не описывались характеристики высвобождения раскрытых трехблочных сополимеров BAB. Кроме того, характеристики высвобождения не были исследованы по отношению к гидрофильным соединениям. Было обнаружено, что характеристики высвобождения прежних трехблочных сополимерных составов для гидрофильных активных веществ непригодны для многих применений, связанных с контролируемым высвобождением.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Разработаны новые восстанавливаемые трехблочные сополимеры BAB, демонстрирующие свойства обратного теплового гелеобразования и обладающие улучшенными характеристиками высвобождения лекарства, в частности, для гидрофильных активных веществ. Было обнаружено, что трехблочные сополимеры BAB изобретения обладают преимуществами по отношению к трехблочным сополимерам ABA, что касается обеспечения термообратимого полимерного состава с контролируемым высвобождением, в частности к тем, которые демонстрируют желаемые характеристики высвобождения при использовании с гидрофильными активными веществами. Изобретатели также установили, что увеличение отношения количества PLG/ПЭГ и возрастание молекулярной массы блочных сополимеров BAB по отношению к известным составам блочных сополимеров BAB оказывает существенное влияние на характеристики высвобождения лекарства блочным сополимером BAB, в частности, в случае гидрофильных активных веществ. Прежняя работа по отношению к трехблочным ABA и BAB навела на мысль, что характеристики высвобождения для обоих полимеров были бы сходными, и что один и тот же диапазон трехблочных молекулярных масс был бы пригодным для трехблочных сополимеров как BAB, так и ABA. Однако изобретатели обнаружили, что диапазон трехблочной молекулярной массы для термообратимых трехблочных составов BAB отличается от того, который имел место для трехблочных сополимеров ABA.
Целью изобретения является предоставление систем доставки лекарственных средств на основе трехблочных сополимеров с низкой молекулярной массой, которые являются биологически разлагаемыми, демонстрируют поведение обратного теплового гелеобразования, а именно существуют в виде жидкого раствора при низких температурах, обратимо формируют гели при физиологически значимых температурах и обеспечивают улучшенные характеристики высвобождения лекарства по отношению к прежним трехблочные сополимеры BAB и ABA.
Еще одна цель изобретения заключается в предоставлении метода для парентерального введения лекарств в биологически разлагаемой полимерной матрице, приводящего к формированию в организме гелевого депо, из которого высвобождаются лекарства, такого, чтобы полимеры демонстрировали улучшенные характеристики высвобождения лекарства по отношению к прежним трехблочным сополимерам BAB и ABA.
Дальнейшая цель изобретения заключается в предоставлении системы доставки лекарственных средств для парентерального или внутриопухолевого введения гидрофильных и гидрофобных лекарственных средств, пептидных и белковых лекарственных средств, гормонов, генов/нуклеиновых кислот, олигонуклеотидов и противораковых веществ. Классы противораковых средств включают, например, алкилирующие средства, антиметаболиты, антибиотики, гормональные средства, средства, предотвращающие новообразование кровеносных сосудов, или нитрозомочевины.
Эти и другие цели могут достигаться с использованием блочного сополимера BAB, при этом указанный блочный сополимер, содержит: i) приблизительно от 60 до 85 мас.% биологически разлагаемого гидрофобного блока A, включающего биологически разлагаемый сложный полиэфир; и ii) приблизительно от 15 до 40 мас.% биологически разлагаемого гидрофильного блока B, включающего полиэтиленгликоль, в котором средневесовая молекулярная масса каждого блока B принимает значения в диапазоне от 300 до 1000 Да, в котором блочный сополимер BAB имеет молекулярную массу в диапазоне от 5000 до 8000 и способен демонстрировать свойства обратного теплового гелеобразования при образовании в водном полимерном растворе. Блочный сополимер предпочтительно имеет содержание блока A в диапазоне от 65 до 80% и содержание блока B сополимера в диапазоне от 20 до 35%, и более предпочтительно блочный сополимер имеет содержание блока A в диапазоне от 67 до 75% и содержание блока B - в диапазоне от 25 до 33%. Среднечисленная молекулярная масса Mn блочного сополимера предпочтительно принимает значения от 3800 до 5000 Да и более предпочтительно от 4000 до 4600 Да.
Эти и другие цели могут достигаться с использованием водосодержащего состава блочного сополимера BAB, при этом указанный состав содержит: i) приблизительно от 60 до 85 мас.% биологически разлагаемого гидрофобного блока A, включающего биологически разлагаемый сложный полиэфир; и ii) приблизительно от 15 до 40 мас.% биологически разлагаемого гидрофильного блока B, включающего полиэтиленгликоль, в котором средневесовая молекулярная масса каждого блока B находится в диапазоне от 300 до 1000 Да; в котором состав блочного сополимера BAB имеет величину Mw в диапазоне от 5000 до 8000 и демонстрирует свойства обратного теплового гелеобразования. Блочный сополимер предпочтительно имеет содержание блока A в диапазоне от 65 до 80% и содержание блока B сополимера - в диапазоне от 20 до 35%, и более предпочтительно блочный сополимер имеет содержание блока A в диапазоне от 67 до 75% и содержание блока B в диапазоне от 25 до 33%. Среднечисленная молекулярная масса Mn блочного сополимера предпочтительно принимает значения от 3800 до 5000 Да и более предпочтительно от 4000 до 4600 Да.
Эти и другие цели могут быть достигнуты с использованием метода для введения, как минимум, одного лекарственного средства теплокровному животному в форме с контролируемым высвобождением, которая включает: (1) предоставление водосодержащего состава блочного сополимера BAB, содержащего: i) приблизительно от 60 до 85 мас.% биологически разлагаемого гидрофобного блока A, включающего биологически разлагаемый сложный полиэфир; и ii) приблизительно от 15 до 40 мас.% биологически разлагаемого гидрофильного блока B, включающего полиэтиленгликоль, в котором средневесовая молекулярная масса каждого блока B принимает значения в диапазоне от 300 до 1000 Да; в котором состав блочного сополимера BAB имеет значение Mw в диапазоне от 5000 до 8000 и демонстрирует свойства обратного теплового гелеобразования; и (2) введение указанного состава теплокровному животному. Блочный сополимер предпочтительно имеет содержание блока A в диапазоне от 65 до 80% и содержание блока B сополимера в диапазоне от 20 до 35%, и более предпочтительно блочный сополимер имеет содержание блока A в диапазоне от 67 до 75% и содержание блока B - в диапазоне от 25 до 33%. Среднечисленная молекулярная масса Mn блочного сополимера предпочтительно принимает значения от 3800 до 5000 Да и более предпочтительно от 4000 до 4600 Да.
Эти и другие цели могут быть достигнуты с использованием метода приготовления состава блочного сополимера BAB, который включает: (1) предоставление состава блочного сополимера BAB, содержащего: i) приблизительно от 60 до 85 мас.% биологически разлагаемого гидрофобного блока A, включающего биологически разлагаемый сложный полиэфир; и ii) приблизительно от 15 до 40 мас.% биологически разлагаемого гидрофильного блока B, включающего полиэтиленгликоль, в котором средневесовая молекулярная масса каждого блока B принимает значения в диапазоне от 300 до 1000 Да; в котором состав блочного сополимера BAB имеет значение Mw в диапазоне от 5000 до 8000 и способен демонстрировать свойства обратного теплового гелеобразования при формировании в водном растворе полимеров; и (2) лиофильную сушку указанного блочного сополимера, в котором блочный сополимер способен демонстрировать эталонное тепловое гелеобразование при формировании в виде водного раствора полимеров. Блочный сополимер предпочтительно имеет содержание блока A в диапазоне от 65 до 80% и содержание блока B сополимера в диапазоне от 20 до 35%, и более предпочтительно блочный сополимер имеет содержание блока A в диапазоне от 67 до 75% и содержание блока B - в диапазоне от 25 до 33%. Среднечисленная молекулярная масса Mn блочного сополимера предпочтительно принимает значения от 3800 до 5000 Да и более предпочтительно от 4000 до 4600 Да.
Краткое описание чертежей
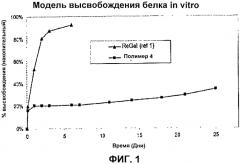
На фиг. 1 приводится сравнение профиля высвобождения состава полимера, соответствующего примеру с блочным сополимером ABA ReGel.
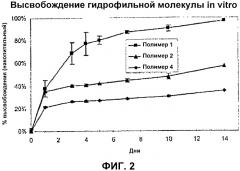
На фиг. 2 приводится сравнение высвобождение гидрофильной макромолекулы составами блочного сополимера BAB из указанных примеров.
Подробное описание предпочтительных вариантов воплощения
Дополнительные цели и преимущества изобретения станут явными из нижеследующего краткого и подробного описания различных вариантов его воплощения. При использовании в настоящем описании приведенные ниже термины должны иметь следующие значения:
«Парентеральный» должен включать внутримышечный, внутрибрюшинный, внутрибрюшной, подкожный, внутриопухолевый, внутричерепной (или вводимый в полость иссеченной опухоли), внутрисуставной, интратекальный, интрамедуллярный, глазной и в той степени, в которой это может быть реализовано, внутривенный и внутриартериальный.
«Температура гелеобразования» означает температуру, при которой биологически разлагаемый блочный сополимер претерпевает обратное тепловое гелеобразование, т.е. температуру, ниже которой блочный сополимер является растворимым в воде и выше которой блочный сополимер претерпевает фазовый переход к повышению своей вязкости или к образованию полутвердого геля.
Термины «температура гелеобразования» и «температура обратного теплового гелеобразования» или аналогичные должны использоваться взаимозаменяемым образом по отношению к температуре гелеобразования.
«Раствор полимера», «водный раствор» и аналогичные термины при использовании по отношению к биологически разлагаемому блочному сополимеру, содержащемуся в таком растворе, должны означать раствор на водной основе, содержащий указанный блочный сополимер, растворенный в нем в функциональной концентрации, и поддерживаемый при температуре ниже температуры гелеобразования блочного сополимера.
Полиэтиленгликоль (ПЭГ) иногда также называется поли(этиленоксидом) (ПЭО) или поли(оксиэтиленом) и термины могут использоваться взаимозаменяемым образом для целей изобретения.
«Обратное тепловое гелеобразование» представляет собой явления, в ходе которых раствор блочного сополимера самопроизвольно повышает свою вязкость и во многих случаях преобразуется в полутвердый гель по мере того, как температура раствора поднимается выше температуры гелеобразования сополимера. Для целей изобретения термин «гель» включает как состояние полутвердого геля, так и состояние высокой вязкости, которое существует выше температуры гелеобразования. При охлаждении ниже температуры гелеобразования гель самопроизвольно возвращается в состояние раствора с меньшей вязкостью. Это циклическое превращение между раствором и гелем может повторяться неограниченное число раз, поскольку переход раствор/гель не включает в себя какого-либо изменения в химическом составе полимерной системы. Все взаимодействия по образованию геля являются физическими по своему характеру и не включают в себя образования или разрешения ковалентных связей.
«Жидкость для доставки лекарственных средств» или «жидкость для доставки лекарственных средств, обладающая свойствами обратного теплового гелеобразования» должна означать раствор полимеров, который содержит лекарственное средство (лекарственное средство само по себе может быть растворенным или коллоидным), пригодное для введения теплокровному животному, и который образует депо лекарственного средства в форме геля, когда температура поднимается до температуры гелеобразования блочного сополимера или превышает ее.
«Депо» означает жидкость для доставки лекарственных средств после введения теплокровному животному, которая образовала гель, когда температура достигла температуры гелеобразования или превысила ее.
«Гель» означает полутвердую фазу, которая самопроизвольно возникает, когда температура «раствора полимеров» или «жидкости для доставки лекарственных средств» поднимается до температуры гелеобразования блочного сополимера или превышает ее. В определенных ситуациях образованный гель может терять или поглощать воду из окружающей среды, становясь более компактным или объемистым; на такие гели также распространяется область изобретения.
«Водосодержащий полимерный состав» означает либо жидкость для доставки лекарственных средств, либо гель, состоящий из водной фазы, содержащей равномерно распределенное в ней лекарственное средство и биологически разлагаемый блочный сополимер. При температурах ниже температуры гелеобразования сополимер может быть растворимым в водной фазе и состав будет представлять собой раствор. При температуре гелеобразования или выше ее сополимер будет затвердевать, образуя гель с водной фазой, и состав будет представлять собой гель или полутвердое вещество.
«Биологически разлагаемый» означает, что блочный сополимер может химически распадаться или разлагаться в организме, образуя нетоксичные компоненты. Скорость разложения может быть равной скорости высвобождения лекарственного средства или отличаться от нее.
«Лекарственное средство» должно означать любое органическое или неорганическое соединение или вещество, обладающее биологической активностью и используемое в лечебных целях или приспособленное к такому использованию. Белки, гормоны, противораковые средства, олигонуклеотиды, ДНК, РНК и средства генной терапии включаются в более широкое определение лекарственного средства.
«Пептид», «полипептид», «олигопептид» и «белок» должны использоваться взаимозаменяемым образом по отношению к пептидпым или белковым лекарственным средствам, и использование этих терминов не должно ограничиваться какой-либо конкретной молекулярной массой, последовательностью или длиной пептидов, областью биологической активности или терапевтическим использованием за исключением особо оговоренных случаев. Такие терапевтические использования могут включать, например, алкилирующие средства, антиметаболиты, антибиотики, гормональные средства, средства, предотвращающие новообразование кровеносных сосудов или нитрозомочевины.
Термин «биологически разлагаемые сложные полиэфиры» относится к любым биологически разлагаемым полиэфирам, которые преимущественно синтезируются, как минимум, из одного из следующих веществ: D,L-лактида, D-лактила, L-лактида, D,L-молочной кислоты, D-молочной кислоты, L-молочпой кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε-гидроксигексоноевой кислоты, γ-бутиролактона, γ-гидрокси-масляной кислоты, δ-валеролактона, δ-гидроксивалериановой кислоты, гидроксимасляных кислот, яблочной кислоты или их сополимеров.
Блочные сополимеры типа ВАВ могут быть синтезированы с использованием полимеризации с раскрытием кольца или конденсационной полимеризации в соответствии со схемами реакций, раскрытыми в патентах США №№5702717; 6004573; и 6117949, полностью включенными в настоящее описание посредством ссылки, приводящих к образованию монофункциональных диблоков (МеО-ПЭГ-PLG) с последующим связыванием диблочных сополимеров с использованием той же самой или отличающейся молекулярной массы, например, сложной эфирной или уретановой связи для получения трехблочного сополимера ВАВ (МеО-ПЭГ-PLG-ПЭГ-ОМе). В других случаях монофункциональные блоки В(ПЭГ) могут связываться с каждым концом блока А (полиэфиры) посредством сложных эфирных или уретановых либо аналогичных связей. В качестве альтернативы блочные сополимеры типа ВАВ можно также готовить путем реакции дифункционального гидрофобного блока А у любого конца с этиленоксидом. Могут использоваться процедуры конденсационной полимеризации и полимеризации с раскрытием кольца, поскольку они способны связывать монофункциональный гидрофильный блок В с любым концом дифункционального гидрофобного блока А в присутствии связующих веществ, таких как изоцианаты. Более того, за реакциями связи может следовать активация функциональных групп с активирующими веществами, такими как карбонилдиимидазол, янтарный ангидрид, N-гидрокси-сукцинимид и р-нитрофенил-хлороформат, и подобные им.
Гидрофильный блок В образуется из ПЭГ соответствующих молекулярных масс. ПЭГ был выбран в качестве гидрофильного водорастворимого блока по причине его уникальных свойств биологической совместимости, отсутствия токсичности, гидрофильности, растворимости и быстрого выведения из организма пациента. В предпочтительном варианте воплощения компонент ПЭГ может быть выбран из смеси ПЭГ, имеющих различные средние молекулярные массы. Гидрофобные блоки А используются по причине их свойств биологической разлагаемости, биологической совместимости и растворимости. Разложение этих гидрофобных, биологически разлагаемых сложнополиэфирных блоков А in vitro и in vivo хорошо понято, и продукты разложения встречаются в природе (или имеют свойства, эквивалентные свойствам продуктов, которые встречаются в природе) или представляют собой биологически совместимые соединения, которые легко усваиваются в организме пациента и/или выводятся из него.
Концентрация, при которой блочные сополимеры растворимы при температурах ниже температуры гелеобразования, может считаться функциональной концентрацией. В общем, концентрации блочного сополимера порядка 3% и приблизительно до 50 мас.% могут использоваться и все еще остаются функциональными. Однако предпочтительными являются концентрации в диапазоне приблизительно от 5 до 40%, а наиболее предпочтительными - концентрации в диапазоне приблизительно от 10-35 мас.%. Для получения осуществимого фазового перехода в гелевую фазу с сополимером требуется определенная минимальная концентрация, т.е. 3 мас.%. В диапазонах более низких функциональных концентраций образующийся гель будет слабым, и может произойти разделение фаз. Если концентрации полимера выше, может возникнуть более прочная гелевая сеть.
Смесь биологически разлагаемого сополимера и пептидных/белковых лекарственных средств и/или других типов лекарств может готовиться как водный раствор сополимера ниже температуры гелеобразования с образованием жидкости для доставки лекарственных средств, в которой лекарственное средство может быть полностью либо частично растворено. Когда лекарственное средство растворено частично или когда оно, по существу, нерастворимо, оно существует в коллоидном состоянии, таком как суспензия или эмульсия. Раскрываемые полимеры успешно используются при парентеральном введении, таком как внутримышечное или подкожное, внутриопухолевое, внутричерепное (или введение в полость иссеченной опухоли), внутрисуставное, интратекальное, интрамедуллярное, глазное, местное, трансдермальное, вагинальное, трансбуккальное, чресслизистое, легочное, трансуретральное, ректальное, а также введение через нос, рот или уши, после чего полимеры будут претерпевать обратимое тепловое гелеобразование, поскольку температура тела будет выше температуры гелеобразования.
Эта система будет приводить к минимальной токсичности и минимальному механическому раздражению окружающих тканей, благодаря биологической совместимости материалов, пластичности геля и точному контролю характеристик набухания в физиологических областях, где набухание привело бы к повреждению окружающей ткани. Сложнополиэфирные блоки в системе будут впоследствии претерпевать полное биологическое разложение до молочной кислоты, гликолевой кислоты и других соответствующих мономеров в пределах конкретного интервала времени. Полиэтиленгликолевые блоки выводятся из организма путем экскреции. Высвобождение лекарственного средства, прочность геля, температура гелеобразования и скорость разложения могут контролироваться путем надлежащей разработки и приготовления различных блоков сополимеров, а именно через изменения процентного содержания блоков А и В по массе, молярного процентного содержания лактата и гликолята, а также молекулярной массы и полидисперсности блочных сополимеров ВАВ. Высвобождение лекарственного средства может также контролироваться путем регулировки концентрации полимера в жидкости для доставки лекарственных средств.
Форма дозировки, состоящая из раствора блочного сополимера, содержащего лекарственное средство либо в растворенном состоянии, либо в состоянии суспензии или эмульсии, вводится в организм. Затем этот состав самопроизвольно переходит в гель, благодаря свойствам обратного теплового гелеобразования блочного сополимера, образуя при этом депо лекарственного средства, когда температура состава повышается до температуры тела. Единственным ограничением, касающимся количества лекарственного средства, которое может быть введено в состав, является ограничение, связанное с его функциональностью. А именно, количество вводимого лекарственного средства может возрастать до тех пор, пока это возрастание не начнет оказывать неблагоприятное воздействие до неприемлемой степени на свойства обратного теплового гелеобразования сополимера, на свойства высвобождения лекарственного средства, или до тех пор, пока не будет оказано неблагоприятное воздействие на свойства состава до такой степени, что введение состава станет неприемлемо затруднительным. Вообще говоря, ожидается, что в большинстве случаев лекарственное средство будет составлять приблизительно от 0,01 до 20% состава по массе, при этом диапазон концентраций приблизительно от 0,01 до 10% будет наиболее распространенным. Эти диапазоны концентраций лекарственного средства не являются ограничивающими по отношению к изобретению. При условии сохранения функциональности, концентрации лекарственного средства, выходящие за указанные диапазоны, будут входить в область изобретения.
Явное преимущество описанных здесь составов заключается в способности блочного сополимера к повышению растворимости многих лекарственных веществ. Комбинация гидрофобных блоков А (одного или нескольких) и гидрофильных блоков В (одного или нескольких) делает блочный сополимер амфифильным с четко выделяемыми гидрофильными и гидрофобными доменами, которые стабилизируют гидрофобные лекарства и повышают их растворимость. В этом отношении данная комбинация действует во многом как мыло или поверхностно-активное вещество в проявлении как гидрофильных, так и гидрофобных свойств. Несмотря на то, что прежние трехблочные сополимеры АВА продемонстрировали преимущества, в частности, в повышении растворимости гидрофобных или плохо растворимых в воде лекарственных средств, таких как паклитаксель, было обнаружено, что характеристики высвобождения этих трехблочных сополимеров АВА для гидрофильных соединений являются неадекватными для многих случаев применения с контролируемым высвобождением.
Было обнаружено, что трехблочные сополимеры ВАВ изобретения обладают преимуществами по отношению к трехблочным сополимерам АВА, что касается обеспечения термообратимого полимерного состава с контролируемым высвобождением, в частности, по отношению к гидрофильным активным веществам. Характеристики высвобождения трехблочных сополимеров ВАВ, являющихся предметом изобретения, были исследованы по отношению к альбумин бычьей сыворотки (BSA), который представляет собой эталонный белок для предсказания поведения контролируемого высвобождения многочисленных гидрофильных белков и других гидрофильных активных веществ. Как показано на фиг.1, являющийся прототипом трехблочный сополимер АВА ReGel, высвобождает приблизительно 95% альбумина бычьей сыворотки (BSA) в течение первых пяти суток. В противоположность ему, трехблочный ВАВ (состав №4, табл. I) продемонстрировал устойчивое высвобождение альбумина бычьей сыворотки в течение периодов, превышающих 25 суток. Данные на фиг. 1 демонстрируют преимущество трехблочных сополимеров ВАВ для контролируемого высвобождения гидрофильных молекул, включая белки, такие как BSA, в течение продолжительных периодов времени.
Изобретатели также установили, что увеличение отношения количества полимеров молочной и гликолевой кислот (PLG/ПЭГ) и возрастание молекулярной массы блочных сополимеров ВАВ по отношению к известным составам блочных сополимеров ВАВ оказывает существенное влияние на характеристики высвобождения лекарства блочным сополимером ВАВ, в частности, в случае гидрофильных активных веществ. Прежняя работа по отношению к трехблочным АВА и ВАВ навела на мысль, что характеристики высвобождения для обоих полимеров были бы сходными, и что один и тот же диапазон трехблочных молекулярных масс был бы пригодным для трехблочных сополимеров как ВАВ, так и АВА. Характеристики высвобождения трехблочных сополимеров ВАВ были исследованы по отношению к образцовой гидрофильной макромолекуле, декстрану (молекулярная масса 70000 Да). Изобретатели обнаружили, что в тех случаях, когда соотношение PLG/ПЭГ и общая молекулярная масса поднималась в триблоках ВАВ выше уровней, которые ранее описывались, как адекватные, были получены желательные характеристики контролируемого высвобождения для гидрофильных активных веществ.
В соответствии с наиболее предпочтительным аспектом изобретения, ожидается, что нижеперечисленные гидрофильные биологически активные вещества являются особенно пригодными для использования в сочетании с блочными сополимерами ВАВ, являющимися предметом изобретения, исходя из их гидрофильных характеристик: окситоцин, вазопрессин, адренокортикотропный гормон, эпидермальный фактор роста, фактор роста тромбоцитов (ТФР), пигментный фактор роста эпителия (PEDF) пролактин, люлиберин, гормон, высвобождающий лютеинизирующий гормон (ЛГ-РГ), агонисты ЛГ-РГ, антагонисты ЛГ-РГ, гормоны роста (человеческий, свиной, бычий и т.д.), фактор, стимулирующий выделение гормона роста, инсулин, эритропоэтин, соматостатин, глюкагон, интерлейкины [интерлейкин-2 (ИЛ-2), интерлейкин-11 (ИЛ-11)], интерфероны (интерферон-α, β, или γ), гастрины (тетрагастрин, пентагастрин, урогастрон), секретин, кальцитонин, энкефалины, иммуноглобулины, эндорфины, ангиотензины, тиролиберин (ТРТ), факторы некроза опухолей (ФНО), факторы роста нервов (NGF), гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарпо-моноцитарный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ), гепариназа, hANP, глюкагоноподобный пептид (GLP-1), костные морфогенетические белки (BMP), антитела и их фрагменты, ферменты, цитокины, вакцины, гозерелин, рапамицин, ритуксимаб, ренин, брадикинин, бацитрацины, полимиксины, колистины, тироцидин, грамицидины, циклоспорины и их синтетические аналоги, модификации и фармакологически активные фрагменты.
В определенных ситуациях полимер, содержащий лекарственное средство, может вводиться в состоянии геля, а не раствора. Гелеобразование может быть результатом повышения температуры раствора полимеров, в который введено лекарственное средство до уровня, превышающего температуру гелеобразовапия полимера перед введением, или может быть вызвано повышением концентрации полимера в растворе до величины, превышающей концентрацию насыщения при температуре введения, а также может быть вызвано добавлением в раствор полимеров присадок, которые приводят к его переходу в состояние геля. В любом случае, гель, образованный таким путем, может вводиться парентеральным способом, таким как внутримышечным или подкожным, внутриопухолевым, внутричерепным (или введением в полость иссеченной опухоли), внутрисуставным, интратекальным, интрамедуллярным, глазным, местным, трансдермальным, вагинальным, трансбуккальным, чрезслизистым, легочным, трансуретральным, ректальным, а также через нос, рот или уши.
Изобретение применимо к биологически активным веществам и лекарственным средствам всех типов, включая нуклеиновые кислоты, гормоны, противораковые средства, и предлагает необычайно эффективный способ доставки полипептидов и белков. Многие подвижные пептидные и белковые лекарственные средства поддаются связыванию в блочные сополимеры, являющиеся предметом изобретения, и для них может быть полезен описанный здесь процесс обратного теплового гелеобразования. Несмотря на отсутствие конкретных ограничений нижеперечисленным, примерами фармацевтически полезных полипептидов и белков могут быть эритропоэтин, окситоцин, вазопрессин, адренокортикотропный гормон, эпидермальный фактор роста, фактор роста тромбоцитов (ТФР), пролактин, люлиберин, гормон, высвобождающий лютеинизирующий гормон (ЛГ-РГ), агонисты ЛГ-РГ, антагонисты ЛГ-РГ, гормон роста (человеческий, свиной, бычий, и т.д.), фактор, стимулирующий выделение гормона роста, инсулин, соматостатин, глюкагон, интерлейкин-2 (ИЛ-2), интерферон-α, β, или γ, гастрин, тетрагастрин, пентагастрин, урогастрон, секретин, кальцитонин, энкефалины, эндорфины, ангиотензины, тиролиберин (ТРТ), фактор некроза опухолей (ФИО), фактор роста нервов (NGF), гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ), гепариназа, костный морфогенетический белок (BMP), hANP, глюкагоноподобный пептид (GLP-1), интерлейкин-11 (ИЛ-11), ренин, брадикинин, бацитрацины, полимиксины, колистины, тироцидин, грамицидины, циклоспорины или их синтетические аналоги, модификации и фармакологически активные фрагменты, ферменты, цитокины, антитела или вакцины.
Единственное ограничение, налагаемое на полипептидное или белковое лекарственное средство, которое может быть использовано, заключается в его функциональности. В некоторых случаях функциональность или физическая устойчивость полипептидов и белков может быть также повышена путем добавления различных присадок к блочным сополимерам ВАВ изобретения как до, так и после формирования состава лекарственного средства с полимером. Добавки могут также добавляться к водным растворам или суспензиям полипептидных или белковых лекарственных средств. Такие добавки, как полиолы (включая сахара), аминокислоты, поверхностно-активные вещества, полимеры, другие белки и некоторые соли могут использоваться в связи со стабилизацией самих лекарств без изменения свойств состава доставки лекарственного средства. Эти добавки могут легко включаться в блочные сополимеры, которые будут сохранять свою функциональность с свойствами обратного теплового гелеобразования.
Разработки в области белковой инженерии могут обеспечить возможность повышения устойчивости, присущей пептидам или белкам. Несмотря на то, что такие разработанные или модифицированные белки могут рассматриваться как новые объекты в отношении нормативных последствий, это не изменяет их пригодности для использования в изобретении. Одним из типичных примеров модификации является пегилирование, благодаря которому устойчивость полипептидных лекарственных средств может быть существенно повышена за счет ковалентного связывания водорастворимых полимеров, таких как полиэтиленгликоль, с полипептидом. Другим примером является модификация последовательности аминокислот в выражении идентичности или расположения одного или более остатков аминокислот за счет конечного и/или внутреннего добавления, удаления или замены. Любое повышение устойчивости позволяет непрерывно высвобождать терапевтически эффективный полипептид или белок в течение продолжительного периода времени после однократного введения жидкости для доставки лекарственных средств в организм пациента.
В дополнение к вышеперечисленным лекарствам на основе пептидов или белков могут использоваться другие лекарства, относящиеся ко всем категориям, полезным в терапевтическом и медицинском отношении. Эти лекарства описываются в таких хорошо известных литературных справочниках, как «Мерк Индекс», «Настольный справочник врача» и «Фармакологические основы терапии». Краткий список конкретных лекарственных средств представлен лишь для иллюстративных целей и не должен рассматриваться как ограничивающий: противораковые средства, такие как актиномицин D, анастрозол, азацитидин, бевацизумаб, бикалутамид, блеомицин, BCNU, бортезомиб, камптотецин, капецитабин, карбоплатин, цетуксимаб, даунорубицин, дазатиниб, доцетаксель, доксорубицин, эпирубицин, эрлотиниб, эксеместан, гефитиниб, гемцитабин, гозерелин, иматиниб, STI-571, иринотекан, лапатиниб, летрозол, лейпролид, метотрексат, митомицин, оксалиплатин, паклитаксель, пеметрексед, ритуксимаб, сорафепиб, сунитиниб, тамоксифен, таксотер, тегафур-урацил, темозоломид, трастузумаб, трипторелин, винорелбин; антифизиотики, такие как оланзапин и зипрасидон; антибактериальные средства, такие как цефокситин; противоглистные средства, такие как ивермектин; антивирусные средства, такие как ацикловир; иммунодепрессивные средства, такие как циклоспорин А (средство типа циклического полипептида), стероиды и простагландины. Дополнительные противораковые средства включают поркабазип, дакарбазин, альтертамин, дисплатин, меркаптопурин, тиогуанин, флударабина фосфат, кладрибин, пентостатин, фторурацил, цитарабин, азацитидин, винбластин, винкристин, этопозид, тенипозид, топотекан, дактиномицин, идарубинцин, пликамицин, флутамид, лейпролид, газоэрели