Конъюгаты аматоксина с улучшенными связями
Иллюстрации
Показать всеИзобретение относится к конъюгатам аматоксина и мишень-связывающего фрагмента, например антитела, соединенных связями определенного типа, которые применимы в лечении рака, и к фармацевтическим композициям, включающим такие конъюгаты. 5 н. и 20 з.п. ф-лы, 2 ил., 3 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лечению опухолей. В одном аспекте настоящее изобретение относится к конъюгатам аматоксина и мишень-связывающего фрагмента, например, антитела, соединенных связями определенного типа, которые используются при лечении рака. В другом аспекте, изобретение относится к фармацевтическим композициям, включающим такие конъюгаты.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аматоксины представляют собой циклические пептиды, состоящие из 8 аминокислот. Их можно выделить из грибов Amanita phalloides или получить синтетически. Аматоксины специфично ингибируют ДНК-зависимую РНК полимеразу II в клетках млекопитающих и за счет этого также подавляют транскрипцию и биосинтез белков в пораженных клетках. Ингибирование транскрипции в клетках вызывает остановку их роста и пролиферации. Несмотря на отсутствие ковалентного связывания, комплекс аманатина и РНК-полимеразы II является очень прочным (KD=3 нм). Разрушение комплекса аманатина и фермента является очень медленным процессом, что делает маловероятным восстановление пораженной клетки. Если ингибирование транскрипции будет продолжаться слишком долго, клетка подвергнется запрограммированной клеточной смерти (апоптозу).
Применение аматоксинов в качестве цитотоксичных частиц для лечения опухолей исследуется с 1981 года, причем осуществляли сшивание антитела анти-Thy 1.2 с α-аманитином с использованием линкера, прикрепленного к индольному циклу Trp (аминокислоты 4, см. фиг.1), путем диазотирования (Davis & Preston, Science 1981, 213, 1385-1388). Davis и Preston определили, что точкой присоединения линкера является положение 7'. Morris и Venton также продемонстрировали, что замещение по положению 7' приводит к образованию производного, которое сохраняет цитотоксическую активность (Morris & Venton, Int. J.Peptide Protein Res. 1983, 21 419-430).
В заявке на патент EP 1859811 A1 (опубликована 28 ноября 2007) описаны конъюгаты, в которых γ C-атом аминокислоты 1 аматоксина в β-аманитине непосредственно, т.е. без линкерной структуры, связан с альбумином или с моноклональным антителом HEA125, OKT3 или PA-1. Кроме того, было показано ингибирующее действие этих конъюгатов на пролиферацию клеток рака груди (MCF-7), клеток лимфомы Беркитта (Raji) и клеток T-лимфомы (Jurkat). В рассматриваемой заявке предполагалось применение линкеров, в т.ч. линкеров, включающих такие элементы, как амид, сложный эфир, простой эфир, тиоэфир, дисульфид, мочевину, тиомочевину, углеводородные фрагменты и т.п., но указанные структуры не показаны фактически, и не приведены другие подробности, например, точки присоединения к молекулам аматоксинов.
В заявках на патент WO 2010/115629 и WO 2010/115630 (обе опубликованы 14 Октября 2010) описаны конъюгаты, в которых антитела, такие как антитела против EpCAM, например, гуманизированное антитело huHEA125, соединены с аматоксинами через (i) γ C-атом аминокислоты 1 аматоксина, (ii) 6' C-атом аминокислоты 4 аматоксина или (iii) через δ C-атом аминокислоты 3 аматоксина, в каждом случае либо непосредственно, либо через линкер между антителом и аматоксинами. Предложенные линкеры включают такие элементы, как амид, сложный эфир, простой эфир, тиоэфир, дисульфид, мочевину, тиомочевину, углеводородные фрагменты и т.п. Кроме того, было продемонстрировано ингибирующее действие этих конъюгатов на пролиферацию клеток рака груди (линия клеток MCF-7), рака поджелудочной железы (линия клеток Capan-1), рака ободочной кишки (линия клеток Colo205) и холангиокарциномы (линия клеток OZ).
Известно, что аматоксины являются относительно нетоксичными, если они связаны с макромолекулярными носителями, например, молекулами антител, и их цитотоксическое действие начинает проявляться только после отщепления биомолекулярного носителя. Вследствие токсичности аматоксинов, особенно в отношении клеток печени, исключительно важно, чтобы конъюгаты аматоксина для нацеленного лечения опухолей сохраняли высокую стабильность после введения в плазму, и чтобы высвобождение аматоксина имело место после интернализации в целевые клетки. В связи с этим, незначительные улучшения стабильности конъюгата могут иметь сильное влияние на терапевтическое окно и безопасность конъюгатов аматоксина для терапевтических применений.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Таким образом, в предшествующем уровне техники существовала сильная потребность в конъюгатах аматоксина, включающих мишень-связывающие фрагменты, которые являются устойчивыми в плазме, с тем, чтобы предельно уменьшить вредные побочные воздействия на нецелевые клетки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на неожиданном обнаружении того, что нацеливающие фрагменты можно присоединить к аматоксинам через линкеры связанные с другими положениями на аминокислоте 4, т.е. триптофане, а именно с положением 1'-N, без отрицательного влияния на взаимодействие этих аматоксинов с их мишенью, т.е. ДНК-зависимой РНК полимеразой II клеток млекопитающих.
Таким образом, настоящее изобретение относится к конъюгату включающему мишень-связывающий фрагмент, соединенный линкером L с аматоксином или аналогом аматоксина, где этот линкер L соединен с аматоксином через атом 1'-N аминокислоты 4.
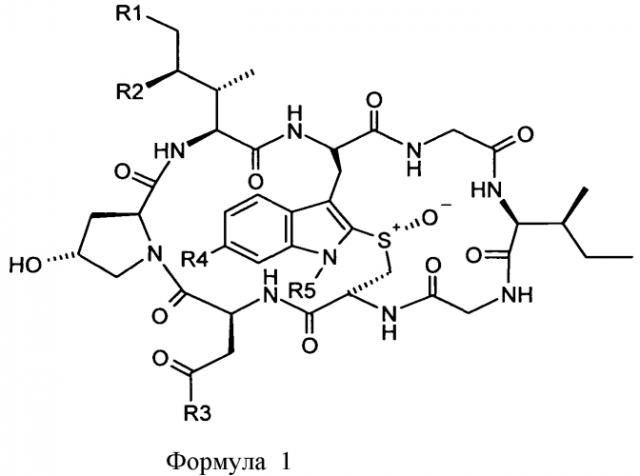
В одном из аспектов, настоящее изобретение относится к конъюгату аматоксина формулы (I):
где:
R1 означает H или OH;
R2 означает H или OH;
R3 означает NH2 или OH;
R4 означает OH или OC1-6 алкил; и
R5 означает L-T, где L означает линкер; и T означает мишень-связывающий фрагмент.
В другом аспекте, настоящее изобретение относится к фармацевтической композиции, включающей конъюгат по настоящему изобретению.
В следующем аспекте, настоящее изобретение относится к молекуле конъюгации с аматоксином формулы (I), в которой группы R1-R4 соответствуют данному выше определению; и где R5=L-X, где L означает линкер; и X означает уходящую группу, которая может быть замещена нуклеофильной группой мишень-связывающего фрагмента, в частности, первичной аминогруппой.
В еще одном аспекте, настоящее изобретение относится к способу синтеза конъюгата по настоящему изобретению, включающему стадию взаимодействия молекулы конъюгации с аматоксином по настоящему изобретению с мишень-связывающим фрагментом, включающим нуклеофильную группу, в частности первичную аминогруппу.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
На Фиг.1 показаны структурные формулы различных аматоксинов. Цифры, показанные жирным шрифтом (от 1 до 8) показывают стандартную нумерацию восьми аминокислотных остатков, образующих молекулу аматоксина. Кроме того, показаны стандартные обозначения атомов в аминокислотах 1, 3 и 4 (греческие буквы от α до γ, греческие буквы от α до δ, и числа от 1' до 7', соответственно).
На Фиг.2 показана цитотоксическая активность конъюгата Her-DSC-30.0378 [2.8] против клеток HER-2-положительных линий in vitro в анализе BrdU после инкубирования в течение 72 ч.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед ознакомлением с приведенным ниже подробным описанием изобретения, следует понимать, что настоящее изобретение не ограничено конкретной методологией, протоколами и реагентами, описанными в настоящей заявке, поскольку они могут меняться. Кроме того, следует понимать, что использованная в описании терминология служит только для описания конкретных вариантов осуществления, и она не предназначена для ограничения объема настоящего изобретения, который должен определяться только приложенной формулой изобретения. Если не приведено иного определения, все технические и научные термины, используемые в описании, имеют те же значения, которые обычно понимает под ними рядовой специалист в данной области техники.
Используемые в заявке термины предпочтительно определяются в соответствии с описаниями, данными в “A multilingual glossary of biotechnological terms: (IUPAC Recommendations)”, Leuenberger, H.G.W, Nagel, B. and Kölbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland).
В тексте настоящей заявке и следующей за ним формулы изобретения, если контекст не требует иного толкования, следует понимать, что слово «включать» и его формы, такие как «включает» и «включающий», подразумевают включение указанного целого числа или стадии, или группы чисел или стадий, но не исключают любых других чисел или стадий, или групп чисел или стадий.
В тексте настоящего описания упоминается ряд документов. Каждый из документов, упомянутых выше или ниже по тексту описания (включая все патенты, заявки на патенты, научные публикации, спецификации и инструкции производителей, инвентарные номера GenBank, представление последовательностей и т.д.), включен в настоящее описание посредством ссылки в полном объеме, в той степени, которая возможна согласно соответствующему патентному законодательству. Ничто в тексте настоящего описания не следует истолковывать, как признание, что это изобретение не дает права датировать такое изобретение задним числом на основании предыдущего изобретения.
Далее по тексту приведено более подробное описание настоящего изобретения. В следующих ниже фрагментах текста более детально раскрыты различные аспекты настоящего изобретения. Каждый из раскрытых аспектов можно скомбинировать с любым другим аспектом или аспектами, если в явном виде не указано противоположное. В частности, любой элемент изобретения, который охарактеризован, как предпочтительный или преимущественный, может быть скомбинирован с любым другим элементом или элементами, которые указаны, как предпочтительные или преимущественные.
Таким образом, настоящее изобретение относится к конъюгату, включающему мишень-связывающий фрагмент, соединенный с помощью линкера L с аматоксином или аналогом аматоксина, где линкер L соединен с аматоксином через 1'-N атом аминокислоты 4.
В контексте настоящего изобретения термин «конъюгат» относится к молекуле, включающей как минимум две различных молекулы, соединенных ковалентной связью.
Термин «мишень-связывающий фрагмент» в настоящем описании относится к любой молекуле или части молекулы, которая способна специфично связываться с целевой молекулой или целевым эпитопом. Предпочтительными мишень-связывающими фрагментами в контексте настоящей заявки являются (i) антитела или их антиген-связывающие фрагменты; (ii) белки, подобные антителам (антитело-подобные белки); и (iii) аптамеры нуклеиновых кислот. «Мишень-связывающие фрагменты», подходящие для применения в настоящем изобретении, как правило, имеют молекулярную массу, равную 40000 Дальтон (40 КДа) или более.
В настоящем описании, считается, что первое соединение (например, антитело) «специфично связывается» со вторым соединением (например, антигеном, таким как целевой белок), если константа диссоциации KD комплекса с указанным вторым соединением составляет 100 мкМ или менее, предпочтительно, 50 мкМ или менее, предпочтительно, 30 мкМ или менее, предпочтительно, 20 мкМ или менее, предпочтительно, 10 мкМ или менее, предпочтительно 5 мкМ или менее, более предпочтительно, 1 мкМ или менее, более предпочтительно 900 нМ или менее, более предпочтительно, 800 нМ или менее, более предпочтительно 700 нМ или менее, более предпочтительно, 600 нМ или менее, более предпочтительно 500 нМ или менее, более предпочтительно 400 нМ или менее, более предпочтительно 300 нМ или менее, более предпочтительно 200 нМ или менее, еще более предпочтительно 100 нМ или менее, еще более предпочтительно 90 нМ или менее, еще более предпочтительно 80 нМ или менее, еще более предпочтительно 70 нМ или менее, еще более предпочтительно 60 нМ или менее, еще более предпочтительно 50 нМ или менее, еще более предпочтительно 40 нМ или менее, еще более предпочтительно 30 нМ или менее, еще более предпочтительно 20 нМ или менее и еще более предпочтительно 10 нМ или менее.
В контексте настоящей заявки, термины «целевая молекула» и «целевой эпитоп» соответственно относятся к антигену и эпитопу антигена, которые специфично связываются с мишень-связывающим фрагментом. Предпочтительно, целевая молекула представляет собой антиген, имеющий отношение к опухоли, в частности, антиген или эпитоп, который присутствует на поверхности одного или нескольких типов опухолевых клеток в повышенной концентрации и/или в другой пространственной конфигурации по сравнению с поверхностью не опухолевых клеток. Предпочтительно, указанный антиген или эпитоп присутствует на поверхности одного или нескольких типов опухолевых клеток, но не на поверхности не опухолевых клеток. В конкретных вариантах осуществления, мишень-связывающий фрагмент специфично связывается с эпитопом HER-2/neu или молекулой адгезии эпителиальных клеток (EpCAM). В других вариантах осуществления, указанный антиген или эпитоп преимущественно экспрессируются на клетках, вовлеченных в аутоиммунные заболевания. В конкретных примерах таких вариантов осуществления, мишень-связывающий фрагмент специфично связывается с эпитопом рецептора IL-6 (IL-6R).
Термин «антитело или его антиген-связывающий фрагмент» в настоящем описании относится к молекулам иммуноглобулина и иммунологически активным фрагментам молекул иммуноглобулина, т.е. молекулам, которые содержат антиген-связывающий сайт, который иммуноспецифично связывается с антигеном. Кроме того, этот термин охватывает иммуноглобулин-подобные белки, которые отобраны с помощью методик, включающих, например, фаговый дисплей, для специфичного связывания с целевой молекулой, например, с целевым белком Her-2/neu или EpCAM. Молекулы иммуноглобулина по настоящему изобретению могут быть молекулами иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса иммуноглобулиновых молекул. «Антитела и их антиген-связывающие фрагменты», подходящие для применения в настоящем изобретении, включают, не ограничиваясь этим, поликлональные, моноклональные, моновалентные, биспецифичные, гетероконъюгаты, мультиспецифичные, человеческие, гуманизированные (в частности, CDR-привитые), деиммунизированные или химерные антитела, одноцепочечные антитела (например, scFv), фрагменты Fab, фрагменты F(ab')2, фрагменты, полученные с использованием экспрессионной библиотеки Fab, диатела или тетратела (Holliger P et al., 1993), нанотела, анти-идиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам по настоящему изобретению), а также эпитоп-связывающие фрагменты любых из перечисленных выше антител.
В некоторых вариантах осуществления, антиген-связывающие фрагменты представляют собой фрагменты человеческих антиген-связывающих антител по настоящему изобретению и включают, не ограничиваясь этим, Fab, Fab' и F(ab')2, Fd, одноцепочечные фрагменты Fvs (scFv), одноцепочечные антитела, дисульфид-связанные фрагменты Fvs (dsFv) и фрагменты, включающие любой из доменов VL или VH. Антиген-связывающие фрагменты антител включающие одноцепочечные антитела, могут содержать вариабельный домен (домены) индивидуально или в комбинации со следующими целыми фрагментами или их частями: шарнирной областью, доменами CL, CH1, CH2 и CH3. Кроме того, изобретение включает антиген-связывающие фрагменты, которые охватывают любую комбинацию вариабельного домена (доменов) с шарнирной областью и доменами CL, CH1, CH2 и CH3.
Антитела, используемые в настоящем изобретении, могут быть любого животного происхождения, включая птиц и млекопитающих. Предпочтительно, источниками антител являются организмы людей, грызунов (например, мышей, крыс, морских свинок или кроликов), кур, свиней, овец, коз, верблюдов, коров, лошадей, ослов, кошек или собак. Особенно предпочтительно, чтобы антитела имели человеческое или мышиное происхождение. В настоящем описании «человеческие антитела» включают антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, и этот термин относится к антителам, выделенным из библиотек человеческого иммуноглобулина или из трансгенных животных, имеющих гены одного или нескольких человеческих иммуноглобулинов, и которые не экспрессируют эндогенных иммуноглобулинов, как описано, например, в патенте США № 5939598, выданном Kucherlapati и Jakobovits.
Термин «антитело-подобный белок», относится к белку, который был сконструирован (например, путем мутагенеза петлевой структуры) для специфичного связывания с целевой молекулой. Обычно, такой антитело-подобный белок содержит, как минимум, одну вариабельную пептидную петлю, прикрепленную обоими концами к белковому каркасу. Эта структура с двойным связыванием значительно увеличивает сродство антитело-подобного белка к связыванию, до уровней, сравнимых с антителами. Длина вариабельной пептидной петли, как правило, составляет от 10 до 20 аминокислотных остатков. Каркасный белок может быть любым белком, имеющим хорошую растворимость. Предпочтительно, каркасный белок является глобулярным белком малого размера. Антитело-подобные белки включают, не ограничиваясь этим, миметики антител компании Affibody, антикалины, и белки с анкириновым повтором (для ознакомления с обзором смотрите Binz et al., 2005). Антитело-подобные белки можно получать из больших библиотек мутантов, например, отбирать из больших библиотек фаговых дисплеев и изолировать аналогично обычным антителам. Антитело-подобные связывающиеся белки можно получать с помощью комбинаторного мутагенеза остатков, находящихся на поверхности глобулярных белков.
Термин «аптамер нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, которая была искусственно создана путем повторяющихся циклов отбора in vitro или с помощью методики SELEX (систематической эволюции лигандов экспоненциальным обогащением) для связывания с целевой молекулой (для ознакомления с обзором смотрите: Brody and Gold, 2000). Аптамер нуклеиновой кислоты может представлять собой молекулу ДНК или РНК. Аптамеры могут включать модификации, например, модифицированные нуклеотиды, такие как 2'-фторзамещенные пиримидины.
В настоящем описании, «аналог» соединения является структурно родственным, но не идентичным этому соединению и демонстрирует хотя бы один вид активности соединения. Соединение, с которым сравнивается аналог известно под названием «первичное» соединение. Упомянутые выше виды активности включают, не ограничиваясь этим: способность связываться с другим соединением; ингибирующую активность, например, способность ингибировать ферменты; токсические действия; активирующее действие, например, способность активировать ферменты. Необязательно, чтобы аналог демонстрировал указанную активность в той же степени, что и первичное соединение. Соединение считается аналогом в контексте настоящей заявки, если оно проявляет соответствующую активность в размере как минимум 1% (более предпочтительно, как минимум 5%, более предпочтительно, как минимум, 10%, более предпочтительно, как минимум, 20%, более предпочтительно, как минимум 30%, более предпочтительно, как минимум, 40% и более предпочтительно, как минимум 50%) от активности «первичного» соединения. Таким образом, термин «аналог аматоксина» в настоящем описании относится к соединению, которое является структурно родственным любому соединению из числа α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты, показанным на фиг.1, и которое демонстрирует, как минимум, 1% (более предпочтительно, как минимум 5%, более предпочтительно, как минимум, 10%, более предпочтительно, как минимум, 20%, более предпочтительно, как минимум 30%, более предпочтительно, как минимум, 40% и более предпочтительно, как минимум 50%) ингибирующей активности в отношении РНК полимеразы II млекопитающих, от активности по крайней мере одного соединения из числа α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты. «Аналог аматоксина», подходящий для применения может проявлять даже большую ингибирующую активность в отношении РНК полимеразы II млекопитающих, чем любое соединение из числа α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты. Эту ингибирующую активность можно измерить путем определения концентрации, при которой наблюдается 50% ингибирование (значения IC50). Ингибирующую активность в отношении РНК полимеразы II млекопитающих можно определить косвенным образом, измеряя ингибирующее действие на клеточную пролиферацию. Подходящая методика для измерения ингибирования клеточной пролиферации описана в разделе примеров.
Термин «полусинтетический аналог» относится к аналогу, который был получен химическим синтезом с использованием в качестве исходных материалов соединений, полученных из природных источников (например, растительных материалов, бактериальных культур или клеточных культур). Как правило, «полусинтетический аналог» по настоящему изобретению синтезирован на основе соединения, изолированного из грибов семейства Amanita. В противоположность этому, термин «синтетический аналог» относится к аналогу, полученному т.н. «полным синтезом» из малых структурных блоков (например, химических реактивов). Как правило, такой полный синтез проводят без помощи биологических процессов.
В настоящем изобретении, термин «аптамерный конъюгат» относится к конъюгату мишень-связывающего фрагмента и токсина, в котором мишень-связывающий фрагмент представляет собой аптамер нуклеиновой кислоты согласно упомянутой выше альтернативе (iii).
Термин «линкер» в контексте настоящего изобретения относится к молекуле, которая связывает два компонента, каждый из которых присоединен к одному из концов линкера, увеличивает расстояние между двумя компонентами и ослабляет пространственное взаимодействие между двумя этими компонентами, как, например, в данном случае, между мишень-связывающим фрагментом и аматоксином. В отсутствии линкера непосредственная связь аматоксина с мишень-связывающим фрагментом может снижать способность аматоксина взаимодействовать с РНК полимеразой II. В конкретных вариантах осуществления, линкер имеет непрерывную цепь, включающую от 1 до 30 скелетных атомов (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 атомов; где в контексте настоящего изобретения, термин «от … до» используется таким образом, что он включает указанные границы), т.е. длина линкера определяется, как кратчайшее расстояние, измеренное числом атомов или связей между фрагментом аматоксина и мишень-связывающим фрагментом, где один конец цепи линкера был введен в реакцию с аматоксином, и другой ее конец с мишень-связывающим фрагментом. В контексте настоящего изобретения, линкер предпочтительно представляет собой C1-20-алкилен, C1-20-гетероалкилен, C2-20-алкенилен, C2-20-гетероалкенилен, C2-20-алкинилен, C2-20-гетероалкинилен, циклоалкилен, гетероциклоалкилен, арилен, гетероарилен, аралкилен или необязательно замещенную гетероаралкиленовую группу. Линкер может содержать один или несколько структурных элементов, таких как карбоксамид, сложный эфир, простой эфир, тиоэфир, тиоэфир, дисульфид, мочевину, тиомочевину, углеводородные фрагменты и т.п. Линкер может также содержать комбинации двух или нескольких из этих структурных элементов. Каждый из этих структурных элементов может быть представлен в линкере более одного раза, например, два раза, три раза, четыре раза, пять раз или шесть раз. В некоторых вариантах осуществления, линкер может включать дисульфидную связь. Имеется в виду, что присоединение линкера к аматоксину и мишень-связывающему фрагменту должно осуществляться либо в одну стадию, либо в две или несколько последовательных стадий. С этой целью линкер должен нести две группы, предпочтительно на проксимальном и дистальном концах, которые могут (i) образовывать ковалентную связь с группой, присутствующей в одном из двух компонентов, которые предполагается связать линкером, предпочтительно активированной группой аматоксина или мишень-связывающего пептида или (ii) которая активирована или может быть активирована для образования ковалентной связи с группой в молекуле аматоксина. Соответственно, предпочтительно, чтобы на проксимальном и дистальном концах линкера находились химические группы, которые образуются в результате такой реакции сочетания, например, сложноэфирная, эфирная, уретановая, пептидная связь и т.д.
В контексте настоящего изобретения, термин «аматоксин» включает все циклические пептиды, состоящие из 8 аминокислот, которые выделены из грибов рода Amanita и описаны в обзоре Wieland, T и Faulstich H. (Wieland T, Fauslstich H., CRC Crit Rev Biochem. 1978 Dec; 5(3): 185-260) и, кроме того, включает все их химические производные; все их полусинтетические аналоги; все их синтетические аналоги, построенные из структурных блоков по аналогии с исходной структурой природных соединений (циклические, 8 аминокислот); все синтетические или полусинтетические аналоги, содержащие негидроксилированные аминокислоты, вместо гидроксилированных аминокислот; все синтетические или полусинтетические аналоги, в которых сульфоксидная группа простого тиоэфира заменена сульфидом, сульфоном или атомами, отличными от серы, например, атомом углерода, как в карбааналоге аманитина, где в каждом случае каждое из упомянутых производных или аналогов является функционально активным с точки зрения ингибирования РНК полимеразы II млекопитающих.
С функциональной точки зрения, аматоксины определяются как пептиды или депсипептиды, которые ингибируют РНК полимеразу II млекопитающих. Предпочтительными аматоксинами являются молекулы, включающие функциональные группы, которые можно ввести во взаимодействие с молекулами линкера или мишень-связывающего фрагмента, как определено выше. Аматоксинами, которые особенно подходят для конъюгатов по настоящему изобретению, являются α-аманитин, β-аманитин, γ-аманитин, ε-аманитин, аманин, аманинамид, амануллин и амануллиновая кислота, которые показаны на фиг.1, а также их соли, химические производные, полусинтетические аналоги и синтетические аналоги. Особенно предпочтительными аматоксинами для применения в настоящем изобретении являются α-аманитин, β-аманитин и аманинамид.
В настоящем описании, термин «химическое производное» (или, сокращенно, «производное») соединения относится к соединениям, имеющим химическую структуру, которая подобна структуре исходного соединения, но содержит как минимум одну химическую группу, которая отсутствует в исходном соединении и/или не содержит, как минимум, одной химической группы, которая присутствует в исходном соединении. Соединение, с которым осуществляется сравнение производного известно как «исходное» или «первичное» соединение. Как правило, «производное» можно получить из исходного соединения химическим синтезом, включающим одну или нескольких стадий.
В конкретных вариантах осуществления настоящего изобретения, аматоксин выбран из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина или амануллиновой кислоты, или из их солей или аналогов.
В одном из аспектов, настоящее изобретение относится к конъюгату аматоксина формулы (I):
где:
R1 означает H или OH;
R2 означает H или OH;
R3 означает NH2 или OH;
R4 означает OH или OC1-6 алкил; и
R5 означает L-T; где L означает линкер; и T означает мишень-связывающий фрагмент.
В отдельном варианте осуществления, конъюгат аматоксина формулы (I) представляет собой производное α-аманитина (R1=OH; R2=OH; и R3=NH2).
В отдельном варианте осуществления, R4 означает O-Me.
В отдельном варианте осуществления, линкер соединен с мишень-связывающим фрагментом через фрагмент мочевины.
В контексте настоящего изобретения, термин «соединен с мишень-связывающим фрагментом через фрагмент мочевины» относится к связи между линкером и мишень-связывающим фрагментом, где мишень-связывающий фрагмент непосредственно прикреплен к линкеру через группу -NH-C(O)-NH-.
В отдельных вариантах осуществления настоящего изобретения, мишень-связывающий фрагмент соединен с линкером L через аминогруппу, входящую в мишень-связывающий фрагмент, где указанная аминогруппа образует часть указанного фрагмента мочевины.
В отдельных вариантах осуществления, линкер имеет длину от 1 до 8 атомов, в т.ч. от 1 до 6 атомов, более конкретно от 1 до 4 атомов и наиболее конкретно от 2 до 4 атомов. Так, например, этиленовый линкер имеет длину 2 атома, пропиленовый линкер имеет длину 3 атома и бутиленовый линкер имеет длину 4 атома.
В отдельных вариантах осуществления настоящего изобретения, линкер L включает одну или несколько групп, в частности, одну, две или три группы, выбранные из перечная, состоящего из: алкилена, алкенилена, алкинилена, циклоалкилена, гетероалкилена, гетероалкенилена, гетероалкинилена, гетероциклоалкилена, арилена, гетероарилена, аралкилена и гетероаралкилена, где каждая из этих групп может необязательно и независимо являться замещенной.
Термин «алкилен» относится к двухвалентным углеводородным группам с линейной насыщенной цепью, включающим от 1 до 20 атомов углерода, в т.ч. группам, включающим от 1 до 10 атомов углерода. В некоторых вариантах осуществления, алкиленовая группа может являться низшей алкиленовой группой. Термин «низший алкилен» относится к алкиленовым группам, включающим от 1 до 6 атомов углерода, и, в некоторых вариантах осуществления, от 1 до 5 или от 1 до 4 атомов углерода. Примеры алкиленовых групп включают, не ограничиваясь этим, метилен (-CH2-), этилен (-CH2-CH2-), н-пропилен, н-бутилен, н-пентилен и н-гексилен.
Термин «алкенилен» относится к двухвалентным группам с линейной цепью, включающим от 2 до 20 атомов углерода, в которых как минимум одна из углерод-углеродных связей является двойной, тогда как другие связи могут быть простыми связями или дополнительными двойными связями. Термин «алкинилен» в настоящей заявке относится к группам, включающим от 2 до 20 атомов углерода, в которых как минимум одна из углерод-углеродных связей является тройной, тогда как другие связи могут быть простыми, двойными или дополнительными тройными связями. Примеры алкениленовых групп включают этенилен (-CH=CH-), 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3-бутенилен и т.п. Примеры алкиниленовых групп включают этинилен, 1-пропинилен, 2-пропинилен и т.д.
Имеется в виду, что в настоящем описании термин «циклоалкилен» относится к двухвалентному циклу, являющемуся частью любой стабильной моноциклической или полициклической системы, где указанный цикл включает от 3 до 12 атомов углерода, но не содержит гетероатомов, и является полностью насыщенным, и термин «циклоалкенилен» предназначен для указания на двухвалентный цикл, являющийся частью любой стабильной моноциклической или полициклической системы, где указанный цикл включает от 3 до 12 атомов углерода, но не содержит гетероатомов, и является по крайней мере частично ненасыщенным (но исключая ариленовый цикл). Примеры циклоалкиленов включают, не ограничиваясь этим, циклопропилен, циклобутилен, циклопентилен, циклогексилен и циклогептилен. Примеры циклоалкениленов включают, не ограничиваясь этим, циклопентенилен и циклогексенилен.
Имеется в виду, что в настоящем описании термины «гетероциклоалкилен» и «гетероциклоалкенилен» относятся к двухвалентному циклу, являющемуся частью любой стабильной моноциклической или полициклической системы, где указанный цикл включает от 3 до примерно 12 атомов и состоит из атомов углерода и, как минимум, одного гетероатома, в т.ч. как минимум одного гетероатома, независимо выбранного из группы, состоящей из N, O и S, где гетероциклоалкилен относится к полностью насыщенному циклу, и гетероциклоалкенилен относится к циклу, который является хотя бы частично ненасыщенным (но исключая любые ариленовые или гетероариленовые циклы).
Имеется в виду, что термин «арилен» означает двухвалентный цикл или циклическую систему, являющуюся частью любой стабильной моноциклической или полициклической системы, где этот цикл или циклическая система включает от 3 до 20 атомов углерода, но не содержит гетероатомов, и состоит из ароматического фрагмента, который определяется согласно правилу «4n+2» π электронов, включая фенилен.
Имеется в виду, что в настоящем описании термин «гетероарилен» относится к двухвалентному циклу или циклической системе, являющейся частью любой стабильной моно- или полициклической системы, где указанный цикл или полициклическая система включают от 3 до 20 атомов, состоит из ароматического фрагмента, который определяется согласно правилу «4n+2» π электронов, и содержит атомы углерода и один или несколько гетероатомов азота, серы и/или кислорода.
В контексте настоящего изобретения, имеется в виду, что термин «замещенный» указывает на то, что один или несколько атомов водорода, присутствующих в скелете линкера, заменены группами, выбранными из указанных групп, при условии, что не превышена нормальная валентность соответствующих атомов в указанных группах или атомов в замещаемой группе, и что замещение приводит к стабильному соединению. Имеется в виду, что термин «необязательно замещенный» означает, что линкер является замещенным или незамещенным, согласно данному выше определению, одним или несколькими заместителями, которые указаны в описании. Если заместитель представляет собой кето- (или оксо, т.е. =O) группу, тио, имино, или подобную группу, тогда замещению подвергаются два атома водорода у атома линкера. Типовые заместители включают, например, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, аралкил, гетероаралкил, ацил, ароил, гетероароил, карбоксил, алкокси, арилокси, ацилокси, ароилокси, гетероароилокси, алкоксикарбонил, галоген, (тио)сложный эфир, циано, фосфорил, амино, имино, (тио)амидо, сульфгидрил, алкилтио, ацилтио, сульфонил, сульфат, сульфонат, сульфамоил, сульфонамидо, нитро, азидо, галогеналкил, включая перфторгалогеналкил (такой как трифторметил), галогеналкокси, алкилсульфанил, алкилсульфинил, алкилсульфонил, алкилсульфониламино, арилсульфоноамино, фосфорил, фосфат, фосфонат, фосфинат, алкилкарбокси, алкилкарбоксиамид, оксо, гидрокси, меркапто, амино (необязательно, моно- или ди замещенную аминогруппу, например, алкилом, арилом или гетероарилом), имино, карбоксамидо, карбамоил (необязательно, моно- или ди-замещенный, например, алкилом, арилом или гетероарилом), амидино, аминосульфонил, ациламино, ароиламино, (тио)уреидо, арил(тио)уреидо, алкил(тио)уреидо, циклоалкил(тио)уреидо, арилокси, аралкокси или -O(CH2)n-OH, -O(CH2)n-NH2, -O(CH2)nCOOH, -(CH2)nCOOH, -C(O)O(CH2)nR, -(CH2)nN(H)C(O)OR или -N(R)S(O)2R, где n означает 1-4 и заместитель R независимо выбран из водорода, -алкила, -алкенила, -алкинила, -циклоалкила, -циклоалкенила, -(С-линкер-гетероциклоалкил), -(C-линкер-гетероциклоалкенил), -арила и -гетероарила, причем допускается наличие различных степеней замещения. Специалист в данной области техники поймет, что заместители, такие как гетероциклоалкил, арил, гетероарил, алкил и т.д., или функциональные группы, такие как -OH, -NHR, и т.д. могут сами по себе быть замещенными, если имеется такая возможность. Кроме того, специалист в данной области поймет, что сами замещенные фрагменты могут быть замещенными, также если имеется такая возможность.
В отдельных вариантах осуществления настоящего изобретения, если линкер L включает m групп, выбранных из: алкилена, алкенилена, алкинилена, циклоалкилена, гетероалкилена, гетероалкенилена, гетероалкинилена, гетероциклоалкилена, арилена, гетероарилена, аралкилена и гетероаралкилена, где каждая группа может быть необязательно независимо замещенной, где указанный линкер дополнительно включает n фрагментов, независимо выбранных из дисульфида (-S-S), простого эфира (-O-), тиоэфира (-S-), амина (-NH-), сложного эфира (-O-C(=O)- или -C(=O)-O-), карбоксамида (-NH-C(=O)- или -C(=O)-NH-), уретана (-NH-C(=O)-O- или -O-C(=O)-NH-) и мочевины (-NH-C(=O)-NH-), где m=n+1. В отдельных вариантах осуществления, m означает 2, и n означает 1, или m означает 3, и n означает 2. В отдельных вариантах осуществления, линкер включает 2 или 3 незамещенные алкиленовые группы и 1 или 2, соответственно, дисульфидные, эфирные, тиоэфирные, амино, сложноэфирные, карбоксамидные, уретановые или мочевинные группы, связывающие эти незамещенные алкиленовые группы.
В отдельных вариантах осуществления настоящего изобр