Система и способ получения и хранения активированных зрелых дендритных клеток
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предложен способ получения нагруженных антигеном, активированных дендритных клеток (DC) для применения в иммунотерапии, включающий нагрузку по меньшей мере одним антигеном неактивированных DC; активацию неактивированных DC IFN-γ и липополисахаридом (LPS) для образования активированных DC; криосохранение активированных DC и размораживание активированных DC; где степень извлечения и жизнеспособность активированных DC после размораживания выше или равна приблизительно 70%, и где размороженные активированные DC продуцируют эффективное количество по меньшей мере одного цитокина для создания Т-клеточного ответа. Также рассмотрена криосохраненная композиция, содержащая DC, и способ вызова иммунного ответа у млекопитающего, включающий введение композиции по изобретению. Данное изобретение может найти дальнейшее применение в производстве лекарственных средств на основе DC. 3 н. и 12 з.п. ф-лы, 8 ил., 4 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Изучение рака показало значительные достижения, что привело к устойчивому снижению показателей смертности при многих типах злокачественных опухолей. На указанное снижение смертности повлияли усовершенствования раннего обнаружения, прогрессивные хирургические технологии и применение новых видов терапевтических вмешательств. При наличии успеха в снижении показателей смертности, связанных с раком, произошло изменение направления исследований с тем, чтобы сосредоточить внимание на новых видах таргетной терапии рака, среди которых разработка вакцин занимает центральное место. Вакцины высокоэффективны в снижении смертности, вызванной патогенами, благодаря своей способности активировать иммунную систему и обеспечивать иммунитет к чужеродным антигенам. Эффективная вакцинация не только способствует снижению смертности, но вакцины также индуцируют долговременный иммунитет, который защищает против повторной инфекции.
Способность вакцин формировать иммунитет с самого начала привлекала к ним интерес при создании противораковых вакцин. Вне всякого сомнения, противораковые вакцины всех форм продемонстрировали по меньшей мере некоторый успех в стимулировании иммунных ответов против опухолевых антигенов, выбранных в качестве мишеней. Хотя противораковые вакцины не оправдали надежд при использовании в качестве отдельной терапии, особенно на поздних стадиях заболеваний (Terrando et al.; 2007, Vaccine 25,4-16; Burgdorf et al., 2008, Oncol. Rep. 20(6), 1305-131 1), новейшие исследования позволяют предположить, что вакцины на основе дендритных клеток (DC) могут влиять на выживаемость пациентов.
В настоящее время способы, применяемые в иммунотерапии, обычно включают стимулированные ex vivo антиген-представляющие клетки (APC), где предшественники DC культивируют сразу после забора у пациента, и затем нагруженные антигеном DC вводят пациенту непосредственно после получения. Указанные способы создают временные ограничения, что не только ограничивает возможные терапевтические применения DC, но также вызывают необходимость проведения многократного афереза продуктов у пациента во время курса иммунотерапии.
Считают, что помимо презентации антигена, DC при созревании, могут кроме того воздействовать на иммунный ответ путем продуцирования ряда сигнальных молекул, в плане цитокинов и хемокинов. Однако в существовавших ранее методах DC-иммунотерапии не использовали зрелые DC. Кроме того, предыдущая работа по созреванию DC не оптимизировала полностью процесс созревания для использования сигнальной продукции DC. Поскольку нагруженные антигеном зрелые DC уже процессируют антиген и обладают способностью представлять антиген иммунным клеткам, указанные клетки, если они активированы, могут не только быстро вызывать антиген-специфические иммунные ответы, но они также могут продуцировать сигнал для дальнейшего действия иммунного ответа. Нет сомнения, что эффективное криосохранение нагруженных антигеном зрелых DC может обеспечить способ быстрого получения функционально активных клеток для иммунотерапии. Криосохранение таких клеток еще не было продемонстрировано по существу. Таким образом, существует назревшая потребность в данной области в эффективных и управляемых средствах криосохранения активированных DC способом, который сохраняет эффективную антигенную презентацию и профили сигнальной секреции свежеполученных DC. Настоящее изобретение отвечает указанной потребности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение включает способ создания нагруженных антигеном, активированных дендритных клеток (DC) для применения в иммунотерапии, способ включает: нагрузку по меньшей мере одним антигеном DC; активациу DC по меньшей мере одним агонистом TLR; криосохранение DC; и размораживание DC; где DC производит эффективное количество по меньшей мере одного цитокина для создания T-клеточного ответа.
В одном варианте осуществления антиген представляет собой опухолевый антиген. В другом варианте осуществления антиген представляет собой микробный антиген. В еще одном варианте осуществления агонист TLR представляет собой LPS. В еще одном варианте осуществления криосохранение включает замораживание DC при температуре приблизительно -70°C или ниже. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 70%. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 80%. В еще одном варианте осуществления DC киосохраняют в течение по меньшей мере приблизительно одной недели. В еще одном варианте осуществления цитокин представляет собой IL12. В еще одном варианте осуществления DC проявляет киллерную функцию, в результате чего DC способны лизировать раковые клетки-мишени.
Изобретение также включает способ активации иммунного ответа у млекопитающего, способ включает введение ранее криосохраненной композиции, содержащей нагруженные антигеном, активированные DC, млекопитающему, которое в этом нуждается, где DC нагружают антигеном и активируют перед тем как их криосохраняют.
В одном варианте осуществления антиген представляет собой опухолевый антиген. В другом варианте осуществления антиген представляет собой микробный антиген. В еще одном варианте осуществления агонист TLR представляет собой LPS. В еще одном варианте осуществления криосохранение включает замораживание DC при температуре приблизительно -70°C или ниже. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 70%. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 80%. В еще одном варианте осуществления DC криосохраняют по меньшей мере в течение приблизительно одной недели. В еще одном варианте осуществления цитокин представляет собой IL12. В еще одном варианте осуществления DC проявляет киллерную функцию, в результате чего DC способны лизировать раковые клетки-мишени.
Изобретение также включает сохраняемую композицию для вызова иммунного ответа у млекопитающего, композиция включает: DC, нагруженную по меньшей мере одним антигеном; где DC активирована путем воздействия по меньшей мере одного агониста TLR; и где DC продуцирует эффективное количество по меньшей мере одного цитокина для развития T-клеточного ответа, независимо от того была ли композиция криосохранена.
В одном варианте осуществления антиген представляет собой опухолевый антиген. В другом варианте осуществления антиген представляет собой микробный антиген. В еще одном варианте осуществления агонист TLR представляет собой LPS. В еще одном варианте осуществления композицию криосохраняют при температуре приблизительно -70°C или ниже. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 70%. В еще одном варианте осуществления степень извлечения и жизнеспособность DC после размораживания выше или равны приблизительно 80%. В еще одном варианте осуществления композицию криосохраняют по меньшей мере в течение по меньшей мере приблизительно одной недели. В еще одном варианте осуществления цитокин является IL12. В еще одном варианте осуществления DC проявляет киллерную функцию, в результате чего DC способны лизировать раковые клетки-мишени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
С целью иллюстрации изобретения, определенные варианты осуществления изобретения изображаются на чертежах. Однако изобретение не ограничивается определенными схемами и техническими средствами вариантов осуществления, изображенных на чертежах.
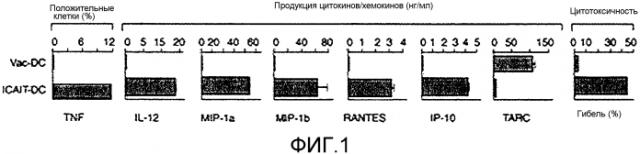
На фигуре 1 сравнивают традиционные DC (vac-DC) и ICAIT-DC в отношении продукции панели цитокинов и хемокинов, а также киллерную функцию, при помощи которой указанные клетки способны лизировать клетки линий рака молочной железы.
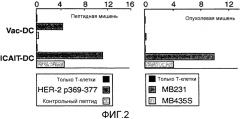
Фигура 2 иллюстрирует традиционно созревавшие DC и ICAIT-DC, успешно сенсибилизирующие T-клетки против опухолевого антигена, при этом только ICAIT-DC подготавливают T-клетки для фактического распознавания HER-2-экспрессирующих опухолей.
Фигура 3, включающая фигуры 3A и 3B, иллюстрирует аналогичные показатели жизнеспособности и восстановления активности свежих в сравнении с криосохраненными и размороженными ICAIT-DC. Используя тест вытеснения трипанового синего, жизнеспособность и показатель восстановления активности криосохраненных ICAIT DC определяли перед криосохранением и сразу после размораживания и отмывки (с помощью цинтрифугирования) криосохраненных клеток. Фигура 3A иллюстрирует три отдельных случая из набора из двух партий, тогда как фигура 3B иллюстрирует два отдельных случая из набора из двух партий. Сравнивают жизнеспособность свежеполученных и криосохраненных DC1. Степень извлечения криосохраненных DC1 составляет обычно 80-90%, и является значительно выше, чем аналогичный показатель для свежеполученных DC1, вследствие потери клеток при сборе свежеполученных DC1.
Фигура 4, включающая фигуры 4A-4F, иллюстрирует превосходные уровни продукции IL12 DC1 после размораживания при криосохранении. Неприрывную продукцию сигнала 3 (IL12) измеряли методом ELISA. На фигуре 4A показано, что продукция IL12 свежими и криосохраненными цитокин-зависимыми DC (CMDC) является значительно ниже, чем продукция IL12, наблюдаемая у свежих и криосохраненных DC1. Фигура 4B иллюстрирует продукцию IL12 DC1 перед криосохранением, через 2 часа после размораживания и через 12 часов после размораживания. На фигурах 4C-4F показана продукция IL12 криосохраненными DC1 в сравнении с DC1, полученными из криосохраненных моноцитов.
Фигура 5 иллюстрирует уровни INFγ, измеренные для криосохраненных DC1 в сравнении с DC1, полученными из криосохраненных моноцитов. Два образца очищенных аллогенных клеток CD4 (1×106/лунку) культивировали совместно с криосохраненными стимулированными агонистом TLR DC (1×105/лунку) в сравнении с DC1, полученными из криосохраненных моноцитов. Через 9 дней T-клетки собирали и повторно стимулировали на планшетах, покрытых антителом anti-CD3 и anti-CD28. Уровни IFNγ (продуцируемого T-клетками) анализировали в супернатанте через 24 часа.
Фигура 6 иллюстрирует CD4+CD25+T-клетки, ингибирующие пролиферацию иммунореактивных клеток в присутствии незрелых, но не DC1 дендритных клеток. CFSE-меченные нефракционированные реактивные лимфоциты в количестве 2,5×105 культивировали совместно с 1×105 незрелых дендритных клеток (iDC), дендритных клеток, созревавших с применением IFN-γ/LPS (LPS-активированные DC) или дендритных клеток, созревавших с применением подходящего цитокинового коктейля (CMM) в течение 5 дней. Как отмечается, вносили 1,25×105 очищенных сортированных по CD4+CD25+T-клеток (Treg). Пролиферация иммунореактивных клеток показана для CD4-селектированных и CD8-селектированных T-клеток. Представленные данные отражают 10 экспериментов. Также представлена пролиферация CD4-положительных реактивных клеток в присутствии Treg и незрелых дендритных клеток, обработанных в течение короткого периода LPS (15 минут) перед совместным культивированием.
Фигура 7, включающая фигуры 7A-7D, иллюстрирует ингибирование функции Treg дендритными клетками DC1, обусловленное растворимым фактором, но IL-6 и IL-12-независимое. На фигуре 7A показаны 1,25×105 сортированных, очищенных Treg, культивированных совместно с 1×105 незрелых дендритных клеток или LPS-активированных дендритных клеток. Показана экспрессия апоптотических маркеров Аннексин-V и 7-AAD через 24 часа. В столбчатом графике обобщен процент клеток, экспрессирующих оба маркера (+/+), только Аннексин-V (+/-), только 7-AAD (-/+), или ни одного маркера (-/-). На фигуре 7B показаны, как отмечено, 1,25×105 сортированных, очищенных Treg, культивированных совместно с 2,5×105 CFSE-меченных нефракционированных реактивных лимфоцитов в присутствии 1×105 незрелых или LPS-активированных дендритных клеток. Кроме того, 1×105 незрелых или LPS-активированных дендритных клеток добавляли на полупроницаемую мембрану Transwell®, помещенную в лунку с культурой, как отмечено. На фигуре 7C показаны 1,25×105 сортированных, очищенных Treg, культивированных совместно с 2,5×105 CFSE-меченных нефракционированных реактивных лимфоцитов и с 1×105 LPS-активированных дендритных клеток в присутствии 5 мкг/мл нейтрализующего антитела anti-IL-6 или anti-IL-12. Представленные данные отражают по меньшей мере 3 отдельных эксперимента в каждом отдельном случае. На фигуре 7D показаны Treg или CFSE-меченные нефракционированные реактивные лимфоциты, культивированные в 500 мкл культуральной среды и 500 мкл среды, взятой из культур LPS-активированных дендритных клеток приблизительно через 10 часов после добавления LPS (1×106 клеток на мл). Через 24 часа указанные "обработанные" популяции использовали в совместных культурах в стандартном отношении (1:2 Treg:реактивные клетки), как отмечено. Данные отражают 2 отдельных эксперимента.
На фигуре 8, включающей фигуры 8A и 8B, показаны супрессорные CD4+CD25+T-клетки, секретирующие эффекторные цитокины в присутствии дендритных клеток DC1. На фигуре 8 A показаны 2,5×105 сортированных по CD4+CD25+(Treg) или CD4+CD25- (Teff) T-клеток, в сочетании с 2,0×105 незрелых или LPS-активированных дендритных клеток. Супернатанты собирали через 5 дней и использовали метод ELISA для измерения количества IFN-γ, представленного в супернатанте. На 5-й день некоторые культуральные образцы пермеабилизировали и внутриклеточный IFN-γ обнаруживали с помощью проточной цитометрии. 34,4% CD4 T-клеток экспрессировали IFN-γ внутриклеточно (N=3). На фигуре 8B показаны 1,25×105 CD4+CD25+T-клеток, культивированных совместно с 1×105 незрелых или LPS-активированных DC. В некоторые образцы вносили нейтрализующее антитело anti-IL12 (5 мкг/мл). Через 48 часов клетки собирали, пермеабилизировали и внутриклеточную экспрессию T-bet и FoxP3 определяли с помощью внутриклеточного окрашивания. Результаты представлены для CD4-положительных клеток, дающих при сортировке сигнал выше порогового значения (N=3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к получению и криосохранению зрелых, нагруженных антигеном DC, активированных агонистами Toll-подобного рецептора, для индукции клинически эффективных иммунных ответов, предпочтительно при раннем применении в патологическом процессе. DC настоящего изобретения обладают способностью обуславливать сильные Th1 клеточные ответы, благодаря продукции цитокинов и химокинов, и также обладают способностью вызывать апоптоз опухолевых клеток. Способы развития DC настоящего изобретения также обеспечивают платформу для таргетинга новых молекул и раковых стволовых клеток, что может устранить клетки с высоким метастатическим потенциалом. Настоящее изобретение также относится к криосохранению указанных активированых DC способом, который сохраняет их активность и функциональность при презентации антигена, а также продукцию ими различных цитокинов и хемокинов после размораживания.
Определения
В данном контексте каждый из нижеследующих терминов имеет значение, соответствующее ему в данном разделе.
Неопределенные артикли используются в описании для обозначения одного или более чем одного (т.е. по меньшей мере один) грамматического объекта артикля. В качестве примера, "элемент" означает один элемент или более чем один элемент. Термин "приблизительно" понятен специалистам в данной области, и изменяется до некоторой степени, исходя из контекста, в котором он используется.
Термин "антитело" в данном контексте обозначает молекулу иммуноглобулина, которая способна специфически связываться со специфическим эпитопом антигена. Антитела могут представлять собой интактные иммуноглобулины, полученные из природных источников или из рекомбинантных источников, и могут представлять собой иммуноактивные части интактных иммуноглобулинов. Антитела обычно представляют собой тетрамеры молекул иммуноглобулинов. Антитела в настоящем изобретении могут существовать в различных формах включая, например, поликлональные антитела, моноклональные антитела, Fv, Fab и F(ab)2, а также одноцепочечные антитела и гуманизированные антитела (Harlow et al., 1988; Houston et al., 1988; Bird et al., 1988).
Термин "антиген" или "ag" в данном контексте определяется как молекула, которая вызывает иммунный ответ. Указанный иммунный ответ может включать либо продукцию антител, либо активацию специфических иммунокомпетентных клеток, или оба указанных процесса. Специалисту в данной области понятно, что любая макромолекула, включая практически все белки или пептиды, может служить в качестве антигена. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту в данной области понятно, что любая ДНК, которая содержит нуклеотидные последовательности или неполную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, соответственно, кодирует "антиген", в том виде как этот термин используется в описании. Кроме того, специалисту в данной области понятно, что антиген необязательно кодируется исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает, но без ограничения, применение неполных нуклеотидных последовательностей более чем одного гена и что указанные нуклеотидные последовательности располагают в различных комбинациях, чтобы вызвать желаемый иммунный ответ. Кроме того, специалисту в данной области понятно, что антиген совсем необязательно должен кодироваться "геном". Совершенно очевидно, что антиген может быть создан или может быть получен из биологического образца. Указанный биологический образец может включать, но без ограничения образец ткани, образец опухоли, клетку или биологичекую жидкость.
"Антигенпрезентирующая клетка" (APC) представляет собой клетку,которая способна активировать T-клетки, и включает, но без ограничения, моноциты/макрофаги, B-клетки и дендритные клетки (DC).
Термин "дендритная клетка" или "DC" относится к любому члену смешанной популяции морфологически сходных клеточных типов, обнаруживаемых в лимфоидной или не лимфоидной тканях. Указанные клетки характеризуются отличительной морфологией и высокими уровнями экспрессии поверхностных молекул MHC класса II. DC можно выделить из ряда тканевых источников. DC обладает высокой способностью к сенсибилизации MHC-рестриктированных T-клеток и является очень эффективной в презентации антигенов T-клеткам in situ. Антигены могут представлять собой аутоантигены, которые экспрессируются во время T-клеточного развития и толерантности, и чужеродные антигены, которые представлены во время обычных иммунных процессов.
В данном контексте "активированная DC" представляет собой DC, которую подвергали воздействию агониста Toll-подобного рецептора. Активированная DC может быть нагружена или не нагружена антигеном.
Термин "зрелая DC" в данном контексте определяется как дендритная клетка, которая экспрессирует молекулы, включая высокие уровни молекул MHC класса II, CD80 (B7. 1) и CD86 (B7.2). Напротив, незрелые дендритные клетки экспрессируют низкие уровни молекул MHC класса II, CD80 (B7.1) и CD86 (B7.2), в то же время еще могут охватывать антиген.
"Нагруженная антигеном APC" или "примированная антигеном APC" включает APC, которую подвергали воздействию антигена и которая активирована антигеном. Например, APC может стать Ag-нагруженной in vitro, например, в процессе культивирования в присутствии антигена. APC также может быть нагружена in vivo в результате воздействия антигена. Обычно "нагруженную антигеном APC" получают одним из двух способов: (1) небольшие пептидные фрагменты, известные как антигенные пептиды, “примируются” непосредственно на наружную поверхность APC; или (2) APC инкубируют с целыми белками или белковыми частицами, которые затем поглощаются APC. Указанные белки перевариваются APC в небольшие пептидные фрагменты и впоследствии транспортируются и презентируются на поверхности APC. Кром того, APC, нагруженная антигеном, также может быть создана путем введения в клетку полинуклеотида, кодирующего антиген.
Термин "аутоиммунное заболевание" в данном контексте определяется как нарушение, которое возникает в результате аутоиммунного ответа. Аутоиммунное заболевание является результатом неадекватного и чрезмерного ответа на аутоантиген. Примеры аутоиммунных заболеваний включают, но без ограничения болезнь Аддисона, очаговая алопеция, анкилозирующий спондилит, аутоиммунный гепатит, аутоиммунный паротит, болезнь Крона, диабет (1-го типа), дистрофический буллезный эпидермолиз, эпидидимит, гломерулонефрит, диффузный тиреотоксический зоб, синдром Гийена-Барре, тиреоидит Хашимото, гемолитическая анемия, системная красная волчанка, рассеянный склероз, злокачественная миастения, pemphigus vulgaris, псориаз, острая ревматическая лихорадка, ревматоидный артрит, саркоидоз, склеродермия, синдром Шегрена, спондилоартропатии, тиреоидит, васкулит, витилиго, myxedema, пернициозная анемия, язвенный колит, наряду с прочим.
В данном контексте термин "аутогенный" предназначен для обозначения любого материала, полученного от того же самого субъекта, которому указанный материал должен быть позднее повторно введен.
Термин "рак" в данном контексте определяется как заболевание, характеризующееся быстрым и неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться местно или по кровотоку и лимфатической системе к другим частям организма. Примеры различных раков включают, но без ограничения рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почки, рак печени, рак мозга, лимфома, лейкемия, рак легких и т.п.
Термин "криосохраненный" или "криосохранение" в данном контексте относится к клеткам, которые ресуспендируют в криосреде и замораживают при температуре приблизительно -70°C или ниже.
Термин "криосреда" в данном контексте относится к любой среде, смешанной с клеточным образцом при подготовке к замораживанию, такой, что по меньшей мере некоторые из клеток в клеточном образце могут восстанавливаться и остаются жизнеспособными после размораживания.
"Антиген донора" относится к антигену, экспрессированному донорной тканью, которую трансплантируют реципиенту.
"Антиген реципиента" относится к мишени для иммунного ответа для донорного антигена.
В данном контексте "эффекторная клетка" обозначает клетку, которая опосредует иммунный ответ против антигена. Пример эффекторной клетки включает, но без ограничения T-клетку и B-клетку.
В данном контексте "эндогенный" относится к любому материалу, полученному из или произведенному внутри организма, клетки, ткани или системы.
В данном контексте термин "экзогенный" относится к любому материалу, введенному извне или произведенному вне организма, клетки, ткани или системы.
Термин "эпитоп" в данном контексте определяется как небольшая химическая молекула на антигене, которая может вызвать иммунный ответ, индуцируя B- и/или T-клеточные ответы. Антиген может иметь один или более эпитопов. Большинство антигенов имеют много эпитопов; т.е. они являются мультивалентными. В общем, по величине эпитоп представляет собой приблизительно пять аминокислот и/или сахаров. Специалисту в данной области понятно, что, в целом, общая трехмерная структура, скорее чем специфичная линейная последовательность молекулы, является главным критерием антигенной специфичности и следовательно разграничивает один эпитоп от другого.
Термин "хелперная T-клетка" в данном контексте определяется как эффекторная T-клетка, главная функция которой заключается в обеспечении активации и функций других B- и T-лимфоцитов и/или макрофагов. Большинство хелперных T-клеток представляют собой CD4 T-клетки.
В данном контексте "иммуноген" относится к веществу, которое способно стимулировать или вызывать гуморальный антителовисимый и/или клоточно-опосредованный иммунный ответ у млекопитающего. Термин "иммуноглобулин" или "Ig" в данном контексте определяется как класс белков, которые действуют как антитела. Пять членов, входящих в данный класс белков, представляют собой IgA, IgG, IgM, IgD, и IgE. IgA является основным антителом, которое представлено в секретах тела, таких как слюна, слезы, грудное молоко, желудочно-кишечные секреты и слизистые секреты респираторного и мочеполового трактов. IgG является самым распространённым циркулирующим антителом. IgM является главным иммуноглобулином, продуцируемым при первичном иммунном ответе у большинства млекопитающих. IgM является самым эффективным иммуноглобулином в реакциях агглютинации, фиксации комплемента и других гуморальных иммунных ответах, и важен при защите против бактерий и вирусов. IgD представляет собой иммуноглобулин, для которого не известна функция антитела, но может служить в качестве антигенного рецептора. IgE является иммуноглобулином, который опосредует гиперчувствительность немедленного типа, вызывая высвобождение медиаторов из тучных клеток и базофилов после воздействия аллергена.
Термин "главный комплекс гистосовместимости", или "MHC", в данном контексте определяется как специфический кластер генов, многие из которых кодируют эволюционно связанные белки клеточной поверхности, участвующие в презентации антигена, которые принадлежат к наиболее важным детерминантам гистосовместимости. Молекулы класса I MHC, или MHC-I, участвуют, главным образом, в презентации антигена CD8 T-лимфоцитам. Молекулы класса II MHC, или MHC-II, участвуют, главным образом, в презентации антигена CD4 T-лимфоцитам.
В данном контексте термин "модулировать" предназначен для обозначения любого изменения в биологическом состоянии т.е. увеличения, снижения и т.п.
Термин "полипептид" в данном контексте определяется как цепь аминокислотных остатков, обычно характеризующаяся определенной последовательностью. В данном контексте термин полипептид взаимно включает термины "пептид" и "белок".
Термин "аутоантиген" в данном контексте определяется как антиген, который экспрессируется клеткой или тканью хозяина. Аутоантигены могут быть опухолевыми антигенами, но в определенных вариантах осуществления, экспрессируются так в нормальных, так и в опухолевых клетках. Специалистам в данной области понятно, что аутоантиген может экспрессироваться в клетке в повышенных количествах. В данном контексте "по существу очищенная" клетка представляет собой клетку, которая находится в основном без других типов клеток. “По существу очищенная клетка” также относится к клетке, которая отделена от других типов клеток, с которыми она обычно ассоциирована в естественном состоянии. В отдельных случаях популяция по существу очищенных клеток обозначает гомогенную популяцию клеток. В других случаях указанный термин относится просто к клеткам, которые отделили от клеток, с которыми они обычно ассоциированы в естественном состоянии. В некоторых вариантах осуществления клетки являются культурой in vitro. В других вариантах осуществления клетки не культивируют in vitro.
Термин "T-клетка" в данном контексте определяется как клетка тимусного происхождения, которая участвует в ряде клеточно-опосредованных иммунных реакций.
Термин "B-клетка" в данном контексте определяется как клетка, полученная из костного мозга и/или селезенки. B-клетки могут развиваться в плазматические клетки, которые продуцируют антитела.
Термин "Toll-подобный рецептор" или "TLR" в данном контексте определяется как класс белков, который играет роль во врожденной иммунной системе. TLR представляют собой одиночные трансмембранные, некаталитические рецепторы, которые распознают структурно консервативные молекулы микробного происхождения. TLR активируют иммунные клеточные ответы после связывания с лигандом.
Термин "агонисты Toll-подобного рецептора" или "агонисты TLR" в данном контексте определяется как лиганд, который связывается с TLR для активации иммунного клеточного ответа.
В данном контексте "терапевтически эффективное количество" представляет собой количество терапевтической композиции, достаточное, чтобы обеспечить благоприятный эффект у млекопитающего, которому вводят композицию.
Термин "вакцина" в данном контексте определяется как материал, применяемый для возбуждения иммунного ответа после введения материала животному, предпочтительно млекопитающему, и более предпочтительно человеку.
Диапазоны: в настоящем раскрытии, различные аспекты изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов используется только для удобства и краткости и не должно истолковываться как жесткое ограничение объема изобретения. Таким образом, описание диапазона следует рассматривать как содержащее конкретно раскрытые все возможные поддиапазоны, а также индивидуальные цифровые значения в пределах указанного диапазона. Например, описание диапазона, такого как от 1 до 6 следует рассматривать как содержащее конкретно раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6, etc., а также отдельные цифровые значения в пределах указанного диапазона, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Указанное выше применимо независимо от ширины диапазона.
Описание
Как предполагается в данном описании, настоящее изобретение предоставляет способ получения и криосохранения DC с улучшенными функциональными свойствами для продукции более сильных сигналов для T-клеток, и что, соответственно, дает в результате более сильную противоопухолевую вакцину на основе DC. Благодаря эффективному криосохранению таких клеток, образцы можно хранить и размораживать для последующего использования, что уменьшает необходимость повторения процессов афереза и элютриации во время приготовления вакцины. Указанные способы также могут быть использованы для непосредственного воздействия на молекулы, вовлеченные в канцерогенные сигнальные пути и на раковые стволовые клетки (CSC).
Настоящее изобретение включает зрелые, нагруженные антигеном DC, активированные агонистами Toll-подобного рецептора, которые вызывают клинически эффективные иммунные ответы, предпочтительно при раннем применении в патологическом процессе. DC настоящего изобретения продуцируют желаемые уровни цитокинов и хемокинов, и, кроме того, обладают способностью вызывать апоптоз опухолевых клеток.
Настоящее изобретение также демонстрирует, что лиганды TLR не только активируют презентирующие клетки, но также ингибируют регуляторные клетки, действие которых ограничивает адаптивные ответы. В определенных вариантах осуществления показано, что передача сигнала с помощью многочисленных Toll-подобных рецепторов, включая TLR-2, TLR-4, TLR-8, и TLR-9, отменяет супрессию под влиянием иммунорегуляторных CD4+CD25+Foxp3+T-клеток (обозначаемых здесь как Treg). В описании показано, что TLR-4-активированные дендритные клетки не только ингибируют эффекты Treg в отношении реактивных клеток, но также, по-видимому, превращают сами регуляторы в IFN-γ продуцирующие эффекторы.
Настоящее изобретение также относится к криосохранению указанных активированных DC способом, который сохраняет их активность и функциональность при представлении антигена, а также продукцию ими различных цитокинов и хемокинов после размораживания, так что криосохраненные и затем размороженные активированные DC являются такими же клинически эффективными как свежеполученные и активированные DC.
Иммунотерапия на основе DC
DC образуются из полипотентных моноцитов, которые выступают в качестве антигенпрезентирующих клеток (APC). DC распространены повсеместно в периферических тканях, где они готовы захватывать антигены. После захвата антигена DC процессируют антиген на небольшие пептиды и двигаются к вторичным лимфоидным органам. В лимфоидных органах DC представляют антигенные пептиды “наивным” T-клеткам, вызывая, таким образом, каскад сигналов которые задают направление T-клеточной дифференцировке. После воздействия DC представляют молекулы антигена, связанные либо со связывающими пептидами MHC класса I либо класса II и активируют CD8+ или CD4+ T-клетки соответственно (Steinman, 1991, Anmi. Rev. Immunol. 9:271-296; Banchereau et al, 1998, Nature392,245-252; Steinman, et al., 2007, Nature 449:419-426; Ginhoux et al., 2007, J. Exp. Med, 204:3133-3146; Banerjee et al., 2006, Blood 108:2655-2661; Sailusto et al., 1999, J. Exp. Med. 189:61 1-614; Reid et al" 2000, Curr. Opin. Immunol.12:1 14-121; Bykovskaia et al., 1999, J. Leukoc. Biol. 66:659-666; Clark et al., 2000, Microbes Infect. 2:257-272).
DC ответственны за индукцию, координацию и регуляцию адаптивного иммунного ответа и также помогают организовать взаимодействие между эффекторами врожденной части и адаптивной части иммунной системы. Указанные особенности делают DC кандидатами, имеющими большие шансы на успех при использовании в иммунотерапии. DC обладают исключительной способностью “брать пробы” из окружающей среды с помощью макропиноцитоза и эндоцитоза, опосредованного рецепторами (Gerner et al., 2008, J. Immunol.1 81:155-164; Stoitzner et al., 2008, Cancer Immunol. Immunother 57:1665-1673; Lanzevecchia A., 1996, Curr. Opin. Immunol.8:348-354; Delamarre et al., 2005, Science, 307(5715):1630-1634).
DC также нуждаются в сигналах созревания для повышения своей антиген-презентирующей способности. DC активируют экспрессию поверхностных молекул, таких как CD80 и CD86 (также известные в качестве молекул второго сигнала) путем предоставления дополнительных сигналов созревания, таких как INF-α, CD40L или агентов кальциевого сигнального пути (Czerniecki et al., 1997. J. Immunol.159:3823-3837; Bedrosian et al. 2000, J. Immunother. 23:31 1-320; Mailiiard et al., 2004, Cancer Res.64,5934-5937; Brossart et al., 1998, Blood 92:4238-4247; Jin et al., 2004, Hum. Immunol. 65:93-103). Установлено, что смесь цитокинов, содержащая TNF-a, IL-1β, IL-6 и простагландин E2 (PGE2), обладает способностью вызывать созревание DC (Jonuleit, et al., 2000, Arch. Derm. Res. 292:325-332). DC также могут созревать с помощью ионофора кальция перед тем как примируются антигеном.
Помимо патоген-распознающих рецепторов, таких как PKR и MDA-5 (Kalali et al., 2008, J. Immunol. 181:2694-2704; Nallagatla et al., 2008, RNA Biol, 5(3):140-144), DC также содержат серии рецепторов, известных как Toll-подобные рецепторы (TLR), которые также способны распознавать опасные патогены. Когда указанные TLR приводятся в действие, индуцируются серии активационных изменений в DC, которые приводят к созреванию и передаче сигналов T-клеток (Boullart et al. 2008, Cancer Immunol. Immunother. 57(11):1589-1597; Kaisho et al., 2003, Curr. Mot. Med. 3(4):373-385; Pulendran et al., 2001, Science 293(5528):253-256; Napolitani et al, 2005, Nat. Immunol. 6(8):769-776). DC могут активировать и усиливать различные ветви клеточно-опосредованного ответа, такие как натуральные киллерные γ-δ T и α-β T-клетки и, после активации DC сохраняют свою иммуногенность (Steinman, 1991, Annu. Rev. Immunol. 9:271-296; Banchereau et al., 1998, Nature 392:245-252; Reid et al., 2000, Curr. Opin. Immunol. 12:114-121 ; Bykovskaia et al., 1999, J. Leukoc. Biol.66:659-666; Clark et al., 2000, Microbes Infect. 2:257-272).
DC-продукция сигнала
Считают, что зрелые DC более эффективны в активации T-клеточно-опосредованных иммунных ответов (Jonuleit et al., 2001, Int. J. Cancer, 93:243-251; Prabakaran et al., 2002, Ann. Surg. Oncol. 9:41 M 18; Xu et al., 2003, J. Immunol. 171:225 1-2261). Зрелые DC способны к формированию более сильного T-клеточного ответа по сравнению с незрелыми DC, отчасти потому что специфические цитокины секретируются зрелыми DC, которые потенцируют более сильный и более действенный T-клеточный ответ. Например, зрелые DC продуцируют IL-12 после взаимодействия с CD4 T-клетками (Koch et al., 1996, J. Exp. Med. 184:741-746; Heifler et al., 1996, Eur. J. Immunol. 26:659-668). DC, которые секретируют Th1-запускающие цитокины, такие как IL-12, IL-18 и IL-23, обозначают как поляризованные DC типа 1, или DC1 (Kalinski, et al., 1999, Immunol. Today 20:561-567; Lanzavecchia et al" 2000, Science 290(5489):92-97).
Цитокины, продуцируемые зрелыми DC, изменяют эффекты на T-клеточный ответ. Например, IL-12, гетородимерный цитокин, продуцируется DC и является основным в образовании IFN-γ-секретирующих CD4+ и CD8+ T-клеток и в усилении антибактериального и противоопухолевого ответов (Gee et al., 2009, Inflamm. Allergy Drug Targets 8:40-52). IL-12 также может ингибировать рост первичной опухоли, а также метастатических опухолевых клеток в мышиных моделях карциномы яичника (OV-HM) (Tatsumi et al., 2001, Cancer Res. 61:7563-7567). IL-12 также может опосредовать образование высоко авидных противоопухолевых T-клеток (Xu et al., 2003, J. Immunol. 171:2251-2261), таким образом, усиливая противоопухолевую T-клеточную функцию. DC также продуцируют хемокины, в качестве четвертого сигнала, который приводит к накоплению T-клеток и затем воздействует на дальнейшие T-клеточные ответы (Xiaoet al., 2003, Cytokine 23:12