Конструкции нуклеиновой кислоты, содержащие кластер генов биосинтеза пирипиропена и маркерный ген
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложена конструкция нуклеиновой кислоты, содержащая кластер генов биосинтеза пирипиропена и маркерный ген. Предложен трансформант, полученный путем введения вышеуказанной конструкции нуклеиновой кислоты в клетку-хозяина нитевидного гриба, продуцирующего пирипиропены. Также предложен трансформант, полученный путем одновременного или раздельного введения конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена, и конструкции нуклеиновой кислоты, содержащей маркерный ген, в клетку-хозяина нитевидного гриба, продуцирующего пирипиропены. Предложен способ продукции пирипиропенов А, Е или О с использованием вышеуказанных трансформантов. Группа изобретений позволяет получить повышенную продукцию указанных пирипиропенов трансформантом по сравнению с родительской клеткой. 4 н. и 6 з. п. ф-лы., 7 ил., 5 табл., 20 пр.
Реферат
ОПИСАНИЕ
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По данной патентной заявки испрашивается приоритет по патентной заявке Японии No. 14700/2010, поданной 26 января 2010 года, и по патентной заявке Японии No. 253183/2010, поданной 11 ноября 2010 года, содержание которых включено в настоящий документ путем ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген.
Предшествующий уровень техники
На сегодняшний день установлено, что существует 18 типов природных аналогов пирипиропена от пирипиропена A до пирипиропена R, отличающихся структурой их боковых цепей (Непатентный документ 1).
Выявлено, что пирипиропены обладают ACAT ингибиторной активностью (Патентный документ 1). Предполагается возможность их применения для лечения заболеваний, вызванных накоплением холестерина или т.п. Также выявлено, что пирипиропены обладают инсектицидной активностью против личинок Helicoverpa armigera (Непатентный документ 2), личинок капустной моли (Патентный документ 2), Tenebrio molitor (Патентный документ 2) или афид (Патентный документ 3), и предполагается возможность их применения в качестве инсектицидов.
Известно, что пирипиропены продуцируются как вторичные метаболиты нитевидными грибами. Например, выявлено, что штамм Penicillium coprobium PF1169 (Патентный документ 4), штамм Aspergillus fumigatus IFO-1289 (Патентный документ 5), штамм Eupenicillium reticulosporum NRRL-3446 (Непатентный документ 2) или штамм Penicillium griseofulvum F1959 (Патентный документ 2) продуцируют пирипиропены.
Промышленное производство пирипиропенов осуществляют за счет культивирования указанных выше бактерий-продуцентов и получения пирипиропенов. В основном, количество продуктов вторичного метаболизма, продуцируемых изолированным природным микроорганизмом, мало. Для промышленного использования необходимо увеличить выработку желаемых продуктов.
Чтобы увеличить выработку желаемых продуктов, ведутся исследования способа культивирования микроорганизмов продуцентов желаемых продуктов, исследования компонентов среды для культивирования и модификаций условий ферментации, таких как добавление предшественников, а также модификаций бактериальных штаммов при помощи мутаций, вызванных ультрафиолетом или мутагенами. Кроме того, дополнительно к этим способам, для увеличения выработки недавно начали применять генетическую рекомбинацию.
В основе способа улучшения выработки при помощи генетической рекомбинации лежит усиление экспрессии генов биосинтеза. Например, используя данный способ, предложили способ увеличения выработки вещества PF1022, продуцируемого Agonomycetales (Патентный документ 6). Для применения данного способа необходимо выделить гены биосинтеза желаемого продукта и разработать способ трансформации ими микроорганизмов продуцентов желаемого продукта.
Что касается пирипиропенов, до настоящего времени не сообщалось о выделении кластера генов их биосинтеза. Кроме того, способ трансформации пирипиропен-продуцирующих грибов, в качестве хозяина, не был показан. Таким образом, до настоящего времени представлялось трудным введение кластера генов биосинтеза пирипиропенов в пирипиропен-продуцирующие микроорганизмы, и невозможно было достичь увеличения выработки при помощи генетической рекомбинации.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[Патентный документ 1] Выложенная патентная заявка Японии No. 184158/1994
[Патентный документ 2] WO2004/060065
[Патентный документ 3] WO2006/129714
[Патентный документ 4] Journal of Technical Disclosure No. 500997/2008
[Патентный документ 5] Выложенная патентная заявка Японии No. 360895/1992
[Патентный документ 6] Патентная заявка Японии No. 3961289
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[Непатентный документ 1] Journal of Antibiotics (1996), 49(3), 292-298
[Непатентный документ 2] Applied and Environmental Microbiology (1995), 61 (12), 4429-4435
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что за счет экспрессии конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген, у хозяина значительно увеличивалась выработка пирипиропенов. Настоящее изобретение осуществлено на основании данного наблюдения.
Таким образом, цель настоящего изобретения заключается в предоставлении конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген.
В соответствии с одним из вариантов осуществления настоящего изобретения предоставляется конструкция нуклеиновой кислоты, содержащая кластер генов биосинтеза пирипиропена и маркерный ген.
Также, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется трансформант, полученный за счет введения указанной выше конструкции нуклеиновой кислоты в хозяина.
Дополнительно, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется трансформант, полученный за счет одновременного или раздельного введения конструкции нуклеиновой кислоты, содержащей указанный выше кластер генов биосинтеза пирипиропена, и конструкция нуклеиновой кислоты, содержащая указанный выше маркерный ген, в хозяина.
Кроме того, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется способ производства пирипиропенов, включающий культивирование указанных выше трансформантов и получение пирипиропенов из культуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[Фиг.1] На фиг.1 представлена электрофоретический картина ПЦР продуктов в агарозном геле. Для электрофореза ПЦР продукты амплифицировали, используя следующие праймеры: M: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 1: праймеры SEQ ID NO:1 и 2, дорожка 2: праймеры SEQ ID NO:239 и 240, дорожка 3: праймеры SEQ ID NO:237 и 238, дорожка 4: праймеры SEQ ID NO:241 и 242, дорожка 5: праймеры SEQ ID NO:247 и 248, дорожка 6: праймеры SEQ ID NO:251 и 252, дорожка 7: праймеры SEQ ID NO:245 и 246, дорожка 8: праймеры SEQ ID NO:243 и 244, дорожка 9: праймеры SEQ ID NO:249 и 250, дорожка 10: праймеры SEQ ID NO:235 и 236, дорожка 11: праймеры SEQ ID NO:233 и 234, дорожка 12: праймеры SEQ ID NO:227 и 228, дорожка 13: праймеры SEQ ID NO:229 и 230, дорожка 14: праймеры SEQ ID NO:231 и 232.
[Фиг.2] Аналогично фиг.1, на фиг.2 представлена электрофоретическая картина ПЦР продуктов в агарозном геле. Для электрофореза ПЦР продукты амплифицировали, используя следующие праймеры: M: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 1: праймеры SEQ ID NO:253 и 254, дорожка 2: праймеры SEQ ID NO:257 и 258, дорожка 3: праймеры SEQ ID NO:259 и 260, дорожка 4: праймеры SEQ ID NO:255 и 256, дорожка 5: праймеры SEQ ID NO:261 и 262.
[Фиг.3] Аналогично фиг.1, на фиг.3 представлена электрофоретическая картина ПЦР продуктов в агарозном геле. Для электрофореза, ПЦР продукты амплифицировали, используя следующие праймеры: дорожка 1: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 2: праймеры SEQ ID NO:264 и 265 (амплифицированный фрагмент в 400 п.н.).
[Фиг.4] На фиг.4 представлена карта плазмидного вектора pBI-AnGPD-EGFP, используемого для нитевидных грибов. На данной фигуре, RB относится к правой границе, HYGr относится к области, кодирующей устойчивость к гигромицину, PAngpdA относится к промотеру глицеральдегид-3-фосфат дегидрогеназы Aspergillus nidulans, EGFP относится к области, кодирующей усиленный зеленый флуоресцентный белок, TAngpdA относится к терминатору глицеральдегид-3-фосфат дегидрогеназы Aspergillus nidulans, и LB относится к левой границе.
[Фиг.5A] На фиг.5A слева показаны устойчивые к гигромицину колонии, образованные при заражении Agrobacterium, и справа показаны результаты наблюдения флуоресценции GFP.
[Фиг.5B] На фиг.5B слева показаны колонии штамма Penicillium coprobium PF1169 без заражения Agrobacterium, причем колонии образовались на среде, не содержащей гигромицин, и справа показаны результаты наблюдения флуоресценции GFP.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Депонирование микроорганизмов
Escherichia coli (Escherichia coli EPI300TM-T1R), трансформированную плазмидой pCC1-PP1, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11133 (преобразован из внутреннего депонирования под инвентарным номером FERM P-21704) (идентификационная ссылка: Escherichia coli EPI300TM-T1R/pCC1-PP1) 9 октября 2008 года (дата депонирования).
Escherichia coli, трансформированную плазмидой pPYRI02, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11203 (идентификационная ссылка: XL1-Blue MRA/pPYRI02) 14 декабря 2009 года.
Escherichia coli, трансформированную космидой pPYRI07, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science и Technology (Address: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11316 (идентификационная ссылка: XL1-Blue MRA/pPYRI07) 1 декабря 2010 года.
Кластер генов биосинтеза пирипиропена
Кластер генов биосинтеза пирипиропена в настоящем изобретении помещают в конструкцию нуклеиновой кислоты таким образом, чтобы иметь возможность экспрессировать его вместе с ниже описанным маркерным геном в хозяине. При условии, что кластер генов вовлечен в биосинтез пирипиропенов, он никак не ограничивается. Предпочтительно, предлагается конструкция, содержащая по меньшей мере одну полноразмерную нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (I)-(IV), или ее часть:
(I) участок от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266;
(II) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной участку от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266, и кодирующая белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266;
(III) нуклеотидная последовательность полинуклеотида участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266 в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266; и
(IV) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266, и которая кодирует белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266.
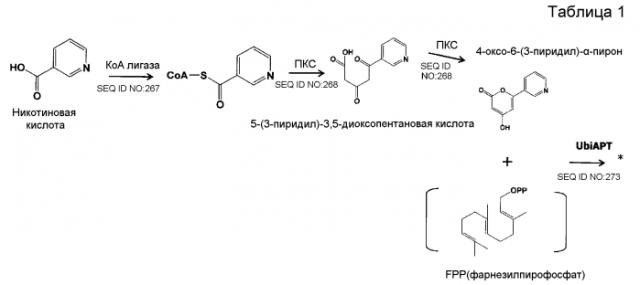
В соответствии с другим предпочтительным вариантом осуществления кластер генов биосинтеза пирипиропена в настоящем изобретении представляет собой кластер генов, содержащий интересующий ген и область регуляции экспрессии. В настоящем описании интересующий ген представляет собой один или более генов, кодирующих белок, участвующий в биосинтезе пирипиропенов. Также, область регуляции экспрессии никак не ограничивается при условии, что она содержит нуклеотидную последовательность, необходимую для регуляции экспрессии указанного выше интересующего гена в хозяине. Например, включаются промоторы и терминаторы, являющиеся нуклеотидными последовательностями, регулирующими уровень транскрипции интересующего гена в хозяине. Кроме того, белок, участвующий в биосинтезе пирипиропенов представляет собой, например, белок, каким-либо образом участвующий в пути биосинтеза, представленном на нижеследующей схеме 1.
Схема 1
В соответствии с предпочтительным вариантом осуществления интересующего гена в настоящем изобретении конструкция нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую по меньшей мере одну аминокислотную последовательность, выбранную из SEQ ID NO:267-275, или аминокислотную последовательность по существу эквивалентную представленным выше.
В соответствии с другим предпочтительным вариантом осуществления интересующего гена в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность согласно (a)-(i):
(a) нуклеотидная последовательность участка от 3342 до 5158 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(b) нуклеотидная последовательность участка от 5382 до 12777 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(c) нуклеотидная последовательность участка от 13266 до 15144 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(d) нуклеотидная последовательность участка от 16220 до 18018 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(e) нуклеотидная последовательность участка от 18506 до 19296 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(f) нуклеотидная последовательность участка от 19779 до 21389 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(g) нуклеотидная последовательность участка от 21793 до 22877 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(h) нуклеотидная последовательность участка от 23205 до 24773 нуклеотидной последовательности, представленной в SEQ ID NO:266, и
(i) нуклеотидная последовательность участка от 25824 до 27178 нуклеотидной последовательности, представленной в SEQ ID NO:266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности по (1), и кодирующая белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности по (1), и которая кодирует белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей.
В соответствии с еще одним предпочтительным вариантом осуществления интересующего гена в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеследующих нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность, содержащая все полноразмерные нуклеотидные последовательности, указанные выше согласно (a)-(i) или (a)-(h);
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности согласно (1), и кодирующая белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности согласно (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности по (1), и которая кодирует белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью.
В соответствии с предпочтительным вариантом осуществления области регуляции экспрессии в настоящем изобретении, предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) полноразмерная нуклеотидная последовательность, выбранная из нижеуказанных последовательностей согласно (j)-(s), или их часть:
(j) нуклеотидная последовательность участка от 2911 до 3341 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(k) нуклеотидная последовательность участка от 5159 до 5381 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(l) нуклеотидная последовательность участка от 12778 до 13265 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(m) нуклеотидная последовательность участка от 15145 до 16219 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(n) нуклеотидная последовательность участка от 18019 до 18505 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(o) нуклеотидная последовательность участка от 19297 до 19778 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(p) нуклеотидная последовательность участка от 21390 до 21792 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(q) нуклеотидная последовательность участка от 22878 до 23204 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(r) нуклеотидная последовательность участка от 24774 до 25823 нуклеотидной последовательности, представленной в SEQ ID NO:266, и
(s) нуклеотидная последовательность участка от 27179 до 27797 нуклеотидной последовательности, представленной в SEQ ID NO:266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с нуклеотидной последовательностью по (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который имеет функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей.
В соответствии с более предпочтительным вариантом осуществления области регуляции экспрессии в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность, содержащая все полноразмерные нуклеотидные последовательности, указанные выше согласно (j)-(s) или (j)-(r);
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с нуклеотидной последовательностью по (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который имеет функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей.
В качестве кластера генов биосинтеза пирипиропена в настоящем изобретении можно использовать полноразмерный или часть кластера генов биосинтеза, выделенного из пирипиропен-продуцирующих грибов, предпочтительно, можно использовать полноразмерный или часть кластера генов биосинтеза пирипиропена, полученного из штамма Penicillium coprobium PF1169, представленного в SEQ ID NO:266, и более предпочтительно, можно использовать полноразмерный кластер генов биосинтеза пирипиропена, полученный из штамма Penicillium coprobium PF1169, представленный в SEQ ID NO:266.
В настоящем изобретении термин "по существу эквивалентная аминокислотная последовательность" означает аминокислотную последовательность полипептида, активность которого не изменилась несмотря на то, что одна или несколько аминокислот подверглись замене, делеции, добавлению или вставке. Предпочтительно, чтобы аминокислотная последовательность, измененная за счет аминокислотных замен, делеций, добавлений или вставок, имела 70% идентичность или более, предпочтительно, 80% или более, более предпочтительно, 90% или более, еще более предпочтительно, 95% или более и, еще более предпочтительно, 98% идентичность или более аминокислотной последовательности до изменений и т.п. Кроме того, количество измененных аминокислотных остатков находится в пределах, предпочтительно, 1-40, более предпочтительно, 1-20, еще более предпочтительно, 1-10, еще более предпочтительно, 1-8 и, наиболее предпочтительно, 1-4.
Кроме того, примеры изменений, не влияющих на активность, включают консервативные замены. Термин "консервативная замена" означает замену, предпочтительно, 1-40, более предпочтительно, 1-20, более предпочтительно, 1-10, еще более предпочтительно, 1-8 и, наиболее предпочтительно, 1-4 аминокислотных остатков другими химически схожими аминокислотными остатками так, что активность полипептида по существу не изменяется. Примеры подобных замен включают случаи, когда некоторый гидрофобный аминокислотный остаток заменяется другим гидрофобным аминокислотным остатком и случаи, когда некоторый полярный аминокислотный остаток заменяется другим полярным аминокислотным остатком, имеющим такой же заряд. Функционально схожие аминокислоты, подходящие для подобных замен, являются известными в данной области для каждой аминокислоты. Конкретно, примеры не полярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин, метионин и т.п. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин, цистеин и т.п. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин, лизин и т.п. Примеры отрицательно заряженных (кислотных) аминокислот включают аспарагиновую кислоту, глутаминовую кислоту и т.п.
Термин "жесткие условия" в настоящем изобретении означает условия, при которых проводится процедура отмывки мембран после гибридизации, включающие высокую температуру и раствор с низкой концентрацией солей, специалисты в данной области могут соответствующим образом выбрать условия, например, условия для отмывки в растворе с 2×SSC (1×SSC: 15 мМ трицитрата натрия, 150 мМ хлорида натрия) и 0,5% SDS при 60°C в течение 20 минут, и условия отмывки в растворе с 0,2×SSC (1×SSC: 15 мМ трицитрата натрия, 150 мМ хлорида натрия) и 0,1% SDS при 60°C в течение 15 минут.
Гибридизацию можно проводить в соответствии с известными способами. Также, в случае использования коммерчески доступной библиотеки, гибридизацию можно проводить в соответствии со способом, описанным в прилагающейся инструкции.
В настоящем описании, термин "идентичность" (также обозначаемый как гомология) нуклеотидных последовательностей означает степень совпадения оснований между двумя сравниваемыми последовательностями. При этом учитываются наличие пропусков и характеристики аминокислот. Любые значения "идентичности", указанные в настоящем описании, могут быть значениями, рассчитанными с помощью программ для определения идентичности, известных специалистам в данной области. Например, значения легко вычисляются при использовании FASTA, BLAST или т.п. с параметрами, установленными по умолчанию (начальная установка).
В настоящем описании "идентичность" нуклеотидных последовательностей равняется 90% или более, предпочтительно, 95% или более, более предпочтительно, 98% или более, еще более предпочтительно, 99% или более.
В настоящем описании термин "один или более нуклеотидов удалены, заменены, вставлены или добавлены к полинуклеотиду" означает, что были сделаны изменение известным способом, таким как сайт-специфический мутагенез, замена и т.п. множества нуклеотидов в той степени, в которой они встречаются в природе. Количество измененных нуклеотидов равняется одному или более нуклеотидам (например, от одного до нескольких нуклеотидов или 1, 2, 3 или 4 нуклеотида).
Термин "нуклеотидная последовательность, которая кодирует белок, по существу эквивалентный белку, кодируемому (любой из указанных) нуклеотидной последовательностью" означает нуклеотидную последовательность, кодирующую белок, который обладает активностью эквивалентной активности «белка, кодируемого (любой из указанных) нуклеотидной последовательностью."
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 3342 до 5158 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел КоА-лигазную активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 5382 до 12777 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел LovB-подобную поликетидсинтазную (ПКС) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 13266 до 15144 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел цитохром P450 монооксигеназную (1) (P450-1) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 16220 до 18018 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел цитохром P450 монооксигеназную (2) (P450-2) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 18506 до 19296 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел циклазную активность (IMP: Интегральный мембранный белок).
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 19779 до 21389 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ФАД-зависимую монооксигеназную (FMO) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 21793 до 22877 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел UbiA-подобную пренилтрансферазную (UbiAPT) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 23205 до 24773 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ацетилтрансферазную (AT) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 25824 до 27178 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ацетилтрансферазную-2 (AT-2) активность.
"Нуклеотидная последовательность, имеющая функцию, по существу эквивалентную любой из указанных нуклеотидных последовательностей" никак не ограничивается при условии, что она обладает функцией, эквивалентной "любой из указанных нуклеотидных последовательностей" и, например, означает обладание функцией, эквивалентной области регуляции экспрессии интересующего гена, и, более конкретно, например, функцией, эквивалентной активности промотора или активности терминатора.
Указанный выше интересующий ген и область регуляции экспрессии можно получить, осуществляя амплификацию ДНК при помощи ПЦР, используя геномную ДНК, выделенную из пирипиропен-продуцирующих грибов или т.п., в качестве матрицы и используя подходящие праймеры, синтезированные на основании указанной выше нуклеотидной последовательности, или осуществляя общий химический синтез.
Пирипиропены
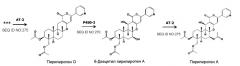
Пирипиропены в настоящем изобретении включают от пирипиропена A до пирипиропена R, и, предпочтительно, представляют собой пирипиропен A, E и O, где пирипиропен A является наиболее предпочтительным.
Способ выделения кластера генов биосинтеза пирипиропена
Кластер генов биосинтеза пирипиропена можно выделить, например, следующим способом. Например, геномную ДНК пирипиропен-продуцирующих грибов выделяют и расщепляют подходящими рестрикционными ферментами, после чего создают библиотеку, состоящую из геномной ДНК, используя космидный вектор. Затем, основываясь на нуклеотидной последовательности, содержащейся в кластере генов биосинтеза пирипиропена, такой как последовательность цитохрома P450, синтезируют подходящие праймеры так, как описано в примере 12. Для амплификации фрагмента ДНК, содержащего часть кластера генов биосинтеза, проводят ПЦР, используя полученные праймеры и геномную ДНК, полученную из пирипиропен-продуцирующих грибов в качестве матрицы. Используя данный фрагмент ДНК в качестве зонда можно выделить полноразмерный или часть кластера генов биосинтеза пирипиропена, проводя скрининг геномной библиотеки.
Кластер генов биосинтеза пирипиропена, экспрессируемый в хозяине, в настоящем изобретении может быть получен с помощью, вдобавок к указанному выше способу, лигирования интересующего гена под контроль области регуляции экспрессии, работающей в организме хозяина. Можно использовать любой способ лигирования интересующего гена и области регуляции экспрессии при условии, что интересующий ген будет экспрессироваться в хозяине. Например, существует способ функционального лигирования промотора выше интересующего гена и терминатора ниже него. Лигирование интересующего гена с областью регуляции экспрессии по настоящему изобретения можно проводить в соответствии с любым известным способом.
Маркерный ген
Маркерный ген по настоящему изобретению встраивают в конструкцию нуклеиновой кислоты таким образом, чтобы он мог экспрессироваться вместе с вышеописанным кластером генов биосинтеза пирипиропена в хозяине и позволял осуществлять селекцию трансформантов, за счет соответствующего селективного признака. Например, можно использовать гены, кодирующие устойчивость к лекарственным средствам и гены ауксотрофности. Примеры генов, кодирующих устойчивость к лекарственным средствам, включают гены против лекарственных средств, таких как дестомицин, гигромицин, беномил, олигомицин, G418, блеомицин, биалафос, бластицидин S, флеомицин, фосфинотрицин, ампициллин или канамицин, предпочтительными являются ген устойчивости к дестомицину или ген устойчивости к гигромицину. Примеры генов ауксотрофности, включают гены, такие как amdS, pyrG, argB, trpC, niaD, TRP1, LEU2 или URA3.
Эти маркерные гены можно выделить, амплифицировать, или синтезировать, используя такой же способ как, например, для кластера генов биосинтеза пирипиропена.
Конструкция нуклеиновой кислоты
Конструкция нуклеиновой кислоты в настоящем изобретении может находиться в любой форме при условии, что его можно ввести в геном хозяина, предпочтительной является форма, встроенная в вектор, который введен в хозяина. Таким образом, в соответствии с предпочтительным вариантом осуществления настоящего изобретения предлагается рекомбинантный вектор, содержащий конструкцию нуклеиновой кислоты по настоящему изобретению.
Рекомбинантный вектор по настоящему изобретению можно получить, встроив кластер генов биосинтеза пирипиропена и маркерный ген, экспрессируемые в хозяине, в подходящий вектор.
В качестве способа для создания рекомбинантного вектора, можно использовать любой общепринятый способ генетической инженерии.
В качестве вектора, который можно использовать в настоящем изобретении, можно использовать любой вектор при условии, что его можно ввести в хозяина. Примеры таких векторов включают космиды, фаговые векторы, плазмиды на основе pUC, плазмиды на основе pBluescript, плазмиды pBR322 и т.п.
Хозяин
Хозяин, который может быть использован в настоящем изобретении, никак не ограничивается при условии, что он при введении конструкции нуклеиновой кислоты по настоящему изобретению способен продуцировать пирипиропены. Хозяин, предпочтительно, представляет собой микроорганизм, способный продуцировать пирипиропены даже в состоянии, до введения конструкции нуклеиновой кислоты по настоящему изобретению. Более предпочтительно, он представляет собой нитевидный гриб, еще более предпочтительно, микроорганизм, принадлежащий роду Penicillium, роду Eupenicillium или роду Aspergillus, еще более предпочтительно, Penicillium coprobium, Penicillium griseofulvum, Eupenicillium reticulosporum или Aspergillus fumigatus. Среди них, наиболее предпочтителен Penicillium coprobium, предпочтительно, штамм Penicillium coprobium PF1169.
Получение трансформанта
По настоящему изобретению предлагается трансформант с введенным кластером генов биосинтеза пирипиропена, полученный при трансформации указанного выше хозяина указанной выше конструкции нуклеиновой кислоты. Способ введения конструкции нуклеиновой кислоты в хозяина никак не ограничивается при условии, что в результате осуществляется введение в хозяина. Например, конструкцию нуклеиновой кислоты можно ввести в хозяина следующим способом, используя рекомбинантный вектор.
Введение конструкции нуклеиновой кислоты в хозяина, используя рекомбинантный вектор, можно проводить в соответствии с традиционным способом. Примеры способов введения включают электропорацию, обработку полиэтиленгликолем, способ с использованием Agrobacterium, способ с использованием солей лития, способ с использованием хлорида кальция и т.п. Выбирается способ наиболее эффективный для клетки-хозяина. В случае использования Penicillium coprobium в качестве хозяина, предпочтительна обработка полиэтиленгликолем.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, предлагается трансформант, полученный при введении плазмиды pPYRI02 в хозяина (инвентарный номер E. coli, трансформированной плазмидой pPYRI02: FERM BP-11203) или космиды pPYRI07 в хозяина (инвентарный номер E. coli, трансформированной космидой pPYRI07: FERM BP-11316).
Культивирование трансформанта и получение пирипиропенов
По настоящему изобретению предлагается способ получения пирипиропенов, включающий культивирование полученных как описано выше трансформантов и получение пирипиропенов из культуры, предпочтительно, способ получения пирипиропенов в большом количестве.
Культивирование трансформантов можно проводить соответствующим образом выбрав среду, условия культивирования и т.п. в соответствии с традиционным способом. В составе среды часто используются следующие компоненты, например, в качестве источника углерода можно использовать глюкозу, сахарозу, целлюлозу, крахмальный сироп, декстрин, крахмал, глицерин, патоку, животные и растительные масла или т.п. Также, в качестве источника азота можно использовать соевую муку, проростки пшеницы, pharmamedia, кукрузный эктракт, хлопковый жмых, бульон, пептон, полипептон, солодовый экстракт, дрожжевой экстракт, сульфат аммония, нитрат натрия, мочевину или т.п. Кроме того, при необходимости, является эффективным добавление натрия, калия, кальция, магния, кобальта, хлора, фосфорной кислоты, серной кислоты или неорганических солей, которые могут генерировать ионы, таких как хлорид калия, карбонат кальция, двухосновный калий фосфат, сульфат магния, калий дигидроген фосфат, сульфат цинка, сульфат марганца или сульфат меди. Также, при необходимости, можно добавлять минорные компоненты такие как различные витамины, такие как тиамин (тиамина гидрохлорид или т.п.), аминокислоты, такие как глутаминовая кислота (глутамат натрия или т.п.) или аспарагин (DL-аспарагин или т.п.), или нуклеотиды; или селектирующие вещества, такие как антибиотики. Кроме того, можно соответствующим образом добавлять органические вещества или неорганические вещества, которые способствуют росту грибов и стимулируют продукцию пирипиропенов.
В качестве способа культивирования можно использовать культивирование при перемешивании в аэробных условиях, культивирование при перемешивании с продуванием воздуха или глубинное аэробное культивирование, в частности, наиболее подходящим является культивирование при перемешивании с продуванием воздуха. pH среды находится в диапазоне, например, приблизительно 6-8. Подходящая температура для кул