Рекомбинантный иммунотоксин, специфичный к клеткам, экспрессирующим рецептор her2
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к иммунологии, и касается рекомбинантного иммунотоксина, специфичного к клеткам, экспрессирующим рецептор HER2. Рекомбинантный иммунотоксин содержит направляющий модуль в виде антитела формата scFv, включающего вариабельные домены легкой и тяжелой цепей моноклонального гуманизированного HER2-специфичного антитела, соединенные между собой линкером, и токсический модуль в виде фрагмента псевдомонадного экзотоксина А ЕТА. При этом направляющий модуль представлен антителом 4D5scFv, рекомбинантный иммунотоксин содержит гибкий гидрофильный hinge-подобный линкер, соединяющий направляющий модуль 4D5scFv с токсическим модулем ЕТА, и последовательность KDEL на С-конце молекулы, и рекомбинантный иммунотоксин представлен последовательностью SEQ ID NO: 2. Использование данного рекомбинантного иммунотоксина позволяет повысить токсичность для клеток, экспрессирующих рецептор HER2, и, следовательно, терапевтическую эффективность. 1 н. и 3 з.п. ф-лы, 6 ил.
Реферат
Предлагаемое изобретение относится к области медицины и биохимии, касается рекомбинантного иммунотоксина, специфичного к клеткам, экспрессирующим рецептор HER2, который может быть использован в качестве терапевтического агента для таргетной терапии опухолей, гиперэкспрессирующих рецептор HER2, характеризующихся повышенным риском метастазирования и устойчивостью к химиотерапии.
Поиск новых терапевтических агентов для лечения опухолевых заболеваний - одна из важнейших задач современной биологии и медицины. Развитие методов молекулярной диагностики опухолей и выявление целого ряда специфических мишеней, характерных для того или иного типа опухолевых клеток, сделало возможной широкую реализацию идеи «магической пули» (использование препаратов, способных избирательно поражать очаги заболевания в организме человека) в онкологии. В рамках этого подхода активно развивающимся в последние годы направлением является разработка новых противоопухолевых иммунотоксинов - терапевтических агентов направленного действия, которые избирательно связываются с опухолевыми клетками и вызывают их гибель [Sharkey R.M., Goldenberg D.M. // СА Cancer J Clin. 2006. V. 56. Р. 226-43].
Иммунотоксины представляют собой бифункциональные молекулярные конструкции, способные, во-первых, специфически связываться с клетками-мишенями, во-вторых - ингибировать их рост. Наиболее оптимальным строением иммунотоксинов является такое, при котором эти две функции выполняются двумя разными структурными модулями: направляющим и токсическим. Первоначально иммунотоксины получали с использованием методов химической конъюгации направляющего и токсического модулей. Однако, ряд недостатков этого подхода (гетерогенность получаемых комплексов, сложность их синтеза, потеря функциональных свойств составляющих модулей) обусловил широкое распространение генно-инженерных технологий получения рекомбинантных иммунотоксинов - белков слияния токсина с направляющим модулем. Такие иммунотоксины легко нарабатываются в бактериальных продуцентах, отличаются постоянством состава, в достаточной мере сохраняют свойства отдельных модулей (специфичность и токсичность) и более стабильны [Dosio F., Brusa P., Cattel L. // Toxins. 2011. V. 3. P. 848-883].
Одной из наиболее клинически значимых мишеней для таргетной терапии опухолей является рецептор HER2 (из уровня техники известный также как HER2/neu, или ErbB2) - член семейства рецепторов эпидермального фактора роста человека. Данный рецептор играет важную роль в контроле пролиферации и дифференцировки клеток, в то время как его нерегулируемая экспрессия (гиперэкспрессия) сопровождает развитие многих опухолей и ассоциируется с повышенным риском метастазирования и устойчивостью к химиотерапии [Поляновский О.Л., Лебеденко Е.Н., Деев С.М. // Биохимия. 2011. Т. 77. С. 289-311].
Среди широкого спектра существующих на сегодняшний день иммунотоксинов и подходов к их конструированию особый интерес вызывают соединения на основе бактериальных токсинов, таких как псевдомонадный экзотоксин А (ЕТА), для проявления терапевтического эффекта которых требуется их доставка внутрь клетки путем рецептор-опосредованной интернализации. Модульная структура этих экзотоксинов и соответствующий механизм действия, связанный с отдельными структурными модулями, делает их удобными для различных модификаций, приводящих к изменению направленности их действия или корректировки уровня их токсичности. Замена исходного рецептор-узнающего домена бактериального экзотоксина на другой направляющий модуль белковой природы позволяет легко создавать токсины с одинаковым цитотоксическим действием, но с разной специфичностью [Weldon J.E., Pastan I. // FEBS J. 2011. V. 278. P. 4683-700].
Так, например, известен рекомбинантный иммунотоксин 425(scFv)-ETA, специфичный к рецептору EGFR, подавляющий рост клеток метастатической карциномы поджелудочной железы, содержащий направляющий модуль, представленный антителом (scFv)425, включающим вариабельные домены легкой VL и тяжелой VH цепей моноклонального антитела 425, соединенные между собой линкером (G4S)3, токсический модуль ЕТА, 10-амминокислотную полигистидиновую последовательность на N-конце полученной молекулы (International journal of oncology 23: 1179-1186. 2003 «The recombinant anti-EGF receptor 425(scFv)-ETA suppresses growth of a highly metastatic pancreatic carcinoma cell line»), причем ген, кодирующий рекомбинантный иммунотоксин 425(scFv)-ETA, помимо последовательностей, кодирующих направляющий и токсический модули и 10-амминокислотную полигистидиновую последовательность, содержит также сигнальную последовательность pelB и находится под контролем промотора Т7-lac.
Также известен рекомбинантный иммунотоксин 4D5MOCB-ETA, специфичный к клеткам, экспрессирующим онкомаркер ЕрСАМ, известный из патента СА 2424255 (А1), содержащий направляющий модуль, представленный антителом формата scFv, включающим вариабельные домены легкой VL и тяжелой VH цепей моноклонального гуманизированного антитела 4D5MOCB, соединенные между собой линкером, токсический модуль ЕТА, две олигогистидиновые последовательности на N- и С-концах молекулы иммунотоксина; токсический и направляющий модули соединены линкером; ген, кодирующий рекомбинантный иммунотоксин 4D5MOCB-ETA, помимо последовательностей, кодирующих направляющий и токсический модули, линкер и олигогистидиновые последовательности, содержит также сигнальную последовательность гена ompA наружной мембраны E. coli. и находится под контролем промотора лактозного оперона lac.
Недостатком указанных рекомбинантных иммунотоксинов, выбранных в качестве аналогов, является использование в качестве направляющего модуля EGFR-специфичного и ЕрСАМ-специфичного антител, не обладающих специфичностью к рецептору HER2/neu и, таким образом, невозможность их использования для таргетной терапии опухолей, гиперэкспрессирующих рецептор HER2 и характеризующихся повышенным риском метастазирования и устойчивостью к химиотерапии.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является рекомбинантный иммунотоксин scFv(FRP5)-ETA, специфичный к клеткам, экспрессирующим рецептор HER2, известный из статьи «Selective Inhibition of Tumor Cell Growth by a Recombinant Single-Chain Antibody-Toxin Specific for the erbB-2 Receptor», опубликованной в журнале «Cancer Research» 1992: 52: 6310-6317, принятый за ближайший аналог (прототип).
Рекомбинантный иммунотоксин по прототипу содержит маркерную последовательность FLAG, направляющий модуль, представленный антителом scFv(FRP5), включающим вариабельные домены легкой VL и тяжелой VH цепей моноклонального антитела FRP5, соединенные между собой линкером, и токсический модуль ЕТА, причем ген, кодирующий рекомбинантный иммунотоксин scFv(FRP5)-ETA, помимо последовательностей, кодирующих направляющий и токсический модули и маркерную последовательность FLAG, содержит также сигнальную последовательность ompA. Рекомбинантный иммунотоксин обладает аффинностью к клеткам, экспрессирующим рецептор HER2, при этом константа диссоциации Κd, являющаяся показателем аффинности, равна 6,5 nM, а также избирательной токсичностью для клеток, экспрессирующих рецептор HER2, при этом половина ингибирующей концентрации ID50 (IC50) равна 0,48 nM для клеток линии SKBR-3.
Недостатком рекомбинантного иммунотоксина по прототипу является недостаточная токсичность для клеток, экспрессирующих рецептор HER2, что может быть обусловлено использованием в качестве направляющего модуля антитела scFv(FRP5) и его соединением непосредственно с токсическим модулем, что может способствовать возникновению стерических затруднений модулей иммунотоксина, в результате чего они могут терять свои функциональные свойства.
В задачу изобретения положено создание нового рекомбинантного иммунотоксина, специфичного к клеткам, экспрессирующим рецептор HER2.
Техническим результатом от использования изобретения является повышение токсичности для клеток, экспрессирующих рецептор HER2, терапевтической эффективности.
Поставленная задача достигается тем, что в рекомбинантном иммунотоксине, специфичном к клеткам, экспрессирующим рецептор HER2, содержащем направляющий модуль в виде антитела формата scFv, включающего вариабельные домены легкой и тяжелой цепей моноклонального гуманизированного HER2-специфичного антитела, соединенные между собой линкером, и токсический модуль в виде фрагмента псевдомонадного экзотоксина А ЕТА, направляющий модуль представлен антителом 4D5scFv, дополнительно рекомбинантный иммунотоксин содержит гибкий гидрофильный hinge-подобный линкер, соединяющий направляющий модуль 4D5scFv с токсическим модулем ЕТА, и последовательность KDEL на С-конце молекулы; гибкий гидрофильный hinge-подобный линкер представлен гибким гидрофильным 16-аминокислотным линкером последовательностью SEQ ID NO: 1; гибкий гидрофильный hinge-подобный линкер представлен гибким гидрофильным линкером, содержащим произвольное количество аминокислотных остатков, при условии, что соединяемые им модули не испытывают стерических затруднений и сохраняют свои функциональные свойства; ген, кодирующий рекомбинантный иммунотоксин, помимо последовательностей, кодирующих направляющий и токсический модули, гибкий гидрофильный hinge-подобный линкер и последовательность KDEL, содержит также последовательности, кодирующие две олигогистидиновые последовательности His6 на N- и С-концах молекулы и сигнальную последовательность гена ompA наружной мембраны E. coli., находится под контролем промотора лактозного оперона lac p/о; представлен последовательностью SEQ ID NO: 2.
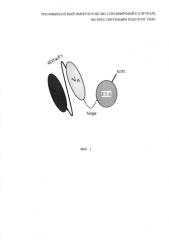
На фиг. 1 представлено схематическое изображение рекомбинантного иммунотоксина 4D5scFv-ETA, специфичного к клеткам, экспрессирующим рецептор HER2, где:
VL, VH - легкая и тяжелая цепи антитела 4D5scFv, соответственно;
hinge - кодирующая последовательность гибкого гидрофильного hinge-подобного линкера;
ЕТА - фрагмент псевдомонадного экзотоксина А;
KDEL - последовательность KDEL.
На фиг. 2 представлена генно-инженерная конструкция, кодирующая рекомбинантный иммунотоксин 4D5scFv-ETA, специфичный к клеткам, экспрессирующим рецептор HER2, где:
lac p/о - регуляторный элемент плазмиды: промотор лактозного оперона;
ompA - сигнальная последовательность гена наружной мембраны E. coli для транспорта целевого белка в периплазму;
His6 - последовательность, кодирующая олигогастидиновую последовательность для последующей очистки белка;
4D5VL, 4D5VH - последовательности, кодирующие направляющий модуль 4D5scFv - вариабельные домены легкой и тяжелой цепей HER2-специфичного антитела 4D5, соединенные линкером L;
hinge - последовательность, кодирующая гибкий гидрофильный hinge-подобный линкер;
ЕТА - последовательность, кодирующая фрагмент псевдомонадного экзотоксина А;
К - последовательность, кодирующая последовательность KDEL.
На фиг. 3 представлены результаты электрофоретического анализа рекомбинантного иммунотоксина 4D5scFv-ETA в 12%=ном полиакриламидном геле, где: Μ - белковый маркер молекулярного веса. Ρ - очищенный 4D5scFv-ETA.
На фиг. 4 представлены фотографии, отображающие связывание рекомбинантного иммунотоксина 4D5scFv-ETA с эукариотическими клетками, где: А - окрашивание мембраны HER2-гиперэкспрессирующих клеток SKBR-3 после их инкубации с иммунотоксином 4D5scFv-ЕТА в условиях пониженной температуры с использованием пероксидазы хрена в качестве проявляющего агента; Б - отсутствие окрашивания мембраны клеток SKBR-3 после инкубации с буфером PBS в тех же условиях; В - отсутствие окрашивания контрольных HER2-отрицательных клеток СНО иммунотоксином 4D5scFv-ETA в тех же условиях; Г - интернализация иммунотоксина клетками SKBR-3 после инкубации при 37°C.
На фиг. 5 представлены кривые дозовой зависимости жизнеспособности эукариотических клеток с разным уровнем экспрессии рецептора HER2 после их кратковременной (А) или длительной (Б) инкубации с рекомбинантным иммунотоксином 4D5scFv-ETA, где: треугольник, пунктирная линия - клеток аденокациномы молочной железы человека SKBR-3 с гиперэкспрессией HER2; ромб, пунктирная линия - клеток аденокациномы яичника человека SKOV-3 с гиперэкспрессией HER2; кружок, сплошная линия - клеток карциномы шейки матки человека HeLa с нормальным уровнем экспрессии; квадрат - HER2-отрицательных клеток яичника китайского хомячка СНО. Планки погрешностей представлены стандартной ошибкой среднего.
На фиг. 6 представлены фотографии последовательных прижизненных изображений животных-опухоленосителей после инъекции иммунотоксина 4D5scFv-ETA и фосфатно-солевого буфера (контроль). За нулевой день принят день подкожной инъекции клеток SKOV-kat (2 млн. клеток на мышь). 4D5scFv-ETA вводили внутривенно на 1 день в количестве 4 мкг на животное.
Генетически кодируемый HER2-специфичный иммунотоксин 4D5scFv-ETA представляет собой рекомбинантный белок, в котором два независимых функциональных модуля белковой природы - направляющий (4D5scFv) и токсический (ЕТА) - объединены в единую полипептидную цепь с помощью гибкого гидрофильного hinge-подобного линкера (hinge).
Направляющий модуль 4D5scFv представляет собой вариабельные домены легкой (VL) и тяжелой (VH) цепей моноклонального гуманизированного HER2-специфичного антитела 4D5 (известного так же как Tastuzumab или Herceptin), соединенные гибким пептидным линкером (L) в единую полипептидную цепь. 4D5scFv является наиболее стабильным, устойчивым в широком диапазоне условий и высокоаффинным из всех имеющихся на данный момент антител формата scFv, специфичных к HER2. Еще одним свойством этого антитела является его способность к интернализации внутрь клетки после связывания с рецептором-мишенью, что необходимо для проявления токсического эффекта псевдомонадного экзотоксина А, выбранного в качестве токсического модуля (ЕТА).
Токсический модуль (ЕТА) сконструированного иммунотоксина представляет собой фрагмент (252-613 а.о.) природного экзотоксина А из Pseudomonas aeruginosa (псевдомонадного экзотоксина А), содержащий транслокационный домен II, а также домены Ib и III природного токсина, отвечающие за АДФ-рибозилирование фактора элонгации 2 эукариот (еЕТ2), т.е. за собственно токсический эффект.
Направляющий и токсический модули соединены гибким гидрофильным hinge-подобным 16-аминокислотным линкером последовательностью SEQ ID NO: 1 (исходно линкер hinge - линкер из шарнирной области мышиного иммуноглобулин IgG3). Этот линкер может образовывать расстояние 2,5-2,7 нм между соединяемыми им участками белковой молекулы, позволяя, таким образом, двум модулям иммунотоксина не испытывать стерических затруднений в пространстве и сохранять свои функциональные свойства.
В экспериментах in vitro и in vivo было подтверждено, что полученный рекомбинантный иммунотоксин специфически связывается с опухолевыми клетками, гиперэкспрессирующими рецептор HER2, и избирательно ингибирует рост этих клеток и, таким образом, является HER2-специфичным иммунотоксином.
Создание предлагаемого изобретения осуществляется следующим образом.
Была создана генно-инженерная конструкция, кодирующая рекомбинантный белок 4D5scFv-ETA (фиг. 2), позволяющая нарабатывать его в высоких количествах в клетках кишечной палочки E. coli.
В генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, была введена последовательность, кодирующая сигнальную последовательность, обеспечивающую секрецию целевого рекомбинантного белка в периплазматическое пространство как для снижения его токсического действия на клетку, так и для повышения уровня растворимой фракции целевого белка. Для этого была выбрана последовательность, кодирующая сигнальную последовательность белка OmpA наружной мембраны E. coli (ompA). Для выделения и очистки целевого белка с помощью аффинной хроматографии на Ni2+NTA-сефарозе, в генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, были введены последовательности, кодирующие олигогистидиновые последовательности из 6 остатков гистидина (His6) на N- и С-концах молекулы иммунотоксина. Кроме того, в генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, была введена последовательность, кодирующая последовательность KDEL на С-конце полученной молекулы иммунотоксина (K), по данным литературы увеличивающую цитотоксический потенциал экзотоксина А для клеток.
Была разработана и оптимизирована методика выделения и очистки соответствующего рекомбинантного белка.
Электрофоретический анализ полученного рекомбинантного иммунотоксина 4D5scFv-ЕТА в 12%=ном полиакриламидном геле в денатурирующих условиях показал, что полученный препарат очищенного белка был гомогенен и не содержал примесей, детектируемых с помощью электрофореза с окрашиванием Coomassi blue G-250 при нанесении образца с перегрузом (рис. 3). Молекулярная масса полученного белка 4D5scFv-ETA по результат электрофореза совпадала с расчетной (69 кДа). Несколько меньшая подвижность полученного рекомбинантного белка относительно белков маркера молекулярных весов объясняется наличием в составе рекомбинантного белка полигистидиновых последовательностей, необходимой для очистки - подобный эффект был неоднократно описан в литературе.
Предлагаемое изобретение работает следующим образом.
На культуре клеток аденокарциномы молочной железы человека SKBR-3 (номер по каталогу АТСС - НТВ-30), гиперэкспрессирующих рецептор HER2 на поверхности цитоплазматической мембраны, была продемонстрирована специфичность связывания полученного рекомбинантного белка 4D5scFv-ETA и возможность его последующей интернализации внутрь клеток.
Клетки инкубировали с 4D5scFv-ETA в условиях пониженной температуры (для предотвращения интернализации иммунотоксина внутрь клеток), фиксировали 4%=ным формальдегидом и обрабатывали моноклональными антителами, специфичными к олигогистидиновой последовательности на С-конце иммунотоксина и конъюгированными с пероксидазой хрена («Anti-6xHis, меченые HRP», Becton Dickinson). Клетки окрашивали с использованием диаминобензидина в качестве субстрата для пероксидазы. Детекцию клеток проводили с помощью инвертированного микроскопа Axiovert 200 (Zeiss) с использованием объектива с увеличением 40×. В качестве контроля такой же процедуре были подвергнуты HER2-отрицательные клетки яичника китайского хомячка СНО (номер по каталогу АТСС - CCL-61). Для оценки фонового сигнала при окрашивании, фиксированные клетки окрашивали согласно приведенной выше методике, заменив иммунотоксин на раствор фосфатно-солевого буфера.
Было показано, что после инкубации клеток SKBR-3 с иммунотоксином 4D5scFv-ETA на микрофотографиях заметно характерное коричневое окрашивание по краю клеток (фиг. 4А). При этом фоновое окрашивание клеток SKBR-3 было минимальным (фиг. 4Б). В то же время, степень окрашивания HER2-отрицательных клеток СНО после инкубации с иммунотоксином в тех же условиях практически не отличалась от фоновой (фиг. 4В), что свидетельствует о специфичности связывания полученного рекомбинантного иммунотоксина к рецептору HER2. После инкубации клеток SKBR-3 с иммунотоксином 4D5scFv-ETA при 37°С наблюдалось характерное коричневое окрашивание цитоплазмы (фиг. 4Г), что свидетельствует об интернализации иммунотоксина внутрь клетки после его связывания с рецептором HER2.
Константа диссоциации 4D5scFv-ETA, полученная с помощью метода поверхностного плазмонного резонанса с использованием рекомбинантного белка p185HER2-ECD (фрагмента рецептора HER2), составила 6,8 нМ, что сравнимо с константой диссоциации свободного антитела 4D5scFv (~5.2 нМ), определенной тем же методом.
Таким образом, антитело 4D5scFv в составе сконструированного рекомбинантного иммунотоксина полностью сохранили свою специфичность и аффинность, а полученный иммунотоксин способен связываться с опухолевыми клетками-мишенями, экспрессирующими рецептор HER2, и интернализоваться (что является необходимым условием для проявления его дальнейшего токсического действия на клетки).
Методом МТТ-теста было показано специфическое цитотоксическое воздействие полученного иммунотоксина на опухолевые клетки, гиперэкспрессирующие рецептор HER2.
Были использованы клетки аденокарциномы молочной железы человека SKBR-3 и клетки аденокарциномы яичника человека SKOV-3 (номер по каталогу АТСС - НТВ-77), гиперэкспрессирующие рецептор HER2 (~1×105-1×106 молекул на клетку), а также клетки карциномы шейки матки человека HeLa (номер по каталогу АТСС - CCL-2) с нормальным уровнем экспрессии HER2 (~1×104 молекул на клетку) и контрольные клетки яичника китайского хомячка СНО, не экспрессирующие данный рецептор.
Было использовано две схемы инкубации клеток с иммунотоксином: кратковременная и длительная. В случае кратковременной инкубации клетки инкубировали в течение 40 мин при +4°C с иммунотоксином в различной концентрации, затем несвязавшийся иммунотоксин отмывали раствором фосфатно-солевого буфера, к клеткам добавляли ростовую среду и выращивали их в течение 72 ч. В случае длительной инкубации к клеткам добавляли иммунотоксин в различной концентрации и инкубировали в течение 72 ч при +37°C.
Выживаемость клеток после их обработки иммунотоксином оценивали с помощью стандартного МТТ-теста.
Было показано, что полученный HER2-специфичный иммунотоксин не оказывает влияния на жизнеспособность HER2-отрицательных клеток СНО как при кратковременной (фиг. 5А, квадрат), так и при длительной (фиг. 5Б, квадрат) инкубации, при этом в обоих случаях значительно снижая жизнеспособность HER2-положительных клеток линий SKBR-3 (фиг. 5А, треугольник, пунктир), SKOV-3 (фиг. 5Б, треугольник, пунктир) и HeLa (фиг. 5А и 5Б, круг, сплошная линия).
В случае кратковременной инкубации значения половины ингибирующей концентрации (IC50), для клеток с нормальным уровнем экспрессии рецептора (HeLa) и его гиперэкпрессией (SKBR-3) составили 4.3 и 2.2 нМ, соответственно. Следует отметить, что даже при кратковременной экспозиции (40 мин) токсическое действие 4D5scFv-ETA для клеток с более высоким уровнем экспрессии рецептора HER2 было более выраженным.
В случае длительной инкубации наблюдался значительно более выраженный цитотоксический эффект иммунотоксина 4D5scFv-ETA: значения IC50 для клеток с нормальным уровнем экспрессии рецептора (HeLa) и его гиперэкпрессией (SKOV-3) составили 0,053 и 0,017 нМ, соответственно.
С использованием флуорецсцентных ксенографтных моделей аденокарциномы яичника человека с гиперэкспрессией HER2 была показана способность полученного иммунотоксина ингибировать рост опухолей in vivo (фиг. 6).
Для создания флуоресцентной ксенографтной модели аденокарциномы яичника человека с гиперэкспрессией рецептора HER2 иммунодефицитным мышам линии BALB/c-Nude (самки, 17-23 г, 4-6 недель, питомник лабораторных животных ФИБХ РАН) были привиты клетки линии SKOV-kat (патент RU №2404244). Клетки SKOV-kat представляют собой модифицированные клетки аденокарциномы яичника человека SKOV-3, трансфицированные красным флуоресцентным белком TurboFP635 (Евроген, Россия). Суспензию клеток SKOV-kat в фосфатно-солевом буфере смешивали с ростовым субстратом в соотношении 1:1 (по объему) и вводили подкожно под правую лопатку в количестве 2×106 клеток на животное.
Через 24 ч после инъекции опухолевых клеток животным опытной группы внутрибрюшинно вводили иммунотоксин 4D5scFv-ETA. Животным контрольной группы внутрибрюшинно вводили фосфатно-солевой буфер. Динамику роста опухоли оценивали методом поверхностного флуоресцентного биоимиджинга на основе интегральной интенсивности флуоресцентного сигнала по площади опухоли.
Для количественной оценки эффекта противоопухолевых агентов рассчитывали коэффициент торможения роста опухоли по формуле: ТРО(%)=[(Flконтроля-Flопыта)/Flконтроля]×100%, где Flконтроля и Flопыта - интегральная интенсивность флуоресцентного сигнала по площади опухоли в контрольной и опытной группах, соответственно.
Было показано, что однократная инъекция иммунотоксина 4D5scFv-ETA вызывала заметное замедление роста опухолевого узла (фиг. 6). Коэффициент торможения роста опухоли составил 80%.
Использование антитела 4D5scFv в качестве направляющего модуля обеспечивает эффективную доставку иммунотоксина к клеткам, экспрессирующим рецептор HER2, и его последующую интернализацию внутрь клеток, обеспечивая проявление цитотоксического эффекта ЕТА.
Наличие гибкого гидрофильного hinge-подобного линкера между направляющим модулем и токсическим модулем исключает возможность стерических затруднений модулями иммунотоксина и потерю ими функциональных свойств.
Наличие сигнальной последовательности KDEL на С-конце иммунотоксина значительно повышает цитотоксический эффект ЕТА.
Таким образом, предлагаемое изобретение обеспечивает повышение токсичности для клеток, экспрессирующих рецептор HER2, терапевтической эффективности.
В задачу изобретения положено создание нового рекомбинантного иммунотоксина, специфичного к клеткам, экспрессирующим рецептор HER2.
Техническим результатом от использования изобретения является повышение токсичности для клеток, экспрессирующих рецептор HER2, терапевтической эффективности.
Поставленная задача достигается тем, что в рекомбинантном иммунотоксине, специфичном к клеткам, экспрессирующим рецептор HER2, содержащем направляющий модуль в виде антитела формата scFv, включающего вариабельные домены легкой и тяжелой цепей моноклонального гуманизированного HER2-специфичного антитела, соединенные между собой линкером, и токсический модуль в виде фрагмента псевдомонадного экзотоксина А ЕТА, направляющий модуль представлен антителом 4D5scFv, дополнительно рекомбинантный иммунотоксин содержит гибкий гидрофильный hinge-подобный линкер, соединяющий направляющий модуль 4D5scFv с токсическим модулем ЕТА, и последовательность KDEL на С-конце молекулы, при этом рекомбинантный иммунотоксин представлен последовательностью SEQ ID NO: 2; гибкий гидрофильный hinge-подобный линкер представлен гибким гидрофильным 16-аминокислотным линкером последовательностью SEQ ID NO: 1; гибкий гидрофильный hinge-подобный линкер представлен гибким гидрофильным линкером, содержащим произвольное количество аминокислотных остатков, при условии, что соединяемые им модули не испытывают стерических затруднений и сохраняют свои функциональные свойства; ген, кодирующий рекомбинантный иммунотоксин, помимо последовательностей, кодирующих направляющий и токсический модули, гибкий гидрофильный hinge-подобный линкер и последовательность KDEL, содержит также последовательности, кодирующие две олигогистидиновые последовательности His6 на N- и C-концах молекулы и сигнальную последовательность гена ompA наружной мембраны E.coli., находится под контролем промотора лактозного оперона lac р/о.
На фиг. 1 представлено схематическое изображение рекомбинантного иммунотоксина 4D5scFv-ETA, специфичного к клеткам, экспрессирующим рецептор HER2, где:
VL, VH - легкая и тяжелая цепи антитела 4D5scFv, соответственно;
hinge - кодирующая последовательность гибкого гидрофильного hinge-подобного линкера;
ЕТА - фрагмент псевдомонадного экзотоксина А;
KDEL - последовательность KDEL.
На фиг. 2 представлена генно-инженерная конструкция, кодирующая рекомбинантный иммунотоксин 4D5scFv-ETA, специфичный к клеткам, экспрессирующим рецептор HER2, где:
lac р/о - регуляторный элемент плазмиды: промотор лактозного оперона;
ompA - сигнальная последовательность гена наружной мембраны E.coli для транспорта целевого белка в периплазму;
His6 - последовательность, кодирующая олигогистидиновую последовательность для последующей очистки белка;
4D5VL, 4D5VH - последовательности, кодирующие направляющий модуль 4D5scFv -вариабельные домены легкой и тяжелой цепей HER2-специфичного антитела 4D5, соединенные линкером L;
hinge - последовательность, кодирующая гибкий гидрофильный hinge-подобный линкер;
ЕТА - последовательность, кодирующая фрагмент псевдомонадного экзотоксина А;
К - последовательность, кодирующая последовательность KDEL.
На фиг. 3 представлены результаты электрофоретического анализа рекомбинантного иммунотоксина 4D5scFv-ETA в 12%=ном полиакриламидном геле, где: М - белковый маркер молекулярного веса; Р - очищенный 4D5scFv-ETA.
На фиг. 4 представлены фотографии, отображающие связывание рекомбинантного иммунотоксина 4D5scFv-ETA с эукариотическими клетками, где: А - окрашивание мембраны HER2-гиперэкспрессирующих клеток SKBR-3 после их инкубации с иммунотоксином 4D5scFv-ЕТА в условиях пониженной температуры с использованием пероксидазы хрена в качестве проявляющего агента; Б - отсутствие окрашивания мембраны клеток SKBR-3 после инкубации с буфером PBS в тех же условиях; В - отсутствие окрашивания контрольных HER2-отрицательных клеток СНО иммунотоксином 4D5scFv-ETA в тех же условиях; Г -интернализация иммунотоксина клетками SKBR-3 после инкубации при 37°C.
На фиг. 5 представлены кривые дозовой зависимости жизнеспособности эукариотических клеток с разным уровнем экспрессии рецептора HER2 после их кратковременной (А) или длительной (Б) инкубации с рекомбинантным иммунотоксином 4D5scFv-ETA, где: треугольник, пунктирная линия - клеток аденокациномы молочной железы человека SKBR-3 с гиперэкспрессией HER2; ромб, пунктирная линия - клеток аденокациномы яичника человека SKOV-3 с гиперэкспрессией HER2; кружок, сплошная линия - клеток карциномы шейки матки человека HeLa с нормальным уровнем экспрессии; квадрат - HER2-отрицательных клеток яичника китайского хомячка СНО. Планки погрешностей представлены стандартной ошибкой среднего.
На фиг. 6 представлены фотографии последовательных прижизненных изображений животных-опухоленосителей после инъекции иммунотоксина 4D5scFv-ETA и фосфатно-солевого буфера (контроль). За нулевой день принят день подкожной инъекции клеток SKOV-kat (2 млн. клеток на мышь). 4D5scFv-ETA вводили внутривенно на 1 день в количестве 4 мкг на животное.
Генетически кодируемый HER2-специфичный иммунотоксин 4D5scFv-ETA представляет собой рекомбинантный белок, в котором два независимых функциональных модуля белковой
природы - направляющий (4D5scFv) и токсический (ЕТА) - объединены в единую полипептидную цепь с помощью гибкого гидрофильного hinge-подобного линкера (hinge).
Направляющий модуль 4D5scFv представляет собой вариабельные домены легкой (VL) и тяжелой (VH) цепей моноклонального гуманизированного HER2-специфичного антитела 4D5 (известного так же как Tastuzumab или Herceptin), соединенные гибким пептидным линкером (L) в единую полипептидную цепь. 4D5scFv является наиболее стабильным, устойчивым в широком диапазоне условий и высокоаффинным из всех имеющихся на данный момент антител формата scFv, специфичных к HER2. Еще одним свойством этого антитела является его способность к интернализации внутрь клетки после связывания с рецептором-мишенью, что необходимо для проявления токсического эффекта псевдомонадного экзотоксина А, выбранного в качестве токсического модуля (ЕТА).
Токсический модуль (ЕТА) сконструированного иммунотоксина представляет собой фрагмент (252-613 а.о.) природного экзотоксина А из Pseudomonas aeruginosa (псевдомонадного экзотоксина А), содержащий транслокационный домен II, а также домены Ib и III природного токсина, отвечающие за АДФ-рибозилирование фактора элонгации 2 эукариот (еЕТ2), т.е. за собственно токсический эффект.
Направляющий и токсический модули соединены гибким гидрофильным hinge-подобным 16-аминокислотным линкером последовательностью SEQ ID NO: 1 (исходно линкер hinge -линкер из шарнирной области мышиного иммуноглобулин IgG3). Этот линкер может образовывать расстояние 2,5-2,7 нм между соединяемыми им участками белковой молекулы, позволяя, таким образом, двум модулям иммунотоксина не испытывать стерических затруднений в пространстве и сохранять свои функциональные свойства.,
В экспериментах in vitro и in vivo было подтверждено, что полученный рекомбинантный иммунотоксин специфически связывается с опухолевыми клетками, гиперэкспрессирующими рецептор HER2, и избирательно ингибирует рост этих клеток и, таким образом, является HER2-специфичным иммунотоксином.
Создание предлагаемого изобретения осуществляется следующим образом.
Была создана генно-инженерная конструкция, кодирующая рекомбинантный белок 4D5scFv-ETA (фиг. 2), позволяющая нарабатывать его в высоких количествах в клетках кишечной палочки E.coli.
В генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, была введена последовательность, кодирующая сигнальную последовательность, обеспечивающую секрецию целевого рекомбинантного белка в периплазматическое пространство как для снижения его токсического действия на клетку, так и для повышения уровня растворимой фракции целевого белка. Для этого была выбрана последовательность, кодирующая сигнальную последовательность белка OmpA наружной мембраны E.coli (отрА). Для выделения и очистки
целевого белка с помощью аффинной хроматографии на Ni2+-NTA-сефарозе, в генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, были введены последовательности, кодирующие олигогистидиновые последовательности из 6 остатков гистидина (His6) на N- и С-концах молекулы иммунотоксина. Кроме того, в генно-инженерную конструкцию, кодирующую 4D5scFv-ETA, была введена последовательность, кодирующая последовательность KDEL на С-конце полученной молекулы иммунотоксина (К), по данным литературы увеличивающую цитотоксический потенциал экзотоксина А для клеток.
Была разработана и оптимизирована методика выделения и очистки соответствующего рекомбинантного белка.
Электрофоретический анализ полученного рекомбинантного иммунотоксина 4D5scFv-ЕТА в 12%=ном полиакриламидном геле в денатурирующих условиях показал, что полученный препарат очищенного белка был гомогенен и не содержал примесей, детектируемых с помощью электрофореза с окрашиванием Coomassi blue G-250 при нанесении образца с перегрузом (рис. 3). Молекулярная масса полученного белка 4D5scFv-ETA по результат электрофореза совпадала с расчетной (69 кДа). Несколько меньшая подвижность полученного рекомбинантного белка относительно белков маркера молекулярных весов объясняется наличием в составе рекомбинантного белка полигистидиновых последовательностей, необходимой для очистки - подобный эффект был неоднократно описан в литературе.
Предлагаемое изобретение работает следующим образом.
На культуре клеток аденокарциномы молочной железы человека SKBR-3 (номер по каталогу АТСС - НТВ-30), гиперэкспрессирующих рецептор HER2 на поверхности цитоплазматической мембраны, была продемонстрирована специфичность связывания полученного рекомбинантного белка 4D5scFv-ETA и возможность его последующей интернализации внутрь клеток.
Клетки инкубировали с 4D5scFv-ETA в условиях пониженной температуры (для предотвращения интернализации иммунотоксина внутрь клеток), фиксировали 4%=ным формальдегидом и обрабатывали моноклональными антителами, специфичными к олигогистидиновой последовательности на С-конце иммунотоксина и конъюгированными с пероксидазой хрена («Anti-6xHis, меченые HRP», Becton Dickinson). Клетки окрашивали с использованием диаминобензидина в качестве субстрата для пероксидазы. Детекцию клеток проводили с помощью инвертированного микроскопа Axiovert 200 (Zeiss) с использованием объектива с увеличением 40х. В качестве контроля такой же процедуре были подвергнуты НЕК2-отрицательные клетки яичника китайского хомячка СНО (номер по каталогу АТСС - CCL-61). Для оценки фонового сигнала при окрашивании, фиксированные клетки окрашивали согласно приведенной выше методике, заменив иммунотоксин на раствор фосфатно-солевого буфера.
Было показано, что после инкубации клеток SKBR-3 с иммунотоксином 4D5scFv-ETA на микрофотографиях заметно характерное коричневое окрашивание по краю клеток (фиг. 4 А). При этом фоновое окрашивание клеток SKBR-3 было минимальным (фиг. 4 Б). В то же время, степень окрашивания HER2-отрицательных клеток СНО после инкубации с иммунотоксином в тех же условиях практически не отличалась от фоновой (фиг. 4 В), что свидетельствует о специфичности связывания полученного рекомбинантного иммунотоксина к рецептору HER2. После инкубации клеток SKBR-3 с иммунотоксином 4D5scFv-ETA при 37°C наблюдалось характерное коричневое окрашивание цитоплазмы (фиг. 4 Г), что свидетельствует об интернализации иммунотоксина внутрь клетки после его связывания с рецептором HER2.
Константа диссоциации 4D5scFv-ETA, полученная с помощью метода поверхностного плазмонного резонанса с использованием рекомбинантного белка p185HER2-ECD (фрагмента рецептора HER2), составила 6,8 нМ, что сравнимо с константой диссоциации свободного антитела 4D5scFv (~5.2 нМ), определенной тем же методом.
Таким образом, антитело 4D5scFv в составе сконструированного рекомбинантного иммунотоксина