Способ извлечения ионов тяжелых металлов из водных растворов
Иллюстрации
Показать всеИзобретение относится к способу извлечения ионов тяжелых металлов из водных растворов. Способ включает экстракцию с использованием в качестве экстрагента растительных масел, содержащих жирные кислоты, при величине рН водных растворов, равной 9-11. Затем ведут отстаивание образующейся системы с расслаиванием ее на фазы и их разделение. При этом отстаивание системы ведут с образованием трех фаз: верхней - масляной, представляющей собой регенерируемый экстрагент, нижней - водной, и промежуточной между ними - гелеобразной, состоящей из воды, масла и содержащей в виде сетчатой структуры гидроксокомплексы тяжелых металлов. Гелеобразную массу подвергают сушке при температуре 100-300°С до образования нанокристаллов оксидов тяжелых металлов. Технический результат заключается в эффективности очистки водных растворов металлов с использованием возобновляемого нетоксичного недорогого и эффективного экстрагента. 6 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к извлечению веществ органическими экстрагентами из водных растворов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков.
Известна жидкостная экстракция, основанная на распределении веществ между двумя несмешивающимися жидкостями, которая широко используется в аналитической химии для разделения компонентов растворов [Гиндин Л.М. Экстракционные процессы и их применение. М.: Наука, 1984. 144 с.]. Обычно в качестве двух жидких несмешивающихся фаз, используются водные растворы и органические растворители.
Недостатком является то, что большинство органических растворителей относятся к легколетучим, пожароопасным и токсичным веществам.
Наиболее близким техническим решением является способ извлечения ионов тяжелых металлов из водных растворов [патент РФ 2481409, МПК С22В 3/26, опубл. 10.05.2013], включающий экстракцию с использованием в качестве экстрагента растительных масел, содержащих жирные кислоты, при величине рН водных растворов, равной 9-11, отстаивание образующейся системы с расслаиванием ее на фазы и их разделение.
Недостатком способа является то, что не указана дальнейшая переработка фаз после расслаивания.
Задачей изобретения является разработка способов переработки фаз после их расслаивания и разделения.
Технический результат, который может быть достигнут при осуществлении изобретения, заключается в высокой степени эффективности извлечения металлов, глубокой очистке водной фазы, регенерации экстрагента с одновременной экономичностью, безопасностью процесса с использованием возобновляемого нетоксичного, недорогого и эффективного экстрагента.
Данный технический результат достигается тем, что в известном способе извлечения ионов тяжелых металлов из водных растворов, включающем экстракцию с использованием в качестве экстрагента растительных масел, содержащих жирные кислоты, при величине рН водных растворов, равной 9-11, отстаивание образующейся системы с расслаиванием ее на фазы и их разделение, отстаивание системы после экстракции ведут с образованием трех фаз: верхней - масляной, представляющей собой регенерируемый экстрагент, нижней - водной, и промежуточной между ними - гелеобразной, состоящей из воды, масла и содержащей в виде сетчатой структуры гидроксокомплексы тяжелых металлов, гелеобразную массу подвергают сушке при температуре 100-300°С до образования нанокристаллов оксидов тяжелых металлов.
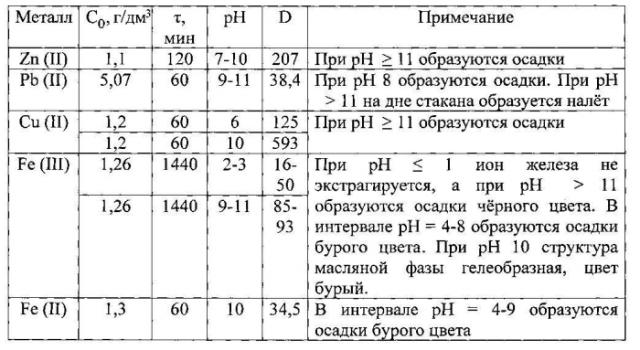
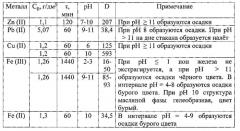
Сущность способа поясняется данными таблицы и фиг. 1-6, в которых указаны концентрация ионов металлов в исходных растворах, время экстракции при заданной величине рН, концентрация металлов и величина рН в осветленной водной фазе, коэффициент распределения D, рассчитываемый как отношение равновесных концентраций ионов металлов в органической и водной фазах.
Перемешивание и поддержание заданного значения рН осуществляли до тех пор, пока в дальнейшем кислотно-основные характеристики системы изменялись незначительно. По достижении равновесия между органической и осветленной водной фазами органическую фазу отделяли от водной, в последней определяли величину рН и остаточную концентрацию иона металла. Для поддержания заданного значения рН раствора в процессе экстракции в качестве нейтрализаторов использовали растворы щелочи или кислоты.
Примеры конкретного выполнения способа
Пример 1 (фиг. 1)
На фиг. 1 дана зависимость остаточной концентрации ионов металлов от величины рН раствора. Экстрагент - оливковое масло; время экстракции 1 час; O:В=1:3, t=24 °С; исходная концентрация С0, г/дм3: 1,1 Zn (II); 5,1 Pb (II); 1,2 Cu (II); 1,3 Fe (III). Лучшие результаты экстракции приведены в таблице.
Пример 2. Исследована зависимость остаточной концентрации ионов металлов от отношения В:O.
В качестве экстрагента использовали оливковое масло; время экстракции - сутки; t=20-24°С.
Zn (II): С0=2,3 г/дм3, рН 10. Экстракция осуществляется при В:O≤7. При В:O≥8 образуются осадки.
Pb (II): С0=5,24 г/дм3, рН 11. Экстракция осуществляется при В:O≤7. При В:O≥8 образуются осадки, при этом остаточная концентрация включала сумму концентраций ионов свинца в растворе и в осадке.
Cu (II):
- рН 6; С0=1,1 г/дм3. Экстракция осуществляется при В:O=3-8.
При В:O>8 образуются осадки;
- рН 10; С0=1,1 г/дм3. Экстракция осуществляется при В:O≤8.
При В:O≥8 образуются осадки.
Fe (III). Экстракция ионов Fe (III) осуществляется при В:O≥3 практически сразу, остаточная концентрация примерно одинакова и равна С=0,095 г/дм3. При экстракции ионов Fe (III) образуется на дне стакана налет бурого цвета.
Fe (II)э7 Экстракция ионов Fe (II) осуществляется в пределах В:O=3-6. При В:O≥7 образуются осадки черного цвета. В процессе экстракции происходит окисление ионов Fe (II) до Fe (III).
Пример 3 (фиг. 2, 3)
На фиг. 2 даны зависимости остаточной концентрации С, г/дм3, ионов металлов Zn (II), Pb (II), Cu (II) и Fe (II) от времени τ, мин, и начальной концентрации С0, г/дм3. Экстрагент - оливковое масло; O:В=1:3. рН=10, t=20-24°С. Экстракция осуществляется за время, мин, не более: Zn (II) - 60; Pb (II) - 90; Cu (II) - 30; Fe (II) - 30 мин при O:В=1:3 и 70 мин при O:В=1:4,5.
Экстракция ионов Fe (III) при рН 10 и O:В=1:3 осуществляется практически сразу, остаточная концентрация примерно одинакова и равна С=0,095 г/дм3. При С0>3 г/дм3 образуются осадки бурого цвета. Экстракция ионов Fe (II) осуществляется в пределах 1 часа. При С0>1,6 г/дм3 образуются осадки черного цвета.
В интервале исследованных исходных концентраций для ионов Zn (II), Pb (II) и Fe (II) с увеличением концентрации указанных ионов скорость процесса убывает незначительно, а для ионов Cu (II) возрастает.
На фиг. 3 даны зависимости остаточной концентрации ионов металлов от времени и температуры. Экстрагент - оливковое масло, O:В=1:3.
В интервале исследованных температур для ионов Zn (II), Pb (II) и Fe (II) с увеличением температуры указанных ионов скорость процесса возрастает, а для ионов Cu (II) убывает.
Из фиг. 2, 3 видно, что экстракция ионов тяжелых металлов зависит от исходной концентрации, времени и температуры.
Для ионов Zn (II), и Fe (II) и Pb (II) процесс экстракции лежит в кинетической области и лимитируется образованием комплекса этих ионов с составляющими экстрагента, который сольватируется в органическую фазу.
Для ионов Cu (II) увеличение скорости процесса с ростом исходной концентрации может свидетельствовать о том, что экстракция лимитируется скоростью внешней диффузии. Уменьшение скорости экстракции с ростом температуры может быть связано с коалесценцией (слиянием капель растительного масла) внутри подвижного раствора при перемешивании. С увеличением температуры скорость коалесценции растет, а следовательно, уменьшается межфазная поверхность между органической и водной фазой, что, согласно первому закону Фика, снижает скорость диффузии. Кроме того, положение двойной связи в олеиновой кислоте может меняться при нагревании и при различных химических воздействиях. Например, термообработка в щелочной среде способствует миграции двойной связи в положение, смежное с карбоксильной группой. Следует учитывать также, что с ростом температуры за счет окислительно-восстановительных реакций между Cu (II) и растительным маслом увеличивается концентрация Cu (I), который не экстрагируется в масляную фазу.
Пример 4. Экстракция ионов железа из смеси солей Fe (II) и Fe (III). Установлено, что с увеличением концентрации коэффициент разделения растет. В процессе экстракции объем экстракта увеличивается на 5-10% от объема экстрагента, причем экстракт имеет структуру геля. Осадки гидроксокомплексов Fe (III) имеют бурый, а осадки Fe (II) - черный цвет. Осадки черного цвета после сушки магнитны и имеют состав FeO·Fe2O3 или Fe3O4.
Пример 5 (фиг. 4)
На фиг. 4 дана зависимость коэффициента распределения D от вида растительного масла: 1 - абрикосовое, 2 - тыквенное, 3 - кедровое, 4 - соевое, 5 - виноградное, 6 - кукурузное, 7 - грецкого ореха, 8 - подсолнечное, 9 - льняное, 10 - оливковое.
Растительные масла обладают различной способностью экстрагировать ионы Zn (II), Pb (II), Cu (II) и Fe (II). Все исследованные масла хорошо экстрагируют ионы Fe (III). Коэффициент распределения D ионов Сu для ряда масел на порядок больше, чем у других исследованных ионов металлов.
Пример 6 (фиг. 5, 6)
При отстаивании системы после экстракции больше суток происходит ее расслаивание на три фазы: верхнюю - масляную (регенерируемый экстрагент), нижнюю - водную, и промежуточную между ними - гелеобразную сетчатую структуру гидроксокомплексов металла с составляющими воды и масла. Из промежуточной фазы геля можно извлечь металл или его соединения.
На фиг. 5 показана динамика отстаивания системы после экстракции свинца для различных масел в пределах суток, O:В=1:3, рН=11, С0=5 г/дм3. Цифрами обозначены высоты фаз в мм (по вертикали) и время отстаивания в мин (по горизонтали).
Аналогичные результаты получены и для других исследованных металлов. Полученные данные дают перспективу технического использования растительных масел, особенно непригодных для употребления в пишу («прогорклые» масла).
При высушивании гидроксокомплексов при температуре выше 100-300°С образуются нанокристаллы оксидов металлов.
На фиг. 6 дана схема экстракции ионов металлов растительными маслами.
Способ извлечения ионов тяжелых металлов из водных растворов, включающий экстракцию с использованием в качестве экстрагента растительных масел, содержащих жирные кислоты, при величине рН водных растворов, равной 9-11, отстаивание образующейся системы с расслаиванием ее на фазы и их разделение, отличающийся тем, что отстаивание системы после экстракции ведут с образованием трех фаз, верхняя из которых - масляная, представляющая собой регенерируемый экстрагент, нижняя - водная, и промежуточная - гелеобразная, состоящая из воды, масла и содержащая в виде сетчатой структуры гидроксокомплексы тяжелых металлов, гелеобразную фазу после разделения подвергают сушке при температуре 100-300°С до образования нанокристаллов оксидов тяжелых металлов.