Лечение заболевания периферических сосудов при помощи клеток, полученных из ткани пуповины
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии, и может быть использована для повышения реперфузии у пациента, имеющего заболевание периферических сосудов. Для этого применяют местно фармацевтическую композицию, содержащую фибриновый клей и выделенную однородную популяцию клеток, полученных из ткани пуповины человека, в количестве, эффективном для лечения заболевания, причем ткань пуповины по существу свободна от крови. Указанная выделенная однородная популяция клеток способна к самообновлению и размножению в культуре, имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Использование данных изобретений позволяет повысить реперфузию у пациента, имеющего заболевание периферических сосудов путем местного использования клеток ткани пуповины. 2 н. и 32 з.п. ф-лы, 7 пр., 13 ил., 7 табл.
Реферат
Перекрестные ссылки на смежные заявки
Настоящая заявка представляет собой частичное продолжение заявки на патент США № 11/617346, поданной 28 декабря 2006 г., которая испрашивает приоритет по предварительной заявке на патент США № 60/754366, поданной 28 декабря 2005 г., содержание которых полностью включено в настоящий документ путем ссылки.
Область применения изобретения
Настоящее изобретение относится к области клеточной или регенеративной терапии для пациентов с заболеванием периферических сосудов, особенно пациентов с ишемией периферических сосудов. Более конкретно, в настоящем изобретении предложены клетки, полученные из ткани пуповины, обладающие способностью стимулировать и поддерживать ангиогенез, улучшать кровоток, регенерировать, восстанавливать и улучшать состояние скелетных мышц, поврежденных в результате периферического ишемического события, и защищать скелетные мышцы от ишемического повреждения.
Предпосылки создания изобретения
В настоящем описании цитируются различные публикации, включая патенты, опубликованные заявки на патенты, технические статьи и научные статьи. Каждая из этих цитируемых публикаций полностью включена в настоящий документ путем ссылки.
Заболевание периферических сосудов (ЗПС) может представлять собой результат атеросклеротической окклюзии кровеносных сосудов, особенно в конечностях и удаленных от сердца областях, приводящей к ухудшению кровотока и недостаточной перфузии кислорода в тканях рядом или ниже по току крови от места окклюзии. ЗПС часто проявляется в кровеносных сосудах подвздошной области, бедренных и подколенных кровеносных сосудах и подключичных кровеносных сосудах, и его эффекты могут дополнительно усугубляться тромбами, эмболами или травмами. Согласно оценкам, в США ЗПС страдают приблизительно от 8 до 12 миллионов человек, особенно люди пожилого возраста и с сахарным диабетом.
Распространенные симптомы ЗПС включают в себя судороги в верхних и нижних конечностях, кистях и стопах, онемение, слабость, мышечную усталость, боли в конечностях, кистях и стопах, гипотермию в конечностях, кистях и стопах, нарушение окраски кожи кистей и стоп, ощущение сухости или шелушение кожи и гипертензию. Самым распространенным симптомом являются хромота или ощущение боли, скованность и спастические боли в местах ниже по току крови от места окклюзии в кровеносном сосуде, которые проявляются при некоторых формах физической нагрузки, таких как ходьба, но проходят сами после периода отдыха.
В терминах патофизиологии окклюзия кровеносных сосудов приводит к ишемии ткани в месте окклюзии и рядом с ним. Эту ишемию по существу называют ишемией периферических сосудов, имея в виду, что она проявляется в местах, дистальных по отношению к сердцу. Степень тяжести ишемии определяется размером и количеством окклюзий, степенью близости места окклюзии к мышце или органу и наличием достаточной дублирующей сосудистой системы. В более тяжелых случаях ишемия приводит к отмиранию затронутых тканей и может привести к ампутации пораженных конечностей или даже смерти пациента.
Используемые в настоящее время способы лечения более тяжелых случаев ЗПС включают в себя курсы химиотерапии, ангиопластику, вставку стентов, восстановительную хирургию, установку обходных сосудистых шунтов, иссечение пораженной ткани или ампутацию. К сожалению, у многих пациентов такие вмешательства приводят лишь к частичному успеху, и многие пациенты испытывают ухудшение своего состояния или симптомов.
В настоящее время существует интерес к использованию либо стволовых клеток, которые способны делиться и дифференцироваться, либо мышечных клеток из других источников, включая клетки гладкой и скелетной мускулатуры, чтобы способствовать восстановлению или обращению повреждения ткани. Трансплантацию стволовых клеток можно использовать в качестве клинического инструмента для восстановления целевой ткани, восстанавливая посредством этого ее физиологическую и анатомическую функциональность. Область применения технологии стволовых клеток очень широка и включает в себя технологии культивирования тканей, доставку агентов генной терапии и клеточных терапевтических агентов, т.е. доставку биотерапевтических агентов в целевую область с использованием экзогенно вводимых живых клеток или клеточных компонентов, которые содержат или вырабатывают такие агенты (обзор приведен в работе Tresco, P. A. et al., (2000 г.) Advanced Drug Delivery Reviews, 42: 2-37). Обнаружение стволовых клеток способствовало появлению исследований, направленных на селективное получение конкретных типов клеток для восстановительной медицины.
Одним препятствием к реализации терапевтического потенциала технологии стволовых клеток является трудность получения достаточного количества стволовых клеток. Один источник стволовых клеток представляет собой эмбриональные ткани или ткани плода. Эмбриональные стволовые клетки и клетки-предшественники выделены из ряда видов млекопитающих, включая людей, и для нескольких типов таких клеток продемонстрирована способность к самообновлению и размножению, а также дифференцированию по нескольким различным клеточным линиям дифференцирования. Однако получение стволовых клеток из эмбриональных тканей или тканей плода породило множество этических и моральных вопросов, которые желательно избегать путем выявления других источников мультипотентных или плюрипотентных клеток.
Ткани из послеродового материала, такого как пуповина и плацента, привлекли к себе интерес в качестве альтернативного источника стволовых клеток. Например, описаны способы извлечения стволовых клеток путем перфузии плаценты или сбора из крови или ткани пуповины. Ограничения этих способов получения стволовых клеток заключались в неадекватном объеме крови пуповины или количества получаемых клеток, а также неоднородности или отсутствии характеризации популяций клеток, полученных из этих источников.
Надежный, хорошо охарактеризованный и обильный источник по существу однородных популяций таких клеток, способных к дифференцированию по различным линиям дифференцирования клеток скелетной мышечной ткани, периваскулярных клеток или васкулярных клеток, будет эффективным во множестве диагностических и терапевтических приложений для восстановления, регенерации и улучшения скелетной мускулатуры, для стимулирования и/или поддержки ангиогенеза и для улучшения кровотока после периферического ишемического события, особенно у пациентов с ЗПС.
Изложение сущности изобретения
В одном аспекте настоящего изобретения описан способ лечения пациента с заболеванием периферических сосудов, включающий введение пациенту клеток, полученных из ткани пуповины, в количестве, эффективном для лечения заболевания периферических сосудов, причем клетки, полученные из ткани пуповины, получены из ткани пуповины человека по существу без крови, и причем клетки способны к самообновлению и размножению в культуре и имеют потенциал для дифференцирования в клетки по меньшей мере фенотипов клеток скелетных мышц, клеток гладких мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов; причем для роста клеткам необходим L-валин, и клетки могут расти в атмосфере с содержанием кислорода по меньшей мере приблизительно 5%; причем клетки дополнительно обладают по меньшей мере одной из следующих характеристик: (a) потенциал к по меньшей мере приблизительно 40 удвоениям в культуре; (b) закрепление и размножение на поверхности сосуда для культивирования ткани с покрытием или без покрытия, причем сосуд для культивирования с покрытием содержит покрытие из желатина, ламинина, коллагена, полиорнитина, витронектина или фибронектина; (c) выработка по меньшей мере одного из тканевого фактора, виментина и альфа-актина гладких мышц; (d) выработка по меньшей мере одного из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A,B,C; (e) отсутствие выработки по меньшей мере одного из CD31, CD34, CD45, CD80, CD86, CD117, CD141, CD178, B7-H2, HLA-G и HLA-DR,DP,DQ по результатам анализа с использованием проточной цитометрии; (f) экспрессия гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, повышена для по меньшей мере одного из генов, кодирующих: интерлейкин-8; ретикулон 1; CXCL1 (хемокиновый (мотив C-X-C) лиганд 1/стимулятор активности роста меланомы, альфа); CXCL6 (хемокиновый (мотив C-X-C) лиганд 6/белок хемотаксиса гранулоцитов 2); CXCL3 (хемокиновый (мотив C-X-C) лиганд 3); TNFAIP3 (индуцируемый фактором некроза опухоли альфа белок 3); (g) экспрессия гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, понижена для по меньшей мере одного из генов, кодирующих: SHOX2 (содержащий гомеобокс ген низкорослости 2); HSPB2 (27 кДа белок теплового шока 2); CXCL12 (хемокиновый (мотив C-X-C) лиганд 12/стромальный фактор 1); эластин (надклапанный аортальный стеноз, синдром Вильямса-Бойрена); мРНК Homo sapiens; кДНК DKFZp586M2022 (из клона DKFZp586M2022); Meox2 (содержащий мезенхимальный гомеобокс гена 2, содержащий гомеобокс блокировки роста ген); SIX1 (гомолог содержащего гомеобокс гена sine oculis 1) (Drosophila); кристаллин, альфа B; DAAM2 (ассоциированный с белком Disheveled активатор морфогенеза 2); белок DKFZP586B2420; аналог нейтралина 1; тетранектин (связывающийся с плазминогеном белок); STAC (ген, содержащий домен src-гомологии 3 (SH3) и богатый цистеином домен); холестерин-25-гидроксилазу; RUNX3 (связанный с карликовостью фактор транскрипции 3); рецептор интерлейкина-11, альфа; PCOLCE (усилитель проколлаген-C-эндопептидазы); FZD7 (гомолог frizzled 7) (Drosophila); гипотетический ген BC008967; коллаген, тип VIII, альфа 1; TNC (тенасцин C, гексабрахион); IRX5 (содержащий гомеобокс IRX белок 5); гефестин; интегрин, бета 8; SV2A (гликопротеин синаптического пузырька 2); NBL1 (нейробластома, ген подавления онкогенности 1); IGFBP2 (связывающийся с инсулиноподобным фактором роста белок 2, 36 кДа); кДНК Homo sapiens FLJ12280 fis, клон MAMMA1001744; CRLF1 (подобный цитокиновому рецептору фактор 1); KCNN4 (активируемый кальцием калиевый канал средней/низкой проводимости, подсемейство N, член 4); интегрин, бета 7; транскрипционный коактиватор с мотивом связывания с PDZ (TAZ); SIX2 (гомолог содержащего гомеобокс гена sine oculis 2) (Drosophila); белок KIAA1034; VAMP5 (везикуло-ассоциированный мембранный белок 5/миобревин); EFEMP1 (содержащий EGF фибулин-подобный белок внеклеточного матрикса 1); EGR3 (белок раннего ростового ответа 3); DLX5 (содержащий гомеобокс distal-less гена 5); гипотетический белок FLJ20373; AKR1C3 (альдокеторедуктаза семейства 1, член C3/3-альфа-гидроксистероиддегидрогеназа, тип II); бигликан; транскрипционный коактиватор с мотивом связывания с PDZ (TAZ); фибронектин 1; проэнкефалин; интегрин, бета-подобный 1 (с доменами EGF-подобных повторов); мРНК Homo sapiens, полноразмерная вставка кДНК, клон EUROIMAGE 1968422; EphA3; белок KIAA0367; NPR3 (рецептор натрийуретического пептида C/гуанилатциклаза C/рецептор атрионатрийуретического пептида C); гипотетический белок FLJ14054; мРНК Homo sapiens; кДНК DKFZp564B222 (из клона DKFZp564B222); BNIP3L (ген белка, подобного белку 3, взаимодействующему с BCL2/белком аденовируса E1B 19 кДа); AE-связывающий белок 1; COX7A1 (полипептид 1 субъединицы VIIa цитохром c оксидазы) (мышечный); аналог нейтралина 1; BTG1 (ген транслокации B-клеток 1); гипотетический белок FLJ23191; и DKFZp586L151, (h) секреция по меньшей мере одного из MCP-1, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIP1b, RANTES и TIMP1; и (i) отсутствие секреции по меньшей мере одного из TGF-бета2, ANG2, PDGFbb, MIP1a и VEGF по результатам ИФА.
В конкретном варианте осуществления заболевание периферических сосудов представляет собой ишемию периферических сосудов. В определенных вариантах осуществления перед введением пациенту клетки индуцируют in vitro для дифференцирования по линиям дифференцирования клеток скелетных мышц, клеток гладких мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов. В других вариантах осуществления клетки модифицируют методами генной инженерии для выработки продукта гена, который способствует лечению заболевания периферических сосудов.
В некоторых вариантах осуществления способа клетки вводят с клетками по меньшей мере одного другого типа, которые могут включать в себя клетки скелетных мышц, клетки-предшественники клеток скелетных мышц, клетки гладких мышц сосудов, клетки-предшественники клеток гладких мышц сосудов, периваскулярные клетки, клетки эндотелия сосудов, клетки-предшественники клеток эндотелия сосудов или другие мультипотентные или плюрипотентные стволовые клетки. Клетки другого типа можно вводить одновременно либо до, либо после клеток, полученных из ткани пуповины.
В других вариантах осуществления клетки вводят по меньшей мере с одним другим агентом, который может представлять собой, например, антитромбогенный агент, противовоспалительный агент, иммуносупрессорный агент, иммуномодулирующий агент, проангиогенный агент или антиапоптозный агент. Другой агент можно вводить одновременно либо до, либо после клеток, полученных из ткани пуповины.
Клетки предпочтительно вводят непосредственно в месте или рядом с местом ишемического повреждения периферических сосудов, но их также можно вводить в местах, дистальных к местам ишемического повреждения периферических сосудов. Клетки можно вводить путем инъекции, инфузии, имплантации устройства пациенту, либо путем имплантации содержащих клетки матрицы или каркаса. Клетки могут оказывать трофическое действие, такое как пролиферация, на мышечную мускулатуру, гладкую мускулатуру сосудов или эндотелий сосудов пациента. Клетки могут индуцировать миграцию клеток скелетных мышц, клеток гладких мышц сосудов, клеток эндотелия сосудов, клеток-предшественников клеток скелетных мышц, периваскулярных клеток, клеток-предшественников клеток гладких мышц сосудов или клеток-предшественников клеток эндотелия сосудов к месту или местам заболевания периферических сосудов, такого как ишемия периферических сосудов.
В другом аспекте настоящего изобретения описаны фармацевтические композиции и наборы для лечения пациента с заболеванием периферических сосудов, содержащие фармацевтически приемлемый носитель и описанные выше клетки, полученные из ткани пуповины, или препараты из таких клеток, полученных из ткани пуповины. В некоторых предпочтительных вариантах осуществления такие препараты содержат FGF и HGF. Фармацевтические композиции и наборы разработаны и/или приготовлены для реализации на практике способов, составляющих предмет настоящего изобретения, как описано выше.
В соответствии с другим аспектом настоящего изобретения описанные выше способы можно применять на практике с использованием препарата, изготовленного из клеток, полученных из ткани пуповины, причем препарат содержит клеточный лизат клеток, полученных из ткани пуповины, внеклеточный матрикс клеток, полученных из ткани пуповины, или кондиционированную среду, в которой выращивали клетки, полученные из ткани пуповины. Такие препараты предпочтительно содержат FGF и HGF.
В других аспектах настоящего изобретения описаны фармацевтические композиции и наборы, в состав которых входят препараты, содержащие клеточные лизаты, внеклеточные матриксы или кондиционированную среду клеток, полученных из ткани пуповины.
Один вариант осуществления настоящего изобретения представляет собой способ лечения пациента с заболеванием периферических сосудов, включающий введение фармацевтической композиции, содержащей фибриновый клей и выделенную однородную популяцию клеток, полученных из ткани пуповины человека, в количестве, эффективном для лечения такого заболевания, причем ткань пуповины по существу свободна от крови, и причем выделенная однородная популяция клеток способна к самообновлению и размножению в культуре, имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Выделенная популяция клеток также может обладать одной или более из следующих характеристик:
(a) экспрессирует рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок;
(b) не экспрессирует CD31, CD34 или CD45;
(c) экспрессирует, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина-8 или ретикулона 1;
(d) имеет потенциал для дифференцирования в клетки по меньшей мере фенотипов клеток скелетных мышц, клеток гладких мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов; и
(е) экспрессирует CD10, CD13, CD44, CD73 и CD90.
В одном варианте осуществления заболевание периферических сосудов представляет собой ишемию периферических сосудов. Фармацевтическую композицию вводят в местах ишемического повреждения периферических сосудов. В другом варианте осуществления фармацевтическую композицию вводят локально. В одном варианте осуществления фармацевтическую композицию вводят путем инъекции, инфузии, имплантации устройства пациенту либо путем имплантации матрицы или каркаса, содержащих фармацевтическую композицию. В альтернативном варианте осуществления фармацевтическую композицию вводят путем внутримышечной инъекции и инъекции в жировые депо в мышцах. В другом варианте осуществления фармацевтическую композицию вводят путем инъекции в интерстициальное пространство таким образом, чтобы композиция не попадала напрямую в кровоток. Выделенную популяцию клеток перед введением пациенту можно индуцировать in vitro для дифференцирования по линиям дифференцирования клеток скелетных мышц, клеток мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов. Популяцию клеток также можно модифицировать методами генной инженерии для выработки продукта гена, который способствует лечению заболевания периферических сосудов. Композиция необязательно дополнительно содержит агент, выбранный из группы, состоящей из антитромбогенного агента, иммуносупрессорного агента, иммуномодулирующего агента, проангиогенного агента, антиапоптозного агента и их смесей. В альтернативном варианте осуществления композиция дополнительно содержит клетки по меньшей мере одного другого типа (такие как, например, клетки скелетных мышц, клетки-предшественники клеток скелетных мышц, клетки гладких мышц сосудов, клетки-предшественники клеток гладких мышц сосудов, периваскулярные клетки, клетки эндотелия сосудов, клетки-предшественники клеток эндотелия сосудов или другие мультипотентные или плюрипотентные стволовые клетки). В одном варианте осуществления фармацевтическая композиция оказывает трофическое действие (такое как, например, пролиферация клеток эндотелия сосудов). В другом варианте осуществления фармацевтическая композиция индуцирует миграцию клеток эндотелия сосудов и/или клеток-предшественников клеток эндотелия сосудов к местам заболевания периферических сосудов. В другом альтернативном варианте осуществления фармацевтическая композиция индуцирует миграцию клеток гладких мышц сосудов и/или клеток-предшественников клеток гладких мышц сосудов к местам заболевания периферических сосудов. В другом варианте осуществления фармацевтическая композиция индуцирует миграцию периваскулярных клеток к местам заболевания периферических сосудов. В одном варианте осуществления фибриновый клей содержит фибриноген и тромбин. В другом варианте осуществления фибриновый клей содержит от приблизительно 16 до приблизительно 24 МЕ/мл тромбина и от приблизительно 39,3 до приблизительно 60,7 мг/мл фибриногена.
Другой вариант осуществления настоящего изобретения представляет собой способ лечения пациента с заболеванием периферических сосудов, включающий введение фибринового клея (например, композиции, содержащей фибриноген и тромбин) и выделенной однородной популяции клеток, полученных из ткани пуповины человека, в количестве, эффективном для лечения такого заболевания, причем ткань пуповины по существу свободна от крови, и причем выделенная однородная популяция клеток способна к самообновлению и размножению в культуре, имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Выделенная популяция клеток может обладать другими характеристиками, включая одну или более из следующих характеристик:
(a) экспрессирует рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок;
(b) не экспрессирует CD31, CD34 или CD45;
(c) экспрессирует, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина-8 или ретикулона 1;
(d) имеет потенциал для дифференцирования в клетки по меньшей мере фенотипов клеток скелетных мышц, клеток гладких мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов; и
(е) экспрессирует CD10, CD13, CD44, CD73 и CD90.
В одном варианте осуществления заболевание периферических сосудов представляет собой ишемию периферических сосудов, и фибриновый клей и популяцию клеток необязательно вводят в местах ишемического поражения периферических сосудов. Можно использовать различные пути введения, включая введение путем инъекции, инфузии, имплантации устройства пациенту либо путем имплантации содержащих клетки матрицы или каркаса. В одном варианте осуществления популяцию клеток и фибриновый клей вводят локально (например, путем внутримышечной инъекции и инъекции в жировые депо в мышцах). В другом варианте осуществления клетки и фибриновый клей вводят путем инъекции в интерстициальное пространство таким образом, чтобы они попадали напрямую в кровоток. Выделенную популяцию клеток перед введением пациенту необязательно индуцируют in vitro для дифференцирования по линиям дифференцирования клеток скелетных мышц, клеток мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов. Популяцию клеток также можно модифицировать методами генной инженерии для выработки продукта гена, который способствует лечению заболевания периферических сосудов. В одном варианте осуществления способ дополнительно содержит введение агента, выбранного из группы, состоящей из антитромбогенного агента, иммуносупрессорного агента, иммуномодулирующего агента, проангиогенного агента, антиапоптозного агента и их смесей. В другом варианте осуществления способ дополнительно содержит введение клеток по меньшей мере одного другого типа (таких как, например, клетки скелетных мышц, клетки-предшественники клеток скелетных мышц, клетки гладких мышц сосудов, клетки-предшественники клеток гладких мышц сосудов, периваскулярные клетки, клетки эндотелия сосудов, клетки-предшественники клеток эндотелия сосудов или другие мультипотентные или плюрипотентные стволовые клетки). В одном варианте осуществления популяция клеток оказывает трофическое действие (такое как, например, пролиферация клеток эндотелия сосудов). Популяция клеток может индуцировать миграцию клеток эндотелия сосудов и/или клеток-предшественников клеток эндотелия сосудов к местам заболевания периферических сосудов. В альтернативном варианте осуществления популяция клеток может индуцировать миграцию клеток гладких мышц сосудов и/или клеток-предшественников клеток гладких мышц сосудов к местам заболевания периферических сосудов. Популяция клеток также может индуцировать миграцию периваскулярных клеток к местам заболевания периферических сосудов. Фибриновый клей может содержать фибриноген и тромбин. В одном варианте осуществления фибриновый клей вводят одновременно либо до, либо после введения выделенной однородной популяции клеток, полученных из ткани пуповины человека. В другом варианте осуществления фибриновый клей содержит от приблизительно 16 до приблизительно 24 МЕ/мл тромбина и от приблизительно 39,3 до приблизительно 60,7 мг/мл фибриногена.
Другой вариант осуществления настоящего изобретения представляет собой набор для лечения пациента с заболеванием периферических сосудов, содержащий фибриноген, тромбин и выделенную однородную популяцию клеток, полученных из ткани пуповины человека, в количестве, эффективном для лечения такого заболевания, причем ткань пуповины по существу свободна от крови, и причем указанная выделенная однородная популяция клеток способна к самообновлению и размножению в культуре, имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Набор может дополнительно содержать инструкцию по применению. В одном варианте осуществления фибриноген и выделенная однородная популяция клеток представлены в виде композиции, к которой непосредственно перед использованием можно добавить тромбин. Выделенная популяция клеток может обладать другими характеристиками, включая одну или более из следующих характеристик:
(a) экспрессирует рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок;
(b) не экспрессирует CD31, CD34 или CD45;
(c) экспрессирует по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека повышенные уровни интерлейкина-8 или ретикулона 1;
(d) имеет потенциал для дифференцирования в клетки по меньшей мере фенотипов клеток скелетных мышц, клеток гладких мышц сосудов, периваскулярных клеток или клеток эндотелия сосудов; и
(е) экспрессирует CD10, CD13, CD44, CD73 и CD90.
В одном варианте осуществления набор содержит от приблизительно 16 до приблизительно 24 МЕ/мл тромбина и от приблизительно 39,3 до приблизительно 60,7 мг/мл фибриногена. В одном варианте осуществления набор содержит фибриногенный компонент, содержащий фибрин и фактор XII, и тромбиновый компонент, содержащий тромбин и кальций.
Другие характеристики и преимущества настоящего изобретения станут понятны после изучения следующего подробного описания и примеров.
Краткое описание чертежей
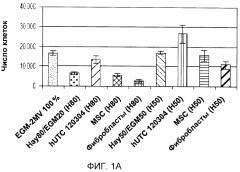
На фигуре 1 показан эффект клеток, полученных из ткани пуповины человека (hUTC), партия № 120304, мезенхимальных стволовых клеток (MSC) и фибробластов на пролиферацию клеток эндотелия. Клетки эндотелия высевали на дно 24-луночной чашки Петри с плотностью 5000 клеток/см2 (10000 клеток/лунку), и клетки hUTC (партия № 120304), клетки MSC или фибробласты высевали во вкладыши трансвел с плотностью 5000 клеток/см2 (1650 клеток/вкладыш) в среде для совместного культивирования (среда Хейфлика 80% + среда EGM-2MV 20% или среда Хейфлика 50% + среда EGM-2MV 50%). После 7 суток совместного культивирования клетки собирали и подсчитывали при помощи анализатора Guava®. Кроме того, клетки эндотелия также поддерживали в среде EGM-2MV в качестве положительного контроля. A, клетки HUVEC (клетки эндотелия пупочной вены человека). B, клетки HCAEC (клетки эндотелия коронарной артерии человека). C, клетки HIAEC (клетки эндотелия подвздошной артерии человека).
На фигуре 2 показан эффект клеток hUTC (партия № 120304) и нейтрализующих антител на пролиферацию клеток эндотелия. Клетки HUVEC или HCAEC высевали на дно 24-луночной чашки Петри с плотностью 5000 клеток/см2 (10000 клеток/лунку), и клетки hUTC (партия № 120304) высевали во вкладыши трансвел с плотностью 5000 клеток/см2 (1650 клеток/вкладыш) в среде для совместного культивирования (среда Хейфлика 50% + EGM-2MV 50%). В это же время также добавляли нейтрализующие антитела к FGF (7 мкг/мл), HGF (1 мкг/мл) или VEGF (1 мкг/мл). После 7 суток совместного культивирования клетки собирали и подсчитывали при помощи анализатора Guava®. Кроме того, клетки эндотелия также поддерживали в среде EGM-2MV в качестве положительного контроля. На фигуре показаны результаты для клеток, обработанных только фактором роста и фактором роста плюс нейтрализующие антитела. A и B, клетки HUVEC. C и D, клетки HCAEC.
На фигуре 3 показан эффект клеточного лизата клеток hUTC (партия № 120304) и нейтрализующих антител на пролиферацию клеток HUVEC. Клетки HUVEC высевали на дно 24-луночной чашки Петри с плотностью 5000 клеток/см2 (10000 клеток/лунку) в среде EGM-2MV на 8 часов. Затем клетки переводили в бессывороточную среду путем инкубации в течение ночи в 0,5 мл среды EGM-2MV, содержащей 0,5% FBS и не содержащей факторов роста. После этого добавляли FBS, свежеприготовленные клеточные лизаты клеток hUTC (партия № 120304) и нейтрализующие антитела к FGF (7 мкг/мл) или HGF (1 мкг/мл). После 4 суток культивирования клетки собирали и подсчитывали при помощи анализатора Guava®. Светло-серыми столбиками показаны результаты для контролей в чистой среде. Серыми столбиками показаны результаты для клеток HUVEC, инкубированных с лизатом, содержащим 62,5 мкг белка. Темно-серыми столбиками показаны результаты для клеток HUVEC, инкубированных с лизатом, содержащим 125 мкг белка.
На фигуре 4 показан эффект клеток hUTC и клеток MSC на миграцию клеток эндотелия. Клетки HUVEC или HCAEC высевали во вкладыши трансвел с плотностью 5000 клеток/см2 (23000 клеток/вкладыш), и клетки hUTC (партия № 120304) или клетки MSC высевали на дно 6-луночной чашки Петри с плотностью 5000 клеток/см2 (48000 клеток/лунку) в среде для совместного культивирования (среда Хейфлика 50% + EGM-2MV 50%). После 7 суток совместного культивирования клетки, оказавшиеся с нижней стороны вкладыша трансвел, собирали и подсчитывали при помощи анализатора Guava®. Кроме того, клетки эндотелия также поддерживали в среде EGM-2MV в качестве контроля. A, клетки HUVEC. B, клетки HCAEC.
На фигуре 5 показан эффект клеток hUTC (партия № 120304) и нейтрализующих антител на миграцию клеток эндотелия. Клетки HUVEC или HCAEC высевали во вкладыши трансвел с плотностью 5000 клеток/см2 (23000 клеток/вкладыш), и клетки hUTC (партия № 120304) высевали на дно 6-луночной чашки Петри с плотностью 5000 клеток/см2 (48000 клеток/лунку) в среде для совместного культивирования (среда Хейфлика 50% + EGM-2MV 50%). В это же время добавляли нейтрализующие антитела к FGF (7 мкг/мл) или HGF (1 мкг/мл). После 7 суток совместного культивирования клетки, оказавшиеся с нижней стороны вкладыша трансвел, собирали и подсчитывали при помощи анализатора Guava®. Кроме того, клетки эндотелия также поддерживали в среде EGM-2MV в качестве контроля. A, клетки HUVEC. B, клетки HCAEC.
На фигуре 6 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации (LDI), из эксперимента с мышами линии NSG в исследовании, раскрытом в примере 5. Данные представлены в виде среднего значения ±СПС. Идентификация точек данных представлена в легенде. Цифры в скобках указывают на (1) P<0,001 по сравнению с соответствующим контролем; (2) P<0,05 по сравнению с клетками hUTC без фибрина.
На фигуре 7 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации, из эксперимента с бестимусными мышами в исследовании, раскрытом в примере 5. Данные представлены в виде среднего значения ±СПС. Идентификация точек данных представлена в легенде. Цифры в скобках указывают на (1) P<0,001 по сравнению с соответствующим контролем; (2) P<0,05 по сравнению с клетками hUTC без фибрина.
На фигуре 8 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации, для сравнения системной (внутривенной (в/в)), локальной (внутримышечной (в/м)) доставки и локальной доставки + фибриновый клей в исследовании, раскрытом в примере 6. Данные представлены в виде среднего значения ±СПС.
На фигуре 9 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации, для различных доз клеток hUTC в фибриновом клее при локальной (в/м) доставке в исследовании, раскрытом в примере 6. Данные представлены в виде среднего значения ±СПС.
На фигуре 10 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации, для сравнения системной (в/в), локальной (в/м) доставки и локальной доставки + фибриновый клей на 14 сутки после травмы в исследовании, раскрытом в примере 6. Для ясности данные представлены в виде средних значений.
На фигуре 11 показаны данные по перфузии, полученные с использованием лазерной доплеровской визуализации, для исследования, раскрытого в примере 7. Идентификация точек данных представлена в легенде. *, P<0,05; ***, P<0,001.
На фигуре 12 показана плотность капилляров в ишемизированных конечностях по сравнению с неишемизированными конечностями мышей, выживших на 21 сутки, для исследования, раскрытого в примере 7.
На фигуре 13 показана плотность артериол в ишемизированных конечностях по сравнению с неишемизированными конечностями мышей, выживших на 21 сутки, для исследования, раскрытого в примере 7.
Подробное описание изобретения
В приведенном ниже описании и формуле изобретения используются различные термины. Считается, что такие термины имеют общепринятое в данной области значение, если не указано иное. Другие специально определенные термины должны трактоваться согласно приведенным в настоящем документе определениям.
Стволовые клетки представляют собой недифференцированные клетки, определяющиеся по способности на уровне единичной клетки как самообновляться, так и дифференцироваться для получения клеток-потомков, включая самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются своей способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из множества зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от множества зародышевых листков, и способствовать образованию по существу большинства, если не всех, тканей после инъекции в бластоцисты.
По своему потенциалу развития стволовые клетки разделяются на: (1) тотипотентные; (2) плюрипотентные; (3) мультипотентные; (4) олигопотентные; и (5) унипотентные. Тотипотентные клетки способны преобразовываться во все типы эмбриональных и внеэмбриональных клеток. Плюрипотентные клетки способны преобразовываться во все типы эмбриональных клеток. Мультипотентные клетки включают в себя клетки, способные преобразовываться в подмножество клеточных линий дифференцирования, но только в пределах конкретной ткани, органа или физиологической системы. Например, гемопоэтические стволовые клетки (ГСК) могут порождать потомство, которое включает в себя ГСК (самообновление), рестриктированные олигопотентные клетки-предшественники клеток крови и все типы и элементы клеток (например, тромбоциты), представляющие собой стандартные компоненты крови. Клетки, которые являются олигопотентными, способны преобразовываться в более ограниченное подмножество клеточных линий дифференцирования, чем мультипотентные стволовые клетки. Клетки, которые являются унипотентными, способны преобразовываться в единственную клеточную линию дифференцирования (например, сперматогенные стволовые клетки).
Стволовые клетки также разделяются на категории по источнику их получения. Взрослая стволовая клетка по существу представляет собой мультипотентную недифференцированную клетку, присутствующую в ткани, содержащей множество дифференцированных типов клеток. Взрослая стволовая клетка способна к самообновлению. В нормальных условиях она также может дифференцироваться для получения специальных типов клеток ткани, в которой они находятся, а также, возможно, тканей других типов. Эмбриональная стволовая клетка представляет собой плюрипотентную клетку из внутренней клеточной массы эмбриона на стадии бластоцисты. Фетальная стволовая клетка представляет собой клетку, происходящую из тканей или мембран плода. Постнатальная стволовая клетка представляет собой мультипотентную или плюрипотентную клетку, происходящую по существу из доступной после родов внеэмбриональной ткани, а именно плаценты и пуповины. Известно, что эти клетки обладают признаками, характерными для плюрипотентных стволовых клеток, включая быструю пролиферацию и потенциал дифференцирования в клетки многих клеточных линий дифференцирования. Постнатальные стволовые клетки можно получить из крови (например, клетки, полученные из пуповинной крови) или не из крови (например, из отличных от крови тканей пуповины и плаценты).
Эмбриональную ткань, как правило, определяют как ткань, происходящую из эмбриона (что для человека обозначает срок разви