Способ планирования высокодозной внутритканевой лучевой терапии рака предстательной железы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургической онкологии, и может быть использовано для планирования высокодозной внутритканевой лучевой терапии рака предстательной железы (ПЖ). Выполняют сатурационную биопсию ПЖ промежностным доступом при помощи комплекса, предназначенного для навигированного ультразвуком введения игл в участки ПЖ. Дополнительно осуществляют прицельный забор биоптатов из парауретральной зоны с обеих сторон и снизу от уретры. При наличии опухолевых изменений в парауретральной зоне выбирают дозы облучения до 100-120 Гр на весь объем ПЖ, включая парауретральную зону. При отсутствии изменений выбирают дозы облучения на парауретральную зону ПЖ до 70-80 Гр и проводят латеральное введение игл-интрастатов по отношению к уретре. Способ позволяет оптимизировать распределение лучевой нагрузки в пределах ПЖ при проведении высокодозной брахитерапии ПЖ, получить достоверную информацию о распространенности опухолевого процесса в парауретральной зоне за счет забора биоптатов из ПЖ и парауретральной зоны, выбора оптимальных доз облучения, введения игл-интрастатов с учетом наличия или отсутствия опухолевых клеток. 3 ил., 2 пр.
Реферат
Изобретение относится к медицине, а именно к хирургической онкологии, и может быть использовано для планирования высокодозной внутритканевой лучевой терапии рака предстательной железы (РПЖ).
Широкое внедрение в клиническую практику современных органосохраняющих методов лечения больных РПЖ (высокодозная и низкодозная брахитерапия, лечение высокофокусированным ультразвуком, криотерапия и др.) предъявляет новые требования к методике выполнения биопсии простаты. Получение образцов ткани, направленное главным образом на гистологическую верификацию диагноза, так же должно играть не менее важную роль при выборе метода лечения и способствовать оптимизации лечебного плана у каждого конкретного больного.
На сегодняшний день выполнение биопсии предстательной железы (ПЖ) под ультразвуковым контролем является обязательным стандартом диагностики и важнейшим элементом первичного определения степени местной распространенности процесса. Согласно действующим рекомендациям ведущих урологических и онкологических ассоциаций (EAU 2014, NCCN 2014) общепринятая методика биопсии подразумевает взятие 12 столбиков ткани преимущественно трансректальным доступом. Вместе с тем, в ряде клинических ситуаций, таких как: уровень простатспецифического антигена (ПСА) менее 10 нг/мл, большой объем железы, первичные негативные биопсии в анамнезе, возникает необходимость выполнять сатурационную биопсию (более 18 биоптатов).
Впервые техника сатурационной биопсии была описана для трансректального доступа в самом начале XXI века (Borboroglu P.G., Comer S.W., Riffenburgh R.H., Amling C.L. Extensive repeat transrectal ultrasound guided prostate biopsy in patients with previous benign sextant biopsies // J. Urol. - 2000. - Vol. 163, N 1. - P. 158-162.). Попытки использования брахитерапевтического оборудования, позволяющего осуществлять чрескожный промежностный доступ к железе с целью получения материала для патоморфологического исследования, также связаны с относительно недавними исследованиями. Преимущества, которые дает этот вид доступа, очевидны: возможность адекватного забора материала из апикальной и передней зоны железы, высокий уровень точности при получении материала за счет использования фиксированного на степпере УЗИ-датчика и брахитерапевтической решетки. Вместе с тем, промежностный доступ в большей степени, чем трансректальный, требует стандартизации в вопросах разделения железы на сектора (квадранты), что служит основой системности при выполнении данного вида процедуры.
Подавляющее большинство авторов при выполнении сатурационной промежностной биопсии (СПБ) разделяют железу от 8 до 24 зон (квадрантов) (Li Н., Yan W., Zhou Y., Ji Z., Chen J. Transperineal ultrasound-guided saturation biopsies using 11-region template of prostate: report of 303 cases // Urology. - 2007. - Vol. 70, №6. P. 1157-1161; Merrick G.S., Gutman S., Andreini H. et al. Prostate cancer distribution in patients diagnosed by transperineal template-guided saturation biopsy // Eur Urol. - 2007. - Vol. 52, №3. - P. 715-723.; Moran B.J., Braccioforte M.H. Stereotactic transperineal prostate biopsy // Urology. - 2009. - Vol. 73, №2. - P. 386-388.).
Анализ имеющихся данных говорит о том, что создание новых модификаций СПБ направлено для решения следующих основных задач: повышение диагностической эффективности процедуры, снижение частоты обнаружения клинически незначимого рака, выявление мультифокальных случаев заболевания при определении кандидатов для фокальных, в первую очередь аблативных методов лечения (Singh Р.В., Anele С., Dalton Е. et al. Prostate cancer tumour features on template prostate-mapping biopsies: implications for focal therapy // Eur. Urol. - 2014. - Vol. 66, №1, - P. 12-19.).
Исследования, направленные на оптимизацию выполнения сатурационной биопсии в целях проведения более радикальных методов лечения, таких как хирургическое лечение или внутритканевая лучевая терапия, отсутствуют.
Внутритканевая лучевая терапия (брахитерапия) является высокоэффективным методом лечения больных РПЖ. Современные способы визуализации и планирования лучевой нагрузки делают ее методом выбора у многих пациентов с локализованными и местно-распространенными формами заболевания. Существует две разновидности брахитерапии (БТ): более распространенная низкодозная и высокодозная (ВДБТ), которую можно рассматривать в качестве следующего этапа развития этого метода лечения.
Одним из существенных преимуществ ВДБТ по сравнению не только с радикальной операцией, но и с альтернативными лучевыми методиками (низкодозная брахитерапия, дистанционная лучевая терапия) является более низкая частота осложнений. Наблюдаемые у больных ранние (острые) расстройства мочеиспускания в большинстве случаев проходят самостоятельно либо требуют непродолжительной консервативной терапии и не оказывают существенного влияния на качество жизни пациентов в последующем (Канаев С.В., Петров С.Б., Носов А.К. и соавт. Расстройства функции нижних мочевыводящих путей при высокодозной брахитерапии по поводу рака предстательной железы // Онкология XXI века - от научных исследований в клиническую практику: Материалы VIII съезда онкологов России, Санкт-Петербург, 11-13 сентября 2013 г. - СПб.: ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России - С. 844.).
Вместе с тем, частота поздних осложнений со стороны нижних мочевых путей по сообщению ряда авторов остается на относительно высоком уровне. Так, Hindson B.R. и соавт. сообщают об общем риске в 8,2% формирования стриктуры уретры в течение последующих 2-х лет после ВДБТ (Hindson B.R., Millar J.L., Matheson В. Urethral strictures following high-dose-rate brachytherapy for prostate cancer: analysis of risk factors // Brachytherapy. - 2013. - Vol. 12, №1. - P. 50-55.). При этом в зависимости от величины поглощенной дозы эта частота варьировала от 2,3% (18 Гр/3 фракции) до 31,6% (20 Гр/2 фракции). Наиболее частой локализацией определен бульбозно-мембранозный отдел (50,0%). Большинство исследователей приводят данные, указывающие на то, что средний уровень частоты формирования стриктуры уретры при проведении ВДБТ в различных режимах составляет около 15% (Pellizzon А.С., Salvajoli J.V., Maia М.А. et al. Late urinary morbidity with high dose prostate brachytherapy as a boost to conventional external beam radiation therapy for local and locally advanced prostate cancer // J. Urol. - 2004. - Vol. 171, №6. - P. 1105-1108.).
Важнейшей технической особенностью ВДБТ является возможность создания идеальных условий для управляемого неравномерного облучения ПЖ с точным подведением дополнительных доз облучения («boost») на участки с высоким риском рецидивирования РПЖ - визуализируемую опухоль, периферическую зону, и при этом снижать лучевую нагрузку на окружающие нормальные ткани, в первую очередь, простатическую часть уретры (Hoskin P.J., Colombo A., Henry A. et al. GEC/ESTRO recommendations on high dose rate afterloading brachytherapy for localised prostate cancer: an update // Radiother. Oncol. - 2013. - Vol. 107, №3. - P. 325-332.).
Указанный метод ВДБТ, рекомендованный европейской ассоциацией GEC-ESTRO, является ближайшим аналогом изобретения.
Однако в связи с отсутствием точных данных о локализации опухолевого процесса в ПЖ авторы рекомендуют равномерное облучение всей ПЖ, включая уретру, что существенно увеличивает риск осложнений лучевого лечения со стороны мочевыводящих путей, особенно при использовании однократного облучения.
Напротив, снижение лучевой нагрузки на уретру при отсутствии точных данных о топографии опухолевого поражения ПЖ может привести к значительному увеличению риска рецидивирования опухоли вследствие нераспознанного поражения центральной доли ПЖ.
Техническим результатом изобретения является оптимизация распределения лучевой нагрузки в пределах ПЖ при проведении высокодозной брахитерапии ПЖ за счет достоверной информации о распространенности опухолевого процесса в непосредственной близости от уретры (парауретральной зоне).
Указанный технический результат достигается тем, что в способе планирования высокодозной внутритканевой лучевой терапии рака предстательной железы (ПЖ), включающем сатурационную биопсию ПЖ с последующим планированием лучевой нагрузки на ПЖ, область опухолевого поражения ПЖ и простатическую часть уретры, согласно изобретению при выполнении сатурационной биопсии ПЖ промежностным доступом при помощи комплекса, предназначенного для навигированного ультразвуком введения игл в участки ПЖ, дополнительно осуществляют прицельный забор биоптатов из парауретральной зоны с обеих сторон и снизу от уретры и при наличии опухолевых изменений в парауретральной зоне выбирают дозы облучения до 100-120 Гр на весь объем ПЖ, включая парауретральную зону, а при отсутствии таковых изменений выбирают дозы облучения на парауретральную зону ПЖ до 70-80 Гр и проводят латеральное введение игл-интрастатов по отношению к уретре.
Трансперинеальный (промежностный) забор биоптатов осуществляют под спинномозговой анестезией в условиях операционной в асептических условиях.
Во время выполнения процедуры производится стандартная 2-мерная трансректальная УЗ визуализация ПЖ с помощью специализированного датчика с инкодером его положения на подставке-держателе, снабженной откалиброванной брахитерапевтической решеткой (template), предназначенной для навигации инвазивных вмешательств (введения игл при биопсии, брахитерапии или введении радиоколлоидов).
Специальное программное обеспечение позволяет совмещать откалиброванное изображение решетки с поперечными УЗИ-сканами ПЖ в режиме реального времени. Подобный подход обеспечивает возможность точной визуализации интрапростатического отдела уретры и парауретральной зоны железы.
В ходе выполнения стандартной сатурационной биопсии промежностным доступом осуществляют забор биоптатов из парауретральной зоны. Количество этих биоптатов зависит от объема простаты.
Полученный в ходе процедуры материал для патоморфологического исследования подлежит обязательной маркировке в соответствии со схемой забора биоптатов.
Достоверная информация о наличии или отсутствии опухолевых клеток в биоптатах, полученных из парауретральной зоны, позволяет наиболее оптимально планировать введение игл-интрастатов, определять границы зоны повышенной лучевой нагрузки «boost» при проведении высокодозной брахитерапии.
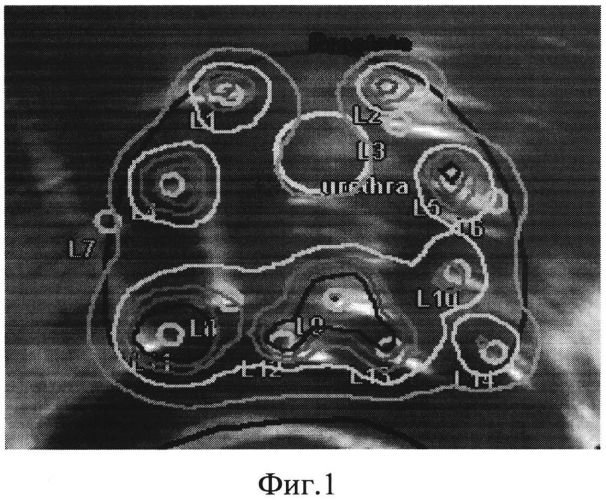
На фиг. 1 представлено схематическое расположение игл-интрастатов, наложенное на поперечный УЗИ-скан ПЖ: интрастаты расположены на достаточном расстоянии от мочеиспускательного канала.
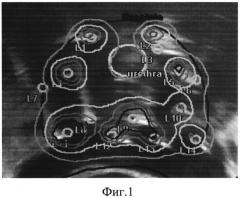
На фиг. 2 представлено схематическое расположение игл-интрастатов, наложенное на поперечный УЗИ-скан ПЖ: интрастаты слева от уретры расположены рядом с мочеиспускательным каналом. Их расположение соответствует топографии позитивных парауретральных столбиков.
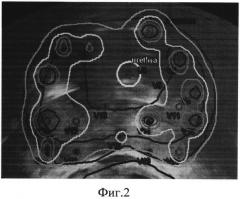
На фиг. 3 представлена схема забора биоптатов из парауретральной зоны: а) поперечный скан ПЖ, совмещенный с откалиброванным изображением (расстояние между ближайшими точками 5 мм), соответствующим брахитерапевтической решетке, б) схема забора парауретральных биоптатов (отмечены кружками). Отверстие мочеиспускательного канала соответствует D3, проекция уретры на поперечный скан обозначена штриховой линией.
Способ осуществляют, например, следующим образом.
На первом диагностическом этапе выполняют стандартное урологическое обследование пациента, включающее в себя определение уровня ПСА, пальцевое ректальное исследование, ультразвуковое исследование органов малого таза. Определяют показания для выполнения сатурационной биопсии ПЖ промежностным доступом.
Биопсия проводится по следующей методике.
Для выполнения предлагаемого нами способа необходимо наличие специализированного комплекса фирмы «В-К Medical» (Дания) для проведения двухмерного трансректального сканирования ПЖ, ультразвукового датчика с частотой 7,5 МГц, помещенного на подставку («степпер») откалиброванной решетки для введения биопсийных игл в ткань ПЖ, биопсийного пистолета фирмы «Bard» (США). Используемые биопсийные иглы должны иметь следующие характеристики: диаметр - 18G, диаметр столбика ткани - 1 мм и глубина выстрела - 22 мм.
После выполнения спинальной или перидуральной анестезии по стандартной методике пациента укладывают на операционный стол в литотомическую позицию, осуществляют сгибание и максимальное разведение нижних конечностей. В мочеиспускательный канал вводят уретральный двухходовый катетер Foley Ch 16. Заполнение баллончика катетера осуществляется при помощи вспененного раствора «Categel®» (рег. номер 012477/01), позволяющего более четко визуализировать базальные отделы железы и ход катетера (границы уретры) в ее пределах. Далее в прямую кишку вводят трансректальный ультразвуковой датчик. Выполняют двухмерное сканирование ПЖ. Наибольший размер ПЖ определяется при сканировании в поперечной плоскости. Полученное изображение совмещается с откалиброванным изображением (расстояние между ближайшими точками 5 мм), соответствующим брахитерапевтической решетке.
Область операции (промежность, мошонку и заднюю поверхность бедер) обрабатывают раствором бетадина.
После определения границ железы и уретры при поперечном сканировании осуществляют графическую фиксацию этих структур на схеме брахитерапевтической решетки, представленной в печатном виде и являющейся необходимым для последующей документальной регистрации места забора биоптатов. Изображение простатической части уретры для стандартизации выполнения биопсии, как правило, устанавливается в центр решетки и соответствует сагиттальной плоскости, имеющей буквенное значение D. Далее осуществляют забор биоптатов. Контроль введения иглы в ткань простаты производят при сканировании в продольной плоскости в режиме реального времени. При больших размерах железы (базально-каудальный расстояние превышает 20 мм) получение ткани из одной точки осуществляется в два этапа: первый вкол - забор ткани из апикальных отделов железы, второй вкол осуществляется из той же точки после предварительного введения иглы до дистальной границы предшествующего входа иглы в ткань ПЖ. Подобная методика позволяет получать материал для патоморфологического исследования на всем протяжении ПЖ, в том числе из ее безальных, труднодостижимых отделов. Определяющим этапом в проведении биопсии по данной методике является получение биоптатов из парауретральной зоны с обеих сторон и снизу от уретры. Все полученные биоптаты подвергаются маркировке (сторона получения, апикальная или базальная локализация). Отдельно маркируются биоптаты, полученные из парауретральной зоны. Наличие (отсутствие) опухолевых клеток в биоптатах, полученных из парауретральной зоны, позволяет наиболее оптимально планировать введение игл-интрастатов, определять границы зоны повышенной лучевой нагрузки «boost» при проведении высокодозной брахитерапии.
Способ иллюстрируется следующими клиническими примерами:
Пример 1. Больной С., 67 лет, поступил в клинику с диагнозом «новообразование ПЖ неопределенного характера». Учитывая низкий предоперационный уровень ПСА - 5,2 нг/мл, рекомендовано выполнение сатурационной биопсии ПЖ промежностным доступом. В ходе выполнения биопсии был осуществлен забор 30 биоптатов, в том числе из парауретральной зоны (7 биоптатов). Последующее патоморфологическое исследование показало наличие ацинарной аденокарциномы ПЖ в 5 из 30 столбиков, сумма Глисона 7 (3+4). Все столбики, содержащие аденокарциному, были получены из левой доли. В биоптатах, полученных из парауретральной зоны, опухолевых клеток не обнаружено. При дальнейшем клинико-инструментальном обследовании (МРТ таза с контрастированием, остеосцинтиграфия костей скелета в режиме ОФЭКТ-КТ) данных за распространение опухолевого процесса за пределы органа не получено. Поставлен клинический диагноз T2 в N0M0G2. По классификации NCCN пациент отнесен к группе промежуточного прогноза. Сформулированы показания для проведения ВДБТ в монорежиме (3 фракции по 11,5 Гр). В ходе проведения сеанса ВДБТ введение игл-интрастатов осуществлялось с учетом отсутствия вовлеченности в процесс парауретральной зоны с целью снижения вероятности лучевого поражения уретры (фиг. 1).
Пример 2. Больной У., 58 лет. Предоперационный уровень ПСА - 7,1 нг/мл. В ходе выполнения сатурационной биопсии ПЖ промежностным доступом осуществлен забор 35 биоптатов в том числе из парауретральной зоны (8 биоптатов). Гистологическое заключение: ацинарная аденокарцинома ПЖ в 12 из 35 столбиков, сумма Глисона 6 (3+3). Позитивные столбики получены из обеих долей. В 2 из 8 биоптатов из парауретральной зоны (слева) выявлена аденокарцинома. На основании результатов стандартного обследования поставлен клинический диагноз T2 с N0M0G1. По классификации NCCN пациент отнесен к группе промежуточного прогноза. Сформулированы показания для проведения ВДВТ в монорежиме (3 фракции по 11,5 Гр) (фиг. 2).
Анализ результатов использования предложенного способа при высокодозной внутритканевой лучевой терапии РПЖ показал, что отсутствие морфологических признаков наличия опухолевого процесса в парауретральной зоне у 21 из 23 больных позволило снизить радиационную нагрузку на уретру на 20%. Ни у одного из указанных пациентов не отмечалась осложнений со стороны уретры и мочевого пузыря.
Предлагаемый способ позволяет осуществлять детальное картирование морфологической информации о топографии очагов РПЖ и использовать полученную информацию для проведения ВДБТ. Впервые предложен способ, который при проведении ВДБТ позволяет осуществлять дозиметрическое планирование и введение игл-интрастатов с учетом наличия или отсутствия опухолевых клеток в непосредственной близости от мочеиспускательного канала, что позволяет в 90% случаев снизить радиационную нагрузку на уретру и уменьшить количество и степень выраженности нежелательных последствий лучевого лечения.
Способ планирования высокодозной внутритканевой лучевой терапии рака предстательной железы (ПЖ), включающий сатурационную биопсию ПЖ с последующим планированием лучевой нагрузки на ПЖ, область опухолевого поражения ПЖ и простатическую часть уретры, отличающийся тем, что при выполнении сатурационной биопсии ПЖ промежностным доступом при помощи комплекса, предназначенного для навигированного ультразвуком введения игл в участки ПЖ, дополнительно осуществляют прицельный забор биоптатов из парауретральной зоны с обеих сторон и снизу от уретры и при наличии опухолевых изменений в парауретральной зоне выбирают дозы облучения до 100-120 Гр на весь объем ПЖ, включая парауретральную зону, а при отсутствии таковых изменений выбирают дозы облучения на парауретральную зону ПЖ до 70-80 Гр и проводят латеральное введение игл-интрастатов по отношению к уретре.