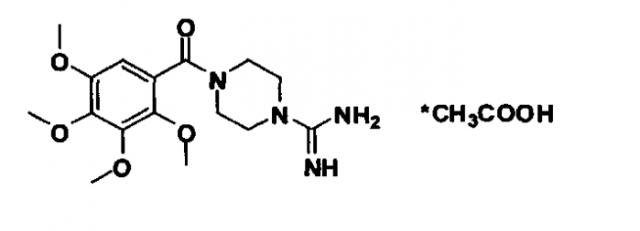
Вещество, обладающее сочетанной антиагрегантной, антикоагулянтной и вазодилаторной активностью, и способ получения n, n'-замещенных пиперазинов
Иллюстрации
Показать всеИзобретение относится к N,N′-замещенным пиперазинам формулы I и способу получения соединений формулы II. Указанные соединения влияют на систему гемостаза и проявляют антиагрегантные, антикоагулянтные и вазодилаторные свойства. Заявленный способ получения позволяет получить соединения формулы II с чистотой более 99% и содержанием индивидуальной примеси не более 0,1% и суммой примесей не более 0,5%. В общей формуле I R1 - линейный или разветвленный алкил С1-С4, R2 - линейный или разветвленный алкил С5-С12, G - минеральная или органическая С1-С4 кислота или вода, в общей формуле II R1 - линейный или разветвленный алкил С1-С4, R2 - линейный или разветвленный алкил С1-С12, G - минеральная или органическая С1-С4 кислота или вода. 2 н. и 9 з.п. ф-лы, 2 ил., 6 табл., 13 пр.
Реферат
Изобретение относится к области фармацевтической химии, а именно, к новым N,N′-замещенных пиперазинам - соединениям, влияющим на систему гемостаза, проявляющих антиагрегантные, антикоагулянтные и вазодилаторные свойства и способу получения N,N′-замещенных пиперазинов.
В частности, изобретение относится к новым органическим соединениям, а именно к N,N′-замещенным пиперазинам общей формулы I:
где R1 - линейный или разветвленный алкил С1-С4;
R2 - линейный или разветвленный алкил С5-С12;
G - минеральная или органическая С1-С4 кислота или вода,
обладающих повышенной сочетанной антиагрегантной, антитромболитической и вазодилаторной активностью, и способам получения как вышеуказанных соединений, так и соединений с меньшей длиной цепи радикалов, то есть к общему способу получения N,N′-замещенных пиперазинов формулы II:
где R1 - линейный или разветвленный алкил С1-С4;
R2 - линейный или разветвленный алкил С1-С12;
G - минеральная или органическая С1-С4 кислота или вода.
Заболевания системы гемостаза являются основной причиной нарушений коронарного и мозгового кровообращения, что делает задачу лечения указанных заболеваний достаточно актуальной. В частности, показано, что эффективная терапия заболеваний системы гемостаза способствует снижению риска развития сердечно-сосудистых событий, нефатального инфаркта миокарда, нефатального инсульта, сосудистой смерти [McConnel Н. // Br. Med. J. 2002. V. 324. Р. 71-86]. Так, назначение антитромботических лекарственных средств снижает суммарный риск развития сердечно-сосудистых событий на четверть, нефатального инфаркта миокарда - на треть, нефатального инсульта - на четверть, сосудистой смерти - на одну шестую [McConnel Н. // Br. Med. J. 2002. V. 324. Р. 71-86].
Основными направлениями антитромботической терапии являются ингибирование агрегации тромбоцитов, целенаправленное воздействие на систему гемокоагуляции, уменьшение тромбоцитной активности эндотелия, вазодилатация. В частности, для решения указанных задач предложено [Cardiovascular Drug Reviews. 2008. V18. N3. Р. 222-231; Life Scinece. 1997. V. 60. N18. P. 1583-88] использовать препараты - блокаторы тромбоксана - Ридогрел, Озагрел, Пирмагрел, которые обладают антигипертензивными и вазодилатирующими свойствами, безопасны и эффективны при инфаркте миокарда, а также способны снимать бронхоспазм.
Недостатками данной группы препаратов являются их относительно невысокая эффективность при пероральном применении.
В качестве антиагрегантного препарата широко используется аспирин. Однако общеизвестны выраженные побочные эффекты препарата, например дисфункция тромбоцитов, гипопротромбонемия [Temple AR. Acute and Chronic effects of aspirin toxicity and their treatment. Archives of Internal Medicine, 1981; 141: 367], аспирино резистентоность у больных инсулинзависимым сахарным диабетом [Trevor A. Mori, at all. Differential Effect of Aspirin on Platelet Aggregation in IDDM Diabetes, vol. 41, p. 261-266, March 1992].
Для преодоления недостатков имеющихся препаратов, ранее [RU 2469029, 2010] авторами были синтезированы соединения общей формулы IIа:
где R1, R2 - линейный или разветвленный алкокси (С1÷C4), CH3С(=O)O;
n=1-5; m=0-3; Z-С=O, SO2; X-C(=NH)NH2, C(=NH)NHC(-NH)NH2;
G - низкомолекулярная органическая или минеральная кислота, катионы натрия, калия, аммония или вода,
которые показали высокую эффективности при различных типах тромбообразования и вазоконстрикции, и разработан способ получения указанных соединений. Эта группа изобретений является наиболее близким аналогом по технической сущности к заявляемому изобретению. Согласно патенту RU 2469029, 2010, способ синтеза N,N′-замещенных пиперазинов общей формулы IIb:
где R1, R2 - линейный или разветвленный алкокси (С1÷C4);
n=1-5; m=0-3; Z-C=O; X-C(=NH)NH2;
G - низкомолекулярная органическая или минеральная кислота, катионы натрия, калия, аммония или вода,
включает в себя следующие стадии (схема синтеза представлена на фиг. 1):
- Обработка бромом 3,4,5-триалкоксибензойной кислоты общей формулы III в кипящем хлороформе, которая приводит к образованию 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV.
- Обработка 2-бромо-3,4,5-триметоксибензойной кислоты общей формулы IV алкоголятом натрия в соответствующем спирте в присутствии 50% мольн. йодида меди с последующим подкислением соляной кислотой, приводящая к образованию 2,3,4,5-тетраалкоксибензойной кислоты общей формулы IX.
- Обработка 2,3,4,5-тетраалкоксибензойной кислоты общей формулы IX хлористым тионилом в растворе хлористого метилена в присутствии N,N-диметилформамида, которая приводит к образованию 2,3,4,5-тетраалкоксибензоилхлорида общей формулы X
- Обработка 2,3,4,5-тетраалкоксибензоилхлорида общей формулы X трет-бутоксикарбонилпиперазином в хлористом метилене в присутствии триэтиламина, которая приводит к образованию 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)пиперазина общей формулы XI;
- Обработка 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)-пиперазина общей формулы XI трифторуксусной кислотой в кипящем хлористом метилене, которая приводит к образованию трифторацетата 1-(2,3,4,5-тетраалкоксибензоил)пиперазина общей формулы XII;
- Обработка трифторацетата 1-(2,3,4,5-тетраалкоксибензоил)пиперазина общей формулы XII водным раствором 1Н-пиразол-1-карбоксимидамида гидрохлорида в присутствии карбоната натрия, которая приводит к образованию 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимидамида общей формулы XIII;
- Обработка 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимидамида общей формулы XIII уксусной кислотой, которая приводит к образованию солей 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимид-амида общей формулы II.
Недостатками способа, описанного в патенте-аналоге [RU 2469029, 2010], являются невозможность достичь чистоты целевого вещества более 99%, с содержанием индивидуальной примеси не более 0,1%, являющейся новым требованием к разрабатываемым фармацевтическим субстанциям [Q3A(R2). Impurities in New Drug Substances]. Кроме того данный способ не позволяет с высоким выходом получать N,N′-замещенные пиперазины с длиной алкильного радикала R2 более С4 в связи с трудностью работы с алкоголятами спиртов с длиной углеродной цепью более С4 на стадии превращения 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IVв 2,3,4,5-тетраалкоксибензойную кислоту общей формулы IX, в то время как эксперименты по оценки их биологической активности показали, что антитромболическая активность N,N′-замещенных пиперазинов возрастает по мере увеличения длины алкильного радикала R2 в соединениях общей формулы II.
Технической задачей, решаемой авторами, являлась создание новых производных N,N′-замещенных пиперазинов с повышенными антиантиагрегантными, антикоагулянтными и вазодилатирующими свойствами и разработка нового способа получения N,N′-замещенных пиперазинов общей формулы II с чистотой более 99%, содержанием индивидуальной примеси не более 0,1% и суммой примесей не более 0,5% [Q3A(R2). Impurities in New Drug Substances], используя коммерчески доступные исходные соединения.
Создание нового способа получения основывалось на результатах работы авторов по увеличению степени чистоты выше 99% по предложенной в ранее в патенте-аналоге [RU 2469029, 2010] схеме показавшей, что основным примесями, загрязняющими конечный продукт являются соли 4-(3,4,5-триалкоксибензоил)пиперазин-1-карбоксимидамида.
Данные примеси образуются на стадии реакции алкоксилирование 2-бром-3,4,5-триалкоксибензойной кислоты общей формулы III алкоголятами натрия в присутствии иодида меди (I). Реакция сопровождается побочной реакцией, приводящей к восстановлению бром-замещенных бензойных кислот до бензойных кислот, то есть согласно фиг. 1 - образованию исходных 3,4,5-триалкоксибензойных кислот общей формулы III. Примесь 3,4,5-триалкоксибензойных кислот общей формулы III не удаляется при перекристаллизации в силу родственной химической природы соединений общей формулы II и VIII. После проведения дальнейших химических процессов и выделения целевого продукта, целевой продукт - N,N′-замещенные пиперазины общей формулы II, то есть соли 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимидамида - содержат примесь солей 4-(3,4,5-триалкоксибензоил)пиперазин-1-карбоксимидамида практически неотделимых от целевого продукта обычными методами (перекристаллизация, хроматография) без значительных потерь целевого продукта.
Технический результат в отношении способа был достигнут путем получения N,N′-замещенных пиперазинов общей формулы I с чистотой более 99%, содержанием индивидуальной примеси не более 0,1%, в результате способа, схема которого приведена на фиг. 2. Способ включает в себя следующие стадии:
- Обработка 3,4,5-триалкоксибензойных кислот общей формулы III бромом в органическом растворителе, которая приводит к образованию 2-бромо-3,4,5-триалкоксибензойных кислот общей формулы IV. В качестве 3,4,5-триалкоксибензойных кислот используют кислоты, содержащие в качестве заместителя линейный или разветвленный алкил С1-С4. В качестве органического растворителя используют этилацетат или хлороформ, или уксусную кислоту.
- Обработка 2-бромо-3,4,5-триалкоксибензойных кислот общей формулы IV щелочами в воде или водно-спиртовом растворителе в присутствии меди или ее солей, или оксидов при мольном соотношении 2-бромо-3,4,5-триалколсибензойной кислоты общей формулы IV с медью или ее солями или ее оксидами не более 1:0,1. В качестве солей меди (I) используют хлорид меди (I), иодид меди (I), ацетат меди (I), в качестве солей меди (II) используют сульфат меди (II), хлорид меди (II), ацетат меди (II), в качестве оксидов меди используют оксид меди (I), оксид меди (II). В качестве спиртов используют метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол.
- Обработка реакционной смеси солями меди (II) при мольном соотношении 2-бромо-3,4,5-триалколсибензойной кислоты общей формулы IV с солями меди (II) не менее 1:0,5; отделение и промывка образовавшегося осадка водным раствором щелочи; обработка осадка кислотой, отделение и промывка образовавшихся 2-гидрокси-3,4,5-триалкоксибензойных кислот общей формулы V водой. В качестве солей меди (II) используют сульфат меди (II), хлорид меди (II), ацетат меди (II). В качестве щелочных реагентов используют гидроксиды калия или натрия в воде или спиртах, или водно-спиртовом растворителе.
- Обработка 2-гидрокси-3,4,5-триалкоксибензойных кислот общей формулы V спиртами в присутствии серной кислоты или со спиртами в растворе хлористого метилена в присутствии дициклогексилкарбодиимида или диалкилсульфатами в полярном апротонном растворителе в присутствии карбоната натрия, которая приводит к образованию 2-гидрокси-3,4,5-триалкоксибензоатов общей формулы VI. В качестве спиртов используют метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-о, в качестве диалкилсульфатов используют диметилсульфат, а в качестве полярного апротонного органического растворителя используют ацетон, метилэтилкетон, ацетонитрил, N,N-диметилформамид.
- Обработка 2-гидрокси-3,4,5-триалкоксибензоатов общей формулы VI соединениями общей формулы VII в полярном апротонном растворителе в присутствии карбоната калия или смеси карбоната и иодида калия, которая приводит к образованию 2,3,4,5-тетраалкоксибензоатов общей формулы VIII; или обработка 2-гидрокси-3,4,5-триалкоксибензойных кислот общей формулы V диалкилсульфатами в полярном апротонном растворителе в присутствии карбоната калия, которая приводит к образованию 2,3,4,5-тетраалкоксибензоатов общей формулы VIII. В качестве диалкилсульфатов используют диметилсульфат, а в качестве полярного апротонного органического растворителя используют ацетон, метилэтилкетон, ацетонитрил, N,N-диметилформамид. В качестве соединений общей формулы VII используют соединения общей формулы R2-Y, где R2 - линейный или разветвленный алкил С1-С12, Y-Cl, Br.
- Обработка 2,3,4,5-тетраалкоксибензоатов общей формулы VIII гидроксидами натрия или калия в воде или спиртах или водно-спиртовом растворителе; а затем обработка полученной реакционной смеси кислотами, которая приводит к образованию 2,3,4,5-тетраалкоксибензойных кислот общей формулы IX. В качестве кислот используют трифторуксусную, серную, хлорную, соляную кислоты, металсульфокислоту. В качестве спиртов используют метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол.
- Обработка 2,3,4,5-тетраалкоксибензойных кислот общей формулы IX хлористым тионилом в растворе хлористого метилена или с хлористым тионилом без растворителей, которая приводит к образованию 2,3,4,5-тетраалкоксибензоилхлоридов общей формулы X.
- Обработка 2,3,4,5-тетраалкоксибензоилхлоридов общей формулы X трет-бутоксикарбонилпиперазином в присутствии аминов в полярном апротонном растворителе или в хлористом метилене, которая приводит к образованию 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)-пиперазинов общей формулы XI. В качестве аминов используют триэтиламин, N-метилморфолин, диизопропилэтиламин.
- Обработка 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)-пиперазинов общей формулы XI кислотами в воде, или в водно-спиртовом растворителе или в хлористом метилене, которая приводит к образованию солей 1-(2,3,4,5-тетраалкоксибензоил)пиперазинов общей формулы XII. В качестве спиртов используют метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол.
- Обработка солей 1-(2,3,4,5-тетраалкоксибензоил)пиперазинов общей формулы XII 1Н-пиразол-1-карбоксимидамида гидрохлоридом в присутствии аминов, или карбонатов или бикарбонатов натрия или калия в воде, или в водно-спиртовом растворителе или в полярном апротонном растворителе, которая приводит к образованию 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимидамида общей формулы XIII. В качестве аминов используют триэтиламин, N-метилморфолин, диизопропилэтиламин.
- Обработка 4-(2,3,4,5-тетраалкоксибензоил)пиперазин-1-карбоксимидамида общей формулы XII минеральной или органической С1-С4 кислотой в воде, или спиртах, или хлористом метилене, или ацетоне или в их смесях, которая приводит к образованию N,N′-замещенных пиперазинов общей формулы II. В качестве минеральной кислоты используют фосфорную, соляную кислоты и т.п, в качестве органической С1-С4 кислоты используют уксусную, фумаровую кислоты, метансульфокислоту и т.п.
Обработка 3,4,5-триалкоксибензойных кислот общей формулы III бромом в органическом растворителе, приводит к образованию 2-бромо-3,4,5-триалкоксибензойных кислот общей формулы IV. В качестве органических растворителей могут быть использованы уксусная кислота, хлороформ или этилацетат. При проведении реакции в уксусной кислоте реакцию проводят при комнатной температуре, когда в качестве растворителей используют хлороформ или этилацетат - процесс проводят при повышенной температуре, при этом наиболее целесообразно реакцию проводить при кипячении.
Одной из ключевых стадий способа получения N,N′-замещенных пиперазинов общей формулы II является стадия получения 2-гидрокси-3,4,5-триалкоксибензойных кислот общей формулы V. Для гидролиза 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV используют гидроксиды, карбонаты или фосфаты натрия или калия. Указанные вещества необходимо вводить в реакцию не менее чем в 3 кратном мольном избытке по отношению к 2-бромо-3,4,5-триалкоксибензойной кислоте общей формулы IV. Реакция может быть проведена в водном или в водно-спиртовом растворе, причем в качестве спиртов могут быть использованы метанол, этанол, пропан-1-ол, пропан-2-ол ибутан-1-ол. Реакция проводится при повышенной температуре, наиболее целесообразно ее проводить при кипячении. Реакция должна проводиться в присутствии меди, ее солей или оксидов. Причем в качестве солей меди могут быть использованы: хлорид меди (I), иодид меди (I), ацетат меди (I), сульфат меди (II), хлорид меди (II), ацетат меди (II); в качестве оксидов меди - оксид меди (I) или оксид меди (II). Мольное соотношение 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV и меди, или солей меди или оксидов меди, используемое для проведения реакции, составляет не более 1:0,1. Большее количество меди, или ее солей, или ее оксидов не влияет на скорость реакции и чистоту 2-гидрокси-3,4,5-триалкоксибензойной кислоты общей формулы V, однако заметно осложняет техническое исполнение процесса. Так, при мольном соотношении 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV и меди, или солей меди или оксидов меди более 1:0,1, в процессе ее превращения в 2-гидрокси-3,4,5-триалкоксибензойную кислоту общей формулы V наблюдается осаждение соединений меди с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V, что приводит к сильному вспениванию реакционной смеси, осложняющему дальнейшее проведение реакции.
После завершения реакции превращения 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV в 2-гидрокси-3,4,5-триалкоксибензойную кислоту общей формулы V, в реакционную смесь добавляют соли меди (II) и получают соединения меди (II) с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V, осаждающиеся из реакционной смеси. В качестве солей меди (II) при выделении малорастворимых соединений меди (II) с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V могут быть использованы любые водорастворимые соли меди (II), например сульфат меди (II), хлорид меди (II), Для осаждения необходимо использовать такое мольное соотношение 2-бромо-3,4,5-триалкоксибензойной кислоты общей формулы IV, взятой в реакцию, к солям меди (II), которое составляло бы не менее 1:0,5. Важным условием осаждения соединения меди (II) с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V является щелочная реакция раствора, которая должна сохраняться таковой и после прибавления всего количества солей меди (II). Для соблюдения этого условия целесообразно добавлять щелочь в реакционную смесь после реакции в мольном соотношении к солям меди (II) не менее чем 2:1.
Получение и выделение малорастворимых соединений меди (II) с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V, позволяет провести их дальнейшую очистку от примесей, в том числе от 3,4,5-триалкоксибензойной кислоты общей формулы III. Очистка проводится путем промывки соединений меди (II) с 2-гидрокси-3,4,5-триалкоксибензойными кислотами общей формулы V раствором щелочи. В качестве щелочей используют растворы гидроксидов натрия или калия в воде. Далее проводят обработку кислотой. В качестве кислоты используют: соляную, серную, хлорную, трифторуксусную кислоты. Могут быть использованы и другие сильные кислоты, образующие растворимые в воде соли меди.
Процесс на этой стадии приводит к получению промежуточного продукта, а именно 2-гидрокси-3,4,5-триалкоксибензойной кислоты общей формулы V, содержащей не менее 99% основного вещества.
Дальнейшее взаимодействие 2-гидрокси-3,4,5-триалколсибензойной кислоты общей формулы V со спиртами в присутствии серной кислоты или со спиртами в растворе хлористого метилена в присутствии дициклогексилкарбодиимида или с диалкилсульфатом в полярном апротонном растворителе в присутствии карбоната натрия приводят к образованию 2-гидрокси-3,4,5-триалкоксибензоатов общей формулы VI. При проведении реакции в дициклогексилкарбодиимиде реакцию проводят при комнатной температуре, а когда ее проводят в присутствии серной кислоты или с диалкилсульфатом - при повышенной температуре, наиболее целесообразно в этом случае проводить реакцию при кипячении. В качестве полярных апротонных растворителей могут быть использованы ацетон, метилэтилкетон, ацетонитрил, диметилформамид.
Взаимодействие 2-гидрокси-3,4,5-триалкоксибензоатов общей формулы VI с соединениями общей формулы VII (а именно алкилгалагенидами или диалкилсульфатами) в полярном апротонном растворителе в присутствии карбоната калия приводит к образованию 2,3,4,5-тетраалколсибензоатов общей формулы VIII. Также, взаимодействие 2-гидрокси-3,4,5-триалкокси-бензойной кислоты общей формулы V с диалкилсульфатом в полярном апротонном растворителе в присутствии карбоната калия приводит к образованию 2,3,4,5-тетраалколсибензоатов общей формулы VIII. Реакция проводится при повышенной температуре. Если в качестве растворителя используется: ацетон, метилэтилкетон, ацетонитрил, реакцию целесообразно проводить при кипячении. В качестве полярных апротонных растворителей могут быть использованы: ацетон, метилэтилкетон, ацетонитрил, диметилформамид.
Гидролиз 2,3,4,5-тетраалколсибензоатов общей формулы VIII проводят гидроксидами натрия или калия в воде или спиртах, или водно-спиртовом растворителе. В качестве спиртов используют метанол, этанол, пропан-1-ол, пропан-2-ол бутан-1-ол. Гидролиз проводят при повышенной температуре (наиболее целесообразно реакцию проводить при кипячении). Дальнейшая обработка реакционной смеси кислотами дает 2,3,4,5-тетраалколсибензойной кислоты общей формулы IX. В качестве кислот используют: трифторуксусную, серную, хлорную, соляную кислоты, метилсульфокислоту.
Взаимодействие 2,3,4,5-тетраалколсибензойной кислоты общей формулы IX с хлористым тионилом в растворе хлористого метилена или с хлористым тионилом без растворителя с каталитическими количествами N,N-диметилформамида дает 2,3,4,5-тетраалкоксибензоилхлорид общей формулы X.
Реакцию проводят при повышенной температуре (наиболее целесообразно реакцию проводить при кипячении). После окончания реакции растворитель и избыток хлористого тионила удаляют при пониженном давлении, полученный 2,3,4,5-тетраалкоксибензоилхлорид общей формулы X используют на следующей стадии без дополнительных очисток.
2,3,4,5-Тетраалкоксибензоилхлорид общей формулы X при взаимодействии с трет-бутоксикарбонилпиперазином в присутствии аминов в полярном апротонном растворителе или в хлористом метилене дает 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)пиперазин общей формулы XI. B качестве полярных апротонных растворителей могут быть использованы: ацетон, метилэтилкетон, ацетонитрил, N,N-диметилформамид. В качестве аминов используют триэтиламин, N-метилморфолин, диизопропилэтиламин. Выделение 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)-пиперазинов общей формулы XI осуществляют с помощью традиционных методов органического синтеза.
Снятие бок-защиты с 1-(трет-бутоксикарбонил)-4-(2,3,4,5-тетраалкоксибензоил)пиперазинов общей формулы XI проводят кислотами в воде или в водно-спиртовом растворителе, или в хлористом метилене с образованием солей 1-(2,3,4,5-тетраалкоксибензоил)пиперазинов общей формулы XII. В качестве кислот могут быть использованы: трифторуксусная, серная, соляная кислоты, метилсульфокислота. Реакцию проводят при повышенной температуре, например, при кипячении. В качестве спиртов используют: метанол, этанол, пропан-1-ол, пропан-2-ол ибутан-2-ол. Выделение полупродукта осуществляется отгонкой растворителя.
Реакция солей 1-(2,3,4,5-тетраалкоксибензоил)пиперазинов общей формулы XII с 1Н-пиразол-1-карбоксимидамида гидрохлоридом приводит к образованию 4-(2,3,4,5-тетраалколсибензоил)пиперазин-1-карбоксимидамида общей формулы XIII. Реакцию проводят при температуре ниже 50°C. В качестве растворителей используют воду, водно-спиртовый растворитель (в качестве спиртов используют: метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-2-ол или полярный апротонный растворитель: ацетон, метилэтилкетон, ацетонитрил, N,N-диметилформамид). Реакцию проводят в присутствии аминов (в качестве аминов используют: триэтиламин, N-метилморфолин, диизопропилэтиламин), карбонатов или бикарбонатов натрия или калия. Выделение 4-(2,3,4,5-тетраалколсибензоил)пиперазин-1-карбоксимидамидов общей формулы XIII осуществляют с помощью традиционных методов органического синтеза.
Реакцию 4-(2,3,4,5-тетраалколсибензоил) пиперазин-1-карбоксимид-амида общей формулы XIII с минеральной или органической С1-С4 кислотой проводят в воде, спиртах, хлористом метилене, ацетоне, или в их смесях, что приводит к образованию N,N′-замещенных пиперазинов общей формулы II. Выделение N,N′-замещенных пиперазинов общей формулы II осуществляют с помощью традиционных методов органического синтеза.
Контроль степени протекания реакций и чистоты полупродуктов на каждой стадии синтеза проводят методом ТСХ на пластинах Merck "TLC Silica gel 60 F254" или Macherey-Nagel "ALUGRAM SIL G/UV254" в системах циклогексан/уксусная кислота/изопропиловый спирт (20:2:3) и циклогексан/трет-бутилметиловый эфир (10:3).
Оценка чистоты полученных соединений проводят методом ВЭЖХ на хроматографе Alliance (Waters) - колонка Zorbax Eclipse XDB-C18, 3,5 мкм, 3*100 мм (Agilent Technologies), подвижная фаза - смесь буферного раствора, содержащего 0,01 М натрия октансульфоната и 0,03 М натрия дигидрофосфата (pH 3,0) с ацетонитрилом (75:25 v/v) в изократическом режиме, или 0,05 М раствор фосфорной кислоты и ацетонитрил в режиме линейного градиента от 5% ацетонитрила до 70%. Детектирование проводят при 210 нм.
Структуру промежуточных и конечных соединений подтверждают методами спектроскопии ЯМР 1Н и 13С (прибор Bruker DPX 300, частота 300 и 75 МГц, соответственно). При регистрации спектров соединений в CDCl3, DMSO или D2O, сигналы остаточных протонов для 1Н (7.28 м.д., 2,50 м.д. и 4.79 м. д. соответственно) и сигналы атомов углерода растворителя для 13С (77.16 м.д. и 39.52 м.д.) используют в качестве внутренних стандартов. КССВ (константа спин-спинового взаимодействия) в протонных спектрах оценивалась в приближении первого порядка. Масс-спектры N,N′-замещенных пиперазинов зарегистрированы на масс-спектрометре Bruker AmaZon (ионизация по методу электроспрей).
На фиг. 1 приведена схема получения N,N′-замещенных пиперазинов по патенту RU 2469029, 2010. На фиг. 2 приведена заявляемая схема получения N,N′-замещенных пиперазинов, обеспечивающая получение целевого продукта с чистотой более 99% и содержанием индивидуальной примеси не более 0,1%.
Физические и фармако-биологические исследования показали, что синтезированные N,N′-замещенные пиперазины общей формулы 1 обладают хорошей растворимостью в воде, по сравнению с известными аналогами -N,N′-замещенными пиперазинами по патенту RU 2469029, 2010, имеют более широкий терапевтический интервал, более низкую средне-эффективную дозу ЕС50 при ингибировании агрегации тромбоцитов, и более сильный вазодилаторный и антикоагулянтный эффект. Это позволяет широко использовать их в качестве препаратов, влияющих на систему гемостаза и сочетающих антиагрегантную, антикоагулянтную и вазодилаторную активность.
В частности, при терапии патологий системы гемостаза, как показали проведенные исследования, введение N,N′-замещенных пиперазинов в организм в дозе 0,001 мМ/кг и более приводит к уменьшению патологической агрегации тромбоцитов, положительное воздействует на систему фибринолиза, обеспечивает вазодилатацию сосудов, что подтверждено нижеизложенными примерами.
N,N′-замещенные пиперазины могут вводиться в организм в составе композиций, содержащих смесь физиологически-активного (действующего) вещества со вспомогательными веществами. В качестве вспомогательных веществ используются разрешенные Фармакопеей вещества, улучшающие условия получения, хранения или применения лекарственного средства, например, растворители, наполнители, ароматизаторы, вкусовые добавки, стабилизаторы и т.п.
Сущность и преимущества заявляемых N,N′-замещенных пиперазинов и способа получения N,N′-замещенных пиперазинов иллюстрируются следующими примерами.
Пример 1. Получение 1-карбимидамидо-4-(2,3,4,5-тетраметоксибензоил)-пиперазина ацетата
2.1. 2-Бромо-3,4,5-триметоксибензойная кислота
К суспензии 3,4,5-триметоксибензойной кислоты (100,0 г, 0,471 М) в этилацетате (500 мл) прибавляют 2 мл воды. Реакционную смесь нагревают до температуры кипения. К кипящей реакционной смеси при перемешивании в течение 30 мин прикапывают бром (26,6 мл, 0,519 М). Смесь кипятят с обратным холодильником течение 2 час. Летучие компоненты из смеси удаляют на ротационно-пленочном испарителе при пониженном давлении. Полупродукт, кристаллы бледно-кремового цвета, получают с количественным выходом (137,2 г, 100%), используют на следующей стадии без дополнительной очистки. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,92 (3Н, CH3O-), 3,93 (3Н, CH3O-), 3,98 (3Н, CH3O-), 7,42 (1Н, с., H-Ar), 11,00 (1Н, ш.с. CO2 H). Чистота полупродукта по данным спектроскопии ЯМР 1Н и ТСХ - 95%.
2.2. 2-Гидрокси-3,4,5-триметоксибензойная кислота
К горячему раствору 2-бромо-3,4,5-триметоксибензойной кислоты (33,2 г, 0,114 М) и гидроксида натрия (18,25 г, 0,456 М) в смеси воды (100 мл) и метанола (100 мл) прибавляют хлорид меди (I) (0,56 г, 5,7 мМ). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 8 час. К горячей реакционной смеси прибавляют воду (100 мл) и гидроксид натрия (4,56 г, 0,114 М), после чего прибавляют при перемешивании горячий раствор хлорида меди (II) дигидрата (9,72 г, 0,057 М) в воде (100 мл). Образовавшийся осадок отделяют фильтрованием. Осадок суспендируют в 5%-ом растворе гидроксида натрия (100 мл), перемешивают 1 час, после чего отделяют фильтрованием (операция повторяется дважды). Осадок суспендируют в воде (100 мл), подкисляют концентрированной соляной кислотой (25 мл, 0,3 М), осадок отделяют фильтрованием, промывают водой (3×100 мл), сушат в вакууме. Полупродукт - кристаллы бледно-кремового цвета (7,80 г, 30%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,87 (3Н, CH3O-), 3,95 (3Н, CH3O-), 4,05 (3Н, CH3O-), 5,5 (1H, ш.с., НО-Ar), 7,17 (1Н, с., Н-Ar), 10,31 (1Н, с. CO2 H).
По данным спектроскопии ЯМР 1Н и ТСХ степень чистоты полупродукта - 2-гидрокси-3,4,5-триметоксибензойной кислоты - 99,5%.
2.3. 2-Гидрокси-3,4,5-триметоксибензойная кислота
К горячему раствору 2-бромо-3,4,5-триметоксибензойной кислоты (33,2 г, 0,114 М), гидроксида натрия (18,25 г, 0,456 М) в смеси воды (100 мл) и пропан-2-ола (100 мл) прибавляют йодид меди (I) (0,23 г, 1,2 мМ, 1% мольн.). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 10 час. К горячей смеси прибавляют воду (100 мл) и гидроксид натрия (13,70 г, 0,342 М), после чего прибавляют при перемешивании - горячий раствор сульфата меди (II) пентагидрата (42,70 г, 0,171 М) в воде (150 мл). Образовавшийся осадок отделяют фильтрованием, суспендируют в 5%-ом растворе гидроксида натрия в воде (100 мл), перемешивают в течение 1 час, отделяют фильтрованием (операция повторяется трижды). Выделенный осадок суспендируют в 100 мл), подкисляют концентрированной соляной кислотой (25 мл, 0,3 М), осадок отделяют фильтрованием, промывают на фильтре водой (3×100 мл) и сушат в вакууме. Полупродукт получают в виде кристаллов бледно-кремового цвета (7,28 г, 28%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,87 (3Н, CH3O-), 3,95 (3Н, CH3O-), 4,05 (3Н, CH3O-), 5,5 (1Н, ш.с., HO-Ar), 7,17 (1Н, с., H-Ar), 10,31 (1Н, с. CO2 H). По данным спектроскопии ЯМР 1Н и ТСХ степень чистоты полупродукта - 2-гидрокси-3,4,5-триметоксибензойной кислоты - 99,5%.
2.4. 2-Гидрокси-3,4,5-триметоксибензойная кислота
К горячему раствору 2-бромо-3,4,5-триметоксибензойной кислоты (37,55 г, 0,129 М) и карбоната натрия (34,20 г, 0,323 М) в воде (200 мл) прибавляют сульфат меди (II) пентагидрата (3,22 г, 0,013 М, 10% мол.), смесь кипятят с обратным холодильником при перемешивании в течение 6 час. К горячей реакционной смеси прибавляют гидроксид натрия (5,20 г, 0,130 М), прибавляют при перемешивании горячий раствор сульфата меди (II) пентагидрата (16,10 г, 0,065 М) в воде (50 мл). Образовавшийся осадок отделяют фильтрованием, суспендируют в 5%-ом растворе гидроксида натрия (100 мл), перемешивают в течение 1 час, после чего осадок отделяют фильтрованием (операция повторяется трижды), суспендируют в воде (100 мл), подкисляют концентрированной соляной кислотой (25 мл, 0,3 М). Выпавший осадок отделяют фильтрованием, промывают на фильтре водой (3×100 мл) и сушат в вакууме. Полупродукт получают в виде кристаллов бледно-кремового цвета (9,13 г, 31%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,87 (3Н, CH3O-), 3,95 (3Н, CH3O-), 4,05 (3Н, CH3O-), 5,5 (1H, ш.с., HO-Ar), 7,17 (1Н, с., H-Ar), 10,31 (1H, с. CO2 H).
По данным спектроскопии ЯМР 1Н и ТСХ степень чистоты полупродукта - 2-гидрокси-3,4,5-триметоксибензойной кислоты - 99,5%.
2.5. 2-Гидрокси-3,4,5-триметоксибензойная кислота
К горячему раствору 2-бромо-3,4,5-триметоксибензойной кислоты (33,2 г, 0,114 М) и гидроксида натрия (18,25 г, 0,456 М) в воде (150 мл) прибавляют оксид меди (II) (4,53 г, 0,057 М, 50% мольн.). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 7 час. К горячей смеси прибавляют воду (100 мл) и гидроксид натрия (4,56 г, 0,114 М), после чего прибавляют при перемешивании горячий раствор сульфата меди (II) пентагидрата (14,23 г, 0,057 М) в воде (100 мл). Образовавшийся осадок отделяют фильтрованием. Выделенный осадок суспендируют в 5%-ом водном растворе гидроксида натрия (100 мл), перемешивают в течение 1 час, осадок отделяют фильтрованием (операция повторяется трижды). Выделенный осадок суспендируют в воде (100 мл) и подкисляют концентрированной соляной кислотой (25 мл, 0,3 М). Выпавший осадок отделяют фильтрованием, промывают на фильтре водой (3×100 мл), отжимают и сушат в вакууме. Полупродукт получают в виде кристаллов бледно-кремового цвета (11,70 г, 45%). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,87 (3Н, CH3O-), 3,95 (3Н, CH3O-), 4,05 (3H, CH3O-), 5,5 (1Н, ш.с., HO-Ar), 7,17 (1H, с., H-Ar), 10,31 (1H, с. СО2 Н). По данным спектроскопии ЯМР 1Н и ТСХ степень чистоты полупродукта - 2-гидрокси-3,4,5-триметоксибензойной кислоты - 99,5%.
2.6. 2,3,4,5-Тетраметоксибензойной кислоты метиловый эфир
К кипящему раствору 2-гидрокси-3,4,5-триметоксибензойной кислоты (31,0 г, 0,136 М) в ацетоне (250 мл) прибавляют при перемешивании безводный карбонат калия (61,0 г, 0,442 М), затем диметилсульфат (38,6 г, 0,306 М). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 6 час. Выпавшие соли отделяют от охлажденной реакционной смеси фильтрованием и отбрасывают. Летучие компоненты фильтрата удаляют на ротационно-пленочном испарителе при пониженном давлении. Полупродукт получают с количественным выходом (35,0 г, 100%) в виде вязкой жидкости светло-коричневого цвета, используют на следующей стадии без дополнительной очистки. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,79 (6Н, с., CH3O- и CH3O2С), 3,81 (3H, CH3O-), 3,87 (3H, CH3O-), 6,10 (1Н, с., H-Ar)
2.7. 2,3,4,5-Тетраметоксибензойная кислота
К 2,3,4,5-тетраметоксибензойной кислоты метиловому эфиру (35,0 г, 0,136 М) при перемешивании и нагревании на кипящей водяной бане в течение 20 мин прикапывают 5 М водный раствор гидроксида калия (200 мл). Реакционную смесь перемешивают при нагревании в течение 1 час, при охлаждении льдом подкисляют концентрированной соляной кислотой (130 мл, ~1,5 М). Выпавший осадок отделяют фильтрованием, промывают водой (2×100 мл).
Осадок растворяют в хлористом метилене (250 мл), промывают раствор водой (1×200 мл), насыщенным раствором хлорида натрия (~100 мл) и сушат над безводным сульфатом магния. Осушитель отделяют фильтрованием. Летучие компоненты фильтрата удаляют на ротационно-пленочном испарителе при пониженном давлении. Полупродукт, кристаллы светло-бежевого цвета (31,0 г, 94%), используют на следующей стадии без дополнительной очистки. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 3,89 (3Н, CH3O-), 3,93 (3Н, CH3O-), 3,99 (3Н, CH3O-), 4,08 (3Н, CH3O-), 7,40 (1Н, с., H-Ar), 10,40 (1Н, с. СО2 Н). По данным спектроскопии ЯМР 1Н и ТСХ степень чистоты продукта реакции - 2,3,4,5-тетраметоксибензойной кислоты - 99,8%.
2.8. 2,3,4,5-Тетраметоксибензоилхлорид
К раствору 2,3,4,5-тетраметоксибензойной кислоты (31,0 г, 0,128 М) в хлористом метилене (50 мл) добавляют хлористый тионил (30,9 г, 0,260 М) и N,N-диметилформамид (0,05 мл). Смесь перемешивают при комнатной температуре 1 час, кипятят с обратным холодильником 2 час. Летучие компоненты смеси удаляют на ротационно-пленочном испарителе при пониженном давлении. Полупродукт, вязкая жидкость светло-коричневого цвета, получают с количественным выходом (33,4 г, 100%), используют на следующей стадии без дополнительной очистки.
2.9. 1-(трет-Бутоксикарбонил)-4-(2,3,4,5-тетраметоксибензоил)-пиперазин
К раствору 1-(трет-бутоксикарбонил)пиперазина (25,7 г, 0,138 М) и триэтиламина (28,4 мл, 0,204 М) в ацетоне (100 мл) прикапывают при перемешивании и внешнем охлаждении на лед-солевой бане раствор 2,3,4,5-тетраметоксибензоилхлорида (33,4 г, 0,128 М) в ацетоне (40 мл). Реакционную смесь перемешивают при охлаждении в течение 10 мин, после чего при комнатной температуре в течение 2 час. Р