Меченное радиоактивным металлом антитело против кадгерина
Иллюстрации
Показать всеИзобретение относится к биохимии. Раскрыто меченное радиоактивным металлом антитело против Р-кадгерина, полученное связыванием радиоактивного металлического элемента с антителом против Р-кадгерина через металл-хелатирующий реагент. Представлены средства и способы лечения и диагностики злокачественной опухоли. Также представлены антитело-продуцирующие клетки для продукции раскрытого антитела, депонированные под номерами NITE BP-897, NITE BP-898, NITE BP-899, NITE BP-1040, NITE BP-1044, NITE BP-1048, NITE BP-1049, NITE BP-1050. Изобретение предоставляет меченное радиоактивным металлом антитело против Р-кадгерина, которое в высокой степени накапливается специфично в злокачественной ткани. А также предоставляет лекарственное средство против злокачественной опухоли, имеющее высокий эффект против злокачественной опухоли и безопасность, и средство для диагностики злокачественной опухоли. 17 н. и 11 з.п. ф-лы, 14 ил., 2 табл., 14 пр.
Реферат
Область техники
Настоящее изобретение относится к меченному радиоактивным металлом антителу против кадгерина, которое в высокой степени специфично накапливается в злокачественных клетках, и к лекарственному средству против злокачественной опухоли и к средству для диагностики злокачественных опухолей, содержащим это антитело.
Уровень техники
Существует острая необходимость в новых способах лечения злокачественных опухолей, которые в настоящее время являются ведущей причиной смертности. В настоящее время используют такие способы терапии, как хирургическая терапия, лучевая терапия и химиотерапия (с использованием противораковых средств). Даже после хирургической операции в послеоперационной терапии используют противораковое средство.
В настоящее время используемые противораковые средства включают алкилирующее средство, антиметаболит, алкалоидное противораковое средство, антибиотическое противораковое средство и средство на основе платины. Эффекты лечения этими средствами являются не полностью удовлетворительными. Некоторые средства не являются специфичными для злокачественной опухоли и часто вызывают неблагоприятные побочные эффекты, которые являются проблематическими. В таких обстоятельствах существует потребность в разработке более эффективных противораковых средств.
Между тем, кадгерин представляет собой Ca2+-зависимую молекулу адгезии, которая экспрессируется на клеточной поверхности. Примеры известных типов кадгеринов включают классические кадгерины, такие как E-кадгерин, N-кадгерин и P-кадгерин (CDH3); а также протокадгерин и десмосомальный кадгерин. Известно, что эти кадгерины гомофильно связываются, образуя адгезионное соединение и связываясь с системой цитоскелета (актиновые филаменты) через внутриклеточный катенин, и считается, что с помощью такого механизма они контролируют клеточную адгезию.
В дополнение к клеточной адгезии полагают, что кадгерин связан с эмбриогенезом, морфогенезом, синаптогенезом, синаптической пластичностью и инфильтрацией и метастазированием злокачественной опухоли. Таким образом, описано, что антитело против кадгерина подходит для терапии злокачественной опухоли (патентные документы 1-3).
Документы уровня техники
Патентные документы
Патентный документ 1: Публикация патента Японии Kohyo (PCT) № 2005-522982
Патентный документ 2: Публикация патента Японии Kohyo (PCT) No. 2008-538909
Патентный документ 3: Публикация патента Японии Kohyo (PCT) № 2009-528257
Сущность изобретения
Проблемы, решаемые с помощью изобретения
Однако эффект антитела против кадгерина в отношении злокачественной опухоли не является удовлетворительным и существует потребность в разработке более эффективного лекарственного средства против злокачественной опухоли.
Таким образом, задачей настоящего изобретения является предоставление меченного радиоактивным металлом антитела против кадгерина, которое может в высокой степени накапливаться в злокачественной ткани. Другой задачей является предоставление лекарственного средства против злокачественной опухоли, которое содержит антитело в качестве активного ингредиента и которое проявляет высокий эффект против злокачественной опухоли. Другой задачей является предоставление средства для диагностики злокачественной опухоли, которое может предсказать эффективность лекарственного средства против злокачественной опухоли и подтвердить его терапевтический эффект.
Способы решения проблем
Авторы настоящего изобретения провели тщательные исследования для решения упомянутых выше задач и открыли, что меченное радиоактивным металлом антитело против кадгерина, в котором радиоактивный металлический элемент связан с антителом против кадгерина через металл-хелатирующий реагент, накапливается специфично в злокачественной ткани у имеющего злокачественную опухоль животного, и что его эффект против злокачественной опухоли, в особенности, значительно усилен по сравнению с группой введения немеченого антитела против кадгерина. Настоящее изобретение осуществлено, основываясь на этих открытиях.
Таким образом, настоящее изобретение относится к меченному радиоактивным металлом антителу против кадгерина, которое получают путем связывания радиоактивного металлического элемента с антителом против кадгерина через металл-хелатирующий реагент, и к лекарственному средству против злокачественной опухоли и средству для диагностики злокачественной опухоли, содержащим, в качестве активного ингредиента, меченное радиоактивным металлом антитело против кадгерина.
Также настоящее изобретение относится к меченному радиоактивным металлом антителу против кадгерина для применения в лечении или диагностике злокачественной опухоли.
Также настоящее изобретение относится к применению меченного радиоактивным металлом антитела против кадгерина для получения лекарственного средства против злокачественной опухоли или средства для диагностики злокачественной опухоли.
Настоящее изобретение также относится к способу лечения или диагностики злокачественной опухоли, включающему введение эффективного количества меченного радиоактивным металлом антитела против кадгерина индивидууму, нуждающемуся в этом.
Эффекты изобретения
Лекарственное средство против злокачественной опухоли, содержащее в качестве активного ингредиента меченное радиоактивным металлом антитело против кадгерина по настоящему изобретению, в высокой степени накапливается в злокачественной ткани и проявляет высокий эффект уменьшения размера злокачественной опухоли. Таким образом, с использованием лекарственного средства против злокачественной опухоли можно эффективно проводить терапию злокачественной опухоли без возникновения побочных эффектов. Также, с использованием средства для диагностики злокачественной опухоли по настоящему изобретению можно предсказать эффективность лекарственного средства против злокачественной опухоли по настоящему изобретению, и можно подтвердить его терапевтический эффект.
Краткое описание чертежей
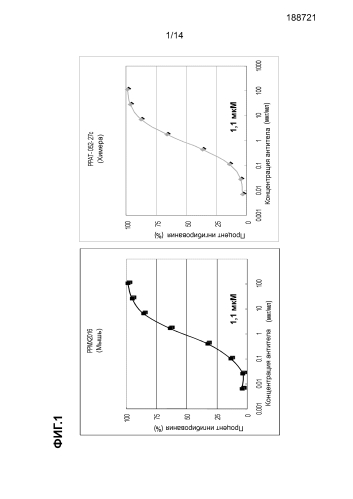
[Фиг. 1] Графики, демонстрирующие результат оценки аффинности антител проточной цитометрией.
[Фиг. 2] Биораспределение антитела 67Ga-DOTA-PPMX2016 (соотношение при добавлении 1:10) через 96 часов после его введения.
[Фиг. 3] Биораспределение антитела 67Ga-DOTA-PPMX2016 (соотношение при добавлении 1:3) через 96 часов после его введения.
[Фиг. 4] Биораспределение антитела 67Ga-DOTA-PPMX2029 (соотношение при добавлении 1:10) через 96 часов после его введения.
[Фиг. 5] Биораспределение антитела 67Ga-DOTA-PPMX2029 (соотношение при добавлении 1:3) через 96 часов после его введения.
[Фиг. 6] Биораспределение антитела 67Ga-DOTA-PPMX2025 (соотношение при добавлении 1:10) через 96 часов после его введения.
[Фиг. 7] Биораспределение антитела 67Ga-DOTA-PPMX2025 (соотношение при добавлении 1:3) через 96 часов после его введения.
[Фиг. 8] Биораспределение антитела 67Ga-DOTA-PPMX2025 в случае соотношений антитело-DOTA при добавлении 1:1, 1:3 и 1:10 через 96 часов после его введения.
[Фиг. 9] Биораспределение антитела 111In-DOTA-PPAT-052-27c (соотношение при добавлении 1:3) через 96 часов после его введения.
[Фиг. 10] Биораспределение антитела 111In-DOTA-PPAT-052-27c (соотношение при добавлении 1:3) через 48 часов после его введения.
[Фиг. 11] Биораспределение антитела 111In-DOTA-PPAT-052-28c (соотношение при добавлении 1:3) через 48 часов и через 96 часов после его введения.
[Фиг. 12] Противоопухолевый эффект антитела 90Y-DOTA-PPMX2029 (соотношение при добавлении 1:3) в модели с ксенотрансплантатом.
[Фиг. 13] Противоопухолевый эффект антитела 90Y-DOTA-PPAT-052-27c (соотношение при добавлении 1:3) в модели с ксенотрансплантатом.
[Фиг. 14] Фотографии, демонстрирующие результаты иммуногистохимического окрашивания для подтверждения экспрессии белка CDH3.
Способы осуществления изобретения
Меченное радиоактивным металлом антитело против кадгерина по настоящему изобретению представляет собой меченое антитело против кадгерина, с которым радиоактивный металлический элемент связан через металл-хелатирующий реагент. Лекарственное средство против злокачественной опухоли или средство для диагностики злокачественной опухоли содержит меченное радиоактивным металлом антитело против кадгерина.
Антитело против кадгерина конкретно не ограничено, при условии, что антитело специфично связывается с кадгерином. Примеры кадгерина включают E-кадгерин, N-кадгерин и P-кадгерин. Среди них более предпочтительным является P-кадгерин.
Антитело против кадгерина охватывает моноклональное антитело, поликлональное антитело, антитело, сохраняющее способность специфично связываться с группой антигенных детерминант и варианты и производные антитела, такие как фрагмент T-клеточного рецептора.
Тип антитела против кадгерина конкретно неограничен и можно соответствующим образом использовать антитела, такие как антитело мыши, антитело человека, антитело крысы, антитело кролика, антитело овцы, антитело верблюда и антитело курицы; и генно-рекомбинантные антитела, которые намеренно модифицированы, чтобы снизить гетероантигенность у человека, такие как химерное антитело и гуманизированное антитело. Рекомбинантное антитело можно получать известным способом. Химерное антитело представляет собой антитело, образованное из вариабельных областей тяжелой цепи и легкой цепи антитела млекопитающих, отличного от антитела человека, например, антитела мыши, и константных областей тяжелой цепи и легкой цепи антитела человека, и его можно получать связыванием фрагмента ДНК, кодирующего вариабельную область антитела мыши, с фрагментом ДНК, кодирующим константную область антитела человека, встраиванием полученного фрагмента в вектор экспрессии, и введением вектора в клетки-хозяева (см., например, Cabilly S. et al., Proc. Natl. Acad. Sci. USA, 1984, 81(11) 3273-7; Morrison et al., Proc. Natl. Acad. Sci. USA, 1984, 81 (21), 6851-5; и опубликованную патентную заявку Европы № 171496). Гуманизированное антитело, которое также называют реконструированным антителом, представляет собой антитело, получаемое путем трансплантации определяющей комплементарность области (CDR) антитела млекопитающего, отличного от антитела человека, например, антитела мыши, в CDR антитела человека, и способы рекомбинации генов для этого общеизвестны. В частности, последовательность ДНК, включающая CDR антитела мыши, связанную с каркасной областью (FR) антитела человека, синтезируют способом ПЦР с использованием нескольких олигонуклеотидов, которые изготавливают так, чтобы они имели перекрывающуюся часть на их конце. Полученный таким образом фрагмент ДНК связывают с фрагментом ДНК, кодирующим константную область антитела человека, затем полученный фрагмент встраивают в вектор экспрессии и вектор вводят в клетки-хозяева, тем самым получая гуманизированное антитело (см. EP239400 A и WO 96/02576 A). FR антитела человека, связанную через CDR, выбирают из FR, имеющих CDR, которая образует подходящий антигенсвязывающий центр. При необходимости аминокислоту в FR вариабельной области антитела можно заменять, так чтобы CDR гуманизированного антитела образовывала соответствующий антигенсвязывающий центр (Sato, K. et al., Cancer Res., 1993, 53, 851-856).
Аминокислотная последовательность химерного антитела или гуманизированного антитела предпочтительно имеет 100% идентичность с аминокислотной последовательностью VH- или VL-области кДНК, экспрессируемой депонированной гибридомой. Вследствие генетической модификации, также предпочтительным является антитело, имеющее идентичность аминокислотной последовательности 90% или выше. В процессе гуманизации или химеризации обычно проводят такую контролируемую замену остатков для повышения связывания с антигеном. Такое антитело, имеющее частично модифицированную последовательность, по существу считается антителом, происходящим из исходной гибридомы.
Способы получения химерного антитела и гуманизированного антитела на основе технологии генетической инженерии уже известны. В частности, последовательности VH и VL моноклонального антитела, выступающие в качестве подтвержденной группы, генетически модифицируют, а затем проводят химеризацию или гуманизацию общепринятыми способами.
Способ выделения антитела человека также известен. В одной методике лимфоциты человека сенсибилизируют in vitro представляющим интерес антигеном или клетками, экспрессирующими антиген, и сенсибилизированные таким образом лимфоциты подвергают слиянию с клетками миеломы человека, например, U266, тем самым продуцируя представляющее интерес антитело человека, обладающее активностью связывания с антигеном (см. JP-B-1989-59878). Альтернативно, представляющее интерес антитело человека можно выделять путем иммунизации представляющим интерес антигеном трансгенного животного, обладающего полным набором генов антител человека (см. WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO96/34096 и W096/33735). Также известен способ выделения антитела человека путем пэннинга с использованием библиотеки антител. В одной методике вариабельную область антитела человека экспрессируют в качестве одноцепочечного антитела (scFv) на поверхности фага способом фагового дисплея, и фаг, который связывает антиген, можно отбирать. С помощью анализа генов отобранного таким образом фага, можно определять последовательность ДНК, кодирующую вариабельную область антитела человека, которая связывается с антигеном. Когда последовательность ДНК scFv, которая связывается с антигеном, становится известной, из последовательности можно получать соответствующий вектор экспрессии, посредством чего можно выделять представляющее интерес антитело. Эти способы широко известны (см. WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388).
Эти антитела против кадгерина могут представлять собой низкомолекулярное антитело, такое как фрагмент антитела, модифицированное антитело или сходные с ними, при условии сохранения способности распознавать весь белок или часть белка, кодируемого геном кадгерина. Примеры фрагмента антитела включают Fab, Fab', F(ab')2, Fv и диатело. Такой фрагмент антитела можно получать конструированием гена, кодирующего фрагмент антитела, встраиванием гена в вектор экспрессии и экспрессией его в подходящих клетках-хозяевах (см., например, Co, M.S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. and Horwitz, A.H., Methods Enzymol. (1989) 178, 476-496, Pluckthun, A. and Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. et al., Methods Enzymol. (1986) 121, 663-669; и Bird, R.E. and Walker, B.W., Trends Biotechnol. (1991) 9, 132-137).
В качестве модифицированного антитела можно использовать антитело, которое связано с любой из различных молекул, таких как полиэтиленгликоль (PEG). Такое модифицированное антитело можно получать путем химической модификации полученного антитела. Способ модификации антител уже является общеизвестным в данной области.
В настоящем изобретении можно использовать антитело с модифицированной цепью сахаров для усиления цитотоксической активности. Способы модификации цепи сахаров в антителе уже известны (например, WO 00/61739 и WO 02/31140).
Антитело против кадгерина по настоящему изобретению также охватывает полиспецифическое антитело, обладающее специфичностью к двум или более различным антигенам. Типичным примером такой молекулы может быть молекула, которая связывает два антигена (т.е. биспецифическое антитело). "Полиспецифическое антитело" по настоящему изобретению включает антитело, обладающее специфичностью к двум или более (например, трем) антигенам. Полиспецифическое антитело может представлять собой полноразмерное антитело или фрагмент такого антитела (например, F(ab')2-биспецифическое антитело).
Антитело против кадгерина по настоящему изобретению и его фрагмент можно получать любым подходящим способом, таким как реакция трансляции in vivo, в культивированных клетках, in vitro, и система для рекомбинантной экспрессии ДНК.
Способы получения моноклональных антител и антителопродуцирующих клеток (гибридом), главным образом, известны в данной области (Campbell, "Monoclonal Antibody Technology: Laboratory Techniques in Biochemistry and Molecular Biology", Elsevier Science Publishers, Amsterdam, The Netherlands, 1984, и St. Groth et al., J. Immunol. Methods 35: 1-21, 1980). В одной конкретной методике белок или его фрагмент, кодируемый геном кадгерина, служащий в качестве иммуногена, подкожно или внутрибрюшинно инъецируют для иммунизации любому животному (например, мыши или кролику), о котором известно, что оно продуцирует антитело. При иммунизации можно использовать адъювант, и такой адъювант хорошо известен в данной области.
Поликлональное антитело можно получать путем выделения антисыворотки, содержащей антитела, из иммунизированного животного и скрининга в отношении присутствия антитела, имеющего заданную специфичность, способом, хорошо известным в данной области (например, ELISA, вестерн-блоттинг или радиоиммунный анализ).
Моноклональное антитело можно получать путем извлечения клеток селезенки из иммунизированного животного и слияния клеток с клетками миеломы, тем самым получая гибридомы, которые могут продуцировать моноклональные антитела. Гибридомные клетки, продуцирующие антитело, которое может распознавать представляющий интерес белок или его фрагмент, можно выбирать с помощью способа, хорошо известного в данной области (например, ELISA, вестерн-блоттинг или радиоиммунный анализ). Затем, гибридому, секретирующую представляющее интерес антитело, клонируют и полученные клетки культивируют в соответствующих условиях. Секретированное таким образом антитело выделяют и очищают способом, хорошо известным в данной области (например, ионообменная колоночная хроматография или аффинная хроматография). В альтернативной методике моноклональное антитело человека можно получать с использованием линии xenomouse (см. Green, J. Immunol. Methods 231: 11-23, 1999; и Wells, Eek, Chem. Biol. 2000 Aug; 7(8): R185-6). В настоящее время проводят получение моноклональных антител на основе фагового дисплея, не вовлекающего иммунизацию. Моноклональное антитело по настоящему изобретению представляет собой антитело одного молекулярного типа, продуцируемое антителопродуцирующими клетками одного типа, или фрагмент ДНК, полученный из них и кодирующий антитело. Моноклональное антитело можно получать любым из описанных выше способов.
Фрагмент ДНК, кодирующий моноклональное антитело, можно легко выделять и секвенировать общепринятым способом (например, с использованием олигонуклеотидного зонда, который может специфично связываться с генами, кодирующими тяжелую цепь и легкую цепь моноклонального антитела). Гибридомная клетка является предпочтительным исходным материалом для получения такого фрагмента ДНК. После выделения такой фрагмент ДНК встраивают в вектор экспрессии, и вектор рекомбинируют с клетками-хозяевами, такими как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, в которых иммуноглобулин не продуцируется, пока клетки не трансформируют. Представляющее интерес моноклональное антитело продуцируется рекомбинантными клетками-хозяевами. Альтернативно, антитело или фрагмент антитела можно выделять из фаговой библиотеки антител способом McCafferty et al. (Nature 348: 552-554 (1990)).
Клетка-хозяин, используемая для экспрессии моноклонального антитела, предпочтительно представляет собой клетку-хозяина, источником которой является млекопитающее. Можно выбирать клетку-хозяина, наиболее подходящую для экспрессии моноклонального антитела. Клетка-хозяин не ограничена, и ее типичные примеры включают происходящую из CHO клеточную линию (клетка яичника китайского хомяка), CV1 (почка обезьяны), COS (производное CV1, экспрессирующее антиген SV40T), SP2/0 (миелома мыши), Р3х63-Ag3.653 (миелома мыши), 293 (почка человека) и 293T (производное 293, экспрессирующее антиген SV40T). Систему клеток-хозяев можно получать из коммерческого предприятия, American Tissue Culture Collection (ATCC), или из организации, которая опубликовала соответствующий документ.
Клетка-хозяин предпочтительно представляет собой происходящую из CHO клеточную линию с дефектом экспрессии гена dhfr (делеция в гене dhfr) или SP2/0 (см. Urland, G. et al., Effect of gamma rays at the dihydrofolate reductase locus: deletions and inversions; Somat. Cell. Mol. Genet. Vol. 12, 1986, p. 5555-566; и Schulman, M. et al., A better cell line for making hybridomas secreting specific antibodies. Nature Vol. 276, 1978, p. 269-270). Предпочтительно, клеткой-хозяином является CHO с делецией DHFR. Трансфекцию плазмид в клетки-хозяева можно проводить любым способом. Способ трансфекции не ограничен, и его конкретные примеры включают трансфекцию (включая способ с фосфатом кальция, способ с DEAE, липофекцию и электропорацию), включение ДНК с использованием оболочки (например, вирус Сендай), микроинъекцию и инфицирование с использованием вирусного (например, ретровирусного или аденовирусного) вектора (см. Current Protocols in Molecular Biology, Chapter 9 Introduction of DNA into Mammalian Cells, John Wiley and Sons, Inc.). Среди них, особенно предпочтительным является включение плазмиды в клетки-хозяева путем электропорации.
Участок распознавания кадгерина в антителе против кадгерина по настоящему изобретению предпочтительно представляет собой область 1-655 SEQ ID NO: 2.
Антитело против кадгерина по настоящему изобретению предпочтительно получают из гибридомы PPMX2016, PPMX2025, PPMX2029, PPAT-052-02, PPAT-052-03, PPAT-052-09, PPAT-052-24, PPAT-052-25, PPAT-052-26 или PPAT-052-28, или трансгенной клеточной линии CHO PPAT-052-27с, PPAT-052-02c, РРАТ-052-03с, PPAT-052-09c, PPAT-052-21c, PPAT-052-24c, PPAT-052-25c, PPAT-052-26c, PPAT-052-28C или PPAT-052-29C. В настоящем описании числа при PPMX или PPAT приведены для указания либо на антителопродуцирующие клетки, либо на антитела, продуцируемые антителопродуцирующими клетками.
Радиоактивный металл, который связан с антителом против кадгерина, предпочтительно представляет собой цитотоксический радиоактивный металл, когда меченное радиоактивным металлом антитело против кадгерина используют в качестве лекарственного средства против злокачественной опухоли, либо нецитотоксический радиоактивный металл, когда меченное радиоактивным металлом антитело против кадгерина используют в качестве средства для диагностики злокачественной опухоли.
Примеры цитотоксического радиоактивного металла включают иттрий-90 (90Y), рений-186 (186Re), рений-188 (188Re), медь-67 (67Cu), железо-59 (59Fe), стронций-89 (89Sr), золото-198 (198Au), ртуть-203 (203Hg), свинец-212 (212Pb), диспрозий-165 (165Dy), рутений-103 (103Ru), висмут-212 (212Bi), висмут-213 (213Bi), холмий-166 (166Ho), самарий-153 (153Sm) и лютеций-177 (177Lu).
Среди этих радиоактивных металлов предпочтительными являются 90Y, 153Sm и 177Lu, с точки зрения срока полураспада, энергии излучения, простоты реакции мечения, процента мечения, стабильности комплекса и т.д.
Нецитотоксический радиоактивный металл, который является подходящим для использования в средстве для диагностики злокачественной опухоли, не ограничен, и его примеры включают технеций-99m (99mTc), индий-111 (111In), индий-113m (113mIn), галлий-67 (67Ga), галлий-68 (68Ga), таллий-201 (201Tl), хром-51 (51Cr), кобальт-57 (57Co), кобальт-58 (58Co), кобальт-60 (60Co), стронций-85 (85Sr), ртуть-197 (197Hg) и медь-64 (64Cu).
Для присоединения радиоактивного металлического элемента к антителу против кадгерина предпочтительно металл-хелатирующий реагент подвергают реакции с антителом против кадгерина, и продукт далее подвергают реакции с радиоактивным металлическим элементом, тем самым формируя комплекс. В полученном таким образом модифицированном антителе радиоактивный металлический элемент связан с антителом против кадгерина через металл-хелатирующий реагент.
Примеры металл-хелатирующего реагента для формирования такого комплекса включают (1) производные хинолина, такие как соединения 8-гидроксихинолина, 8-ацетоксихинолина, 8-гидроксихиналдина, оксихинолинсульфата, O-ацетилоксина, O-бензоилоксина, O-п-нитробензоилоксина и хинолона, имеющие скелет хинолина (например, норфлоксацин, офлоксацин, эноксацин, ципрофлоксацин, ломефлоксацин, тосфлоксацин, флероксацин и спарфлоксацин); (2) соединения, такие как хлораниловая кислота, алюминон, тиомочевина, пирогаллол, купферон, висмутиол (II), галлоилгалловую кислоту, тиолид, 2-меркаптобензотиазол и хлорид тетрафениларсония; (3) этилендиаминтетрауксусную кислоту (EDTA), диэтилентриаминпентауксусную кислоту (DTPA) и соединения, имеющие сходный скелет (дигидроксиэтилглицин, диаминопропанолтетрауксусная кислота, этилендиаминдиуксусная кислота, гидрохлорид этилендиаминдипропионовой кислоты, гидроксиэтилэтилендиаминтриуксусная кислота, этилендиаминтетракис(метиленсульфоновая кислота), гликолевый простой эфир-диаминтетрауксусная кислота, гексаметилендиаминтетрауксусная кислота, гидроксиэтилиминодиуксусная кислота, иминодиуксусная кислота, диаминопропантетрауксусная кислота, нитрилотриуксусная кислота, нитрилотрипропионовая кислота, нитрилотрис(метиленсульфоновая кислота) тринатриевая соль, триэтилентетрамингексауксусная кислота, метил-DTPA, циклогексил-DTPA, аминобензил-EDTA, изотиоцианобензил-EDTA, изотиоцианобензил-DTPA, метилизотиоцианобензил-DTPA, циклогексилизотиоцианобензил-DTPA, малеимидопропиламидобензил-EDTA, малеимидопентиламидобензил-EDTA, малеимидодециламидобензил-EDTA, малеимидопентиламидобензил-DTPA и малеимидодециламидобензил-DTPA); и (4) 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 1,4,8,11-тетраазациклотетрадекан-1,4,8,11-тетрауксусную кислоту (TETA), 1,4,7,10-тетраазациклододекан (циклен), 1,4,8,11-тетраазациклотетрадекан (циклам), изотиоцианобензил-DOTA и изотиоцианобензил-NOTA.
Среди металл-хелатирующих реагентов предпочтительными являются изотиоцианобензил-DOTA, метилизотиоцианобензил-DTPA, циклогексилизотиоцианобензил-DTPA, с точки зрения простоты реакции встраивания металл-хелата в антитело, процента мечения, стабильности комплекса и т.д.
Радиоактивный металлический элемент может быть связан с антителом против кадгерина общепринятым способом. В одной методике металл-хелатирующий реагент подвергают реакции с антителом против кадгерина, тем самым получая предшественника метки, и предшественник подвергают реакции с радиоактивным металлическим элементом.
В лекарственном средстве против злокачественной опухоли и средстве для диагностики злокачественной опухоли по настоящему изобретению, молярное соотношение антитела против кадгерина и металл-хелатирующего реагента является важным для накопления в злокачественных клетках и эффекта против злокачественной опухоли. Молярное отношение (антитело против кадгерина:хелатирующий реагент) предпочтительно составляет от 1:0,1 до 1:4,5, более предпочтительно от 1:0,5 до 1:3. Для достижения таких молярных отношений антитело против кадгерина и хелатирующий реагент предпочтительно добавляют в реакционную смесь в соотношении от 1:0,1 до 1:менее 5, особенно предпочтительно от 1:1 до 1:3. Количество хелатирующей молекулы(молекул) на антитело против кадгерина можно вычислять путем измерения молекулярной массы с помощью анализа масс MALDI-TOF или сходного способа и сравнения молекулярной массы немодифицированного антитела с молекулярной массой модифицированного антитела (публикация патента США № 7514078, Lu et al., J. Pharm. Sci. 94(4), 2005, p. 788-797, и Tedesco et al., J. Clin. Onco. 23 (16S), 2005, 4765). Альтернативно, количество хелатирующей молекулы(молекул) на антитело против кадгерина можно определять путем хелатометрического титрования. В одном из известных способов используется колориметрический реагент на основе щелочноземельного металла (arsenazo III) (Bradyr et al., Nucl. Med. Biol. 31, 795-802, 2004, и Dadachova et al., Nucl. Med. Biol. 26, 977-982, 1999).
Лекарственное средство против злокачественной опухоли или средство для диагностики злокачественной опухоли по настоящему изобретению может быть предоставлено в качестве меченого состава или состава в наборе, содержащего предшественник метки. В настоящем изобретении можно использовать любой из составов. В случае меченого состава лекарственное средство против злокачественной опухоли или средство для диагностики злокачественной опухоли, содержащее меченое антитело против кадгерина, можно вводить как есть. В случае состава в наборе, средство можно вводить после мечения представляющим интерес радиоактивным металлическим элементом.
Антитело против кадгерина, содержащее радиоактивный металлический элемент, связанный с ним, в высокой степени накапливается в злокачественной ткани и проявляет высокую токсическую активность в отношении злокачественных клеток. Таким образом, антитело представляет собой подходящее лекарственное средство против злокачественной опухоли, которое в меньшей степени повреждает ткань, отличную от злокачественной ткани, и которое является высоко безопасным. Также антитело против кадгерина, содержащее радиоактивный металлический элемент, связанный с ним, обладает активностью против злокачественной опухоли, значительно превышающей активность соответствующего антитела против кадгерина. Активность против злокачественной опухоли является значительно более высокой, особенно когда молярное отношение антитела к хелатирующему агенту составляет от 1:0,1 до 1:4,5.
Лекарственное средство против злокачественной опухоли по настоящему изобретению можно использовать в комбинации с другим средством против злокачественной опухоли. Примеры такого средства против злокачественной опухоли включают алкилирующее средство, антиметаболит, ингибитор микротрубочек, антибиотическое средство против злокачественной опухоли, ингибитор топоизомераз, средство на основе платины, лекарственное средство против молекулярной мишени, гормональное средство и биологические средства. Примеры алкилирующего средства включают средства против злокачественной опухоли на основе азотистого иприта (например циклофосфамид), средства против злокачественной опухоли на основе нитрозомочевины (например ранимустин) и дакарбазин. Примеры антиметаболита включают 5-FU, UFT, кармофур, капецитабин, тегафур, TS-1, гемцитабин и цитарабин. Примеры ингибитора микротрубочек включают алкалоидные средства против злокачественной опухоли (например винкристин) и средства против злокачественной опухоли на основе таксанов (например доцетаксел и паклитаксел). Примеры антибиотического средства против злокачественной опухоли включают митомицин C, доксорубицин, эпирубицин, даунорубицин и блеомицин. Примеры ингибитора топоизомераз включают иринотекан и ногитекан, обладающие активностью ингибирования топоизомеразы I, и этопозид, обладающий активностью ингибирования топоизомеразы II. Примеры средства на основе платины включают цисплатин, параплатин, недаплатин и оксалиплатин. Примеры лекарственного средства против молекулярной мишени включают трастузумаб, ритуксимаб, иматиниб, гефитиниб, эрлотиниб, бевацизумаб, бортезомиб, сунитиниб и сорафениб. Примеры гормонального средства включают дексаметазон, финастерид и тамоксифен. Примеры биологических средств включают интерфероны α, β и γ, и интерлейкин 2.
Лекарственное средство против злокачественной опухоли по настоящему изобретению можно использовать в комбинации с терапией против злокачественной опухоли. Примеры терапии против злокачественной опухоли включают хирургическую операцию, лучевую терапию (включая терапию гамма-ножом, терапию киберножом, бор-нейтронзахватную терапию и терапию протонным пучком/пучком тяжелых ионов), MR-управляемую сфокусированную ультразвуковую хирургическую операцию, криотерапию, радиочастотную аблацию, терапию подкожной инъекцией этанола и эмболотерапию.
Лекарственное средство против злокачественной опухоли по настоящему изобретению является эффективным в отношении различных злокачественных опухолей млекопитающего (в том числе человека). Примеры злокачественной опухоли-мишени включают карциномы, такие как рак глотки, рак гортани, рак языка, рак легкого, рак молочной железы, рак пищевода, рак желудка, рак ободочной и прямой кишки, рак тела матки, рак яичника, рак печени, рак поджелудочной железы, рак желчного пузыря, рак почки, рак предстательной железы, злокачественная меланома и рак щитовидной железы; и саркомы, такие как остеосаркома, хондросаркома, рабдомиосаркома, лейомиосаркома, липосаркома, ангиосаркома, фибросаркома, лейкоз, злокачественная лимфома и миелома.
Лекарственное средство против злокачественной опухоли по настоящему изобретению можно растворять в водном растворе, предпочтительно физиологически адаптируемом буфере, таком как раствор Хэнкса, раствор Рингера или забуференный физиологический раствор. Также лекарственное средство может иметь форму суспензии, раствора, эмульсии или сходных с ними в маслянистом или водном носителе.
Дозировка лекарственного средства против злокачественной опухоли по настоящему изобретению, которая варьирует в зависимости от симптома, пути введения, массы тела, возраста и т.д. пациента, нуждающегося в этом, предпочтительно составляет, например, от 37 до 3700 МБк для одной обработки у взрослого.
Лекарственное средство против злокачественной опухоли по настоящему изобретению, главным образом, вводят парентерально. Например, лекарственное средство против злокачественной опухоли инъецируют (например, подкожно, внутривенно, внутримышечно, внутрибрюшинно) или вводят чрескожно, через слизистую оболочку, через носовую полость, через легкие и т.д.
Средство для диагностики злокачественной опухоли по настоящему изобретению можно использовать в визуализации опухоли. В случае, когда пациент имеет опухоль, в которой экспрессируется белок CDH3, средство для диагностики злокачественной опухоли по настоящему изобретению накапливается в опухоли. Таким образом, опухоль можно визуализировать путем детекции радиации с помощью устройства, такого как однофотонный эмиссионный компьютерный томограф (SPECT), позитронно-эмиссионный томограф (PET) или сцинтилляционная камера. Например, с использованием средства для диагностики злокачественной опухоли по настоящему изобретению, можно предсказывать терапевтический эффект лекарственного средства против злокачественной опухоли по настоящему изобретению до введения лекарственного средства. Диагностическое средство вводят пациенту до лечения и визуализируют опухоль. Когда наблюдают высокое накопление, может быть предсказана возможность лучшего эффекта лекарственного средства. Для определения терапевтического эффекта можно использовать диагностическое средство. Диагностическое средство по настоящему изобретению вводят пациенту, которому проводили лечение лекарственным средством по настоящему изобретению или любое другое лечение, так чтобы визуализировать опухоль. Путем мониторинга зависимого от времени варьирования накопления диагностического средства, можно наблюдать увеличение или уменьшение опухоли с течением времени.
Антитело для применения в качестве диагностического средства предпочтительно распознает эпитоп, за который конкурирует лекарственное средство. Более предпочтительно, антитело распознает тот же эпитоп, который распознается лекарственным средством. Наиболее предпочтительно, лекарственное средство и диагностическое средство представляют собой одно и то же антитело.
Средство для диагностики злокачественной опухоли по настоящему изобретению обычно вводят индивидууму внутривенно. Однако средство для диагностики злокачественной опухоли также можно вводить внутриартериально. Его дозировка, которая варьирует, в зависимости от симптома, пути введения, массы тела, возраста и т.д. пациента, нуждающегося в этом, предпочтительно составляет например, 37-1120 МБк за одну обработку у взрослого.
Примеры
Настоящее изобретение далее подробно описано с помощью примеров, которые не следует истолковывать как ограничивающие изобретение.
Пример 1: Получение растворимого антигена CDH3
Растворимый белок CDH3 (sCDH3), в котором C-концевая трансмембранная область удалена, получали, чтобы он служил в качестве иммуногена для получения антитела против CDH3.
(1) Получение вектора экспрессии для растворимого антигена CDH3
ПЦР проводили с использованием полноразмерной кДНК CDH3 в качестве матрицы и прямого праймера (SEQ ID NO:3: CGCGGTACCATGGGGCTCCCTCGT, (hCDH3FullFW)) и обратного праймера (SEQ ID NO:4: CCGTCTAGATAACCTCCCTTCCAGGGTCC, (hCDH3SolbRV)), который сконструирован так, чтобы амплифицировать сегмент, соответствующий внеклеточной области CDH3 (1-654 в SEQ ID NO:2, далее обознача