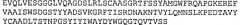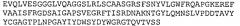Улучшенные аминокислотные последовательности, направленные против респираторно-синцитиального вируса человека (hrsv), и полипептиды, включающие такие последовательности, для профилактики и/или лечения инфекций дыхательных путей
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к аминокислотным последовательностям, которые направлены против и/или которые могут специфически связывать белок F hRSV. Заявлены соединения или конструкции, в частности белки и полипептиды, которые включают или, по существу, состоят из одной или трех таких аминокислотных последовательностей. Также изобретение относится к нуклеиновым кислотам, кодирующим указанные аминокислотные последовательности и полипептиды, к фармацевтическим композициям, способам лечения и профилактики заражения hRSV. Полипептиды и композиции по изобретению проявляют улучшенную стабильность, меньшую иммуногенность и/или улучшенную аффинность и/или авидность в отношении белка F hRSV. 16 н. и 12 з.п. ф-лы, 21 ил., 16 табл., 22 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к аминокислотным последовательностям, которые направлены на и/или которые могут специфически связывать (как определено в данном описании) белок F hRSV, а также к соединениям иди конструкциям, и в частности, белкам и полипептидам, которые включают или, по существу, состоят из одной или нескольких таких аминокислотных последовательностей (также называемым в данном описании «аминокислотная(ые) последовательностей) по изобретению», «соединение(я) по изобретению», «конструкция(и) по изобретению» и «полипептид(ы) по изобретению», соответственно).
Изобретение также относится к нуклеиновым кислотам, кодирующим такие аминокислотные последовательности (также называемым в данном описании «нуклеиновая(ые) кислота(ы) по изобретению» или «нуклеотидная(ые) последовательностей) по изобретению»; к способам получения таких аминокислотных последовательностей и полипептидов; к клеткам-хозяевам, экспрессирующим или способным экспрессировать такие аминокислотные последовательности или полипептиды; к композициям, и в частности, фармацевтическим композициям, которые включают такие аминокислотные последовательности, полипептиды, соединения или конструкции, нуклеиновые кислоты и/или клетки-хозяева; и к применениям таких аминокислотных последовательностей, полипептидов, соединений или конструкций, нуклеиновых кислот, клеток-хозяев и/или композиций, в частности, для профилактических и/или лечебных целей, таких как профилактические и/или лечебные цели, упоминаемые в данном описании.
Другие аспекты, преимущества и применения изобретения станут ясными из дальнейшего описания.
Уровень техники
Респираторно-синцитиальный вирус человека (hRSV) является членом семейства Paramyxoviridae и является оболочечным вирусом с двумя основными гликопротеинами поверхности, которые образуют шипы на вирусной частице. Один из таких гликопротеинов (белок G) является прикрепляющим белком, который опосредует связывание вируса с поверхностью клетки. Другой гликопротеин (белок F или слияния) опосредует слияние вирусной и клеточной мембран, допуская проникновение вирусного нуклеокапсида в цитоплазму клетки. Ингибирование стадий, опосредуемых или G- или F-гликопротеинами, блокирует начальные стадии инфекционного цикла и нейтрализует инфекционность вируса. Поэтому антитела, направленные против или G или F и ингибирующие их соответствующую активность, могут нейтрализовать инфекционность вируса и могут защитить от заражения hRSV. Белок F является высококонсервативным и образует тримерные выступы, которые претерпевают конформационные изменения после активации.
В зимние месяцы hRSV является основной причиной тяжелых инфекций нижних дыхательных путей (бронхиолита и пневмонии) у новорожденных и детей младшего возраста и вызывает ежегодные эпидемии. Вирус также является причиной тяжелых заболеваний среди людей пожилого возраста, и взрослых предрасположенных к сердечно-легочным расстройствам и/или иммуносупрессивным состояниям, которые также находятся в группе риска тяжелого течения заболевания hRSV. Иммунная реакция не предотвращает повторных заражений.
Не существует вакцины, способной предотвратить заражение hRSV. Единственным доступным на рынке лекарственным средством являются гуманизированные моноклональные антитела (Синагис® (Synagis®)), направленные против одного из гликопротеинов вируса (белка F), который используют для профилактики у детей, которые находятся в группе повышенного риска развития тяжелого инфекционного заболевания hRSV. Ограниченное применение Синагиса® имеет место, по меньшей мере, частично, из-за высокой стоимости указанного продукта. Существует отчетливая потребность в улучшенных и/или более дешевых профилактических и/или терапевтических средствах для предупреждения и или лечения заражений hRSV.
Сущность изобретения
Настоящее изобретение относится к аминокислотным последовательностям (также называемым «аминокислотная(ые) последовательность(и) по изобретению», полипептидам (также называемым «полипептид(ы) по изобретению») и терапевтическим соединениям и композициям, которые направлены против белка F hRSV и имеют улучшенные профилактические, терапевтические и/или фармакологические свойства в дополнение к другим выгодным свойствам (таким как, например, более легкое получение и/или уменьшенная стоимость товара) по сравнению с аминокислотными последовательностями и антителами предшествующего уровня техники. Такие улучшенные и выгодные свойства станут более ясными из дальнейшего описания. Без ограничений, аминокислотные последовательности, полипептиды и терапевтические соединения и композиции по изобретению могут показывать улучшенную стабильность, меньшую иммуногенность, улучшенное связывание с белком F hRSV, улучшенную аффинность и/или авидность в отношении белка F hRSV, улучшенную эффективность и/или активность нейтрализации hRSV (как определено в данном описании), улучшенную селективность в отношении белка F hRSV, и/или они могут быть способны частично или, предпочтительно, полностью блокировать взаимодействие белка F hRSV с хозяйской клеткой-мишенью или ее мембраной. Они могут быть способны к нейтрализации hRSV путем модуляции, ингибирования и/или предотвращения инфективности hRSV, путем модуляции, ингибирования и/или предотвращения слияния hRSV с (клеточной мембраной) хозяйской клетки-мишени и/или путем модуляции, ингибирования и/или предотвращения проникновения hRSV в хозяйскую клетку-мишень (как определено в данном описании). Они могут быть перекрестно реагирующими с и/или способными к нейтрализации различных вирусных штаммов hRSV и/или различных «ускользнувших» мутантов hRSV.
В первом аспекте настоящее изобретение относится к ряду тяжей из аминокислотных остатков (как определено в данном описании), которые особенно подходят для связывания со специфическим эпитопом белка F hRSV. Такие тяжи аминокислотных остатков могут присутствовать в и/или могут быть введены в аминокислотные последовательности по изобретению, в частности, таким образом, что они образуют антигенсвязывающий сайт (или его часть) аминокислотной последовательности по изобретению. Полученные аминокислотные последовательности будут способны связывать специфический эпитоп на белке F hRSV, который находится, образует часть или перекрывает (т.е. в первичной или третичной структуре) или находится в непосредственной близости к (т.е. в первичной или третичной структуре) антигенному сайту II на белке F hRSV (т.е. аминокислотным остаткам 250-275 белка F hRSV).
Соответственно, в одном аспекте настоящее изобретение относится к аминокислотным последовательностям, которые включают, по меньшей мере, тяж из аминокислотных остатков, выбранный из следующего:
a) SEQ ID NO: 102;
b) тяж из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам.
В предпочтительном аспекте настоящее изобретение относится к аминокислотным последовательностям, которые включают два или больше тяжей из аминокислотных остатков, один тяж из которых выбран из следующего:
a) SEQ ID NO:102;
b) тяж из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, которая включает указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
и, по меньшей мере, один тяж выбран из
c) SEQ ID NO: 98;
d) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 98, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
e) SEQ ID NO: 121; и
f) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 121, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам,
так что тяж из аминокислотных остатков, который соответствует одному из а) и b), должен всегда присутствовать в аминокислотной последовательности по изобретению, и так что второй тяж из аминокислотных остатков выбран из одного из с), d), e) и f).
Даже предпочтительнее, аминокислотные последовательности по изобретению включают три или больше тяжей из аминокислотных остатков, первый тяж из которых выбран из группы, состоящей из
a) SEQ ID NO: 98;
b) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 98, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам; или второй тяж из аминокислотных остатков выбран из группы, состоящей из
c)SEQ ID NO: 102;
d) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
и третий тяж из аминокислотных остатков выбран из группы, состоящей из
e) SEQ ID NO: 121;
f) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 121, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам.
Аминокислотные последовательности, включающие один или несколько таких специфических тяжей из аминокислотных остатков, проявляют улучшенные свойства, такие как, например, улучшенные характеристики связывания (соответственно измеренные и/или выраженные в виде величины KD (действительной или кажущейся), величины KA (действительной или кажущейся), константы скорости kon и/или константы скорости koff или, с другой стороны, величины IC50, описанные далее в данном описании), улучшенной аффинности и/или улучшенной авидности в отношении белка F hRSV и/или улучшенной эффективности и/или активности в отношении нейтрализации hRSV.
Аминокислотная последовательность по изобретению может, в частности, представлять собой доменное антитело (или аминокислотную последовательность, которая подходит для использования в качестве доменного антитела), однодоменное антитело (или аминокислотная последовательность которая подходит для использования в качестве однодоменного антитела) «dAb» (или аминокислотную последовательность, которая подходит для использования в качестве dAb) или нанотело® (определенное в данном описании и включающее, но не ограниченное указанным, VHH-последовательность); другие отдельные вариабельные домены или любой подходящий фрагмент любого из них.
В этом отношении аминокислотные последовательности по изобретению могут, по существу, состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), из которых CDR2 выбран из
a) SEQ ID NO: 102;
b) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам.
Такие предпочтительные гипервариабельные участки (последовательности CDR2) также называются «CDR2 по изобретению».
Предпочтительно, аминокислотные последовательности по изобретению могут, по существу, состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), из которых CDR2 выбран из
a) SEQ ID NO: 102 или
b) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
и, по меньшей мере, один из CDR1 или CDR3 выбран из
- CDR1, выбранного из группы, состоящей из
c) SEQ ID NO: 98;
d) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 98, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам; или
и/или
- CDR3, выбранного из группы, состоящей из
e) SEQ ID NO: 121 или
f) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 121, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам.
Даже предпочтительнее, аминокислотные последовательности по изобретению могут, по существу, состоять из 4 каркасных участков (FR1-FR4, соответственно) и 3 гипервариабельных участков (CDR1-CDR3, соответственно), из которых
- CDR1 выбран из группы, состоящей из
a) SEQ ID NO: 98;
b) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 98, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
и
- CDR2 выбран из группы, состоящей из
c) SEQ ID NO: 102 или
d) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
i) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату) и
ii) аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам;
и
- CDR3 выбран из группы, состоящей из
e) SEQ ID NO: 121;
f) тяжа из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 121, при условии, что аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность, включающая указанный тяж из аминокислотных остатков, имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью, включающей указанный тяж из аминокислотных остатков без 3, 2 или 1 различия по аминокислотам.
В конкретном аспекте аминокислотная последовательность или нанотело® по изобретению включает, по меньшей мере, SEQ ID NO: 102. Предпочтительно, аминокислотная последовательность или нанотело® по изобретению включает SEQ ID NO: 98, SEQ ID NO: 102 и SEQ ID NO: 121.
Настоящее изобретение также относится к ряду гуманизированных аминокислотных последовательностей, которые, в частности, подходят для связывания белка F hRSV. Аминокислотные последовательности по настоящему изобретению проявляют уменьшенную иммуногенность при введении человеку. Кроме того, аминокислотные последовательности по настоящему изобретению проявляют другие улучшенные свойства, такие как, например, улучшенные характеристики связывания (соответственно измеренные и/или выраженные в виде величины KD (действительной или кажущейся), величины KA (действительной или кажущейся), константы скорости kon и/или константы скорости koff или, с другой стороны, величины IC50, описанных далее в данном описании), в отношении белка F hRSV, улучшенной аффинности и/или улучшенной авидности в отношении белка F hRSV и/или улучшенной эффективности и/или активности в отношении нейтрализации hRSV, по сравнению с соответствующими им аминокислотными последовательностями дикого типа (описанными в заявке РСТ/ЕР 2009/056975, озаглавленной «Аминокислотные последовательности, направленные на белки оболочки вируса и включающие их полипептиды для лечения вирусных заболеваний», поданной Ablynx N.V. 5 июня 2009).
Соответственно, в другом аспекте настоящее изобретение относится к аминокислотным последовательностям, выбранным из следующего:
a) SEQ ID NO: 60-76;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 60-76, при условии, что
i) аминокислотная последовательность имеет глутамин (Gin, Q) в позиции 105 (указанная позиция определена согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
В предпочтительном аспекте аминокислотная последовательность по изобретению включает или, по существу, состоит из SEQ ID NO: 60-76.
В другом аспекте настоящее изобретение относится к аминокислотным последовательностям, выбранным из следующего:
a) SEQ ID NO: 62, 65, 67, 68, 75 и 76;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с одной из SEQ ID NO: 62, 65, 67, 68, 75 и 76, при условии, что
i) аминокислотная последовательность имеет глутамин (Gin, Q) в позиции 105, лейцин (Leu, L) в позиции 78 и/или аргинин (Arg, R) в позиции 83 (указанные позиции определены согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
Предпочтительные аминокислотные последовательности по изобретению включают или, по существу, состоят из SEQ ID NO: 62, 65, 67, 68, 75 и 76.
В еще одном аспекте настоящее изобретение относится к аминокислотным последовательностям, выбранным из следующего:
a) SEQ ID NO: 65 и 76;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с одной из SEQ ID NO: 65 и 76, при условии, что
i) аминокислотная последовательность имеет аспарагиновую кислоту (Asp, D) в позиции 54, глутамин (Gin, Q) в позиции 105, лейцин (Leu, L) в позиции 78 и/или аргинин (Arg, R) в позиции 83 (указанные позиции определены согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
В предпочтительном аспекте аминокислотная последовательность по изобретению включает или, по существу, состоит из SEQ ID NO: 65. В другом предпочтительном аспекте аминокислотная последовательность по изобретению включает или, по существу, состоит из SEQ ID NO: 76.
В другом аспекте настоящее изобретение относится к аминокислотным последовательностям, выбранным из следующего:
a) SEQ ID NO: 146-153;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с одной из SEQ ID NO: 146-153, при условии, что
i) аминокислотная последовательность имеет пролин (Pro, P) в позиции 14, аргинин (Arg, R) в позиции 19, лейцин (Leu, L) в позиции 20 и лейцин (Leu, L) в позиции 108 (указанные позиции определены согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
В предпочтительном аспекте аминокислотные последовательности по изобретению включают или, по существу, состоят из SEQ ID NO: 146-153.
В другом аспекте настоящее изобретение относится к аминокислотным последовательностям, выбранным из следующего:
a) SEQ ID NO: 146-149 и 151-153;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с одной из SEQ ID NO: 146-149 и 151-153, при условии, что
i) аминокислотная последовательность имеет пролин (Pro, P) в позиции 14, аргинин (Arg, R) в позиции 19, лейцин (Leu, L) в позиции 20 и лейцин (Leu, L) в позиции 108 и, кроме того, аргинин (Arg, R) в позиции 83, глутаминовую кислоту (Glu, E) в позиции 85 и/или глутамин (Gin, Q) в позиции 105, так что когда аминокислотная последовательность имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с
- SEQ ID NO: 146, аминокислотная последовательность предпочтительно имеет глутамин (Gin, Q) в позиции 105;
- SEQ ID NO: 147, аминокислотная последовательность предпочтительно имеет аргинин (Arg, R) в позиции 83 и глутамин (Gin, Q) в позиции 105;
- SEQ ID NO: 148, аминокислотная последовательность предпочтительно имеет глутаминовую кислоту (Glu, E) в позиции 85 и глутамин (Gin, Q) в позиции 105;
- SEQ ID NO: 149, аминокислотная последовательность предпочтительно имеет аргинин (Arg, R) в позиции 83, глутаминовую кислоту (Glu, E) в позиции 85 и глутамин (Gin, Q) в позиции 105;
- SEQ ID NO: 151, аминокислотная последовательность предпочтительно имеет аргинин (Arg, R) в позиции 83;
- SEQ ID NO: 152, аминокислотная последовательность предпочтительно имеет глутаминовую кислоту (Glu, E) в позиции 85;
- SEQ ID NO: 153, аминокислотная последовательность предпочтительно имеет аргинин (Arg, R) в позиции 83 и глутаминовую кислоту (Glu, E) в позиции 85;
(указанные позиции определены согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
Предпочтительные аминокислотные последовательности по изобретению включают или, по существу, состоят из одной из SEQ ID NO: 146-149 и 151-153.
Настоящее изобретение относится к ряду аминокислотных последовательностей и/или нанотел®, оптимизированных по последовательности, которые проявляют повышенную стабильность при хранении во время исследований стабильности, и которые особенно подходят для связывания белка F hRSV. Аминокислотные последовательности по настоящему изобретению проявляют уменьшенную пироглутаматную посттрансляционную модификацию N-конца и, следовательно, имеют повышенную стабильность продукта. Кроме того, аминокислотные последовательности по настоящему изобретению проявляют другие улучшенные свойства, такие как меньшая иммуногенность, улучшенные характеристики связывания (соответственно измеренные и/или выраженные в виде величины KD (действительной или кажущейся), величины KA (действительной или кажущейся), константы скорости kon и/или константы скорости koff или, с другой стороны, в виде величины IC50, описанных далее в данном описании) в отношении белка F hRSV, улучшенной аффинности и/или улучшенной авидности в отношении белка F hRSV и/или улучшенной эффективности и/или активности в отношении нейтрализации hRSV, по сравнению с их соответствующими исходными аминокислотными последовательностями (описанными в заявке РСТ/ЕР 2009/056975, озаглавленной «Аминокислотные последовательности, направленные на белки оболочки вируса и включающие их полипептиды для лечения вирусных заболеваний», зарегистрированной Ablynx N.V. 5 июня 2009).
Соответственно, в одном аспекте настоящее изобретение относится к аминокислотным последовательностям и/или нанотелам®, выбранным из следующего:
a) SEQ ID NO: 138-141 и 154-157;
b) аминокислотные последовательности, которые имеют не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с одной из SEQ ID NO: 138-141 и 154-157, при условии, что
i) аминокислотная последовательность имеет аспарагиновую кислоту (Asp, D) в позиции 1 (указанная позиция определена согласно нумерации по Кабату); и
ii) аминокислотная последовательность связывает белок F hRSV с одинаковой, примерно одинаковой или более высокой аффинностью (указанную аффинность измеряют методом поверхностного плазменного резонанса), и/или аминокислотная последовательность имеет одинаковую, примерно одинаковую или более высокую активность (как определено в данном описании) при сравнении с аминокислотной последовательностью без 3, 2 или 1 различия по аминокислотам.
В предпочтительном аспекте аминокислотная последовательность и/или нанотело® по изобретению включает или, по существу, состоит из одной из SEQ ID NO: 138-141 и 154-157.
Аминокислотные последовательности и нанотела® по изобретению предпочтительно находятся в, по существу, изолированной форме (как определено в данном описании) или образуют часть белка или полипептида по изобретению (также называемых в данном описании «полипетид по изобретению» или «белок по изобретению»), которые могут включать или, по существу, состоять из одной или нескольких аминокислотных последовательностей или нанотел® по изобретению, и которые могут, необязательно, также содержать одну или несколько других аминокислотных последовательностей или нанотел® (все необязательно соединенные через один или несколько подходящих линкеров).
Соответственно, в другом аспекте изобретение также относится к белку или полипептиду (также называемых в данном описании «белок по изобретению» или «полипетид по изобретению», соответственно), который включает или, по существу, состоит из одной или нескольких аминокислотных последовательностей и/или нанотел® по изобретению (или их подходящих фрагментов).
Например, и без ограничения, одну или несколько аминокислотных последовательностей и/или нанотел® по изобретению можно использовать в качестве связывающей единицы в таком белке или полипептиде, так что получается моновалентный, поливалентный или полипаратопный полипептид по изобретению, соответственно, все описанные в данном описании. Таким образом, настоящее изобретение также относится к полипептиду, который представляет собой моновалентную конструкцию, включающую или, по существу, состоящую из аминокислотной последовательности и/или нанотела® по изобретению. Таким образом, настоящее изобретение также относится к полипептиду, который является поливалентным полипептидом, таким как, например, двухвалентный или трехвалентный полипептид. Настоящее изобретение также относится к полипептиду, который является полипаратопным полипептидом, таким как, например, бипаратопный или трипаратопный полипептид.
В предпочтительном аспекте изобретение относится к поливалентному, предпочтительно, двухвалентному или трехвалентному, полипептиду, включающему или, по существу, состоящему из, по меньшей мере, двух аминокислотных последовательностей и/или нанотел® по изобретению (описанных выше).
В одном аспекте изобретение относится к поливалентному, предпочтительно, двухвалентному или трехвалентному, полипептиду, включающему или, по существу, состоящему из, по меньшей мере, двух (предпочтительно, идентичных) или, по меньшей мере, трех (предпочтительно, идентичных) аминокислотных последовательностей или нанотел®, выбранных из аминокислотных последовательностей, которые включают, по меньшей мере, тяж из аминокислотных остатков, выбранный из следующего:
a) SEQ ID NO: 102;
b) тяж из аминокислотных остатков, который имеет не более 3, предпочтительно, не более 2, предпочтительнее, не более 1 различия по аминокислотам с SEQ ID NO: 102, при условии, что
1) указанный тяж из аминокислотных остатков имеет аспарагиновую кислоту (Asp, D) в позиции 6 (позиции 54, определенной согласно нумерации по Кабату); и
ii) аминокислотная последовательность, включающая указанны