Способ получения рекомбинантного белка sav-rgd
Иллюстрации
Показать всеИзобретение касается способа получения рекомбинантного белка SAV-RGD, где SAV - мономер стрептавидина, RGD - меланома-адресующий олигопептид, имеющий аминокислотную последовательность Ser-Arg-Ala-Gly-Ala-Asp-Gly-Phe-Pro-Gly-Cys-Arg-Gly-Asp-Cys-Ser-Gln-Glu. Представленный способ включает культивирование в питательной среде бактериального штамма E. coli MG1655/pSAV-RGD, полученного трансформацией штамма E. coli MG1655 плазмидой pSAV-RGD, в свою очередь полученной на базе вектора pUC18 и включающей последовательность, кодирующую слитый пробелок SAV-RGD (pro-sav-rgd) под контролем промотора уридинфосфорилазы (Pudp) Е. coli. Получение фракции клеток бактериального штамма, очистку полученного рекомбинантного белка. Причем культивирование проводят в два этапа. На первом этапе осуществляют подпитку источником глюкозы, а на втором этапе осуществляют подпитку пептоном и дрожжевым экстрактом. Изобретение может быть использовано для производства лекарственных средств для лечения меланомы человека. 4 з.п. ф-лы, 15 ил., 2 табл., 10 пр.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности и медицинской биотехнологии и представляет собой способ препаративного получения рекомбинантного белка SAV-RGD, специфически узнающего клетки меланомы, где: SAV обозначает мономер стрептавидина, имеющий аминокислотную последовательность SEQ NO 1; RGD - меланома-адресующий олигопептид, имеющий аминокислотную последовательность SEQ NO 2, с использованием штамма MG1655/pSAV-RGD Escherichia coli - продуцента данных слитых белков.
Предшествующий уровень техники
Известно, что RGD-содержащие пептиды способны оказывать токсический эффект на клетки, связываясь с интегриновыми рецепторами на поверхности опухолевых клеток, они запускают внутриклеточные сигнальные каскады, приводящие к остановке роста, снижению пролиферации и, как следствие, гибели клеток. Данный принцип положен в основу действия препарата Cilengitide производства Merck KGaA (Германия), представляющего собой циклический пептид RGDfV (Arg-Gly-Asp-(D-Phe)-Val). [Mas-Moruno С., Rechenmacher F., Kessler H. (2010) Anti-Cancer Agents in Medicinal Chemistry, 10, 753-768.] Тем не менее, использование малых концентраций таких пептидов имеет обратный эффект, обусловленный кластеризацией рецепторов интегрина и активацией другого сигнального пути. Это создает дополнительные сложности при использовании препаратов, в состав которых входят RGD-содержащие пептиды, не несущий токсической части. Для устранения вышеописанного эффекта такие пептиды конъюгируют с токсическими агентами либо располагают на поверхности нагруженных токсическим агентом наноструктур или липосом [Pattillo СВ. et al. (2005) Pharm. Res., 22, 1117-1120; Dubey P.K. Mishra V., Jain S., Manor S., Vyas S.P. (2004) J. Drug Target, 12, 257-264], что является достаточно трудоемкой процедурой.
Для эффективного связывания с интегриновыми рецепторами на поверхности меланомных клеток белок должен содержать трипептид Arg-Gly-Asp (RGD). [Pierschbacher M.D. and Ruoslahti E. (1984) Nature, 309, 30-33] Однако связывать RGD-мотив способны несколько интегриновых рецепторов (это группа интегринов, содержащих субчастицу αv, а также интегрины α5β1, α8β1 αIIbβ3). Для обеспечения селективности важно окружение RGD-мотива. Варьируя последовательность аминокислотных остатков, окружающих RGD-мотив, была создана панель RGD-содержащих олигопептидов с различной тканевой специфичностью, обусловленной селективным взаимодействием с различными интегриновыми рецепторами. В ряду прочих, были получены RGD-содержащие олигопептиды, обладающие способностью селективно связываться с рецепторами на поверхности меланомных клеток и клеток эндотелия опухолевых сосудов человека и мыши (RGD10, RGD13, RGD15). [Hölig P., Bach М, Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17,433-441.]
Следует отметить, что для эффективного связывания с рецептором трипептид RGD должен принимать изогнутую конформацию, которую стабилизируют либо посредством циклизации пептидной цепочки [Aumailey М., Gurrath М., Müller G., Calvete J., Timple R., Kessler H. (1991) FEBS Lett., 291, 50-54; Gurrath M., Müller G., Kessler H., Aumailey M. Timple R. (1992) Eur. J. Biochem., 210, 911-921], либо путем образования дисульфидной связи между фланкирующими RGD-мотив остатками цистеина [Pierschbacher M.D. and Ruoslahti Е. (1987) J. Biol. Chem., 262, 17924-17928; Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441].
Короткие пептиды, как правило, получают методом химического синтеза. Однако при реализации данного способа возможна рацемизация аминокислотных остатков. Замена L-формы аминокислот на D-форму может приводить к образованию нефункциональных пептидов, в данном случае - со сниженной аффинностью к рецептору. [Han Y., Albericio F., Barany G. (1997), J Org Chem, 62, 4307-4312; Palasek S.A., Cox Z.J., Collins J.M. (2007) J. Peptide Sci., 13, 143-148].
Короткие RGD-пептиды имеют и другие недостатки помимо вышеперечисленных.
Изогнутая конформация трипептида RGD, обусловленная кольцевой структурой химически синтезируемых пептидов, подобных Cilengitide, может также поддерживаться за счет дисульфидной связи, образуемой между фланкирующими RGD-мотив остатками цистеина. [Pierschbacher M.D. and Ruoslahti E. (1987) J. Biol. Chem., 262, 17924-17928; Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441]. Это предоставляет возможность для биотехнологического получения пептидов, исключающего саму возможность рацемизации. Тем не менее, основной проблемой, возникающей при наработке белков в клетках микроорганизмов, является деградация коротких молекул, осуществляемая протеолитическими ферментами в цитоплазме клетки. Небольшие пептиды, как правило, имеют малое время циркуляции в организме, что, наряду с пониженным сродством к рецептору, может вести к необходимости увеличения как количества применяемого препарата, так и частоты его введения. Эти процессы могут существенно снижать эффективность действия препарата.
Из уровня техники известна аминокислотная последовательность растворимого, экскретируемого в периплазму стрептавидина; нуклеотидная последовательность, кодирующая данный белок; создан вектор, в состав которого входит вышеупомянутая нуклеотидная последовательность, находящаяся под контролем сильного конститутивного промотора или промотора уридинфосфорилазы Е. coli (Pudp); штамм Е. coli, содержащий упомянутый вектор и являющийся продуцентом стрептавидина; а также способ получения данного полипептида в бактериальных клетках с использованием хроматографической очистки [патент РФ 2153535]. Прототипами таких экспрессионных систем могут служить векторы, описанные нами ранее в патенте [патент РФ 2153535] и статье [Syrkina MS и др. Preparation and functional evaluation of RGD-modified streptavidin targeting to integrin-expressing melanoma cells. Protein Eng Des Sel. 2013 Feb; 26(2): 143-50]».
Кроме того, известна аминокислотная последовательность меланома-адресующих олигопептидов RIO, R13 и R15 (упоминающихся в литературном источнике как RGD10, RGD13 и RGD15) [Hölig P., Bach М., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17,433-441].
Наконец, подробно описан и охарактеризован RGD-содержащий циклический пептид RGDfV, выпускаемый под торговой маркой Cilengitide компанией Merck KgaA (Германия). [Mas-Moruno С., Rechenmacher F., Kessler H. (2010) Anti-Cancer Agents in Medicinal Chemistry, 10, 753-768].
Включение олигопептида в состав тетрамеризующегося белка-носителя, стрептавидина, приводит к тому, что рекомбинантный слитый белок будет содержать в своем составе четыре интегрин-адресующих олигопептида. В результате взаимодействия такой структуры с рецептором на поверхности клетки происходит увеличение локальной концентрации RGD-мотивов вблизи данного рецептора, что повышает эффективность связывания. Литературные данные подтверждают повышенную эффективность связывания таких поливалентных структур по сравнению с моновалентными [патент РФ 2153535].
Помимо этого, стрептавидин способен с высоким сродством связывать остаток d-биотина (Kd=10-15). Учитывая тот факт, что каждая субъединица стрептавидина связывает 1 молекулу биотина, тетрамер способен связать 4 молекулы биотина, что может приводить к амплификации сигнала при использовании биотинилированного диагностического агента или усилению токсического эффекта при использовании биотинилированного терапевтического агента [Xia N., Liu L., Harrington M.G., Zhou F.(2010), Anal. Chem., 82, 10151-10157].
Использование запатентованной экспрессионной системы, позволяющей в препаративных количествах нарабатывать рекомбинантный стрептавидин в периплазме Е. coli [патент РФ 2153535], обеспечивает локализацию химерного белка на основе стрептавидина в периплазматическом пространстве клетки, что позволяет не только ограничить его расщепление протеолитическими ферментами, присутствующими в цитоплазме, но и существенно упростить стадию выделения с использованием аффинной хроматографии.
Ранее авторы настоящего изобретения создали систему для экспрессии рекомбинантных слитых белков SAV-RGD, специфически узнающих меланомные клетки, в состав которых входит стрептавидин (S) и меланома-адресующий олигопептид (R), соединенный со стрептавидином посредством пептидного линкера, содержащего сайт расщепления эн-теропептидазой; конструировали рекомбинантные плазмидные ДНК, обеспечивающие гетерологичную экспрессию указанных слитых белков; а также получили штаммы бактерий, принадлежащих к роду Escherichia, - продуценты указанных слитых белков. Указанные плазмидные ДНК обеспечивают экспрессию пробелка, содержащего лидерный пептид, обеспечивающий его секрецию в периплазматическое пространство клеток бактерий, где происходит отщепление лидерного пептида, и указанный белок SAV-RGD локализуется в биологически активном растворимом состоянии [Syrkina MS и др. Preparation and functional evaluation of RGD-modified streptavidin targeting to integrin-expressing melanoma cells. Protein Eng Des Sel. 2013 Feb;26(2): 143-50].
Краткое описание настоящего изобретения
Целью настоящего изобретения является создание высокоэффективного и экономичного способа препаративного получения рекомбинантного белка SAV-RGD, специфически узнающего клетки меланомы, в качестве препарата для производства лекарственных препаратов для лечения меланомы человека.
Данная цель была достигнута за счет разработки и оптимизации способа препаративного получения рекомбинантного белка SAV-RGD с использованием штамма MG1655/pSAV-RGD Escherichia coli.
Поставленная задача решается тем, что разработан и оптимизирован способ препаративного получения рекомбинантного белка SAV-RGD с использованием штамма Escherichia coli MG1655/pSAV-RGD.
Бактериальный штамм Escherichia coli MG1655/pSAV-RGD получен в результате трансформации штамма Escherichia coli MG1655 рекомбинантной плазмидной ДНК pSAV-RGD на базе вектора pUC18, которая включает последовательность промотора уридинфосфорилазы E. coli (Pudp), а также последовательность, кодирующую слитой белок SAV-RGD. В свою очередь, рекомбинантный слитой белок SAV-RGD, специфически узнающий меланомные клетки, имеет формулу SAV-RGD, где:
SAV - мономер стрептавидина, имеющий аминокислотную последовательность SEQ NO 1;
RGD - меланома-адресующий олигопептид, имеющий аминокислотную последовательность SEQ NO 2, где
Вышеупомянутый способ препаративного получения рекомбинантного белка SAV-RGD включает следующие стадии:
- культивирование в питательной среде (LB, М9++глюкоза) штамма Escherichia coli MG1655/pSAV-RGD с рН-статированием в диапазоне рН 7,5-7,8 и сниженной аэрацией (концентрация растворенного кислорода не превышает 20-25%), включающее 2 этапа, где на первом этапе осуществляют подпитку источником глюкозы, а на втором этапе осуществляют подпитку источником аминокислот (пептоном и/или дрожжевой экстрактом);
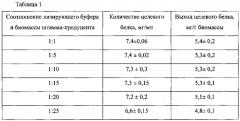
- получение периплазматической фракции клеток бактериального штамма Escherichia coli MG1655/pSAV-RGD с использованием лизирующего буфера, в состав которого входит лизоцим в концентрации 1 г/л;
- очистку рекомбинантного белка по SAV-RGD методом ионообменной хроматографии с последующей ультрафильтрацией; и
- лиофилизацию очищенного рекомбинантного белка SAV-RGD с получением препарата на основе самособирающегося слитого белка, содержащего меланома-узнающие пептиды и адапторную часть для присоединения токсического агента.
В указанном способе условия культивирования оптимизированы для наиболее эффективного получения белка SAV-RGD, очистка целевого рекомбинантного белка SAV-RGD методом ионообменной хроматографии позволяет существенно снизить издержки процесса на стадии очистки по сравнению с использованием аффинной хроматографии на 2-иминобиотин-агарозе при сопоставимых выходах по целевому белку и степени его чистоты.
Настоящее изобретение более детально описано ниже.
Подробное описание настоящего изобретения.
Способом согласно настоящему изобретению является способ препаративного получения рекомбинантного белка SAV-RGD, где SAV - мономер стрептавидина, имеющий аминокислотную последовательность SEQ ID NO 1, RGD - меланома-адресующий олиго-пептид, имеющий аминокислотную последовательность SEQ ID NO 2, с использованием бактериального штамма Escherichia coli MG1655/pSAV-RGD.
Указанный способ включает следующие стадии:
- культивирование в питательной среде бактериального штамма Escherichia coli MG1655/pSAV-RGD - продуцента рекомбинантного белка SAV-RGD, при этом культивирование ведут в питательной среде с рН-статированием в диапазоне рН 7,5-7,8 и сниженной аэрацией (концентрация растворенного кислорода не превышает 20-25%), в 2 этапа, где на первом этапе осуществляют подпитку источником глюкозы, а на втором этапе осуществляют подпитку источником аминокислот (пептоном и/или дрожжевой экстрактом);
- получение периплазматической фракции клеток указанного штамма-продуцента рекомбинантного белка SAV-RGD;
- очистку рекомбинантного белка SAV-RGD методом ионообменной хроматографии с последующей ультрафильтрацией; и
- лиофилизацию очищенного рекомбинантного белка SAV-RGD с получением препарата на основе самособирающегося слитого белка, содержащего меланома-узнающие пептиды и адапторную часть для присоединения токсического агента.
Рекомбинантным белком SAV-RGD, получаемым способом согласно настоящему изобретению, является белок формулы SAV - мономер стрептавидина, имеющий аминокислотную последовательность SEQ ID NO 1, RGD - меланома-адресующий олигопептид, имеющий аминокислотную последовательность SEQ ID NO 2.
Примером рекомбинантной плазмиды, экспрессирующей указанный рекомбинант-ный белок SAV-RGD, содержащий лидерный пептид, обеспечивающий секрецию пробелка в периплазматическое пространство клеток Е. coli, где происходит отщепление лидерного пептида и стрептавидин локализуется в биологически активном растворимом состоянии, является плазмида pSAV-RGD на базе вектора pUC18, включающая последовательность, кодирующую слитой пробелок под контролем промотора уридинфосфорилазы Е. coli (Pudp). Схематическое изображение плазмиды pSAV-RGD представлено на Фиг. 1. Следует понимать, что круг плазмид, которые возможно использовать в настоящем способе, не ограничивается только указанной плазмидой.
Бактерией, используемой в способе согласно настоящему изобретению, является бактерия, принадлежащая к роду Escherichia - продуцент рекомбинантного белка SAV-RGD.
Термин «бактерия, принадлежащая к роду Escherichia, означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. Среди примеров бактерий, принадлежащих к роду Escherichia, но не ограничивающихся ими, может быть упомянута бактерия Escherichia coli (E. coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Согласно настоящему изобретению термин «бактерия - продуцент рекомбинантного белка SAV-RGD» означает бактерию, способную производить и накапливать рекомбинантный белок SAV-RGD, предпочтительно в периплазме указанной бактерии, когда такая бактерия культивируется в питательной среде. Термин «бактерия - продуцент рекомбинантного белка SAV-RGD» означает, что микроорганизм способен производить и накапливать рекомбинантный белок SAV-RGD в количестве не меньше чем 0,05 г на 1 л культуральной жидкости и более предпочтительно не меньше чем 0,1 г на 1 л культуральной жидкости после выращивания в течение предпочтительно 18 часов.
Примером бактериального штамма, принадлежащего к роду Escherichia, - продуцента рекомбинантного белка SAV-RGD, является штамм Escherichia coli MG1655, трансформированный указанной выше плазмидой, например штамм Escherichia coli MG1655/pSAV-RGD, но не ограничивается им. Указанный штамм хранится в коллекции Биологического факультета МГУ.
Согласно настоящему изобретению выращивание бактерии - продуцента рекомбинантного белка SAV-RGD, осуществляют в подходящей питательной среде. Питательная среда для выращивания может быть как синтетической, так и натуральной, при условии, что она содержит источники углерода, азота, минеральные соединения и, если необходимо, питательные добавки в количестве, необходимом для роста бактерии. Источники углерода включают в себя различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способа ассимиляции используемых бактерий, могут быть использованы спирты, такие как этанол и глицерин. В качестве источников азота используются аммиак, различные соли аммония, такие как сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов и микробный ферментолизат. В качестве минеральных соединений используются однозамещенный фосфат калия, хлорид натрия, хлорид кальция, соли магния, соли железа, соли марганца и подобные им. В качестве витаминов используются тиамин, дрожжевой экстракт и подобные им.
Выращивание проводят предпочтительно в аэробных условиях, таких как взбалтывание и аэрация с перемешиванием, при температуре от 20°С до 40°С, предпочтительно от 30°С до 38°С, наиболее предпочтительно при 37°С. Значение рН обычно варьирует в пределах от 5 до 9, предпочтительно в пределах от 7,0 до 8,0, наиболее предпочтительно при рН 7,5-7,8. рН среды может быть скорректирован аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно, выращивание в течение 18 часов приводит к накоплению биомассы бактерий, содержащих целевой белок в периплазматическом пространстве.
В ходе оптимизации условий культивирования штамма-продуцента рекомбинантного белка SAV-RGD установлено, что наиболее оптимальным является рН питательной среды 7.5.
Также в ходе оптимизации условий культивирования штамма-продуцента рекомбинантного белка SAV-RGD установлено, что снижение аэрации, за счет перемешивания со скоростью предпочтительно 450 об/мин, ведет к увеличению выхода целевого рекомбинантного белка SAV-RGD. Принудительную аэрацию проводят путем подачи 1 объема воздуха на 1 объем питательной среды.
Также в ходе оптимизации условий культивирования штамма-продуцента рекомбинантного белка SAV-RGD установлено, что наиболее оптимальным является двухступенчатое культивирование штамма. В первой части культивирования осуществляют наращивание популяции клеток штамма-продуцента путем подпитки источником углерода, в частности глюкозой, при этом предпочтительно контролировать скорость подпитки таким образом, чтобы конечная концентрация глюкозы в питательной среде не превышала 1-2 г/л. Во второй части культивирования осуществляют подпитку аминокислотами для эффективного биосинтеза рекомбинантного белка SAV-RGD. В качестве источников аминокислотами используют пептон и/или дрожжевой экстракт.
После выращивания получают периплазматическую фракцию указанных клеток. Для этого осаждают клетки центрифугированием, предпочтительно при 5000 об/мин при температуре 4°С в течение предпочтительно 10 минут. Культуральную жидкость удаляют, а полученную биомассу ресуспендируют в лизирующем буферном растворе, после чего центрифугированием при предпочтительно 12500 об/мин при 4°С в течение предпочтительно 20 минут получают супернатант, представляющий собой суммарную фракцию пе-риплазматических белков Е. coli. Варианты указанного процесса подробно описаны в Sambrook J., Fritsch E.F., Maniatis Т. (1989) [Cold Spring Harbor Laboratory Press].
В ходе оптимизации условий получения периплазматической фракции бактериальных клеток установлено, что экономически целесообразным является использование лизирующего буфера, содержащего лизоцим в концентрации 1 г/л, в соотношении объемов 1:20 к объему биомассы клеток.
Выделение целевого рекомбинантного белка SAV-RGD из фракции периплазматических белков осуществляют методом ионообменной хроматографии. В ходе оптимизации условий очистки установлено, что в качестве носителя в методе ионообменной хроматографии экономически целесообразным является использование SP-сефарозы (гранулированная агароза, модифицированная сульфопропильными группами) вместо 2-иминобиотинагарозы. К тому же SP-сефароза в качестве носителя достаточно стабильна и выдерживает многократные циклы очистки белка. Выходы целевого белка и его чистота при использовании SP-сефарозы и 2-иминобиотинагарозы сопоставимы.
После проведения хроматографии целевые рекомбинантные белки подвергают очистке методом ультрафильтрации через мембрану, позволяющую фильтровать белки размером свыше предпочтительно 30 кДа, для концентрирования и перевода в раствор. Для ультрафильтрации предпочтительно использование мембраны YM-30 (Amicon, США). Предпочтительно использовать разведение 1:20 с не менее чем пятикратной сменой буфера. Ультрафильтрацию осуществляют под давлением инертного газа (аргон, гелий с давлением не менее 4,7 атм).
В результате вышеописанных процедур получают очищенные препараты рекомбинантных белков SAV-RGD. Структуры полученных гибридных белков подтверждают методом масс-спектрометрии (MALDI-TOF MS). Гомогенность рекомбинантных белков подтверждают электрофорезом в денатурирующем полиакриламидном геле. Чистота полученного препарата рекомбинантных белков SAV-RGD, полученного указанным способом, составляла не менее 97%.
Для получения препарата для приготовления лекарственного средства для лечения меланомы человека полученный раствор очищенного рекомбинантного белка SAV-RGD лиофилизуют. Лиофилизацию осуществляют, разливая раствор во флаконы, замораживают раствор при температуре предпочтительно -70°С и помещают в лиофильную сушку. Процесс лиофильного высушивания проводят в течение 10-16 часов в вакууме. По окончании высушивания флаконы запаковывают. Хранение лиофилизированного препарата осуществляют при температуре 4°С.
Краткое описание чертежей
На Фиг. 1 приведено схематическое изображение плазмиды pSAV - RGD, содержащей гибридный ген pro-sav-rgd. Pudp - промотор гена уридинфосфорилазы из Е. coli, рrо-sav - ген предшественника стрептавидина (про-стрептавидин) из Streptomyces avidinii, rgd - искусственный ген меланома-адресующего пептида, АРr - ген устойчивости к ампициллину (бета-лактамаза).
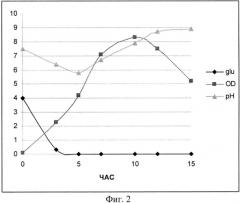
На Фиг. 2 показана динамика роста штамма-продуцента рекомбинантного белка SAV-RGD (контрольная ферментация). Glu - содержание глюкозы в среде культивирования (г/л); OD - оптическая плотность суспензии клеток при 600 нм; рН - значение рН среды культивирования.
На Фиг. 3 показана кинетика накопления целевого продукта - рекомбинантного белка SAV-RGD (мг/л) в условиях контрольной ферментации.
На Фиг. 4 показано содержание рекомбинантного белка SAV-RGD мг в пересчете на единицу биомассы в условиях контрольной ферментации.
На Фиг. 5 показана динамика роста штамма-продуцента рекомбинантного белка SAV-RGD в 1,5-литровом ферментере при рН-статировании. Glu - содержание глюкозы в среде культивирования (г/л); OD - оптическая плотность суспензии клеток при 600 нм; рН - значение рН среды культивирования.
На Фиг. 6 показана кинетика накопления целевого продукта - рекомбинантного белка SAV-RGD (мг/л) в 1,5-литровом ферментере при рН-статировании.
На Фиг. 7 показано содержание рекомбинантного белка SAV-RGD мг в пересчете на единицу биомассы в 1,5-литровом ферментере при рН-статировании.
На Фиг. 8 показана динамика роста штамма-продуцента рекомбинантного белка SAV-RGD в 1,5-литровом ферментере при сниженном уровне аэрации. Glu - содержание глюкозы в среде культивирования (г/л); OD - оптическая плотность суспензии клеток при 600 нм; рН - значение рН среды культивирования.
На Фиг. 9 показана кинетика накопления целевого продукта - рекомбинантного белка SAV-RGD (мг/л) в 1,5-литровом ферментере при сниженном уровне аэрации.
На Фиг. 10 показано содержание рекомбинантного белка SAV-RGD мг в пересчете на единицу биомассы в 1,5-литровом ферментере при сниженном уровне аэрации.
На Фиг. 11 показана динамика роста штамма-продуцента рекомбинантного белка SAV-RGD в 1,5-литровом ферментере в условиях подпитки источниками углерода и аминокислот. Glu - содержание глюкозы в среде культивирования (г/л); OD - оптическая плотность суспензии клеток при 600 нм; рН - значение рН среды культивирования.
На Фиг. 12 показана кинетика накопления целевого продукта - рекомбинантного белка SAV-RGD (мг/л) в 1,5-литровом ферментере в условиях подпитки источниками углерода и аминокислот.
На Фиг. 13 показано содержание рекомбинантного белка SAV-RGD мг в пересчете на единицу биомассы в 1,5-литровом ферментере в условиях подпитки источниками углерода и аминокислот.
На Фиг. 14 показана оценка чистоты рекомбинантного белка SAV-RGD, очищенного методом аффинной хроматографии (А) и ионообменной хроматографии (Б), с помощью ВЭЖХ.
На Фиг. 15 показаны результаты эксперимента по оценке эффективности связывания рекомбинантного белка SAV-RGD клетками меланомы человека линии Me Wo.
Рекомбинантная плазмида pSAV-RGD, представленная на фиг. 1, состоит из следующих фрагментов ДНК:
1) последовательность с 1 нуклеотида по 404 нуклеотид (н.) включает фрагмент ДНК размером 404 п. о., содержащий фрагмент ДНК плазмиды pUC18 с 1н. по 404 н.
2) последовательность с 405 н. по 455 н. включает фрагмент ДНК размером 51 п. о., содержащий ген RGD.
3) последовательность с 456 н. по 461 н. включает синтетический фрагмент ДНК размером 6 п. о., содержащий синтетический полилинкер;
4) последовательность с 462 н. по 1010 н. включает фрагмент ДНК размером 549 п. о., содержащий ген прострептавидина, SAV (последовательность, кодирующая стоп-кодон, отсутствует);
5) последовательность с 1011 н. по 1017 н. включает фрагмент ДНК размером 6 п. о., содержащий синтетический полилинкер;
6) последовательность с 1018 н. по 1196 н. включает фрагмент ДНК размером 180 п. о., содержащий последовательность промотора уридинфосфорилазы Е. coli, Pudp;
7) последовательность с 1197 н. по 3433 н. включает фрагмент ДНК плазмиды pUC18 с 450 н. по 2686 н. размером 2237 п. о., содержащий промотор гена β-лактамазы (P(BLA)), ген устойчивости к ампициллину (АРr), последовательность, ответственную за репликацию плазмиды (ori) и lac промотер (P(LAC)).
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие никоим образом не ограничивающие настоящее изобретение Примеры.
ПРИМЕРЫ
Пример 1. Конструирование гена SAV-RGD и создание плазмид pSAV-RGD.
Для получения слитых генов необходимо получение гена стрептавидина (SAV) и генов RGD-coдержащего олигопептида (RGD). Нуклеотидная последовательность кодирующей цепи ДНК гена RGD: GCGGGTGCAGATGGCTTCCCAGGTTGCCGTGGTGATTGCAGTCAGGAATGA
Ген RGD-содержащего олигопептида получали путем отжига и PCR-достройки синтетических олигонуклеотидов RGD_F (5'-GCGATCTAGAGCGGGTGCAGATGGCTTCCCAGGTTGCCGTGGTG-3') и RGD_R (5'-TGACAAGCTTTCATTCCTGACTGCAATCACCACGGCAACCTGGGAAG-3')
Реакционная смесь имела следующий состав: 10х буфер для ПЦР (конечная концентрация в смеси: 75mM Tris-HCl (рН 8.8 at 25°С), 20 mМ (NH4)2S04, 0.01% (v/v) Tween 20) - 2 мкл, 25 mМ MgC12 (конечная концентрация - 3 mМ) - 3 мкл, 1.25 mМ dNTP (конечная концентрация - 0.125 mМ) - 2 мкл, праймеры - по 10 pmol на реакцию каждого, Taq-полимераза - 5 ед. акт. на реакцию, mQ Н20 - до 20 мкл. Амплификация включала: предварительную денатурацию при 94°С в течение 2 мин, 5 циклов (денатурация 94°С - 10 сек., отжиг праймеров 65°С - 10 сек, элонгация 72°С - 20 секунд), заключительная элонгация 72°С - 2 минуты. Последовательности нуклеотидов, полученные таким образом, содержали сайты расщепления эндонуклеазами рестрикции Xbal и Hindlll для лигирования с вектором.
После проведения ПЦР полученные фрагменты ДНК осаждали 3,5 объемами 96% этанола с добавлением 1/10 по объему 3 М ацетата натрия (рН 5,0) в течение 30 минут на -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, осадок промывали 70% этанолом, затем центрифугировали еще 5 минут при 13400 об/мин и высушивали на вакуумной сушке.
Для получения слитых генов в составе вектора pUC18 под контролем промотора уридинфосфорилазы E. coli (Pudp) использовали вектор pLSAVdS(H), аналогичной плазмиде pflSAV19 [Гулько Л.Б., Дьяков Н.А., Окорокова Н.А., Вейко В.П., Дебабов В.Г. (1999) Биотехнология, 4, с. 3-8]. Данный вектор содержит ген стрептавидина (последовательность, кодирующая стоп-кодон, отсутствует) под контролем промотора уридинфосфорилазы Е. coli (Pudp).
Затем проводили совместное расщепление вектора и фрагмента эндонуклеазами рестрикции Xbal и Hindlll. Реакционная смесь рестрикции имела следующий состав: плаз-мида - 6 мкл (900 нг); фрагмент - 5 мкл (100 нг); 10х буфер Trango Yellow+(Fermentas (Литва) (конечная концентрация в смеси: 33 mM Tris-acetate, рН 7,9, 10 mМ Mg-acetate, 66 mМ K-acetate, 0,1 mg/ml BSA) - 2 мкл; рестриктаза XbaI - 1 мкл (10 ед.акт.); рестриктаза Hindlll - 1 мкл (10 ед.акт.); mQ Н2O - 5 мкл. Молярное соотношение вектор: фрагмент в смеси составило 1:5. Рестрикцию проводили при 37°С в течение 1 часа.
После проведения расщепления ДНК осаждали 3,5 объемами 96% этанола в присутствии 0,3М ацетата натрия (рН 5,0) в течение 30 минут при -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, промывали осадок 70% этанолом и высушивали.
Полученную смесь расщепленных гена и плазмиды лигировали в течение 1 часа при 22 °С. Реакционная смесь лигирования имела следующий состав: 10х буфер для лигирования (Fermentas (Литва); конечная концентрация в смеси: 40 mM Tris-HCl, 10 mМ MgC12, 10 mМ DTT, 2,5 mМ АТР (рН 7.8 при 2°С)) - 2 мкл, расщепленные по сайтам Xbal и Hindlll вектор pLSAVdS(H) и ген RGD в молярном соотношении 1:5-15 мкл, Т4-лигаза - 2 мкл (10 ед.акт.), mQ Н2O - 1 мкл. После проведения лигирования ДНК в составе лигазной смеси осаждали 3,5 объемами 96% этанола в присутствии 0,3 М ацетата натрия (рН 5,0) в течение 30 минут при -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, осадок промывали 70% этанолом, осаждали центрифугированием и высушивали.
Далее лигазной смесью трансформировали компетентные клетки штамма E. coli JM110 и рассевали на чашке Петри с агаризованной средой LB, содержащей 100-150 мг/л ампициллина. Переосажденную лигазную смесь добавляли к компетентным клеткам. Количество ДНК, использовавшейся для трансформации, составляло около 300 нг в пересчете на плазмидную ДНК), 40 минут инкубировали на ледяной бане, далее 2 минуты при 42°С, потом добавляли по 1 мл среды LB, 1 час инкубировали при 32-37°С и рассевали клетки по чашке. Чашки инкубировали при 32-37°С в течение ночи.
Скрининг выросших клонов осуществляли с помощью ПЦР с использованием праймеров M13F (5-TAACTAGTACGCAAGTTCACG-3') и Seq2SAV (5'-AGACCGCTTCTGCGTTCTG-3'). Реакционная смесь имела следующий состав: 10х буфер для ПЦР (конечная концентрация в смеси: 75 mM Tris-HCl (рН 8.8 при 25°С), 20 mМ (NH4)2S04, 0.01% (v/v) Tween 20) - 2 мкл, 25 mМ MgC12 (конечная концентрация - 3 mМ) - 2,4 мкл, 1.25 mМ dNTP (конечная концентрация - 0.125 mМ) - 2 мкл, праймеры - по 5 pmol на реакцию каждого, клетки с колонии, суспендированные в стерильной воде, - 1 мкл на реакцию, Taq-полимераза - 5 ед. акт. на реакцию, mQ Н2O - до 20 мкл. Амплификация включала: предварительную денатурацию при 94°С в течение 2 мин, 25 циклов` (денатурация 94°С - 10 сек, отжиг праймеров 60°С - 10 сек, элонгация 72°С - 10 секунд), заключительная элонгация 72°С - 2 минуты.
После проведения ПЦР реакционную смесь подвергали электрофоретическому разделению в 3% агарозном геле, содержащем этидий бромид. Наличие слитого гена в ДНК бактериальных клеток идентифицировали по наличию светящихся продуктов ПЦР-амплификации требуемого размера (около 150 п. о.).
Колонии, продемонстрировавшие положительный ответ при ПЦР-скрининге, высевали в жидкую среду LB, содержащую 100-150 мг/л ампициллина, и культивировали при 32-37°С в течение ночи при покачивании.
На следующий день клетки осаждали центрифугированием (3-5 минут при 4500-6000 об/мин) и выделяли плазмидные ДНК при помощи набора GeneJETTM Plasmid Miniprep Kit (Fermentas, Литва). Схематическое изображение плазмиды pSR представлено на фиг. 1.
Пример 2. Получение штаммов E. coli MG1655/pSAV-RGD - продуцента рекомбинантного слитого белка SAV-RGD
Полученную на предыдущем этапе плазмиду pSAV-RGD секвенировали на участке, содержащем ген RGD. Реакцию секвенирования проводили на амплификаторе Eppendorf (Германия) по следующей программе: предварительная денатурация 94°С - 2 мин, 25 циклов (денатурация 94°С - 10 сек, отжиг праймеров 60°С - 10 сек, элонгация 72°С - 20 секунд), заключительная элонгация 72°С - 5 минут. Секвенирование проводили с помощью следующих праймеров: Seq2SAV и M13F. Реакционная смесь имела следующий состав: 10х буфер для секвенирования - 1 мкл, праймер - по 10 pmol на реакцию, плазмида -200 нг на реакцию, радиоактивная метка (α32P-dATP, активность 250 mkKu) - 1 мкл, ди-дезоксирибонуклеозидтрифосфаты-терминаторы - 2 мкл (свой в каждую реакцию), Taq-полимераза - 1 мкл (10 ед.акт.), mQ Н2O - до 8 мкл. Остановка реакции осуществлялась добавлением реагента StopSolution. Далее продукты реакции секвенирования прогревали до 95°С и наносили на 5% полиакриламидный гель с мочевиной. Электорофорез проводили в течение 2-3 часов. После этого гель вымачивали 20 минут в 10% уксусной кислоте, переносили на лист 3 мм ватмана и высушивали на гель-драйере. Далее гель закладывали в кассету с рентгеновской пленкой и оставляли на ночь в полной темноте. На следующий день пленку проявляли, последовательность нуклеотидов читали вручную, оценку проводили в программе VectorNTI 8.0 (Invitrogen, США). Плазмидой с выверенной нуклеотидной последовательностью трансформировали штамм E. coli MG1655. Трансформацию проводили химическим методом: плазмиду в количестве 20 нг добавляли в компетентные клетки, смесь 40 минут инкубировали сначала на ледяной бане, затем 2 минуты при 42°С, потом добавляли по 1 мл среды LB, 1 час инкубировали при 32-37°С и рассевали клетки на чашке Петри со средой LB с агаром, содержащей 100-150 мг/л ампициллина. Чашки инкубировали при 37°С в течение ночи.
В результате вышеописанных процедур получали штамм E. coli MG1655/p SAV-RGD - продуцент гибридного белка SAV-RGD.
Пример 3. Подготовка стерильных питательных сред.
Стерильная среда LB
| Стерильная среда имеет следующий состав | (г/л): |
| Бакто-триптон Дифко | 10,0 |
| Бакто-дрожжевой экстракт Дифко | 5,0 |
| NaCl | 10,0 |
Среду готовят в мерном стакане емкостью 1000 мл, в который наливают 900 мл дистиллированной воды, добавляют навеску бакто-триптона (10 г), бакто-дрожжевого экстракта (5 г), натрий хлористого (10 г), перемешивают. рН среды доводят 10 N водным раствором NaOH до значения 7,5. Приготовленный раствор переносят в колбу емкостью 2000 мл, закрывают ватно-марлевой пробкой и стерилизуют в течение 20 мин при 121°С в автоклаве (Sanyo MLS 2420 U, Япония). После стерилизации добавляют в асептических условиях стерильный ампициллин (Россия) до концентрации 150 мкг/мл. Среду хранят при комнатной температуре не более 3 месяцев.
Стерильная среда М9++глюкоза
Стерильная среда имеет следующий состав (г/л):
| Бакто-дрожжевой экстракт Дифко | 2,0 |
| Аммоний сернокислый | 4,0 |
| NaCl | 0,6 |
| Калий фосфорнокислый 2-замещенный | 2,0 |
| Магний сернокислый | 0,4 |
| Железо сернокислое | 0,02 |
| Марганец сернокислый | 0,02 |
| Тиамин | 0,04 |
| Глюкоза | 4,0 |
Среду готовят в мерном стакане емкостью 1000 мл, в который наливают 990 мл дистиллированной воды, добавляют навеску бакто-дрожжевого экстракта (2 г), аммоний сернокислый (4 г), натрий хлористого (0,6 г), калий фосфорнокислый 2-замещенный (2 г), магний сернокислый (0,4 г), железо сернокислое (0,02 г), марганец сернокислый (0,02 г), перемешивают. рН среды доводят 10 н. водным раствором NaOH до значения 7,0-7,2. Приготовленный раствор переносят в колбу емкостью 2000 мл, закрывают ватно-марлевой пробкой и стерилизуют в течение 20 мин при 121°С в автоклаве (Sanyo MLS 2420 U, Япония). После стерилизации добавляют в асептических условиях стерильный ампициллин (Россия) до концентрации 150 мкг/мл и стерильный тиамин до концентрации 0,04 г/л. Среду хранят при комнатной температуре не более 3 месяцев.
Для приготовления 40% раствора глюкозы в 100 мл дистиллированной воды растворяют 40 г глюкозы и стерилизуют в течение 15 мин при 115°С в автоклаве (Sanyo MLS 2420 U, Япония). Раствор хранят при комнатной температуре не более 6 месяцев.
Перед употреблением к стерильной среде добавляют в асептических условиях 10 мл стерильного 40% раствора глюкозы. Полученная среда с глюкозой не подлежит хранению.
Пример 4. Оптимизация процесса культивирования штамма-продуцента путем рН-статирования среды культивирования.
При проведении культивирования (контрольное, моделирующее процесс на лабораторном уровне «колба-ферментер») использовали среду следующего состава: М9++глюкоза, выбранную ранее как оптимальную для лабораторных экспериментов, которая содержала 2 г/л дрожжевого экстракта, 4 г/л глюкозы и 200 мкг/мл ампициллина. При внесении посевного материала контролировали оптическую плотность до достижения значения OD600, равного 0,09. Скорость мешалки поддерживали равной 750 об/мин. Принудительную аэрацию проводили путем подачи 1 V воздуха на V среды (1,5 л/мин). Следует отметить, что при таком режиме по показаниям датчика содержание растворенного кислорода снижалось в течение первых 5 часов (до мин. значения 15%), зате