Способы комбинированной терапии для лечения пролиферативных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для получения лекарственного средства для лечения пролиферативного заболевания у индивидуума. Для этого применяют композицию, содержащую наночастицы таксана и белка-носителя в комбинации с эффективным количеством по меньшей мере одного другого средства, выбранного из децитабина и азацитидина. Причем азацитидин пригоден для перорального введения. Также предложен набор для лечения пролиферативного заболевания. Группа изобретений обеспечивает лечение заболеваний за счет синергетического действия композиции, содержащей наночастицы таксана и белка-носителя в комбинации с децитабином. 2 н. и 39 з.п. ф-лы, 3 табл., 7 ил., 11 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет преимущество приоритета на основании предварительных заявок на выдачу патента № 61/352333, поданной 7 июня 2010 г., и 61/446909, поданной 25 февраля 2011 г., содержание каждой из которых включено в настоящее описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам и композициям для лечения пролиферативных заболеваний, включающим в себя введение комбинации таксана и, по меньшей мере, одного другого терапевтического средства, применимого для лечения пролиферативных заболеваний.
УРОВЕНЬ ТЕХНИКИ
Злокачественная опухоль является лидирующей причиной смертности во всем мире. Несмотря на значительные успехи в области химиотерапии, многие из наиболее распространенных форм злокачественной опухоли все еще резистентны к химиотерапевтическому вмешательству.
Рак молочной железы является наиболее распространенной формой злокачественной опухоли у женщин. Судя по оценкам, в 2009 году ожидается диагностирование 192370 новых случаев инвазивного рака молочной железы у женщин в США, наряду с 62280 новыми случаями неинвазивного (in situ) рака молочной железы. Предполагается, что примерно 40170 женщин умрут в 2009 году от рака молочной железы.
Трижды негативный рак молочной железы является подтипом рака молочной железы, который является клинически негативным в отношении экспрессии рецептора эстрогена (ER), рецепторов прогестерона (PR) и белка HER2. Поскольку трижды негативные злокачественные клетки молочной железы не экспрессируют ни один из указанных рецепторов, они обычно не реагируют на стандартные опосредованные рецепторами обработки. В настоящее время химиотерапия является наиболее эффективным лечением пациентов с трижды негативным раком молочной железы. Однако многие пациенты продолжат страдать от рецидивов и умирают, несмотря на инвазивную терапию, что подчеркивает необходимость в новых терапевтических методиках.
Эпигенетические изменения в геноме вносят вклад в инициацию и прогрессирование злокачественной опухоли. Например, гипоацетилирование гистонов и аномальное метилирование ДНК в промоторных областях важных генов может приводить к сайленсингу генов. Множество генов являются метилированными и, следовательно, молчащими в злокачественной опухоли молочной железы. Pu RT. Mod. Path., 2003. Были исследованы функции эпигенетических модификаторов при лечении различных злокачественных опухолей. Cooper et al., Gynecol. Oncol. 2007, 104(3):596-601;Ramalingam et al., J. Clin. Oncology, 2006 ASCO Annual Meeting Proceedings, Part I., Vol. 24 (18S); и Kim MS, Cancer Res 2003.
Было показано, что таксаны (такие как паклитаксел и доцетаксел) оказывают значимое антинеопластическое и противораковое действие на широкий круг злокачественных опухолей. Например, паклитаксел действует, препятствуя нормальной функции разрушения микротрубочек. Паклитаксел связывается с бета-субъединицей тубулина, строительными блоками микротрубочек, вызывая гиперстабилизацию структур микротрубочек. Полученная в результате структура паклитаксел/микротрубочки неспособна к разборке, приводя тем самым к задержке митоза и ингибируя ангиогенез. Однако плохая растворимость таксанов в воде представляет собой значительную проблему для разработки эффективных, основанных на таксанах, терапевтических средств против злокачественных опухолей. Кроме того, взаимодействие разных препаратов таксанов с другими терапевтическими средствами в контексте комбинированной терапии еще необходимо исследовать.
Композиции, содержащие наночастицы на основе альбумина, были разработаны в качестве системы доставки для того, чтобы доставлять по существу не растворимые в воде лекарственные средства, такие как таксаны. См., например, патенты США № 5916596, 6506405, 6749868 и 6537579 и 7820788, а также публикации патентов США № 2007/0082838. В методике применения наночастиц на основе альбумина используют природные свойства белка альбумина транспортировать и доставлять по существу не растворимые в воде лекарственные средства в место, пораженное заболеванием. Такие наночастицы легко включаются в собственные процессы транспорта в организме, и способны использовать привлечение опухолями альбумина, обеспечивая возможность доставки более высоких концентраций активного лекарственного средства, инкапсулированного в наночастицах, к участку-мишени. Кроме того, методика использования основанных на альбумине наночастиц предоставляет возможность повысить растворимость лекарственного средства, избегая необходимости в применении токсических химических веществ, таких как растворители, в процессе введения, таким образом потенциально повышая безопасность за счет исключения связанных с растворителями побочных эффектов.
Другие публикации включают заявки PCT № WO08/057562, WO2009126938A1, WO2009126401A1, WO2009126175A1.
Описания всех публикаций, патентов, заявок на выдачу патента и опубликованных заявок на выдачу патента, упоминаемых в настоящем описании, включены при этом в настоящую публикацию виде ссылки в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам комбинированной терапии для лечения пролиферативного заболевания (такого как злокачественная опухоль), включающим в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел) и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке (также называемого в настоящем описании «эпигенетическим модификатором» или «другим средством»). В некоторых вариантах изобретение относится к способу лечения пролиферативного заболевания (такого как злокачественная опухоль) у индивидуума, включающему в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие паклитаксел, покрытый альбумином (такой как абраксан® или «наб-паклитаксел»), и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке. В некоторых вариантах другое средство модифицирует (например, ингибирует) метилирование ДНК. В некоторых вариантах другое средство модифицирует модификацию гистонов, которая включает без ограничения ацетилирование гистонов, метилирование гистонов, сумоилирование гистонов и фосфорилирование гистонов. В некоторых вариантах другое средство является ингибитором ДНК-метилтрансферазы (таким как азацитидин). В некоторых вариантах другое средство является ингибитором ДНК-метилтрансферазы (таким как децитабин). В некоторых вариантах другим средством является ингибитор деацетилазы гистонов (такой как вориностат).
В некоторых вариантах пролиферативное заболевание является резистентным или рефрактерным к лечению таксаном при его введении отдельно или в сочетании с другим средством, отличным от эпигенетического модификатора. В некоторых вариантах пролиферативное заболевание является резистентным или рефрактерным к лечению, когда эпигенетический модификатор вводят отдельно или в сочетании с другим средством, отличным от композиции, содержащей наночастицы (такой как не содержащая наночастиц композиция таксана, включая паклитаксел).
В некоторых вариантах композицию, содержащую наночастицы (также называемую «композицией на основе наночастиц») и другое средство вводят одновременно, либо в одной и той же композиции, либо в виде отдельных композиций. В некоторых вариантах композиция на основе наночастиц и другое средство вводят последовательно, т.е., композицию на основе наночастиц вводят либо до, либо после введения другого средства.
В некоторых вариантах введение композиции на основе наночастиц и другого средства осуществляют одновременно, т.е., период введения композиции на основе наночастиц и период введения другого средства перекрываются друг с другом. В некоторых вариантах композицию на основе наночастиц вводят в течение, по меньшей мере, одного цикла (например, по меньшей мере, в течение любого количества 2, 3 или 4 циклов) перед введением другого средства. В некоторых вариантах другое средство вводят в течение, по меньшей мере, одной, двух, трех или четыре недель после прекращения введения композиции на основе наночастиц. В некоторых вариантах композицию на основе наночастиц и эпигенетический модификатор вводят на протяжении одних и тех же циклов лечения.
В некоторых вариантах введение композиции на основе наночастиц и другого средства осуществляют не одновременно. Например, в некоторых вариантах введение композиции на основе наночастиц прекращают перед введением другого средства. В некоторых вариантах введение другого средства прекращают перед введением композиции на основе наночастиц.
В некоторых вариантах другое средство представляет собой ингибитор деацетилазы гистонов, включая без ограничения вориностат, ромидепсин, панобиностат, белиностат и энтиностат. В некоторых вариантах другое средство представляет собой ингибитор ДНК-метилтрансферазы, включая без ограничения 5-азацитидин (азацитидин или видаза), 5-аза-2'-дезоксицитидин (децитабин или дакоген), 1-β-D-арабинофуранозил-5-азацитозин, дигидро-5-азацитидин, антисмысловой олигонуклеотид MG98 и зебуларин.
Таким образом, например, в некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль), включающий в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), и белок-носитель (такой как альбумин), и b) эффективного количества вориностата. В некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль), включающий в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), и белок-носитель (такой как альбумин), и b) эффективного количества азацитидина. В некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль), включающий в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), и белок-носитель (такой как альбумин), и b) эффективного количества децитабина.
В некоторых вариантах предлагается способ лечения рака молочной железы у индивидуума, включающий в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке. В некоторых вариантах предлагается способ лечения рака молочной железы у индивидуума, при этом индивидуум является негативным в отношении ER, PR и HER2, включающий в себя введение индивидууму a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке. В некоторых вариантах способ дополнительно включает в себя проведение окончательной операции в пределах примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 после предоперационной терапии.
Способы согласно изобретению обычно включают в себя введение композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел) и белок-носитель. В некоторых вариантах композиция на основе наночастиц содержит наночастицы, содержащие паклитаксел и альбумин. В некоторых вариантах наночастицы в композиции, описанной в настоящей публикации, имеют средний диаметр не более чем примерно 200 нм, включая, например, не больше чем примерно 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70 или 60 нм. В некоторых вариантах, по меньшей мере, примерно 50% (например, по меньшей мере, примерно 60%, 70%, 80%, 90%, 95% или 99%) всех наночастиц в композиции имеют диаметр не больше чем примерно 200 нм, включая, например, не больше чем примерно 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70 или 60 нм. В некоторых вариантах, по меньшей мере, примерно 50% (например, по меньшей мере, 60%, 70%, 80%, 90%, 95% или 99%) всех наночастиц в композиции находятся в пределах диапазона примерно от 20 до примерно 400, включая, например, примерно от 20 до примерно 200 нм, примерно от 30 до примерно 180 нм, и в пределах любого из диапазонов примерно от 40 до примерно 150, примерно от 50 до примерно 120, и примерно от 60 до примерно 100 нм.
В некоторых вариантах белок-носитель имеет сульфгидрильные группы, которые могут образовывать дисульфидные связи. В некоторых вариантах, по меньшей мере, примерно 5% (включая, например, по меньшей мере, примерно 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80% или 90%) белка-носителя в состоящей из наночастиц части композиции поперечно связаны (например, поперечно связаны одной или несколькими дисульфидными связями).
В некоторых вариантах наночастицы содержат таксан (такой как паклитаксел), покрытый белком-носителем, таким как альбумин (например, сывороточный альбумин человека). В некоторых вариантах композиция содержит таксан как в форме наночастиц, так и не в форме наночастиц, при этом, по меньшей мере, примерно 50%, 60%, 70%, 80%, 90%, 95% или 99% таксана в композиции находится в форме наночастиц. В некоторых вариантах таксан в наночастицах составляет более чем примерно 50%, 60%, 70%, 80%, 90%, 95% или 99% наночастиц по массе. В некоторых вариантах наночастицы содержат сердцевину из таксана, которая по существу не содержит полимерных материалов (таких как полимерный матрикс).
В некоторых вариантах композиция на основе наночастиц по существу не содержит (например, не содержит) поверхностно-активных веществ (таких как кремофор®, твин 80 или других органических растворителей, используемых для введения таксанов). В некоторых вариантах композиция на основе наночастиц содержит менее чем примерно 20%, 15%, 10%, 7,5%, 5%, 2,5%, или 1% органического растворителя. В некоторых вариантах массовое отношение белка-носителя (такого как альбумин) к таксану в композиции на основе наночастиц составляет примерно 18:1 или меньше, например, примерно 15:1 или меньше, например, примерно 9:1 или меньше. В некоторых вариантах массовое отношение белка-носителя (такого как альбумин) к таксану в композиции находится в диапазоне примерно от 1:1 до примерно 18:1, примерно от 2:1 до примерно 15:1, примерно от 3:1 до примерно 13:1, примерно от 4:1 до примерно 12:1, примерно от 5:1 до примерно 10:1, примерно 9:1. В некоторых вариантах массовое отношение белка-носителя к таксану в состоящей из наночастиц части композиции составляет примерно 1:2, 1:3, 1:4, 1:5, 1:9, 1:10, 1:15 или меньше.
В некоторых вариантах состоящая из частиц композиция имеет одну или несколько из перечисленных выше характеристик.
В некоторых вариантах композицией наночастиц является абраксан®. Композиции на основе наночастиц, содержащие другие таксаны (такие как доцетаксел и ортатаксел) также имеют одну или несколько из перечисленных выше характеристик.
Таким образом, например, в некоторых вариантах предлагается способ лечения рака молочной железы (такой как трижды негативный рак молочной железы), включающий в себя введение указанному индивидууму a) эффективного количества абраксана®, и b) эффективного количества ингибитора деацетилазы гистонов. В некоторых вариантах, предлагается способ лечения рака молочной железы (такого как трижды негативный рак молочной железы), включающий в себя введение указанному индивидууму a) эффективного количества абраксана® и b) эффективного количества ингибитора ДНК-метилтрансферазы. В некоторых вариантах предлагается способ лечения рака молочной железы (такого как трижды негативный рак молочной железы), включающий в себя введение указанному индивидууму a) эффективного количества абраксана®, и b) эффективного количества вориностата. В некоторых вариантах способ дополнительно включает в себя введение индивидууму эффективного количества основанного на платине средства.
В некоторых вариантах предлагается способ лечения рака молочной железы (такой как трижды негативный рак молочной железы), включающий в себя: a) внутривенное введение индивидууму эффективного количества абраксана®, и b) пероральное введение индивидууму эффективного количества вориностата. В некоторых вариантах способ дополнительно включает в себя внутривенное введение индивидууму эффективного количества основанного на платине средства (такого как карбоплатин). В некоторых вариантах предлагается способ лечения рака молочной железы (такого как трижды негативный рак молочной железы), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 100 мг/м2) абраксана®, и b) пероральное введение индивидууму примерно от 200 до примерно 500 мг (например, примерно 400 мг) вориностата. В некоторых вариантах способ дополнительно включает в себя внутривенное введение индивидууму эффективного количества основанного на платине средства (такого как карбоплатин) в дозе AUC2.
В некоторых вариантах предлагается способ лечения рака молочной железы (такого как трижды негативный рак молочной железы), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 100 мг/м2) абраксана® еженедельно, и b) пероральное введение индивидууму примерно от 200 до примерно 500 мг (например, примерно 400 мг) вориностата три дня из каждых семи дней. В некоторых вариантах способ дополнительно включает в себя внутривенное введение индивидууму эффективного количества карбоплатина в дозе AUC2 еженедельно. В некоторых вариантах композицию на основе наночастиц (и карбоплатин) вводят в первый день каждой недели, а вориностат вводят в 1-3 дни каждой недели.
В некоторых вариантах предлагается способ лечения рака легких (такого как немелкоклеточный рак легких (NSCLC)), включающий в себя введение указанному индивидууму a) эффективного количества абраксана®, и b) эффективного количества ингибитора ДНК-метилтрансферазы. В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя введение указанному индивидууму a) эффективного количества абраксана® и b) эффективного количества децитабина.
В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму эффективного количества абраксана® и b) внутривенное введение индивидууму эффективного количества децитабина. В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 90 или 100 мг/м2) абраксана®, и b) внутривенное введение индивидууму примерно от 1 мг/м2 до примерно 15 мг/м2 (например, 4,5 мг/м2) децитабина.
В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 100 мг/м2) абраксана®, и b) внутривенное введение индивидууму примерно от 5 мг/м2 до примерно 100 мг/м2 (например, 15 мг/м2) децитабина.
В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 90 или 100 мг/м2) абраксана® в течение пяти следующих друг за другом дней, и b) внутрибрюшинное введение индивидууму примерно от 1 мг/м2/сутки до примерно 15 мг/м2/сутки (например, 4,5 мг/м2/сутки) децитабина два раза в сутки в течение пяти следующих друг за другом дней.
В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 100 мг/м2) абраксана® в неделю, и b) внутривенное введение индивидууму примерно от 5 мг/м2 до примерно 100 мг/м2 (например, 15 мг/м2) децитабина каждые восемь часов в течение трех следующих друг за другом дней. В некоторых вариантах лечение децитабином повторяют каждые шесть недель, проводя четыре или больше циклов.
В некоторых вариантах предлагается способ лечения рака легких (такого как NSCLC), включающий в себя: a) внутривенное введение индивидууму примерно от 80 до примерно 200 мг/м2 (например, примерно 100 мг/м2) абраксана® в неделю, и b) внутривенное введение индивидууму примерно от 5 мг/м2 до примерно 100 мг/м2 (например, 20 мг/м2) децитабина ежедневно в течение пяти следующих друг за другом дней. В некоторых вариантах лечение децитабином повторяют каждые четыре недели, проводя четыре или больше циклов.
Также предлагаются наборы и композиции, применимые в способах, описанных в настоящей публикации.
Способы, предлагаемые в настоящей заявке, применимы для лечения различных заболеваний, включая, например, рак молочной железы, рак легких (такой как мелкоклеточный рак легких и немелкоклеточный рак легких), рак почек, рак мочевого пузыря, рак поджелудочной железы, рак яичника, рак простаты, рак головного мозга, рак прямой и ободочной кишки, лейкоз, лимфома и множественная миелома. В некоторых вариантах пролиферативным заболеванием является солидная опухоль. В некоторых вариантах пролиферативным заболеванием является несолидная опухоль.
Указанные и другие аспекты и преимущества настоящего изобретения станут очевидными из последующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что одно, несколько или все свойства различных вариантов, описанных в настоящей публикации, можно сочетать, получая другие варианты осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
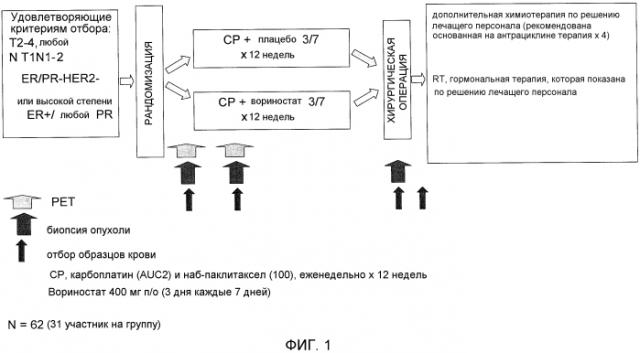
На фигуре 1 показан дизайн исследования лечения карбоплатином и наб-паклитакселом, проводимого с вориностатом или без него, у пациентов с HER2-негативным первичным операбельным раком молочной железы.
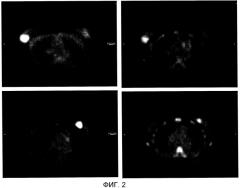
На фигуре 2 показаны результаты ФДГ-ПЭТ перед неоадъювантной терапией и на 7 день после неоадъювантной терапии у 2 пациентов. Для пациента 1 (вверху) показаны результаты ФДГ-ПЭТ перед неоадъювантной терапией (слева), документально подтверждающие правостороннее объемное образование в молочной железе (SUV 12,4), и на 7 день после неоадъювантной терапии (справа), показывающие уменьшение SUV до 6,7. У пациента 1 наблюдали частичный ответ на терапию. Для пациента 2 (внизу) показаны результаты ФДГ-ПЭТ перед неоадъювантной терапией (слева), документально подтверждающие левостороннее объемное образование в молочной железе (SUV 31) и на 7 день после неоадъювантной терапии (справа), показывающие уменьшение SUV до 9,9. У пациента 2 наблюдали полный ответ на терапию.
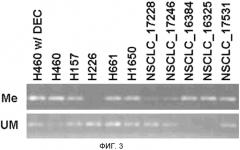
На фигуре 3 показаны типичные примеры анализа специфичной для метилирования ПЦР для SPARC в линиях клеток NSCLC и ксенотрансплантатах NSCLC. Клетки H460 обрабатывали децитабином (5 мкМ) in vitro в течение 3 дней (H460 w/DEC). Продукты ПЦР визуализировали в 1,5% агарозных гелях. Me означает метилированный и UM означает неметилированный.
На фигуре 4 показан Вестерн-блот-анализ, демонстрирующий, что экспрессия SPARC в ксенотрансплантатах и линиях клеток NSCLC подвергается повышающей регуляции при лечении децитабином. На панели A показан Вестерн-блот линий клеток NSCLC A549, H460 и H157, обработанных 5 мкМ децитабина в течение 3 дней in vitro и затем собранных для ПЦР-РВ. На панели B показаны полученные от пациентов (PD) ксенотрансплантаты NSCLC и ксенотрансплантаты H460, обработанные децитабином в дозе 1,5 мг/кг/сутки или без децитабина. Ксенотрансплантаты собирали для анализа экспрессии SPARC. GAPDH использовали в качестве эндогенного контроля. GAPDH означает глицеральдегид-3-фосфатдегидрогеназу.
На фигуре 5 показана эффективность абраксана® по сравнению с таксолом в ксенотрансплантатах PD NSCLC. Мыши SCID, несущие SPARC-позитивные ксенотрансплантаты (NSCLC_16372) (панель A), SPARC-промежуточные ксенотрансплантаты (NSCLC_15946) (панель B), или SPARC-негативные ксенотрансплантаты, NSCLC_16465 (панель C) и NSCLC_16591 (панель D). Клетки обрабатывали наполнителем, токсолом в дозе с эквивалентной токсичностью (13,4 мг/кг) или абраксаном® (30 мг/кг) (ABX). Общую противоопухолевую эффективность лекарственных средств измеряли на основе объема опухолей каждые 2-3 дня. Планки погрешностей представляли стандартную ошибку среднего.
На фигуре 6 показана повышенная противоопухолевая эффективность таксола и абраксана® при предварительной обработке децитабином в SPARC-негативных ксенотрансплантатах. Панели A-C, мышам SCID, несущим SPARC-негативные ксенотрансплантаты, NSCLC_16325 (панель A), NSCLC_16384 (панель B) или H460 (панель C), вводили децитабин (1,5 мг/кг) (DEC), таксол (13,4 мг/кг) или абраксан® (30 мг/кг) (ABX) отдельно или комбинацию децитабина и таксола или децитабина и абраксана®. Общую противоопухолевую эффективность лекарственных средств измеряли на основе объема опухолей каждые 2-3 дня. Планки погрешностей представляли стандартную ошибку среднего.
На фигуре 7 показан анализ показателя гибели клеток в случае линий NSCLC-клеток A549 и H460 in vitro, показывающий аддитивную противоопухолевую активность абраксана® (ABX) или таксола при предварительной обработке децитабином. Панели A и C показывают результаты, полученные на клетках H460, обработанных возрастающими концентрациями абраксана® или таксола после предварительной обработки децитабином в концентрации 5 мкМ. Панели B и D показывают результаты, полученные на клетках A549, обработанных возрастающими концентрациями абраксана® от 0 до 50 нМ или таксола, от 0 до 50 нМ, после предварительной обработки децитабином в концентрации 5 мкМ. Обработанные клетки собирали для анализа показателя гибели клеток (*p<0,05, по сравнению с обработкой абраксаном® или таксолом отдельно). Данные представлены в виде среднего ± стандартное отклонение из трех независимых экспериментов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам комбинированной терапии, включающим в себя первую терапию, включающую введение наночастиц, содержащих таксан (такой как паклитаксел) и белок-носитель (такой как альбумин), вместе со вторым средством, которое модифицирует эпигенетику в клетке (также называемым «эпигенетическим модификатором»).
Авторы предполагают, что комбинированная терапия с использованием композиции на основе наночастиц, содержащей таксан (такой как паклитаксел) и белок-носитель (такой как альбумин) и эпигенетического модификатора может значимо повысить эффективность основанной на таксанах терапии в форме наночастиц и/или эффективность эпигенетического модификатора.
Таким образом, в настоящей заявке предлагаются способы комбинированной терапии. Специалисту в данной области должно быть понятно, что способы комбинированной терапии, описанные в настоящей публикации, требуют того, чтобы одно средство или композиция были введены в сочетании с другим средством. «В сочетании с» относится к введению одного средства лечения в дополнение к другому средству лечения, например, введению композиции на основе наночастиц, описанной в настоящей публикации, в дополнение к введению другого средства одному и тому же индивидууму. По сути «в сочетании с» относится к введению одного средства лечения до, во время или после доставки другого средства лечения индивидууму.
Способы, описанные в настоящей публикации, как правило применимы для лечения пролиферативных заболеваний. В используемом в настоящем описании смысле «лечение» означает способ получения полезных или требуемых клинических результатов. В целях настоящего изобретения полезные или требуемые клинические результаты включают без ограничения любой один или несколько из следующих результатов: облегчение одного или нескольких симптомов, уменьшение степени заболевания, профилактику или замедление распространения заболевания (например, метастазирования, например, метастазов в легкие или в лимфатические узлы), профилактику или задержку рецидива заболевания, задержку или замедление прогрессирования заболевания, ослабление патологического состояния и ремиссию (либо частичную, либо общую). Также термин «лечение» охватывает уменьшение патологических последствий пролиферативного заболевания. Способы согласно изобретению предполагают любой один или несколько таких аспектов лечения.
«Средство, которое модифицирует эпигенетику в клетке» или «эпигенетический модификатор» относится к средству, которое модифицирует эпигенетический статус клетки, а именно фенотип или экспрессию генов в клетке, что вызвано механизмами, отличными от изменений в последовательности ДНК. Эпигенетический статус клетки включает, например, метилирование ДНК, модификацию(ии) гистонов и РНК-ассоциированный сайленсинг.
Термин «индивидуумы, имеющие трижды негативный рак молочной железы», используемый в настоящем описании, относится к индивидуумам, которые являются клинически негативными в отношении экспрессии рецептора эстрогена (ER), рецепторов прогестерона (PR) и белка HER2.
Термин «эффективное количество», используемый в настоящем описании, относится к количеству соединения или композиции, достаточному для лечения конкретного расстройства, состояния или заболевания, например, для ослабления, облегчения, уменьшения и/или замедления одного или нескольких симптомов. В отношении злокачественных опухолей или другой нежелательной пролиферации клеток эффективное количество включает количество, достаточное для того, чтобы вызвать сокращение опухоли и/или уменьшение скорости роста опухоли (например, подавить рост опухоли) или предотвратить или приостановить другую нежелательную пролиферацию клеток.
Термин «индивидуум» означает млекопитающее, включая человека. Индивидуумом является без ограничения человек, корова, лошадь, кошка, собака, грызун или примат. В некоторых вариантах индивидуумом является человек.
Способы могут быть практически осуществлены в условиях адъювантной терапии. Термин «условия адъювантной терапии» относится к клиническим условиям, в которых индивидуум имел пролиферативное заболевание в анамнезе, в частности, злокачественную опухоль, и обычно (но не обязательно) отвечал на терапию, которая включает без ограничения хирургическую операцию (такую как хирургическую резекцию), радиотерапию и химиотерапию. Однако вследствие наличия в анамнезе такого пролиферативного заболевания (такого как злокачественная опухоль) считают, что для таких индивидуумов существует риск развития заболевания. Лечение или введение «в условиях адъювантной терапии» относится к последующему способу лечения. Степень риска (т.е., когда считают, что для индивидуума в условиях адъювантной терапии существует «высокий риск» или «низкий риск») зависит от нескольких факторов, чаще всего от степени заболевания при первом лечении.
Способы, предлагаемые в настоящем описании, также могут быть осуществлены на практике в «условиях неоадъювантной терапии», т.е., способ может быть осуществлен до основной/радикальной терапии. В некоторых вариантах индивидуум ранее был подвергнут лечению. В некоторых вариантах индивидуум ранее не подвергался лечению. В некоторых вариантах лечение является терапией первой линии.
Понятно, что аспект и варианты осуществления изобретения, описанные в настоящей публикации, включают «состоящий» и/или «по существу состоящий» из аспектов и вариантов.
Указание «примерно» в отношении значения или параметра в данном описании включает (и описывает) варианты, которые по сути относятся и к такому значению или параметру. Например, описание, относящиеся к «примерно X» включает описание «X».
В используемом в настоящем описании смысле и в прилагаемой формуле изобретения формы единственного числа включают указания форм множественного числа, если контекст ясно не диктует иное. Понятно, что аспекты и варианты согласно изобретению, описанные в настоящей публикации, включают «состоящие» и/или «по существу состоящие» из аспектов и вариантов.
Способы комбинированной терапии
Настоящее изобретение относится к способам лечения пролиферативного заболевания (такого как злокачественная опухоль) у индивидуума, включающим в себя введение индивидууму: a) эффективного количества композиции, содержащей наночастицы (например, паклитаксела) и белка-носителя (такого как альбумин); и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке.
В некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль) у индивидуума, включающий в себя введение индивидууму: a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел) и белок-носитель (такой как альбумин); и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке, при этом композицию на основе наночастиц и другое средство вводят одновременно. В некоторых вариантах введения композиции на основе наночастиц и другого средства начинают примерно в одно и то же время (например, в пределах любого из следующих периодов: 1, 2, 3, 4, 5, 6 или 7 дней). В некоторых вариантах введения композиции на основе наночастиц и другого средства заканчивают примерно в одно и то же время (например, в пределах любого из следующих периодов: 1, 2, 3, 4, 5, 6 или 7 дней). В некоторых вариантах введение другого средства продолжается (например, в течение примерно любого из следующих периодов: 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев) после прекращения введения композиции на основе наночастиц. В некоторых вариантах введение другого средства начинают после (например, примерно через 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев) начала введения композиции на основе наночастиц. В некоторых вариантах введения композиции на основе наночастиц и другого средства начинают и прекращают примерно в одно и то же время. В некоторых вариантах введения композиции на основе наночастиц и другого средства начинают примерно в одно и то же время и введение другого средства продолжают (например, в течение примерно любого из периодов: 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев) после прекращения введения композиции на основе наночастиц. В некоторых вариантах введение композиции на основе наночастиц и другого средства останавливают примерно в одно и то же время и введение другого средства начинают после (например, примерно через любой из периодов времени: 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев) начала введения композиции на основе наночастиц. В некоторых вариантах введение композиции на основе наночастиц и другого средства останавливают примерно в одно и то же время и введение композиции на основе наночастиц начинают после (например, примерно через любой из периодов времени: 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев) начала введения другого средства.
В некоторых вариантах таксан представляет собой (и в некоторых вариантах по существу состоит из) любой из следующих таксанов: паклитаксел, доцетаксел и ортатаксел. В некоторых вариантах таксаном является паклитаксел. В некоторых вариантах таксаном является доцетаксел. В некоторых вариантах композиция на основе наночастиц содержит абраксан®. В некоторых вариантах композиция на основе наночастиц представляет собой абраксан®.
Таким образом, например, в некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль) у индивидуума, включающий в себя введение индивидууму: a) эффективного количества композиции, содержащей наночастицы, содержащие таксан (такой как паклитаксел), покрытые белком-носителем (таким как альбумин); и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке. В некоторых вариантах наночастицы имеют средний размер 20-400 нм, такой как 40-200 нм. В некоторых вариантах предлагается способ лечения пролиферативного заболевания (такого как злокачественная опухоль) у индивидуума, включающий в себя введение индивидууму: a) эффективного количества абраксана®; и b) эффективного количества, по меньшей мере, одного другого средства, которое модифицирует эпигенетику в клетке. В некоторых вариантах композицию на основе наночастиц (например, абраксан®) и