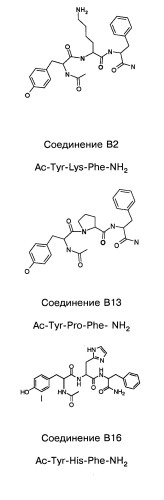
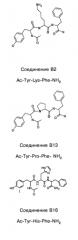
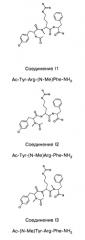
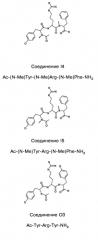
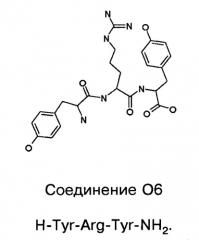
Способ лечения или профилактики ракового заболевания у человека, которое характеризуется повышенным уровнем экспрессии или активности gadd45β по сравнению с обычными здоровыми клетками, в случае зависимости жизнеспособности и/или роста раковых клеток от nf-кв, и трипептид.
Иллюстрации
Показать всеИзобретение относится к применению соединений на основе тетрапептидных и трипептидных групп и соответствующих пептоидных групп при лечении или профилактике ракового заболевания у человека, которое характеризуется повышенным уровнем экспрессии или активности Gadd45β по сравнению с обычными здоровыми клетками, в случае зависимости жизнеспособности и/или роста раковых клеток от NF-κB. 8 н. и 6 з.п. ф-лы, 54 ил., 9 табл., 15 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к раку и другим заболеваниям и нарушениям, например, воспалительным заболеваниям и нарушениям, и их терапевтической модуляции. В частности, изобретение относится к соединениям на основе коротких пептидов, способным модулировать запрограммированную гибель клеток (PCD) и пролиферацию раковых клеток и провоспалительных/аутоиммунных клеток.
Уровень техники
Индукцию апоптоза давно считают способом направленного воздействия на раковые клетки, а также провоспалительные, аутоиммунные клетки и другие больные клетки. Существует ряд клеточных путей, участвующих в запуске гибели клеток, включая путь c-Jun N-концевой киназы JNK. Киназы JNK чувствительны к цитокинам и стрессовым стимулам, таким как ультрафиолетовое излучение, тепловой шок и осмотический шок. Кроме того, в ответ на цитокины и клеточный стресс происходит активация пути NF-κВ. Путь NF-κВ может ингибировать путь JNK посредством взаимного влияния, опосредованного Gadd45β и киназой JNK, активированной митогеном киназы 7 протеинкиназы (NFKK7/JNKK2). Активность MKK7 ингибируется Gadd45β, членом семейства индуцируемых факторов Gadd45 и непосредственной транскрипционной мишенью NF-κВ. Это означает, что Gadd45β опосредует супрессию посредством NF-κВ передачи сигнала JNK путем связывания с MKK7 и ингибирования его активности. См. статью Papa, et al. 2004, Nature Cell Biology 6(2):1462153.
Предложено использование ингибиторов NF-κВ при лечении рака и воспалительных заболеваний. Однако, поскольку NF-κВ обладает рядом активностей, включая участие в PCD, иммунитете, воспалении и развитии тканей, предпочтительно ингибировать специфические функции NF-κВ, а не саму NF-κВ.
Настоящее изобретение относится к ингибированию Gadd45β, которая, как известно, регулируется положительным образом при ряде форм рака и, кроме того, при хронических воспалительных и наследственных нарушениях.
Множественная миелома (ММ), известная также как миелома клеток плазмы или болезнь Калера, представляет собой рак клеток плазмы. Множественная миелома в настоящее время неизлечима, хотя можно вызвать временные ремиссии при использовании стероидов, химиотерапии, талидомида, ингибиторов протеасом (Pis), например, бортецомиба, мелфалана и трансплантатов стволовых клеток. Согласно данным Американского общества борьбы с раковыми заболеваниями в США живет приблизительно 45000 больных множественной миеломой при том, что в США каждый год диагностируют приблизительно 15000 новых случаев. Средний период выживания от времени постановки диагноза составляет приблизительно три года. Множественная миелома является второй наиболее распространенной формой рака крови после лимфомы не-Ходжкина и составляет приблизительно 1% от всех форм рака и приблизительно 2% от всех смертей от рака. Частота множественной миеломы, по-видимому, будет возрастать, и имеется ряд доказательств снижения возраста, в котором начинается развитие заболевания. Таким образом существует явная необходимость в усовершенствованных препаратах для лечения множественной миеломы.
Почти все первичные опухоли множественной миеломы и клеточные линии множественной миеломы проявляют конститутивную активность NF-κВ. Блокирование активности NF-κВ вызывает гибель клеток множественной миеломы. Главным препятствием в достижении долговременных результатов лечения рака при использовании стратегий с направленностью на NF-κВ является отсутствие специфичности и, следовательно, неудовлетворительная переносимость лечения. Это обусловлено плейотропными функциями NF-κВ и протеасом. Существует необходимость в принципиально новом подходе к лечению, который является более специфическим, безопасным и, вследствие этого, более эффективным.
Одной из ключевых функций NF-κВ при множественной миеломе является стимуляция выживаемости. Показано (см. статью De Smaele, et al. (2001) Nature 414:306-313), что NF-κВ обеспечивает цитопротекцию, подавляя каскад JNK МАРК посредством Gadd45β, члена семейства индуцируемых факторов Gadd45. NF-κВ регулирует положительным образом Gadd45β в ответ на различные стимулы и способствует выживаемости путем направленного воздействия на киназу JNK MKK7 (см. статьи Papa, et al. 2004 Nature Cell Biology 6:146-153, Papa, et al. 2007, J. Biol. Chem. 282: 19029-19041, Papa, et al. (2008) J. Cliri. Invest. 118:191-1923).
Ингибиторы протеасом (PIs) и прямые ингибиторы NF-κВ уничтожают клетки множественной миеломы путем активации пути JNK, но непригодны для терапевтического лечения множественной миеломы вследствие их неизбирательных эффектов на NF-κВ и/или неизбирательных эффектов на протеасому, которые препятствуют их использованию в полностью ингибирующих лечебных дозах.
Кроме множественной миеломы Gadd45β экспрессируется на высоких уровнях в других опухолях, включая диффузную круп но клеточную В-клеточную лимфому, лимфому Беркетта, промоноцитарный лейкоз и другие формы лейкоза, а также некоторые солидные опухоли, включая гепатоцеллюларную карциному, рак мочевого пузыря, рак головного мозга и центральной нервной системы, рак молочной железы, рак головы и шеи, рак легкого и рак простаты. Вследствие этого ингибирование Gadd45β в данных опухолях может индуцировать гибель раковых клеток и, таким образом, имеет благоприятные терапевтические эффекты. Известно также, что многие гематологические злокачественные заболевания (в том числе множественная миелома, лимфома из клеток мантии, лимфома MALT, диффузная крупноклеточная В-клеточная лимфома, лимфома Ходжкина, миелодиспластический синдром, Т-клеточный лейкоз взрослых (HTLV-1), хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, острый миелогенный лейкоз и острый лимфоцитарный лейкоз) и солидные опухоли (включая рак молочной железы, рак шейки матки, рак почки, рак легкого, рак толстой кишки, рак печени, рак пищевода, рак желудка, рак гортани, рак щитовидной железы, рак паращитовидной железы, рак мочевого пузыря, рака яичников, рак простаты, рак поджелудочной железы и многие другие формы рака) демонстрируют конститутивную активацию NF-κВ, давая направленные на выживаемость сигналы клеткам посредством PCD, которые могли бы в другом случае привести к повышенному уровню гибели опухолевых клеток (см. статью V.Baud and M.Karin 2009, Nat. Rev. Drug Disc. 8:33-40). Конститутивную активность NF-κВ обнаруживают также в меланоме, цилиндроме, карциноме сквамозных клеток (кожи, а также головы и шеи), карциноме полости рта, эндометриальной карциноме, ретинобластоме, астроцитоме и глиобластоме (см. статью V.Baud and M.Karin 2009, Nat. Rev. Drug Disc. 8: 33-40). Ингибирование Gadd45β в данных опухолях, характеризующихся патологически высокой конститутивной активностью NF-κВ, также может давать благоприятные терапевтические эффекты посредством индукции запрограммированной гибели клеток среди раковых клеток. Настоящее изобретение основано на реализации того факта, что направленность отдельных направленных на выживаемость функций NF-κВ, опосредованная Gadd45β, дает более безопасный, более эффективный способ лечения, чем прямая направленность NF-κВ на ряд заболеваний и нарушений, включая рак, а также другие болезни, характеризующиеся патологической выживаемостью клеток, или болезни, которые можно было бы лечить индукций повышенного уровня PCD (такие как аутоиммунные заболевания, хронические воспалительные заболевания, дегенеративные заболевания, а также ишемические и сосудистые заболевания).
Широкий круг заболеваний и нарушений зависит от активности NF-κВ. В самом деле в настоящее время считают, что патогенез практически каждого известного человеческого заболевания или нарушения зависит от воспаления и, следовательно, включает NF-κВ. Она действует как групповой переключатель воспалительного ответа, координации экспрессии последовательности из более 200 генов, кодирующих цитокины, рецепторы, факторы транскрипции, хемокины, провоспалительные ферменты и другие факторы, включая направленные на выживаемость факторы, которые инициируют и замедляют воспаление. Соединения, соответствующие изобретению, ингибируют отдельную направленную на выживаемость активность NF-κВ при воспалении. Вследствие этого заболевания и нарушения, поддающиеся лечению данными соединениями, включают, кроме распространенных хронических воспалительных заболеваний (таких как воспалительная болезнь кишки, ревматоидный артрит и псориаз), другие заболевания и нарушения, которые в существенной степени зависят от воспалительного компонента. Примеры данных заболеваний и нарушений, которые лечатся противовоспалительными препаратами или препаратами, ингибирующими NF-κВ, или таких, которые, как предполагают, подходят для лечения ингибиторами NF-κВ и которые можно было бы лечить соединением, соответствующим изобретению, включают:
1. Дыхательные пути: обструктивные заболевания дыхательных путей, включая: астму, в том числе бронхиальную, аллергическую, эндогенную, экзогенную, вызываемую физической нагрузкой, вызываемую лекарственными препаратами (включая вызываемую аспирином и NSAID (нестероидными противовоспалительными лекарственными препаратами)) и вызываемую пылью астму, как интермиттирующую, так и постоянную, и всех степеней тяжести, а также другие случаи гиперчувствительности дыхательных путей; хроническое обструктивное легочное заболевание (COPD); бронхит, в том числе инфекционный и эозинофильный бронхит; эмфизему; бронхоэктазию; муковисцидоз; саркоидоз; "легкие фермера" (экзогенный аллергический альвеолит) и подобные заболевания; пневмонит, связанный с гиперчувствительностью; фиброз легкого, в том числе криптогенный фиброзирующий альвеолит, идиопатическое интерстициальное воспаление легких, фиброз как осложнение противоопухолевой терапии и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения при трансплантации легкого; васкулитные и тромботические нарушения легочной сосудистой сети и легочную гипертензию; противокашлевую активность, в том числе лечение хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенный кашель; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, в том числе нейрогенный ринит (сенная лихорадка); назальный полипоз; острую вирусную инфекцию, включая насморк, и инфекцию респираторно-синцитиального вируса, гриппа, коронавируса (в том числе SARS (тяжелый острый респираторный сидром) или аденовируса; либо эозинофильный эзофагит;
2. Кости и суставы: поражения ревматического или подагрического характера, ассоциированные с остеоартритом/остеоартрозом или включающие их, как первичные, так и вторичные, например, врожденная дисплазия тазобедренного сустава; шейный и поясничный спондилит и боль в нижнем отделе спины и шее; остеопороз; ревматоидный артрит и болезнь Стилла; серонегативные спондилоартропатии, включая анкилозирующий спондилит, псориатический артрит, реактивный артрит и недифференцированную спондартропатию; септический артрит и другие связанные с инфекцией артропатии и нарушения костей, такие как туберкулез, включая болезнь Пота и синдром Понсе; острый и хронический кристаллический синовит, включая подагру, заболевание, связанное с отложением пирофосфата кальция, и обусловленное апатитом кальция воспаление сухожилия, бурсы и синовии; болезнь Бехчета; первичный и вторичный синдром Шегрена, системный склероз и ограниченная склеродермия; системная красная волчанка, заболевание комбинированной соединительной ткани и заболевание недифференцированной соединительной ткани; воспалительные миопатии, в том числе дерматомиозит и полимиозит; ревматическая полимиалгия; ювенильный артрит, в том числе идиопатический воспалительный артрит, распространяющийся на любые суставы, и ассоциированные синдромы, и ревматическая лихорадка и ее системные осложнения; васкулиты, включая артериит гигантских клеток, артериит Такаяши, синдром Чин-Страусса, узелковый полиартериит, микроскопический полиартериит и васкулиты, ассоциированные с вирусной инфекцией, реакции гиперчувствительности, криоглобулины и парапротеины, боль в нижней области спины; семейная средиземноморская лихорадка, синдром Макла-Уэллса, семейная ирландская лихорадка, болезнь Кикучи; вызываемые лекарственными препаратами арталгии, тендиниты и миопатии;
3. Боль и ремоделирование соединительных тканей при скелетно-мышечных нарушениях, обусловленных повреждением [например, спортивной травмой]
или заболеванием: артритом (например, ревматоидным артритом, остеоартритом, подагрой или кристаллической артропатией), другим заболеванием суставов (таким как дегенерация межпозвоночного диска или дегенерация височно-нижнечелюстного сустава), заболевание, связанное с ремоделированием костей (такое как остеопороз, болезнь Педжета или остеонекроз), полихондрит (воспаление нескольких хрящей), склеродермия, нарушение комбинированной соединительной ткани, спондилоартропатии или заболевание периодонта (такое как периодонтит;
4. Кожа: псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы и реакции гиперчувствительности замедленного типа; фито- и фотодерматит; себорейный дерматит, герпетиформный дерматит, плоский лишай, склеротический атофический лишай, гангренозная пиодермия, кожный саркоид, дискоидная красная волчанка, пемфигус, пемфигоид, буллезный эпидермолиз, крапивница, ангионевротический отек (болезнь Квинке), васкулит, токсическая эритема, кожные эозинофилии, очаговая алопеция, облысение по мужскому типу, синдром Свита, синдром Вебера-Христиана, мультиформная эритема; целлюлит, как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, рак кожи, отличный от меланомы и другие диспластические повреждения; вызываемые лекарственными препаратами нарушения, включая постоянную лекарственную сыпь;
5. Глаза: блефарит, конъюнктивит, включая круглогодичный и весенний аллергический конъюнктивит, ирит; передний и задний увеит; хориоидит; аутоиммунные, дегенеративные или воспалительные нарушения, поражающие сетчатку; офтальмит, в том числе симпатический офтальмит; саркоидоз; инфекции, включая вирусную, грибковую и бактериальную;
6. Желудочно-кишечный тракт: глоссит, гингивит, периодонтит, эзофагит, включая рефлюкс; эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, колит, в том числе язвенный колит, проктит, анальный зуд; заболевания брюшной полости, синдром раздраженной кишки и пищевые аллергии, которые могут иметь эффекты, отдаленные от кишки (например, мигрень, ринит или экзему);
7. Брюшная полость: гепатит, включая аутоиммунный, алкогольный и вирусный; фиброз и цирроз печени; холецистит, панкреатит, как острый, так и хронический;
8. Мочеполовая система: нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и язву Ханнера; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильная дисфункция (как у мужчин, так и у женщин);
9. Отторжение аллотрансплантата: острое и хроническое после, например, трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы, или после переливания крови, либо хроническая болезнь трансплантат против хозяина;
10. ЦНС (центральная нервная система): болезнь Альцгеймера и другие нарушения, связанные с деменцией, включая БКЯ (болезнь Крейтцфельда-Якоба) и нвБКЯ (болезнь Крейтцфельда-Якоба, новый вариант); амилоидоз; рассеянный склероз и другие демиелинизирующие синдромы; церебральный атеросклероз и васкулит; височный артериит; злокачественная миастения; острая и хроническая боль (острая, временная или хроническая, центральной или периферической природы), включая боли в животе, головную боль, мигрень, невралгию тройничного нерва, атипическую лицевую боль, боль в суставах и костях, боль, вызываемую раком и инвазией опухоли, невропатические болевые синдромы, включая диабетическую, пост-герпетическую и связанную с ВИЧ невропатию; нейросаркоидоз; осложнения на центральную и периферическую нервную систему злокачественных, инфекционных или аутоиммунных процессов;
11. Другие аутоиммунные и аллергические нарушения, в том числе тиреоидит Хашимото, болезнь Грейвса, болезнь Аддисона, сахарный диабет, идиопатическая тромбоцитопеническая пурпура, эозинофильный фасцит, синдром гипер-IgE, антифосфолипидный синдром;
12. Другие заболевания с воспалительным или иммунологическим компонентом, включая синдром приобретенного иммунодефицита (СПИД), лепру, синдром Сезари и паранеопластические синдромы;
13. Сердечно-сосудистая система: атеросклероз, поражающий коронарное и периферическое кровообращение; перикардит; миокардит, воспалительная и аутоиммунная кардиомиопатия, включая саркоид миокарда; ишемические реперфузионные повреждения; эндокардит, вальвулит и аортит, включая инфекционный (например, сифилитический); васкулит; нарушения проксимальных и периферических вен, включая флебит и тромбоз, в том числе тромбоз глубоких вен и осложнения варикоза вен;
14. Желудочно-кишечный тракт: Глютеновая болезнь, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, язвенный колит, микроскопический колит, индетерминантный колит, нарушение раздраженной кишки, синдром раздраженной кишки, невоспалительная диарея, пищевые аллергии, которые могут иметь эффекты, отдаленные от кишки, например, мигрень, ринит или экзему.
Настоящее изобретение относится к новым ингибиторам комплекса Gadd45β/MKK7 и/или передачи сигнала данного комплекса, которые можно использовать для подавления функции, направленной на выживаемость NF-κВ при онкологических, воспалительных, аутоиммунных и дегенеративных, ишемических и сосудистых нарушениях.
Раскрытие изобретения
Согласно первому аспекту изобретения предусматривают соединение формулы I:
I: X1-A-X2,
А представляет собой А””, или А”-[М-А'-]n М-А”';
А”” представляет собой А”, А”' или Z1-Y2-Y3-Z4, где Y2-Y3 представляет собой олигопептидную группу или олигопептоидную группу, имеющую остатки Y2-Y3, и Z, присоединено к N-концевому атому азота Y2-Y3, и Z4 присоединено к С-концевому атому углерода Y2-Y3;
А” представляет собой А' или Y1-Y2-Y3-Y4, где Y1-Y2-Y3 представляет собой олигопептоидную группу или олигопептоидную группу, содержащую остатки Y1-Y2-Y3, и Z4 присоединено к С-концевому атому углерода Y1-Y2-Y3;
А”' представляет собой А' или Z1-Y2-Y3-Y4, где Y2-Y3-Y4 представляет собой олигопептоидную группу или олигопептоидную группу, содержащую остатки Y2-Y3-Y4, и Z1 присоединено к N-концевому атому азота Y2-Y3-Y4;
каждое присутствующее А' независимо представляет собой олигопептидную группу или олигопептоидную группу, содержащую остатки Y1-Y2-Y3-Y4;
n представляет собой целое число от 0 до 18,
Y1 и Y4 независимо представляют собой остатки аминокислот или -13-остатки производных аминокислот, имеющих ароматические боковые цепи,
Y2 представляет собой остаток аминокислоты или остаток производного аминокислоты или отсутствует,
Y3 представляет собой остаток аминокислоты или остаток производного аминокислоты или отсутствует;
Z1 представляет собой группу формулы II:
которая связана с N-концевым атомом азота Y2,
W отсутствует или представляет собой кислород или азот или алкиленовую группу из одного-трех атомов углерода, причем алкиленовая группа из одного-трех атомов углерода необязательно замещена по меньшей мере одним заместителем, выбранным из алкила с одним-четырьмя атомами углерода или 5-10-членной карбоциклической или гетероциклической ароматической группы;
J представляет собой 5-10-членную карбоциклическую или гетероциклическую ароматическую группу, причем ароматическая группа необязательно замещена по меньшей мере одним заместителем, выбранным из гидроксила, галогена, алкила из одного-четырех атомов углерода или алкокси из одного-четырех атомов углерода;
Z4 представляет собой группу формулы III:
которая связана с С-концевым атомом углерода Y3,
R представляет собой водород или алкил из одного-четырех атомов
углерода;
W' отсутствует или представляет собой алкиленовую группу из
одного-трех атомов углерода, причем алкиленовая группа из одного-трех атомов углерода необязательно замещена по меньшей мере одним заместителем, выбранным из алкила из одного-четырех атомов углерода или 5-10-членной карбоциклической или гетероциклической ароматической группой;
J' представляет собой 3-10-членную алифатическую карбоциклическую группу или 5-10-членную карбоциклическую или гетероциклическую ароматическую группу, причем алифатическая или ароматическая группа необязательно замещена по меньшей мере одним заместителем, выбранным из гидроксила, галогена, алкила из одного-четырех атом углерода или алкокси из одного-четырех атомов углерода;
М представляет собой пептидную связь между предшествующей олигопептидной или олигопептидоидной группой (А', А” или А”') и следующей олигопептидной или олигопептидоидной группой (А', А" или А”') либо линкерную группу, присоединенную посредством амидной связи, сложно-эфирной связи, эфирной связи или тиоэфирной связи к концевой карбоксильной группе предшествующей олигопептидной или олигопептидоидной группы (А', А" или А"') и посредством амидной связи, сложно-эфирной связи, эфирной связи или тиоэфирной связи к концевой аминогруппе следующей олигопептидоидной группы (А', А” или А”');
Х1 отсутствует или представляет собой группу, введенную в аминоконец А с целью блокировать свободные аминогруппы;
X2 отсутствует или представляет собой группу, введенную в - карбоксильный конец А с целью блокировать свободные карбоксильные группы;
при условии, что Х1 отсутствует, если А содержит Z1 и X2 отсутствует, если А содержит Z4,
или их производные, причем указанные производные выбраны из группы, состоящей из:
a) олигомеров или мультимеров молекул соединения формулы I, причем указанные олигомеры и мультимеры содержат две или более молекул соединения формулы I, каждая их которых соединена с обычной группой основы посредством амидной связи между амино- или группой карбоновой кислоты, присутствующей в молекулах соединения формулы I и противоположной амино- или группой карбоновой кислоты на группе основы, причем указанная группа основы участвует по меньшей мере в 2 амидных связях,
b) производных, содержащих молекулу соединения формулы I или его олигомер либо мультимер, как определено выше в разделе а), конъюгированные посредством амидной связи, сложно-эфирной связи, эфирной связи или тиоэфирной связи с:
ПЭГ,
соединениями на основе ПЭГ,
проникающими в клетку пептидами,
флуоресцентными красителями,
биотином или другой группой метки,
жирными кислотами,
наночастицами дискретного размера
или
хелатирующими лигандами, комплексованными с ионами металлов или
ионами радиоактивных веществ.
c) производных, содержащих молекулу соединения формулы I или его олигомер либо мультимер, как определено выше в разделе а), которые модифицированы амидированием, гликозилированием, карбамилированием, ацилированием, сульфатированием, фосфорилированием, циклизацией, липидированием, пегилированием или связыванием с пептидным или пептидоидным партнером слияния с целью получения слитого пептида или слитого пептидоида и
d) солей и сольватов молекулы соединения формулы 1 или его производного, как определено выше в разделе а).
Согласно второму аспекту изобретения предусматривают фармацевтическую композицию, содержащую соединение, соответствующее первому аспекту изобретения, и фармацевтически приемлемый носитель.
Согласно третьему аспекту изобретения представлен способ лечения заболевания или нарушения, характеризующегося повышенной активностью и/или экспрессией NF-κВ и/или повышенной активностью и/или экспрессией Gadd45β, предусматривающий введение терапевтически эффективного количества соединения, соответствующего первому аспекту изобретения, или фармацевтической композиции, соответствующей второму аспекту изобретения, нуждающемуся в этом пациенту.
Согласно четвертому аспекту изобретения предусматривают соединение, соответствующее первому аспекту изобретения, или композиции, соответствующей второму аспекту изобретения, предназначенные для использования в качестве лекарственного средства.
Согласно пятому аспекту изобретения предусматривают применение соединения, соответствующего первому аспекту изобретения, или фармацевтической композиции, соответствующей второму аспекту изобретения, для изготовления лекарственного средства для лечения заболевания или нарушения, характеризующегося повышенной активностью и/или экспрессией NF-κВ и/или повышенной активностью и/или экспрессией Gadd45β.
Краткое описание чертежей
Фигура 1. Показано схематическое представление защитного взаимного влияния путей NF-κВ и JNK в контексте передачи сигнала ФНО-R1 (рецептора 1 фактора некроза опухоли). Можно видеть, что Gadd45β опосредует взаимное влияние пути выживаемости, индуцируемого NF-κВ, и пути гибели, индуцируемого MKK7 и JNK. Ингибирование данного взаимного влияния путем блокирования Gadd45β позволяет MKK7 активировать JNK, запуская, таким образом, путь гибели в опухолевых клетках.
Фигура 2. Представлена модель комплекса Gadd45β-MKK7. Модель строят, как описано в ссылке Papa S. et al. 2007, J Biol Chem 282: 19029-19041. Далее модель уточняют, используя кристаллографическую структуру MKK7 (pdb (база данных процесса): 2DYL) и моделируют структуру Gadd45β на кристаллографической структуре Gadd45β (pdb: 3FFM). Структура Gadd45β показана синим цветом (ленты), тогда как структура MKK7 показана желтым цветом (ленты с поверхностью Ван дер Ваальса также представлены). Ингибирующие кислые петли 60-71 и 104-118 Gadd45β (см. статью Papa S. et al 2007, J Biol Chem 282: 19029-19041) выделены.
Фигура 3. Представлен скрининг с помощью ELISA (иммуноферментный твердофазный анализ), используемый для выделения соединяющих D-тетрапептидов (DTPs) 1 и 2. Антагонисты взаимодействия Gadd45β/MKK7 отбирают путем скрининга упрощенной комбинаторной библиотеки пептидов общей формулы Fmoc-(βA1a)2-X1-X2-X3-X4-CONH2 (см. ссылку на статью Marasco et al. 2008, Curr. Protein Pept. Sci. 9:447-67), полученной с использованием одной из 12 аминокислот в каждом положении от Х1 до Х4. Данную библиотеку, содержащую в целом 124=20736 различных пептидов, многократно подвергают деконволюционному анализу в четырех стадиях конкурентных анализов ELISA, используя на каждой стадии покрытый человеческий MKK7 (42 нМ), растворимый меченный биотином человеческий (h) Gadd45β (21 нм) и каждую из 12 суббиблиотек в номинальной концентрации 42 нМ (не показано).
Фигура 4. Представлен скрининг библиотеки второго поколения, полученной из наиболее активного пептида первого поколения. Скрининг данной библиотеки дает два высокоактивных пептида (отмечены на Фиг.4 как 1 и 8).
Фигура 5. Представлена активность изомеров оптимизированных пептидов. Так оптимизированные пептиды освобождают от метки Fmoc-(βAla)2 и синтезируют в виде D-изомеров, получая DTP1 и DTP2, которые нарушают взаимодействие Gadd45β/MKK7 с IC50 (50% ингибирующая концентрация) 0,22 нм и 0,19 нМ, соответственно. Можно также видеть, что L-изомеры данных пептидов (т.е. LTP1 и LTP2) демонстрируют 1650, близкую к данным значениям для DTP в конкурентных анализах ELISA, тогда как пептиды отрицательного контроля, LNC и DNC, не проявляют определяемый ингибирующий эффект на формирование комплекса Gadd45β/MKK7. LNC - отрицательный контроль L-изомера; LTP1 - тетрапептид L-изомера 1; LTP2 - тетрапептид L-изомера 2; DNC - отрицательный контроль D-изомера.
Фигура 6. Показана стабильность Z-DTPs в биологических жидкостях. Результаты конкурентных анализов ELISA показывают, что Z-защищенные DTP (Z-DTP1, Z-DTP2) сохраняют полную ингибирующую активность после 48-часового инкубирования с человеческой сывороткой при 37°С (IC50=0,19 нМ, Z-DTP1; IC50=0,18 нМ, ZDTP2), тогда как Z-защищенные LTP (Z-LTP1, Z-LTP2) почти полностью инактивируются после данной обработки (1050>10 мкМ). Анализы проводят, как показано на Фиг.3С, используя покрытый MKK7, растворимый биотин-hGadd45β и указанные концентрации тетрапептидов. Z-LNC и Z-DNC - отрицательные контроли L- и D-изомеров, соответственно.
Фигура 7. Представлены анализы соиммунопреципитации (co-IP), показывающие эффективное и специфическое нарушение взаимодействия Gadd45β/MMK7D-тетрапептидами 1 и 2 (DTP1 и DTP2), но не D-тетрапептидами отрицательного контроля (NC) (NC1, NC2, NC3 и NC4). Co-IP проводят при использовании антитела к FLAG (MKK7), и результаты вестерн-блоттинга проявляют с помощью антител к НА (детекция HA-Gadd45β) (верх) или к MKK7 (низ), как указано.
Фигура 8. Представлены анализы киназы MKK7, показывающие эффективное и специфическое нарушение взаимодействия Gadd45β/MMK7 и восстановление каталитической активности MKK7 посредством D-тетрапептидов 1 и 2 (DTP1 и DTP2), но не D-тетрапептидами отрицательного контроля (NC) (NC1, NC2, NC3 и NC4). Активную MKK7 подвергают иммунопреципитации с использованием антитела к FLAG из клеток НЕК293Т, обработанных форбол 12-миристат 13-ацетатом (РМА)/иономицином (P/I) и инкубируют с D-тетрапептидами в присутствии (верхняя панель) или в отсутствие (нижняя панель) рекомбинантного человеческого (h) Gadd45β, как указано. Как показано, ни активные соединяющие D-тетрапептиды, ни контрольные NC тетрапептиды не ингибируют каталитическую активность MKK7 при инкубировании с киназой в отсутствие Gadd45β (нижняя панель).
Фигуры 9-11. Представлены анализы включения [3H]тимидина, показывающие, что Z-защищенные производные DTP2 (Z-DTP2) (Фиг.9), но не ацетиловые производные DTP2 (Ac-DTP2) (Фиг.10) или Z-защищенные производные L-изомеров DTP2 (Z-LTP2) (Фиг.11), обладают существенной активностью уничтожения опухолевых клеток в опухолевых клеточных линиях. Результаты выражают как доля выживаемости/пролиферации опухолевых клеток после обработки либо 10 мкМ Z-DTP2 (Фиг.9), Ac-DTP2 (Фиг.10) или Z-LTP2 (Фиг.11) (закрашенные колонки) или Z-DNC (Фиг.9), Ac-DNC (Фиг.10) и Z-LNC (Фиг.11) (незакрашенные колонки) относительно уровня выживаемости/пролиферации необработанных клеток. Точки времени указаны. Показаны 3 из 8 тестированных чувствительных клеточных линий множественной миеломы (т.е. U266, KMS-11, NCI-H929) (Фиг.9-11) и клеточные линии лимфомы Беркетта (BJAB) (Фиг.9) и промоноцитарного лейкоза (U937) (Фиг.9). Данные результаты показывают высокую цитотоксическую активность Z-DTP2 (Фиг.9) по сравнению с отсутствием активности yAc-DTP2 (Фиг.10) и низкой активностью Z-LTP2 (Фиг.11) (см. также Фиг.12, 13 и 14 и Таблицу IV; дополнительные линии множественной миеломы). Отсутствие активности уничтожения опухолевых клеток Ac-DTP2 (Фиг.10) в клеточных линиях множественной миеломы коррелируется низким уровнем проницаемости клеток у данного соединения, как установлено в анализах CaCO2 (результаты не показаны). Выживаемость клеточных линий множественной миеломы после обработки другими, менее эффективными производными DTP (разработанными также для повышения поглощения DTP клетками), включая несущие метильную (Me), ацетиловую (Ас), миристиловую (Муг), 3-метокси,4-гидрокси-бензоиловую, бензоиловую, SCI-бензилоксикарбонильную (6CI-Z) и/или флуоренилметилоксикарбониловую (Fmoc) группу, не показана. Хотя активность in vitro и клеточное поглощение Z-LTP (Фиг.11) сравнимы с данными показателями Z-DTP (см. Фиг.5; результаты также не показаны), Z-LTP2 демонстрируют низкую активность в клетках множественной миеломы вследствие низкой стабильности в биологических жидкостях (см. Фиг.6).
Фигуры 12-14. Представлена проапоптотическая активность Z-DTP избирательна в отношении опухолевых клеточных линий с конститутивной активностью NF-κВ. Анализы включения [3H]тимидина, проведенные, как описано на Фиг.9-11, показывающие выживаемость клеток на панели опухолевых клеточных линий после обработки 10 мкМ Z-DTP или Z-DNC в следующие периоды времени: 144 часа (Фиг.12); 24 часа, 72 часа или 144 часа (Фиг.13 и Фиг.14), как указано. На Фиг.12 показана высокая активность уничтожения опухолевых клеток Z-DTP2 в 8 из 9 клеточных линий множественной миеломы, 1 из 2 клеточных линий диффузной крупноклеточной В-клеточной лимфомы (DLBCL; LY3), 1 из 1 клеточной линии промоноцитарного лейкоза (U937) и в 1 из 6 клеточных линий лимфомы Беркетта (BJAB), которые тестируют (см. также Фиг.15). Интересно, что Z-DTP2 показывает цитотоксическую активность только в клеточной линии DLBCL (АВС)-подобного подтипа активированных В-клеток (т.е. LYg) и не показывает в подтипе, подобном В-клеткам зародышевого центра (GCB) (т.е. SUDHL6), который не характеризуется конститутивной активацией NF-κВ (см. статью Ngo VN, et al. Nature 441(7089): 106-10; см. также Фиг.22 и Фиг.23, уровни экспрессии Gadd45β). Они также проявляют активность в клеточных линиях множественной миеломы, фактически все из которых характеризуются конститутивной активацией NF-κВ. Активность уничтожения опухолевых клеток Z-DTP2 (Фиг.13) и Z-DTP1 (Фиг.14) в клеточных линиях множественной миеломы и DLBCL после обработки 10 мкМ Z-DTP1, Z-DTP2 и Z-DNC в указанные точки времени (т.е. 24, 72 или 144 часа, как показано). Результаты подтверждают анализами исключения трипанового синего (результаты не показаны) и анализами с использованием йодида пропидия (PI) (см. Фиг.16-20; результаты также не показаны).
Фигура 15. Представлены анализы включения [3H]тимидина, показывающие отсутствие цитотоксичности Z-DTP2 на панели из 22 устойчивых опухолевых клеточных линий после обработки Z-DTP2 в течение 144 часов, даже когда данное соединение используют в очень высоких концентрациях, т.е. 100 мкМ. ZDNC означает Z-защищенный D-отрицательный контроль. Кроме того, показаны чувствительные клеточные линии BJAB (лимфомы Беркетта), KMS-11 и KMS-12 (множественная миелома). Таким образом, существует сильная корреляция среди данных клеточных линий между чувствительностью к индуцированной Z-DTP2 гибели и уровнями эндогенной экспрессии Gadd45β (см. Фиг.22 и 23).
Фигуры 16-20. Показано, что индуцированная Z-DTP2 гибель в клеточных линиях множественной миеломы обусловлена апоптозом. Анализы на основе окрашивания ядра йодидом пропидиума (PI) показывают индукцию апоптоза (т.е. содержание ДНК в фазе суб-G1; см. FL2-A) в репрезентативных клеточных линиях множественной миеломы ARH-77 (Фиг.16), KMS-11 (Фиг.17), JJN-3 (Фиг 18), NCI-H929 (Фиг 19) и U266 (Фиг.20) после обработки 10 мкМ Z-DTP2 или ZDNC1, как показано для точек 72 или 144 час. Показано также содержание ДНК в необработанных клетках, культивируемых в тех же условиях. Доли апоптотических клеток представлены на гистограммах.
Фигура 21. Показано, что обработка Z-DTP2 вызывает сильную активацию JNK в клеточных линиях множественной миеломы. Клетки KMS11 и NCI-H929 обрабатывают 10 мкМ Z-DTP2 или Z-DNC, как показано, и мониторируют активацию JNK в указанных точках времени с помощью вестерн-блоттинга с использованием специфического антитела к фосфо (P)-JNK. Повышенный уровень фосфорилирования JNK (маркер активации JNK) наблюдают только после обработки Z-DTP2, но не после обработки Z-защищенным пептидом отрицательного контроля (Z-DNC). Стимуляцию α-ФНО (2000 ед/мл) используют в качестве положительного контроля при активации JNK. Важно, что аналогичные эффекты ZDTP2 наблюдают в отношении активации MKK7 (результаты не показаны). Более того, как видно по биологической активности Gadd45β (см. ссылки на статьи: De Smaele, et al. (2001) Nature 414:306313; Papa, S et al., (2004) Nat. Cell Biol. 6, 146-153; Papa, et al. 2007 J. Biol. Chem. 282:19029-19041; Papa, et al. (2008) J.CIin.Invest. 118:191-1923), эффекты Z-DTP в клеточных линиях множественной миеломы специфичны в отношении пути MKK7/JNK, поскольку при использовании данных соединений не наблюдают никаких эффектов на активацию путей IKK/NF-κВ, ERK и р38 в данных клеточных линиях (результаты не показаны).
Фигуры 22 и 23. Показана сильная корреляция в опухолевых клеточных линиях между чувствительностью клеток к индуцированной Z-DTP гибели и уровнями экспрессии Gadd45β. На верхней панели Фиг.22 показывают экспрессию Gadd45β на панели из 29 раковых клеточных линий (кОТ-ПЦР (количественная ПЦР с использованием обратной полимеразы); колонки красного цвета), тогда как нижняя панель Фиг.22 показывает долю гибели клеток в тех же клеточных линиях после обработки 10 мкМ Z-DTP2 в течение 144 час (