Способ получения фторсодержащих хинолиниевых производных
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения меченных тритием фторфенилсодержащих хинолиниевых производных ядерно-химическим методом в результате ион-молекулярных реакций нуклеогенных дифторфенил-катионов с нуклеофильными центрами производных хинолина. Согласно изобретению производные хинолина (хинолин, хинальдин) подвергают ион-молекулярным реакциям с нуклеогенными фторированными фенил-катионами, которые генерируют при бета-распаде трития в составе дифтордитритийбензола в присутствии стабилизирующей соли - тетрафторбората калия, в результате чего достигается одновременное введение тритиевой метки и двух атомов фтора в фенильное кольцо кватернизированного атома азота гетероцикла и увеличивается выход ониевой соли в случае 2-метильного производного хинолина. Технический результат: разработан простой по исполнению, доступный по реагентам, с высокими радиохимическими выходами одностадийный способ получения N-дифторфенильных хинолиниевых производных, меченных тритием, которые могут быть использованы в качестве радиоактивных маркеров при проведении биологических и медицинских исследований. 2 ил., 1 табл., 2 пр.
Реферат
Настоящее изобретение относится к радиохимии, а именно к одностадийному способу получения неизвестных меченных тритием фторсодержащих хинолиниевых производных ядерно-химическим методом в результате ион-молекулярных реакций нуклеогенных дифторфенил-катионов с нуклеофильными центрами производных хинолина.
В настоящее время более 10% от продажи всех фармацевтических препаратов приходится на лекарственные средства, содержащие атом фтора.
Большой интерес к химии фторсодержащих шестичленных азотистых гетероциклов объясняется их интересными и необычными физическими, химическими и биологическими свойствами вследствие присутствия атома фтора в ароматическом кольце. Уникальные свойства фторорганических молекул возникают вследствие ряда факторов: 1) самой большой электроотрицательности фтора; 2) самой большой силы связи C-F; 3) слабыми Ван-дер-ваальсовыми взаимодействиями из-за низкой поляризуемости; 4) увеличенной гидрофобностью; 5) малым размером атома фтора. Эти факторы по отдельности или иногда в комплексе могут сильно изменять фармакологические свойства фторированных молекул [Fluorinated Heterocyclic Compounds. Synthesis, Chemistry, and Applications. Ed. by Viacheslav A. Petrov. John Wiley&Sons, Inc. 2009. 533 р.]. Введение фтора в хинолиновое кольцо привело к открытию нового класса сильнодействующих антибактериальных препаратов - фторхинолонового ряда, без которых сегодня трудно представить современный арсенал антибактериальных химиотерапевтических средств [Chemistry of Organic Fluorine Compounds; II ACS Monograph 187: Washington DC, 1995. 1296 p.; Падейская E.H., Яковлев В.П. Фторхинолоны. М.: Биоинформ, 1995. 208 с.; Машковский М.Д. Лекарственные средства 15-е изд. М.: Новая Волна, 2005. 844 с.; Wright D.H., Brown G.H., Peterson M.L., Rotschafer J.C. Application of fluoroquinolone Pharmacodynamics // J. Antimicrob. Chemother. 2000. V. 46. P. 669-683; Страчунский Л.С., Кречиков B.A. Моксифлоксацин - фторхинолон нового поколения с широким спектром активности. (Обзор литературы). Клиническая микробиология и антимикробная химиотерапия. 2001. Т. 3, №3. С. 243-259; Hooper D.C. Emerging mechanisms of fluoroquinolone resistance. Emerg Infect Dis. 2001. V. 7(2). P. 337-341; Noreddin A.M., Haynes V.L., Zhanel G.G. Pharmacokinetics and pharmacodynamics of the new quinolones // J. Pharm. Pract. 2005. V. 18. P. 432-443; Melhus A. Fluoroquinolones and tendon disorders // Expert Opin. Drug Saf. 2005. V. 4. P. 299-309; Leibovitz E. The use of fluoroquinolones in children. Curr Opin Pediatr. 2006. V. 18(1). P. 64-70; Murray T.S., Baltimore R.S. Pediatric uses of fluoroquinolone antibiotics // Pediatr. Ann. 2007. V. 36. P. 336-342; Mehlhorn A.J., Brown D.A. Safety concerns with fluoroquinolones. Ann Pharmacother. 2007. V. 41(11). P. 1859-1866; Boogaard J., Kibiki G.S., Kisanga E.R., Boeree M.J., Aarnoutse R.E. New drugs against tuberculosis; problems, progress, and evaluation of agents in clinical development // Antimicrob. Ag. Chemother. 2009. V. 53. P. 849-862; Mafra L., Santos S.M., Siegel R., Alves I., Almeida Paz F.A., Dudenko D., Spiess H.W. Packing interactions in hydrated and anhydrous forms of the antibiotic ciprofloxacin: a solid-state NMR, X-ray diffraction, and computer simulation study. J. Am. Chem. Soc. 2012. V. 134. P. 71-74].
Причем при исследованиях N(1)-фенилпроизводных фторхинолонов было обнаружено, что фенильный заместитель с одним или двумя атомами фтора оказывает благоприятное воздействие, увеличивая активность фторхинолонов в отношении анаэробных бактерий [Е.Н. Падейская, В.Э. Мнацаканян. Фторхинолоны в проблеме лечения инфекций, вызванных PSEUDOMONAS AERUGINOSA. Хим.-фарм. журнал. 1993. №6. С. 19-24.; Г.А. Мокрушина, В.Н. Чарушин, О.Н. Чупахин. Взаимосвязь структуры и антибактериальной активности в ряду фторхинолонов (обзор). Хим.-фарм. журнал. 1995. №9. С. 5-19].
Кроме того, ряд фторированных производных конденсированных хинолинов и хиназолинов обнаружили противоопухолевую активность [Г.Н. Липунова, Э.В. Носова, Г.А. Мокрушина, Л.П. Сидорова, В.Н. Чарушин. Противоопухолевая активность фторированных производных конденсированных хинолинов и хиназолинов. Хим.-фарм. журнал. 2000. №1. С. 20-23; Kato Т, Hakura A, Mizutani Т, Saeki K. Anti-mutagenic structural modification by fluorine-substitution in highly mutagenic 4-methylquinoline derivatives. Mutat Res. 2000. V. 465(1-2). P. 173-182].
Эффективность лекарственных препаратов во многом определяется растворимостью в воде и проницаемостью через клеточные мембраны, и этим во многом объясняется широкое использование гидрофобных липофильных четвертичных пиридиниевых солей [Zhao Т., Sun G. Hydrophobicity and antimicrobial activities of quaternary pyridinium salts // J. Appl. Microbiol. 2008. V. 104. P. 824-830; Kumar V., Malhotra S.V. Ionic liquids as pharmaceutical salts: a historical perspective // ACS Symposium Series. 2010. V. 1038. Ch. 1. P. 1-12; Laufer R., Bathori M., Csermery Т., Petroiani G., Kuca K., Toth N., Kalasz H. LC Determination of hydrophilicity parametr of some pyridinium aldoximes // J. of Liquid Chromatography and Related Techlogies. 2007. V. 30. No. 15. P. 2337-2344].
Было обнаружено, что катионные производные пиридиния обладают чрезвычайно широким спектром антимикробной активности по отношению как к грамположительным, так и грамотрицательным организмам [Docherty K., Kulpa C.F. Toxicity and antimicrobial activity of imidazolium and pyridinium ionic liquids // Green Chem. 2005. V. 7. P. 185-189; Alptuzun V., Parlar S., Tash H., Erciyas E. Synthesis and antimicrobial activity of some pyridinium salts // Molecules. 2009. V. 14. P. 5203-5215; Mancini I., Sicurelli A., Guella G., Turk Т., Macek P., Sepcic K. Synthesis and bioactivity of linear oligomers related to polymeric alkylpyridinium metabolites from the Mediterranean sponge Reniera sarai // Org. Biomol. Chem. 2004. No. 2. P. 1368-1375; Musilek K., Kusa K., jun D., Dohnal V., Dolezal M. Synthesis of a novel series of bispyridinium compounds bearing a xylene linker and evaluation of their reactivation activity against chlopyyrifos-inhibited acetylcholinnesterase // J. Enzyme Inhib. Med. Chem. 2005. V. 20. No. 5. P. 409-415], причем эффект наблюдается даже при очень низких концентрациях.
Исследования показали, что противомикробная активность пиридиниевых производных во многом зависит от структуры заместителя, имеющегося в пиридиновом цикле. Соединения бензопиридина - хинолина открыли новые горизонты в химии лекарственных препаратов [Гуцуляк Б.М., Дзюбак С.Т., Петровский Р.С., Кынина Е.С., Мыкытын С.И. Противомикробная активность солей 4-{n-диметиламиностирил}-хинолиния // Хим.-фарм. Журнал. 1988. №5. С. 570-572; Шинкоренко С.В., Опанасенко E.П., Волянский Ю.Л., Шульга Н.Н., Перепичка М.П., Бунятян Н.Д. Кислотно-основные характеристики моно- и динитрофенилгидразонов 2{4}-формилхинолиния и их биологическая активность // Хим.-фарм. Журнал. 1989. №1. С. 59-62; Боев В.И., Москаленко А.И., Даева Е.Д. Противомикробная активность α-алкилмеркурированных солей пирилия, пиридиния, хинолиния и бензазолиев // Хим.-фарм. Журнал. 1995. №11. С. 29-31; Stojan J., Marcelb V., Fournierb D. Inhibition of Drosophila acetylcholinesterase by 7-(methylethoxyphosphinyloxy)1-methyl-quinolinium iodide // Chem-Biolog. Interactions. 1999. V. 119-120. P. 147-157; Joaquin C.R., Galanakis D., Piergentili A., Bhandari K., Ganellin C.R., Dunn P.M.., Jenkinson D.H. Synthesis, Molecular Modeling, and Pharmacological Testing of Bis-Quinolinium Cyclophanes: Potent, Non-Peptidic Blockers of the Apamin-Sensitive Ca2+-Activated K+ Channel // J. Med. Chem. 2000. V. 43. No. 3. P. 420-431; Mukherjee P.K., Chandra J., Kuhn D.M., Ghannoum M.A. Mechanism of Fluconazole Resistance in Candida albicans Biofilms: Phase-Specific Role of Efflux Pumps and Membrane Sterols // Infection and Immunity. 2003. V. 71. No. 8. P. 4333-4340].
Было обнаружено, что полученные только в середине 20 века различные N-фенильные производные пиридиния и хинолиния по биологическому действию во многих случаях превосходят свои алифатические аналоги. В последнее время разрабатываются новые эффективные лекарственные вещества на основе производных хинолиния и бензохинолиния [Campos J.M., Núñez М.С., Sánchez R.M., Gómez-Vidal J.A., Rodríguez-González A., Báñez M., Gallo M.A., Lacal J.C., Espinosa A. Quantitative structure-activity relationships for a series of symmetrical bisquaternary anticancer compounds // Bioorg Med Chem. 2002. V. 10. No. 7. P. 2215-2231; Srivani P., Sastry G.N. Potential choline kinase inhibitors: a molecular modeling study of bis-quinolinium compounds // J. Mol. Graph. Model. 2009. V. 27. No. 6. P. 676-688; Barchéchath S.D., Tawatao R.I., Corr M., Carson D.A., Cottam H.B. Quinolinium salt as a potent inhibitor of lymphocyte apoptosis // Bioorg Med Chem Lett. 2005. V. 15. No. 7. P. 1785-1788; Geldenhuys W.J., Lockman P.R., Nguyen Т.Н., Van der Schyf C.J., Crooks P.A., Dwoskin L.P., Allen D.D.. 3D-QSAR study of bis-azaaromatic quaternary ammonium analogs at the blood-brain barrier choline transporter // Bioorg Med Chem. 2005. V. 13. No. 13. P. 4253-4261; Abd El-Aala R.M., Younis M. Synthesis and antimicrobial activity of meso-substituted polymethine cyanine dyes // Bioorganic Chemistry. 2004. V. 32. P. 193-210; Otarigi M.A molecular functional study on the interactions of drugs with plasma proteins // Drug Metab. Pharmocokinet 2005. V. 20. No. 5. P. 309-323; Hipler U-C., Eisner P., Fluhr J.W. A New Silver-Loaded Cellulosic Fiber with Antifungal and Antibacterial Properties. Biofunctional Textiles and the Skin // Curr Probl Dermatol. Basel, Karger. 2006. V 33. P. 165-178; Lee C-H., Kim H.J., Lee J-H., Cho H-J., Kim J., Chung K.C., Jung S., Paik S.R. Dequalinium-induced Protofibril Formation of α-Synuclein // J. Biolog. Chem. 2006. V. 281. No. 6. P. 3463-3472].
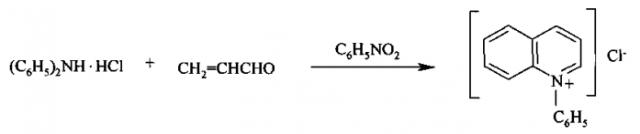
Однако синтез даже незамещенных N-фенильных хинолиниевых солей представляет существенные синтетические трудности, поскольку реакция прямого фенилирования атома азота в кольце производных хинолина не осуществима [Pausacker K.Н. Arylation of aromatic compounds. VI. Benzoyl Peroxide with Pyridine and Quinoline // Australian Journal of Chemistry. 1958. V. 11. No. 2. P. 200-210; Brody F., Ruby P.R. In: Pyridine and its Derivatives. Part I. Edited by Klingsberg. New York, Interscience, 1960. 210 p.].
Одним из основных методов получения солей N-фенилхинолиния является реакция циклизации Скраупа из дифениламина, акролеина (или глицерина) и нитробензола [Джилкрист Т. Химия гетероциклических соединений. М.: Мир, 1996. 463 с.; Mortelmans С., Van Binst G. Synthesis of 9,10-Dihydro-8bH-quino[1,2-f]phenanthridine- and 6-Phenyl-4,5,6,7-tetrahydropyrido[3,2,1-j,k]carbazole-Derivatives // Tetrahedron. 1978. V. 34. P. 363-369; Katritzky A.R., Pozharski A.F. Handbook of Heterocyclic Chemistry. Pergamon, Amsterdam, 2000. 734 p.]:
Осуществление синтеза меченых производных по данной классической методике требует предварительного получения меченного тритием в кольцо предшественника, проведение сложных и многостадийных синтезов, характеризующихся не очень высокими выходами, а значительные потери радиоактивности за счет разбавления и водородного обмена делают этот путь трудновыполнимым и крайне дорогостоящим. Необходимо отметить, что получение меченных тритием N-дифтрорфенильных хинолиниевых производных классическими методами просто неосуществимо.
В связи с исключительной прикладной значимостью производных бензопиридинов (хинолинов), актуальной становится необходимость детального изучения механизмов химических и биологических процессов с их участием. В настоящее время для этой цели эффективно используется метод изотопной, особенно тритиевой, метки, позволяющий проводить высокочувствительные исследования биоорганических веществ [Saljoughian M. Synthetic Tritium Labeling p. Reagents and Methodologies // Synthesis. 2002. P. 1781-1801; Сидоров Г.В., Мясоедов Н.Ф. Синтез меченных тритием биологически важных диазинов // Успехи химии. 1999. Т. 13. №6. С. 398-401; Шевченко В.П., Негаев И.Ю., Мясоедов Н.Ф. Меченные тритием липофильные соединения. М.: Наука, 2003. 246 с.; Balan A., Barness I., Simon G., Levy D., Ashani Y. Tritium labeling of a powerful methylphosphonate inhibitor of cholinesterase synthesis and biological applications // Anal. Biochem. 1988. V. 169. No. 1. P. 95-103].
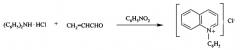
Ранее нам удалось осуществить одностадийный ядерно-химический синтез неизвестных N-фенилзамещенных хинолиниевых производных [патент РФ №2320647 от 27.03.2008 г.; патент РФ №2442776 от 20.02.2012 г.], эффективных радиоактивных маркеров для биологических исследований (прототип способа).
Задачей данного изобретения является разработка простого по исполнению, доступного по реагентам, с высокими радиохимическими выходами одностадийного способа получения неизвестных в классической химии N-дифторфенильных хинолиниевых производных, меченных тритием.
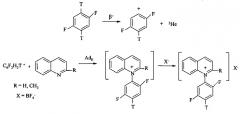
Поставленная задача достигается описываемым новым ядерно-химическим способом получения меченных тритием неизвестных N-дифторфенильных хинолиниевых производных, заключающимся в том, что хинолин и хинальдин подвергают ион-молекулярным реакциям со свободными меченными тритием нуклеогенными дифторфенильными катионами, которые генерируются самопроизвольно при бета-распаде трития в составе дитритийдифторбензола [Щепина Н.Е., Аврорин В.В. Способ получения дитритийдифторбензола источника фторированных нуклеогенных фенил-катионов. Патент РФ №2479561, опубл. 20.04.2013, бюл. №11] согласно следующей схемы:
При взаимодействии новых нуклеогенных фторированных фенил-катионов с гетероциклической системой исследуемых хинолинов происходит неописанная ранее реакция электрофильного присоединения AdE (прямое взаимодействие по неподеленной электронной паре атома азота) с образованием неизвестных N-дифторфенильных хинолиниевых производных, меченных тритием.
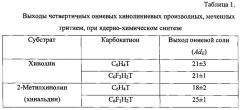
Возрастающий интерес к химии фторзамещенных производных пиридинового цикла объясняется их интересными и необычными физическими, химическими и биологическими свойствами, что связано с наличием сильных электроноакцепторных заместителей в ароматическом кольце [Fluorinated Heterocyclic Compounds. Synthesis, Chemistry, and Applications. Ed. by Viacheslav A. Petrov. John Wiley&Sons, Inc. 2009. 533 p.]. Такие большие эффекты, связанные с введением фторзаместителей, еще часто называют «магией фтора» [K. Uneyama. Organofluorine Chemistry. Blackwell Publishing Ltd. Oxford, UK, 2006]. В случае проведения ядерно-химического синтеза с 2-метилхинолином совокупное влияние метальной группы и двух атомов фтора приводит к повышению выхода четвертичной соли (см. табл. 1).
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат. Авторами создан простой по исполнению, доступный по реагентам, с высокими радиохимическими выходами одностадийный способ получения неизвестных N-дифторфенильных хинолиниевых производных, меченных тритием, которые могут быть использованы в качестве радиоактивных маркеров при проведении биологических и медицинских исследований. Использование новых фторированных нуклеогенных фенил-катионов позволило одновременное введение тритиевой метки и дифтор-заместителей в бензольное кольцо четвертичного гетероциклического атома азота при ядерно-химическом синтезе, достигнуто значительное увеличение выхода ониевой соли в случае 2-метильного производного.
Изобретение иллюстрируется следующими примерами.
Пример 1
Синтез солей N-дифторфенилхинолиния, меченных тритием
Нуклеогенные фенил-катионы генерировались при β-распаде трития в составе дитритийдифторбензола, синтезированного по разработанной ранее методике [Щепина Н.Е., Аврорин В.В. Способ получения дитритийдифторбензола источника фторированных нуклеогенных фенил-катионов. Патент РФ №2479561, опубл. 20.04.2013, бюл. №11] из 1,4-дибром-2,5-дифторбензола (20 мкмолей) и 2,5 Ки газообразного трития. Удельная активность синтезированного 1,4-дифтор-2,5-дитритийбензола составляла 54±5 мКи/мкмоль. Радиохимическая чистота не менее 99,8%.
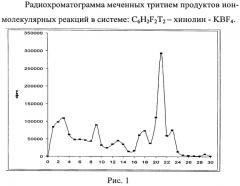
В стеклянную ампулу объемом 0,5 мл вносили кристаллы стабилизирующей соли KBF4, затем 5,9 мкл хинолина и при охлаждении ампулы жидким азотом добавляли 1 мкл полученного гексанового раствора C6F2H2T2. Исследуемый субстрат был взят в большом мольном избытке, соотношение не менее ~1:103 (1 мкл гексанового раствора C6F2H2T2 и 5 мкмоль субстрата). Ампулу запаивали и выдерживали 1-2 месяца для накопления продуктов ядерно-химического синтеза. Ампулу вскрывали, содержимое ампулы переносили в специальную виалу, добавляли 0,5 мл бензола и 0,5 мл ацетонового раствора изоморфного носителя - неактивной соли - борфторида N-фенилхинолиния (~1 мг/мл). Непрореагировавший тритированный бензол отгоняли в вакууме. К сухому остатку добавляли 0,5 мл ацетона и отбирали пробы по 5 мкл для разделения меченых соединений методом ТСХ. Радиохроматографию полученных тритированных соединений осуществляют на стеклянных пластинках Analtech TLC Uniplates USA (С-18 silica gel matrix, UV) 5 cm × 20 cm. Радиохроматограмма при хроматографировании в CH3CN приведена на рис. 1.
Первый пик на хроматограмме соответствует ониевой соли - борфториду N-дифторфенилхинолиния. Значения относительных выходов третированных соединений были определены по отношению активностей идентифицированных продуктов к суммарной активности всех продуктов реакции. Радиохимический выход борфторида N-дифторфенилхинолиния составляет 21±1%.
Пример 2
Синтез борфторида N-дифторфенилхинальдиния
Ядерно-химический синтез проводился аналогичным образом (см. пример 1). В ампулу соответственно было взято 5,1 мкл хинальдина (2-метилхинолина). Радиохроматограмма в случае 2-метилхинолина приведена на рис. 2. Радиохимический выход борфторида N-дифторфенилхинальдиния составляет 25±1%.
Вышеперечисленная совокупность существенных признаков в формуле изобретения, неочевидная для специалистов позволяет получить следующий технический результат - достигается одновременное введение тритиевой метки и двух атомов фтора в фенильное кольцо кватернизированного атома азота гетероцикла и увеличивается выход ониевой соли в случае 2-метильного производного.
Способ получения меченных тритием фторфенилсодержащих хинолиниевых производных ядерно-химическим методом в результате ион-молекулярных реакций нуклеогенных дифторфенил-катионов с нуклеофильными центрами производных хинолина по схеме: отличающийся тем, что производные хинолина (хинолин, хинальдин) подвергают ион-молекулярным реакциям с нуклеогенными фторированными фенил-катионами, которые генерируют при бета-распаде трития в составе дифтордитритийбензола в присутствии стабилизирующей соли - тетрафторбората калия, в результате чего достигается одновременное введение тритиевой метки и двух атомов фтора в фенильное кольцо кватернизированного атома азота гетероцикла и увеличивается выход ониевой соли в случае 2-метильного производного хинолина.