Способ прогнозирования получения незрелых ооцитов в программах вспомогательных репродуктивных технологий с использованием молекулярно-генетических маркеров
Иллюстрации
Показать всеИзобретение относится к области клинико-лабораторной диагностики и предназначено для прогнозирования вероятности получения незрелых ооцитов в программах вспомогательных репродуктивных технологий (ВРТ) с использованием молекулярно-генетических маркеров. Из образцов периферической крови пациентки с трубно-перитонеальным фактором бесплодия выделяют ДНК, посредством ПЦР в режиме реального времени определяют полиморфные локусы AMHR2 (-482 A>G) [rs2002555], LHCGR (Ser312Asn) [rs2293275], ESR2 G>A [RsaI] [rs4986938], LHCGR (Asn291Ser) [rs12470652]. Полученные данные включают в дискриминантную функцию. Вероятность получения незрелых ооцитов определяют по формуле p=1/(1+e-z). В случае р меньше 0,5 предполагают, что событие не наступит, в противном случае предполагается наступление события. Изобретение обеспечивает создание эффективного способа прогнозирования получения незрелых ооцитов в программах ВРТ, в частности с целью предикции исходов программы ЭКО. 1 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к области клинико-лабораторной (молекулярно-генетической) диагностики с целью предикции вероятности получения зрелых ооцитов и касается оптимизации проводимой терапии бесплодия методом вспомогательных репродуктивных технологий (ВРТ).
В связи с интенсивным развитием ВРТ возросла необходимость в индивидуализации протоколов стимуляции суперовуляции с использованием клинических, гормональных и функциональных маркеров овариального ответа [1; 2; 3]. При этом прогноз качества получаемых гамет и эмбрионов представляет собой одну из наиболее трудноразрешимых проблем при лечении пациенток методом экстракорпорального оплодотворения (ЭКО). Предложены различные маркеры исходов программ ВРТ (возраст, овариальный резерв, гормональный статус и другие) [2; 4; 5]. Однако эти факторы не обладают достаточной предиктивной способностью. Генетическая предрасположенность представляется важным фактором, детерминирующим данные процессы в программе ЭКО [6; 7].
При интерпретации результатов исследования генома, полученные данные не меняются с возрастом, не зависят от веса, от дня менструального цикла и так далее, и могут определяться однократно, в отличие от гормональных маркеров. Исследование влияния генетических маркеров продолжает формировать научный и практический интерес современной медицины.
Описаны проведенные однофакторные модели, основанные на молекулярно-генетических предикторах, позволяющих прогнозировать овариальный ответ на стимуляцию суперовуляции и качество ооцитов. Однако недостатками таких моделей являются низкая предиктивная способность и противоречивость данных [8].
В литературе встречаются достаточно редкие попытки создания мультигенных моделей. Так, наиболее аналогичной работой является исследование, проведенное на популяции индийских женщин, в ходе которого установлено, что у гомозиготных женщин по аллелю 680Ser полиморфизма гена FSHR (Asn680Ser) [rs 6166, здесь и далее rs - регуляторная область гена] и 49Ser гена АМН (Ile49Ser) [rs10407022], получают большее количество зрелых ооцитов, чем у пациенток, гомозиготных по аллелю 680Asn полиморфизма гена FSHR (Asn680Ser) [rs 6166] и/или гомозиготных по аллелю 49Ile гена АМН (Ile49Ser) [rs10407022] (р=0,009) [9]. Аналогичным исследованием является работа de Castro et al., проведенная на популяции европейских женщин, были представлены данные анализа мультигенной модели 680Ser (FSHR 2039 A>G (Ser680Asn) [rs6166]) - T (ESR1-397 T>C [PvuII] [rs2234693] - G (ESR2+1730G (AluI) [rs1256049/A]), которая прогнозировала «бедный» овариальный ответ на стимуляцию суперовуляции препаратами рФСГ, но не было выявлено ассоциации полиморфизма гена с качеством ооцитов и эмбрионов [2].
Задача настоящего изобретения - создать мультигенную модель прогнозирования получения незрелых ооцитов в программах ВРТ путем предварительного генотипирования пациенток перед началом стимуляции функции яичников. Исследование полиморфизма гена может служить мало инвазивным, нетрудоемким, недорогим тестом, позволяющим анализировать одновременно большое количество образцов.
Цель настоящего изобретения - создание многофакторной молекулярно-генетической модели предикции получения незрелых ооцитов, оптимизации проводимой терапии бесплодия методом ВРТ.
Поставленная цель достигается генотипированием пациентки по следующим полиморфным локусам:
AMHR2(-482 A>G) [rs2002555]; LHCGR (Ser312Asn) [rs2293275]
ESR2 G>A [RsaI] [rs4986938]; LHCGR (Asn291Ser) [rs 12470652].
Определяют генотип по данным позициям с применением полимеразной цепной реакции (ПЦР) или аналогичного метода, позволяющего определить указанные генетические маркеры. ПЦР и определение температуры плавления олигонуклеотидных проб проводят при помощи детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). ДНК для генотипирования выделяют из образцов периферической крови, взятой с ЭДТА (этилендиаминтетрауксусная кислота) в качестве антикоагулянта, объемом 0,5 мл, смешивают в микроцентрифужных пробирках (объемом 1,5 мл) типа Эппендорф с лизирующим раствором (0,5 мл), состоящим из 10 мМ Трис-HCl рН 7,5, 0,32 М сахарозы, 5 мМ MgCl, 1% Тритона Х-100 центрифугируют. Центрифугирование проводится в течение 1 мин при 10000 об/мин, супернатант удаляется, осадки клеточных ядер двукратно отмывают соответствующим буфером. В последующем протеолиз проводят в буферном растворе (50 мкл), содержащем 10 мМ Трис-HCl рН 8,3, 50 мМ KCl, 0,45% NP40, 045% Твина 20 и 250 мкг/мл протеиназы К, 2,5 мМ MgCl, в течение 20 минут при 37°С. Инактивация протеиназы К производится в течение 20 минут при температурном режиме 98°C. Концентрация ДНК определяется на ДНК-минифлуориметре (Hoefer, США) и составляет около 50-100 мкг/мл. Идентификацию однонуклеотидных полиморфизмов проводят с помощью модифицированного метода «примыкающих проб» (adjacent probes, kissing probes), с использованием оригинальных олигонуклеотидов [10; 11].
Определение полиморфизма генов сначала проводится ПЦР с праймерами, которые связываются с комплементарными последовательностями, и между циклами нагревания (для денатурации ДНК) и охлаждения (для обеспечения синтеза) синтезируются копии данной области гена [12]. Праймеры общие для обоих вариантов нуклеотидной последовательности, после чего температуру реакционной смеси для гибридизации матрицы с олигонуклеотидными пробами понижают. Для определения типа последовательности используют два варианта олигонуклеотидов. В первом случае олигонуклеотиды метят флуорофором, во втором - гасителем флуоресценции. Этот процесс протекает при помощи ферментов, способных соединять нуклеотидные основания и выдерживать необходимые для денатурации температурные режимы [12]. В качестве такого фермента используется Taq-полимераза, блокированная специфическими антителами, чтобы предотвратить неспецифический отжиг праймеров и повысить чувствительность тест-систем.
В режиме реального времени измеряют уровень флуоресценции в процессе температурной денатурации дуплексов олигонуклеотидов и полученных матриц. Генотип определяется путем анализа кривых плавления. В том случае, если анализируемый образец содержит только один тип нуклеотидной последовательности гена, т.е. гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, выше, чем для пробы, образующей несовершенный дуплекс. В том случае, если анализировался гетерозиготный образец, содержащий два типа нуклеотидной последовательности, каждый из вариантов проб может образовать совершенный дуплекс, поэтому температуры плавления одинаковы [12].
Бинарная логистическая регрессия рассчитывает вероятность наступления события (в данном случае получение незрелых ооцитов) в зависимости от значений независимых переменных (в данном случае полиморфизма исследуемых генов).
Вероятность наступления события (р) для некоторого случая рассчитывается по формуле, имеющей общий вид:
где
р - искомая вероятность наступления события;
z (классифицирующая дискриминантная функция) = a+b1*X1+b2*X2+…+bn*Xn,а - константа; X1 - независимые переменные; b1 - коэффициенты, расчет которых является задачей бинарной логистической регрессии.
В случае р меньше 0,5 предполагают, что событие не наступит; в противном случае предполагается наступление события.
В бинарной логистической регрессионной модели исходом является переменная, характеризующая получение незрелых ооцитов, предикторами - генотип по следующим полиморфным локусам: AMHR2 (-482 A>G) [rs2002555]; LHCGR (Ser312Asn) [rs2293275]; ESR2 G>A [RsaI] [rs4986938]; LHCGR (Asn291Ser) [rs 12470652].
При построении бинарной логистической регрессионной модели используют метод обратной селекции. Качество приближения регрессионных моделей при каждом последующем шаге оценивают при помощи функции подобия. Мерой правдоподобия служит отрицательное удвоенное значение логарифма этой функции (-2LL). В качестве начального значения для -2LL применяется значение, которое получается для регрессионной модели, содержащей только константы. После добавления переменной влияния значение -2LL равно 198,613. Разность между значением -2LL начальной и конечной модели составила 20,391 (р=0,009). Подобное снижение величины означает улучшение полученной модели.
Мера определенности указывает часть дисперсии, которую можно объяснить с помощью логистической регрессии. Мера определенности по Коксу и Шелу имеет тот недостаток, что значение, равное 1, является теоретически не достижимым; этот недостаток устранен благодаря модификации данной меры по методу Наделькеркеса. Часть дисперсии, объяснимой с помощью логистической регрессии, в данном уравнении составляет 16,1% (вычисляется по методу Наделькеркеса).
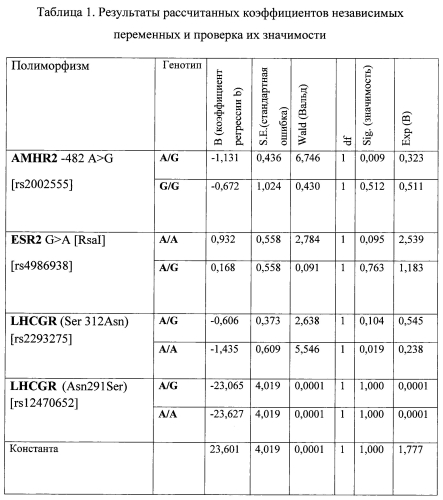
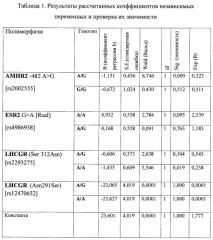
Результаты рассчитанных коэффициентов в логистической регрессии и проверке их значимости приведены в таблице (табл. 1).
Проверка значимости отличия коэффициентов от нуля проводится при помощи статистики Вальда, использующей распределение хи-квадрат, которая представляет собой квадрат отношения соответствующего коэффициента к его стандартной ошибке.
Согласно полученной константе и согласно значимым коэффициентам для прогнозирования вероятности получения незрелых ооцитов (р) классифицирующая дискриминантная функция имеет вид:
Z=23,601-1,131*AMHR2A/G-0,672*AMHR2G/G+0,932*ESR2A/A+0,168*ESR2A/G-0,606*LHCGR(Ser312Asn)A/G-1,435*LHCGR(Ser312Asn)A/A-23,065*LHCGR(Asn291Ser)A/G-23,627*LHCGR(Asn291Ser)A/A, где
23,601 - константа;
AMHR2A/G - наличие у пациентки генотипа A/G гена AMHR2(-482 A>G) [rs2002555] (1 - да, 0 - нет);
AMHR2G/G - наличие у пациентки генотипа G/G гена AMHR2(-482 A>G) [rs2002555] (1 - да, 0 - нет);
ESR2A/A - наличие у пациентки генотипа А/А гена ESR2 G>A [RsaI] [rs4986938] (1 - да, 0 - нет);
ESR2A/G - наличие у пациентки генотипа A/G гена ESR2 G>A [RsaI] [rs4986938] (1 - да, 0 - нет);
LHCGR (Ser312Asn)A/G - наличие у пациентки генотипа A/G гена LHCGR (Ser312Asn) [rs2293275] (1 - да, 0 - нет);
LHCGR (Ser312Asn)A/A - наличие у пациентки генотипа А/А гена LHCGR (Ser312Asn) [rs2293275] (1 - да, 0 - нет);
LHCGR (Asn291Ser)A/G - наличие у пациентки генотипа A/G гена LHCGR (Asn291Ser) [rs 12470652] (1 - да, 0 - нет);
LHCGR (Asn291Ser)A/A - наличие у пациентки генотипа А/А гена LHCGR (Asn291Ser) [rs12470652] (1 - да, 0 - нет);
-1,131, -0,672, 0,932, 0,168, -0,606, -1,435, -23,065, -23,627 - коэффициенты; и вероятность получения незрелых ооцитов определяют по формуле p=1/(1+e-z),
где в случае р меньше 0,5 предполагают, что событие не наступит; в противном случае предполагается наступление события.
Точность прогнозирования вероятности получения незрелых ооцитов с использованием следующих полиморфных локусов AMHR2(-482 A>G) [rs2002555]; LHCGR (Ser312Asn) [rs2293275]; ESR2 G>A [RsaI] [rs4986938]; LHCGR (Asn291Ser) [rs 12470652] составляет 68,6%. Провели ROC-анализ для валидации полученной модели (фиг. 1). Чувствительность составила 73,6%, специфичность - 62,5%, значение AUC (площадь под кривой) для данной модели составляет 0,704, 95% доверительный интервал от 0,622 до 0,786.
Пример
Прогнозирование вероятности получения незрелых ооцитов провели у пациентки X. 28 лет, обратившейся для проведения программы ЭКО и ПЭ по поводу трубно-перитонеального фактора бесплодия. Из анамнеза: беременностей 0, в 2011 г. проведена лапароскопия, двухсторонняя тубэктомия по поводу гидросальпинксов. Данная попытка ЭКО первая.
Кровь для генотипирования у пациентки X. брали натощак из локтевой вены в стерильную пробирку. Определяли замены однонуклеотидных последовательностей с применением ПЦР. ПЦР и определение температуры плавления олигонуклеотидных проб проводили при помощи детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). Центрифугирование проводили в течение 1 мин при 10000 об/мин, супернатант удалялся, осадки клеточных ядер двукратно отмывали соответствующим буфером. В последующем протеолиз проводили в буферном растворе (50 мкл), содержащем 10 мМ Трис-HCl рН 8,3, 50 мМ KCl, 0,45% NP40, 045% Твина 20 и 250 мкг/мл протеиназы К, 2,5 мМ MgCl, в течение 20 минут при 37°С. Концентрацию ДНК определяли на ДНК-минифлуориметре (Hoefer, США). Идентификацию однонуклеотидных полиморфизмов проводили с помощью модифицированного метода «примыкающих проб» (adjacent probes, kissing probes), с использованием оригинальных олигонуклеотидов.
Определение полиморфизма генов сначала проводили ПЦР с праймерами, которые связываются с комплементарными последовательностями, и между циклами нагревания (для денатурации ДНК) и охлаждения (для обеспечения синтеза) синтезируются копии данной области гена.
Результат генотипирования пациентки X.:
AMHR2(-482 A>G) [rs2002555] - A/G
ESR2 G>A [RsaI] [rs4986938] - A/G
LHCGR (Ser312Asn) [rs2293275] - A/A
LHCGR (Asn291Ser) [rs 12470652] - A/A.
Значение дискриминантной функции составило:
z=23,601-1,131*1+0,168*1-1,435*1-23,627*1=-2,424
Вероятность (р) получения незрелых ооцитов у данной пациентки рассчитывали по формуле 1:
р=1/(1+е-2,424)=0,925
Рассчитанная вероятность р указывает на исполнение прогноза, в данном случае - на получение незрелых ооцитов с вероятностью 92,5%.
В результате проведения программы ВРТ у пациентки всего было получено 11 ооцитов, из них 9 ооцитов - незрелые, 2 - зрелые.
Согласно полученным данным прогноз вероятности получения незрелых ооцитов при проведении программ ВРТ носит статистически достоверный характер.
Полученный результат свидетельствует о независимой генетической детерминации процессов оогенеза. Следовательно, способ прогнозирования вероятности получения незрелых ооцитов в программах вспомогательных репродуктивных технологий с использованием молекулярно-генетических маркеров может быть использован в клинико-лабораторной практике с целью предикции исходов программы ЭКО.
На фиг. 1 приведен ROC-анализ ассоциации полиморфизма генов AMHR2(-482 A>G) [rs2002555]; LHCGR (Ser312Asn) [rs2293275]; ESR2 G>A [RsaI] [rs4986938]; LHCGR (Asn291Ser) [rs12470652] с вероятностью получения незрелых ооцитов (sensitivity - чувствительность; specificity - специфичность).
Список использованных источников
1. Gearhart J., Coutifaris С. In vitro fertilization, the Nobel Prize, and human embryonic stem cells // Cell stem cell. - 2011. - Vol. 8. - №1. - P. 12-15.
2. Altmae S., Hovatta O., Stavreus-Evers A., Salumets A. Genetic predictors of controlled ovarian hyperstimulation: where do we stand today? // Human reproduction update. - 2011. - Vol. 17. - №6. - P. 813-828.
3. Серебренникова К.Г. и др. Современные технологии лечения бесплодия у женщин с оперированными яичниками. // Международный журнал экспериментального образования. 2010 - №9. С. 115-117.
4. Сухих Г.Т., Сароян Т.Т., Корнеева И.Е. Иммунные аспекты патофизиологии синдрома гиперстимуляции яичников. // Акушерство и гинекология. 2009 - №3. С. 3-6.
5. O'Brien Т.J., Kalmin М.М., Harralson A.F., Clark А.М., Gindoff I., Simmens S.J., Frankfurter D., Gindoff P. Association between the luteinizing hormone/chorionic gonadotropin receptor (LHCGR) rs4073366 polymorphism and ovarian hyperstimulation syndrome during controlled ovarian hyperstimulation // Reproductive biology and endocrinology: RB&E. - 2013. - Vol. 11. - №1. - P. 71.
6. Twigt J.M., Hammiche F., Sinclair K.D., Beckers N.G., Visser J.A., Lindemans J., de Jong F.H., Laven J.S., Steegers-Theunissen R.P. Preconception folic acid use modulates estradiol and follicular responses to ovarian stimulation // The Journal of clinical endocrinology and metabolism. - 2011. - Vol. 96. - №2. - P. E322-329.
7. Alviggi C, Humaidan P., Ezcurra D. Hormonal, functional and genetic biomarkers in controlled ovarian stimulation: tools for matching patients and protocols // Reproductive biology and endocrinology: RB&E. - 2012. - Vol. 10. - P. 9.
8. van Disseldorp J., Franke L., Eijkemans R., Broekmans F., Macklon N., Wijmenga C, Fauser B. Genome-wide analysis shows no genomic predictors of ovarian response to stimulation by exogenous FSH for IVF // Reproductive biomedicine online. - 2011. - Vol. 22. - №4. - P. 382-388.
9. Boudjenah R., Molina-Gomes D., Torre A., Bergere M., Bailly M, Boitrelle F., Taieb S., Wainer R., Benahmed M, de Mazancourt P., Selva J., Vialard F. Genetic polymorphisms influence the ovarian response to rFSH stimulation in patients undergoing in vitro fertilization programs with ICSI // PloS one. - 2012. - Vol. 7. - №6. - P. e38700.
10. Кофиади И.А., Ребриков Д.В. Методы детекции однонуклеотидных полиморфизмов: аллель-специфичная ПЦР и гибридизация с олигонуклеотидной пробой // Генетика 2006 - Т. 42 (1). С. 22-32.
11. Lyon Е. Mutation detection using fluorescent hybridization probes and melting curve analysis // Expert Rev Mol Diagn. - 2001. - Vol. 1. - №1. - P. 92-101.
12. Элдер К., Дэйл Б. Экстракорпоральное оплодотворение / М.: МЕДпресс-информ, 2008. - 276 с.
Способ прогнозирования вероятности получения незрелых ооцитов в программах вспомогательных репродуктивных технологий с использованием молекулярно-генетических маркеров, включающий выделение ДНК из образцов периферической крови пациентки с трубно-перитонеальным фактором бесплодия, определение полиморфных локусов AMHR2 (-482 A>G) [rs2002555]; LHCGR (Ser312Asn) [rs2293275]; ESR2 G>A [RsaI] [rs4986938]; LHCGR (Asn291Ser) [rs12470652] с применением ПЦР в режиме реального времени, после чего полученные данные включают в функциюZ=23,601 -1,131 * AMHR2A/G -0,672 * AMHR2G/G + 0,932 * ESR2A/A + 0,168 * ESR2A/G -0,606 * LHCGR (Ser312Asn)A/G -1,435 * LHCGR (Ser312Asn)A/A -23,065 * LHCGR (Asn291Ser)A/G -23,627 * LHCGR (Asn291Ser)A/A, где23,601 - константа;AMHR2A/G - наличие у пациентки генотипа A/G гена AMHR2 (-482 A>G) [rs2002555] (1 - да, 0 - нет);AMHR2G/G - наличие у пациентки генотипа G/G гена AMHR2 (-482 A>G) [rs2002555] (1 - да, 0 - нет);ESR2A/A - наличие у пациентки генотипа А/А гена ESR2 G>A [RsaI] [rs4986938] (1 - да, 0 - нет);ESR2A/G - наличие у пациентки генотипа A/G гена ESR2 G>A [RsaI] [rs4986938] (1 - да, 0 - нет);LHCGR (Ser312Asn)A/G - наличие у пациентки генотипа A/G гена LHCGR (Ser312Asn) [rs2293275] (1 - да, 0 - нет);LHCGR (Ser312Asn)A/A - наличие у пациентки генотипа А/А гена LHCGR (Ser312Asn) [rs2293275] (1 - да, 0 - нет);LHCGR (Asn291Ser)A/G - наличие у пациентки генотипа A/G гена LHCGR (Asn291Ser) [rs12470652] (1 - да, 0 - нет);LHCGR (Asn291Ser)A/A - наличие у пациентки генотипа А/А гена LHCGR (Asn291Ser) [rs12470652] (1 - да, 0 - нет);-1,131, -0,672, 0,932, 0,168, -0,606, -1,435, -23,065, -23,627 - коэффициенты; и вероятность получения незрелых ооцитов определяют по формуле p=1/(1+e-z), где в случае р меньше 0,5 предполагают, что событие не наступит; в противном случае предполагается наступление события.