Система и способ для обнаружения амилоидных белков
Иллюстрации
Показать всеЗаявлена группа изобретений, включающая устройство и способ для обнаружения амилоидного белка в глазе млекопитающего, может быть использована в медицине. Работа устройства и реализация способа построены, в частности, на освещении глаза источником света с, по меньшей мере, длиной волны или поляризацией или их комбинацией, каждая из которых является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при этом амилоидсвязывающее соединение связано с амилоидным белком, при этом амилоидсвязывающее соединение введено в глаз и специфически связывается с амилоидным белком, указывающим на наличие амилоидогенного заболевания; улавливании света, включая флуоресценцию, индуцированную в результате освещения глаза; и определение времени затухания флуоресценции притом, что флуоресценция, по меньшей мере, индуцируется связанным с амилоидным белком амилоидсвязывающим соединением; определении возможности обнаружения присутствия связанного с амилоидным белком амилоидсвязывающего соединения в глазе на основе, по меньшей мере, времени затухания, при этом определение включает осуществление подсчета единичных фотонов индуцируемой глазом флуоресценции с корреляцией по времени. Заявленная группа позволяет на ранних стадиях определять наличие заболевания, связанного с увеличением содержания амилоидного белка в тканях глаза или устанавливать риск развития такого заболевания. 5 н. и 89 з.п. ф -лы, 12 ил., 1 табл., 2 пр.
Реферат
ССЫЛКИ НА РОДСТВЕННЫЕ 3АЯВКИ
Данная заявка испрашивает приоритет по предварительной заявке на патент США №61/374131, поданной 16 августа 2010 года, и предварительной заявке на патент США №61/425490, поданной 21 декабря 2010 года, а также в соответствии 35 U.S.С. § 119 или 365 испрашивает приоритет по заявке на Европейский патент №11001148.3, поданной 11 февраля 2011 года.
Данная заявка также связана с заявкой на патент США №11/786514, поданной 11 апреля 2007 года, по которой выдан патент США №7828436, и с заявкой на патент США №12/154226, поданной 21 мая 2008 года и опубликованной в виде опубликованной заявки на патент США №2009/0041666, а также с патентом США №7107092 и с патентом США №7297326.
Исчерпывающее изложение всех вышеупомянутых патентов, публикаций и заявок на патенты приведено здесь в виде соответствующих ссылок.
УРОВЕНЬ ТЕХНИКИ
Обнаружение заболеваний на их ранних стадиях всегда является желательным. Раннее обнаружение позволяет осуществлять раннее лечение, что, в целом, позволяет достигать более успешных результатов при лечении различных заболеваний. Было открыто, что анализ глаз людей и, в частности, хрусталиков глаз, может помочь получить свидетельства наличия различных типов заболеваний. Например, исследователи обнаружили наличие β-амилоидных пептидов и их агрегатов в надъядерном участке хрусталика глаз пациентов с болезнью Альцгеймера [AD]. См. патент США 7297326 Goldstein et al. Поскольку надъядерный участок является фрагментом толщиной в доли миллиметра, полученные измерения, относящиеся к этому участку хрусталика глаза, должны быть точными в плане месторасположения, определенными в плане информативности и быстрыми в плане получения. Это тем более верно в связи с тем, что глаз человека находится практически в постоянном движении, даже в тех случаях, когда внимание пациента фиксируется на освещенном объекте.
Было доказано, что присутствие или увеличение количества β-амилоидных пептидов и их агрегатов в надъядерных и/или кортикальных слоях хрусталика глаза испытуемого млекопитающего по сравнению с нормальным контрольным значением указывает на то, что испытуемое млекопитающее страдает нейродегенеративным заболеванием, таким как амилоидогенное заболевание, или обладает риском его развития.
Существует постоянная необходимость в наличии систем и способов, позволяющих осуществлять ранее обнаружение амилоидогенных заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с вариантом осуществления данного изобретения предлагается способ обнаружения амилоидного белка в глазе млекопитающего, например амилоидного белка, представляющий собой агрегат. В некоторых вариантах осуществления данного изобретения обнаружение амилоидного белка указывает на наличие амилоидогенного заболевания. Способ включает освещение глаза источником света с, по меньшей мере, длиной волны или поляризацией или их комбинацией, при этом каждая из них является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при этом амилоидсвязывающее соединение связано с амилоидным белком, при этом амилоидсвязывающее соединение введено в глаз и особым образом связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания; полученный свет включает флуоресценцию, индуцированную в результате освещения глаза; а также определение времени затухания флуоресценции при том, что флуоресценция, по меньшей мере, индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком; исследование возможности определения наличия амилоидсвязывающего соединения, связанного с амилоидным белком в глазе на основе, по меньшей мере, времени затухания.
В других родственных вариантах осуществления данного изобретения способ может также включать определение интенсивности флуоресценции при том, что флуоресценция индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком. Количество амилоидсвязывающего соединения, связанного с амилоидным белком, может быть определено на основе, по меньшей мере, интенсивности или времени затухания. Способ может также включать определение месторасположения части глаза, такой как капсула хрусталика глаза, на основе увеличения сигнала флуоресценции в связи с естественной флуоресценцией, излучаемой тканями глаза. По меньшей мере, один участок глаза может быть использован в качестве образца при использовании освещения источником света, при этом выборка включает выполнение, по меньшей мере, одного измерения всего участка или выборку различных мест в рамках участка или участков с использованием освещения источником света, при этом выборка различных месторасположений включает освещение, по меньшей мере, одной точки, плоскости и/или объема глаза. Выборка может включать выборку различных мест в рамках более чем одного участка глаза. Например, планарные сканограммы глаза могут быть выполнены с помощью источника света последовательно в плоскостях, лежащих вдоль перпендикулярной оси по направлению в глубину глаза. Расположение надъядерного участка глаза может быть определено на основе (i) расстояния от определенной анатомической структуры, такой как поверхность капсулы хрусталика глаза или поверхность роговицы или (ii) обнаружения изменения (наклона) интенсивности. Определение присутствия амилоидсвязывающего соединения, связанного с амилоидным белком, может включать определение присутствия амилоидсвязывающего соединения, связанного с амилоидным белком на основе фоновой аутофлуоресценции тканей глаза и аутофлуоресценции других неспецифичных частиц, а также несвязанного трейсера. Способ может включать определение, по меньшей мере, присутствия или количества более чем одного из следующих: амилоидсвязывающего соединения; амилоидсвязывающего соединения, связанного с амилоидным белком, и амилоидного белка. Амилоидный белок может представлять собой агрегат или агрегат предамилоидного белка (включая димеры, тримеры или олигомеры более высокого порядка пептидов Аβ1-42 и/или Аβ1-40). Например, амилоидный белок может представлять собой β-амилоид. Амилоидогенное заболевание может представлять собой болезнь Альцгеймера.
В других родственных вариантах осуществления данного изобретения амилоидсвязывающее соединение может включать молекулярный ротор, хризамин и/или производное хризамина, Конго красный и/или производное амилоидсвязывающее соединение Конго красного, хризамин G или производное амилоидсвязывающее соединение хризамина G, тиофлавин Т или производное амилоидсвязывающее соединение тиофлавина Т, тиофлавин S или производное амилоидсвязывающее соединение тиофлавина S. Способ может включать определение, по меньшей мере, присутствия амилоидного белка только на основе обнаруженной флуоресценции. Способ может также включать определение среднего количества фотонов с определенной скоростью затухания в определенном участке глаза. Скорость доставки амилоидсвязывающего соединения в глаз, пространственное распределение амилоидсвязывающего соединения, доставляемого в глаз, и/или градиент концентрации амилоидсвязывающего соединения на поверхности роговицы глаза могут быть определены на основе обнаруженной флуоресценции. Также, пространственное распределение амилоидсвязывающего соединения и/или распределение по времени амилоидсвязывающего соединения в водянистой влаге глаза могут быть определены на основе обнаруженной флуоресценции.
Способ может также включать определение, по меньшей мере, одной величины анатомической структуры или субструктуры глаза на основе естественного флуоресцентного возбуждения, по меньшей мере, части анатомической структуры или субструктуры. Определение, по меньшей мере, одной величины может включать, по меньшей мере, определение толщины структуры или субструктуры, определение формы структуры или субструктуры и определение расстояния между одной или несколькими структурами или субструктурами глаза. Например, определение, по меньшей мере, одной величины может включать определение толщины роговицы, формы роговицы, глубины водянистой влаги, формы хрусталика или толщины хрусталика или проведение внутренних измерений внутри хрусталика или другой структуры или субструктуры глаза, таких как расстояния от поверхности хрусталика до коры или надъядерного участка или ядра. Способ может также включать обнаружение флуоресценции, индуцируемой глазом, с помощью фотодетекторного устройства, такого как, по меньшей мере, фотодиод, фотоумножитель, прибор с зарядовой связью (CCD) и прибор с интенсивной зарядовой связью (ICCD); например с помощью быстрого лавинного фотодиодного детектора. Способ может включать осуществление подсчета единичных фотонов индуцируемой глазом флуоресценции с корреляцией по времени. Подсчет единичных фотонов с корреляцией по времени может включать использование пульсирующего источника света и определение времени затухания флуоресценции на основе распределения количества фотонов в виде канальных единиц функции времени.
В других вариантах осуществления данного изобретения способ может включать сканирование глаза для определения возбужденной естественной флуоресценции и, определения, таким образом, по меньшей мере, одного целевого участка глаза; а также выборку, по меньшей мере, одного целевого участка глаза с помощью освещения источником света, при этом выборка включает выполнение. Например, способ может включать выполнение осевого сканирования (продольного сканирования) в глубину глаза для определения возбужденной естественной флуоресценции вдоль каждой точки осевой сканограммы и, таким образом, определения, по меньшей мере, одного целевого участка в глазе; а также выполнение планарных сканирований глаза с использованием источника света в последующих плоскостях, перпендикулярных направлению осевого сканирования для определения интенсивности флуоресценции и времени затухания флуоресценции, при этом флуоресценция индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком в каждой точке каждой планарной сканограммы. Способ позволяет осуществлять поиск амилоидного белка в глазе, указывающего на наличие амилоидогенного заболевания, в реальном времени.
В других родственных вариантах осуществления данного изобретения способ может также включать освещение глаза светом с подходящей длиной волны пикового участка спектра флуоресцентного возбуждения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе; а также обнаружение полученного из глаза света с подходящей длиной волны пикового участка спектра флуоресцентного излучения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе. Амилоидсвязывающее соединение может являться Соединением №11. Спектр возбуждения может обладать значением пика около 470 нм при длине волны освещения глаза в диапазоне ± около 20 нм пика спектра возбуждения, а спектр излучения может обладать значением пика около 580 нм при обнаружении света, полученного из глаза, длина волны которого лежит в диапазоне ± около 20 нм пика спектра излучения.
В другом варианте осуществления данного изобретения предлагается устройство для обнаружения амилоидного белка в глазе млекопитающего. Устройство включает источник света, настроенный для излучения света для освещения глаза с, по меньшей мере, длиной волны света, поляризацией света или их комбинацией, при этом каждая из них является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при связи амилоидсвязывающего соединения с амилоидным белком, при этом амилоидсвязывающее соединение введено в глаз и особым образом связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания; а оптический блок настроен для получения света, включая флуоресценцию, индуцированную в результате освещения глаза и определения времени затухания флуоресценции при том, что флуоресценция, по меньшей мере, индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком; исследование возможности определения наличия амилоидсвязывающего соединения, связанного с амилоидным белком в глазе на основе, по меньшей мере, времени затухания.
В других родственных вариантах осуществления данного изобретения оптический блок может быть настроен для определения время затухания, по меньшей мере, одного из: молекулярного ротора на основе амилоидсвязывающего соединения; Конго красного и/или производного амилоидсвязывающего соединения Конго красного; амилоидсвязывающего соединения хризамина; производного амилоидсвязывающего соединения хризамина; хризамина G или производного амилоидсвязывающего соединения хризамина G; тиофлавина Т или производного амилоидсвязывающего соединения тиофлавина Т; тиофлавина S или производного амилоидсвязывающего соединения тиофлавина S. Оптический блок может определять интенсивность флуоресценции при том, что флуоресценция индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком. Оптический блок может быть настроен для определения количества амилоидсвязывающего соединения, связанного с амилоидным белком на основе, по меньшей мере, интенсивности или времени затухания. Оптический блок может быть настроен для определения среднего количества фотонов с определенной скоростью затухания в определенном участке глаза. Источник света может включать пульсирующий лазер. Устройство может также включать оптический сканирующий блок, настроенный для сканирования света, полученного от источника света в областях глаза. Оптический сканирующий блок может включать объектив, установленный на столе поступательного перемещения и сканер, включающий зеркальный гальванометр. Оптический сканирующий блок может быть настроен для выборки, по меньшей мере, одного участка глаза с помощью освещения источником света, при этом выборка включает осуществление, по меньшей мере, одного измерения, по меньшей мере, одного целого участка, по меньшей мере, одного участка или выборку различных участков в рамках, по меньшей мере, одного участка с помощью освещения источником света, выборку различных участков, включающую освещение, по меньшей мере, одной точки, плоскости или объема в рамках, по меньшей мере, одного участка. Оптический сканирующий блок может быть настроен для выборки различных участков в рамках более чем одного участка глаза. В одном примере оптический сканирующий блок может быть настроен для осуществления планарных сканирований глаза с помощью источника света последовательно в плоскостях, лежащих вдоль перпендикулярной оси по направлению в глубину глаза. Устройство может также включать фотодетекторный блок для обнаружения флуоресценции, излучаемой глазом, такого как, по меньшей мере, фотодиод, фотоумножитель, прибор с зарядовой связью (CCD) и прибор с интенсивной зарядовой связью (ICCD); например, лавинный фотодетектор.
В других родственных вариантах осуществления данного изобретения устройство может также включать модуль подсчета единичных фотонов с корреляцией по времени, получающий электрические сигналы от фотодетекторного блока при подсчете каждого фотона флуоресцентного света глаза. Устройство может включать, по меньшей мере, один процессорный модуль, настроенный для определения времени затухания флуоресценции на основе распределения количества фотонов в виде канальных единиц функции времени. Оптический блок может быть настроен для обнаружения амилоидсвязывающего соединения, связанного с амилоидным белком на основе фоновой аутофлуоресценции тканей глаза и аутофлуоресценции других неспецифичных частиц, а также несвязанного трейсера. Оптический блок может быть настроен для обнаружения, по меньшей мере, присутствия или количества более чем одного из следующих соединений: амилоидсвязывающего соединения; амилоидсвязывающего соединения, связанного с амилоидным белком, и амилоидного белка. Амилоидный белок может представлять собой агрегат или агрегат предамилоидного белка. Например, амилоидный белок может представлять собой β-амилоид. Амилоидогенное заболевание может представлять собой болезнь Альцгеймера.
В других родственных вариантах осуществления данного изобретения оптический блок может быть настроен для обнаружения, по меньшей мере, присутствия амилоидного белка только на основе обнаруженной флуоресценции. Оптический блок может быть настроен для определения скорости доставки амилоидевязывающего соединения в глаз, пространственного распределения амилоидсвязывающего соединения, доставляемого в глаз, и/или градиент концентрации амилоидсвязывающего соединения на поверхности роговицы глаза на основе обнаруженной флуоресценции. Оптический блок может быть настроен для определения, по меньшей мере, пространственного распределения и распределения по времени амилоидсвязывающего соединения в водянистой влаге глаза на основе обнаруженной флуоресценции. Оптический блок может быть настроен для обнаружения месторасположения части глаза, такой как капсула хрусталика глаза, на основе увеличения сигнала флуоресценции в связи с естественной флуоресценцией, излучаемой тканями глаза. Оптический блок может быть настроен для определения расположения надъядерного участка глаза на основе (i) расстояния от определенной анатомической структуры, такой как поверхность капсулы хрусталика глаза или поверхность роговицы или (ii) обнаружения изменения (наклона) интенсивности. Оптический блок может быть настроен для определения, по меньшей мере, одной величины анатомической структуры или субструктуры глаза на основе естественного флуоресцентного возбуждения, по меньшей мере, части анатомической структуры или субструктуры, при этом определение, по меньшей мере, одной величины может включать, по меньшей мере, определение толщины структуры или субструктуры, определение формы структуры или субструктуры и определение расстояния между одной или несколькими структурами или субструктурами глаза.
В других родственных вариантах осуществления данного изобретения оптический блок может быть настроен для сканирования глаза для определения возбужденной естественной флуоресценции и, таким образом, определения, по меньшей мере, одного целевого участка глаза; а также выборки, по меньшей мере, одного целевого участка глаза с помощью освещения источником света, при этом выборка включает выполнение, по меньшей мере, одного измерения, по меньшей мере, одного целого участка, по меньшей мере, одного участка или выборку различных мест в рамках, по меньшей мере, одного участка с помощью освещения источником света, при этом выборка различных мест включает освещение, по меньшей мере, точки, плоскости или объема в рамках, по меньшей мере, одного участка; при этом выборка проводится для определения интенсивности флуоресценции и времени затухания флуоресценции, при этом флуоресценция индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком в, по меньшей мере, одном выбранном участке. Например, оптический блок может быть настроен для определения возбужденной естественной флуоресценции в каждой точке осевой сканограммы по направлению в глубину глаза (продольная сканограмма) и, таким образом, определения, по меньшей мере, одного целевого участка в глазе; и для определения интенсивности флуоресценции и времени затухания флуоресценции при том, что флуоресценция индуцируется связанным с амилоидным белком амилоидсвязывающим соединением в каждой точке каждого набора планарных сканограмм глаза (поперечные сканограммы) с использованием источника света в последующих плоскостях, перпендикулярных направлению продольной сканограммы. Устройство может быть настроено для осуществления поиска амилоидного белка в глазе, указывающего на наличие амилоидогенного заболевания, в реальном времени.
Далее, в других родственных вариантах осуществления данного изобретения источник света может быть настроен для излучения света с подходящей длиной волны пикового участка спектра флуоресцентного возбуждения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе; а оптический блок может быть настроен для обнаружения света с подходящей длиной волны пикового участка спектра флуоресцентного излучения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе. Амилоидсвязывающее соединение может являться Соединением №11. Спектр возбуждения может обладать значением пика около 470 нм при длине волны настроенного источника света в диапазоне±около 20 нм пика спектра возбуждения, а спектр излучения может обладать значением пика около 580 нм при обнаружении света оптическим блоком, настроенным на обнаружение света, длина волны которого лежит в диапазоне±около 20 нм пика спектра излучения. Амилоидный белок может указывать на наличие амилоидо генного заболевания.
В другом варианте осуществления данного изобретения предлагается способ диагностики амилоидогенного заболевания или предрасположенности к нему у млекопитающего, например примата (такого как человек), собак, кошек, овец, коров и т.п.. Способ включает освещение глаза млекопитающего источником света с, по меньшей мере, длиной волны, поляризацией или их комбинацией, при этом каждая из них является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при этом амилоидсвязывающее соединение связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания, при этом амилоидсвязывающее соединение введено в глаз и особым образом связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания; полученный свет включает флуоресценцию, индуцированную в результате освещения глаза; а также определение времени затухания флуоресценции при том, что флуоресценция, по меньшей мере, индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком; исследование возможности определения наличия амилоидсвязывающего соединения, связанного с амилоидным белком в глазе на основе, по меньшей мере, времени затухания. Увеличение связывания амилоидсвязывающего соединения с амилоидным белком в глазе по сравнению с нормальным контрольным уровнем связывания указывает на наличие амилоидогенного заболевания или риска развития амилоидогенного заболевания у млекопитающего. Амилоидогенное заболевание может являться болезнью Альцгеймера.
В другом варианте осуществления данного изобретения предлагается способ идентификации анатомической структуры глаза млекопитающего. Способ включает освещение глаза источником света с, по меньшей мере, длиной волны, поляризацией или их комбинацией, при этом каждая из них является подходящей для индуцирования естественной флуоресценции в анатомической структуре глаза; и определение участка глаза с наибольшим изменением интенсивности естественной флуоресценции, индуцированной в результате освещения с помощью источника света; исследование возможности идентификации анатомической структуры на основе участка с наибольшим изменением интенсивности естественной флуоресценции. В определенном варианте осуществления данного изобретения описанное здесь устройство в соответствии с вариантом осуществления данного изобретения используется в данном способе.
Далее, в других вариантах осуществления данного изобретения анатомическая структура может включать анатомическую структуру переднего сегмента глаза. Идентификация анатомической структуры может включать определение участка анатомической поверхности, такое как определение участка поверхности капсулы хрусталика глаза на основе определения участка с наибольшим увеличением интенсивности естественной флуоресценции. Идентификация анатомической структуры может включать определение, по меньшей мере, толщины роговицы, формы роговицы, глубины водянистой влаги, формы хрусталика, толщины хрусталика и толщины и/или формы субструктур хрусталика глаза (например, капсулы хрусталика, коры, надъядерного участка, ядра) на основе естественной флуоресценции глаза, индуцируемой источником света; и может включать определение внутриглазного расстояния между, по меньшей мере, двумя анатомическими структурами глаза. Способ может также включать использование источника света для обнаружения амилоидного белка, указывающего на наличие амилоидогенного заболевания, в глазе млекопитающего. Способ может включать освещение глаза млекопитающего источником света, при этом источник света также включает, по меньшей мере, длину волны или поляризацию или их комбинацию, при этом каждая из них является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при этом амилоидсвязывающее соединение связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания, при этом амилоидсвязывающее соединение введено в глаз и особым образом связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания;
полученный свет включает флуоресценцию, индуцированную в результате освещения глаза; а также определение времени затухания флуоресценции при том, что флуоресценция, по меньшей мере, индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком; исследование возможности определения наличия амилоидсвязывающего соединения, связанного с амилоидным белком в глазе на основе, по меньшей мере, времени затухания. Определение присутствия амилоидсвязывающего соединения, связанного с амилоидным белком, может включать определение присутствия амилоидсвязывающего соединения, связанного с амилоидным белком в фоновой аутофлуоресценции тканей глаза и аутофлуоресценции других неспецифичных частиц, а также несвязанного амилоидсвязывающего соединения. Способ может делать возможным поиск амилоидного белка в глазе, указывающего на наличие амилоидогенного заболевания, в реальном времени. Способ может также включать освещение глаза светом с подходящей длиной волны пикового участка спектра флуоресцентного возбуждения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе; а также обнаружение полученного из глаза света с подходящей длиной волны пикового участка спектра флуоресцентного излучения амилоидсвязывающего соединения, связанного с амилоидным белком в глазе. Амилоидсвязывающее соединение может являться Соединением №11. Спектр возбуждения может обладать значением пика около 470 нм при длине волны освещения глаза в диапазоне ± около 20 нм пика спектра возбуждения, а спектр излучения может обладать значением пика около 580 нм при обнаружении света, полученного из глаза, длина волны которого лежит в диапазоне ± около 20 нм пика спектра излучения.
В других родственных вариантах осуществления данного изобретения способ может позволять отличать, по меньшей мере, два различных флуорофора с аналогичными спектрами флуоресценции в глазе на основе, по меньшей мере, времени затухания, при этом аналогичные спектры флуоресценции включают, по меньшей мере, значительное наложение в спектрах излучения или спектрах возбуждения. Способ может также включать представление распределения, по меньшей мере, интенсивности флуоресценции или времени затухания, по меньшей мере, одного флюорофора в двух измерениях. Также, способ может включать определение количества связанных фотонов и количества несвязанных фотонов в глазе на основе, по меньшей мере, интенсивности флуоресценции или времени затухания, по меньшей мере, одного флюорофора. Способ может включать представление распределения интенсивности флуоресценции и времени затухания амилоидсвязывающего соединения, связанного с белком и амилоидсвязывающего соединения, не связанного с белком, в двух измерениях. Представление в двух измерениях может быть синхронизировано с помощью, по меньшей мере, сканера или лазера. Способ может также включать определение параметра с помощью усреднения интенсивности флуоресценции, связанной с определенным временем затухания в определенном участке глаза. Кроме того, способ может также включать выравнивание источника света относительно глаза вдоль софокусного расстояния для определения необходимой точки глаза.
В другом варианте осуществления данного изобретения предлагается способ определения связанных с белком флюорофоров в ткани глаза. Способ включает освещение ткани глаза источником света с, по меньшей мере, длиной волны или поляризацией или их комбинацией, при этом каждая из них является подходящей для индуцирования флуоресценции в, по меньшей мере, амилоидсвязывающем соединении, при этом амилоидсвязывающее соединение связано с амилоидным белком, при этом амилоидсвязывающее соединение введено в ткань глаза и особым образом связано с амилоидным белком, указывающим на наличие амилоидогенного заболевания; полученный свет включает флуоресценцию, индуцированную в результате освещения глаза; а также определение времени затухания флуоресценции при том, что флуоресценция, по меньшей мере, индуцируется амилоидсвязывающим соединением, связанным с амилоидным белком; исследование возможности определения наличия амилоидсвязывающего соединения, связанного с амилоидным белком в ткани глаза на основе, по меньшей мере, времени затухания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенное будет более понятно благодаря нижеприведенному более подробному описанию примерных вариантов осуществления данного изобретения и прилагаемым фигурам с обозначениями, относящимися к одним и тем же соответствующим частям, изображенным на разных фигурах. Фигуры не подлежат обязательному увеличению; акцент делается на иллюстрировании вариантов осуществления настоящего изобретения.
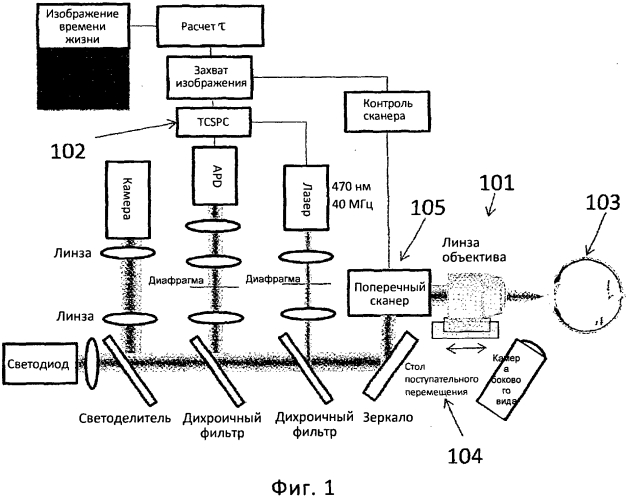
Фиг.1 является схематичной диаграммой оптической системы в соответствии с вариантом осуществления данного изобретения.
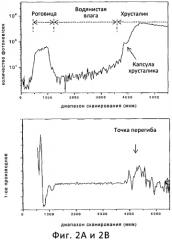
Фиг.2А является графиком интенсивности флуоресценции относительно смещения, измеренной в рамках реализации алгоритма обнаружения поверхности хрусталика при продольном сканировании глаза, а Фиг.2B является графиком первого производного графика на Фиг.2А в соответствии с вариантом осуществления данного изобретения.
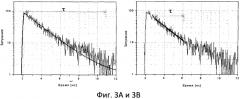
Фиг.3А и 3B являются графиками, иллюстрирующими определение времени затухания флуоресценции в соответствии с вариантом осуществления данного изобретения.
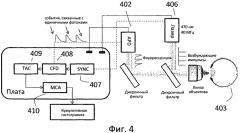
Фиг.4 является схематичной диаграммой, иллюстрирующей использование подсчета единичных фотонов с корреляцией по времени в соответствии с вариантом осуществления данного изобретения.
На Фиг.5 изображена структура Соединения №11, которое может использоваться в качестве флуоресцентного амилоидсвязывающего соединения в соответствии с вариантом осуществления данного изобретения.
Фиг.6 является флуоресцентной гистограммой флуоресцентного амилоидсвязывающего соединения Соединение №11, полученной с помощью устройства в соответствии с вариантом осуществления данного изобретения.
Фиг.7 является диаграммой изображения времени жизни флуоресценции Соединения №11 и связанным с ним изображением интенсивности, полученной в соответствии с вариантом осуществления данного изобретения.
Фиг.8А является изображением времени жизни флуоресценции, демонстрирующим амилоидсвязывающее соединение и амилоидсвязывающее соединение, связанное с агрегатным пептидом, в соответствии с вариантом осуществления данного изобретения.
Фиг.8B является изображением времени жизни флуоресценции, демонстрирующим амилоидсвязывающее соединение и амилоидсвязывающее соединение, связанное с агрегатным пептидом, время жизни флуоресценции которых изображено на Фиг.8А в соответствии с вариантом осуществления данного изобретения.
Фиг.9А является схемой частоты фотонов с определенной скоростью затухания, относящихся к флуоресцентному амилоидсвязывающему Соединению №11 при измерении на кроликах в исследовании in vivo в соответствии с вариантом осуществления данного изобретения.
Фиг.9B является гистограммой флуоресценции, относящейся к исследованию на Фиг.9А в соответствии с вариантом осуществления данного изобретения.
Фиг.10А и Фиг.10B являются схемами, демонстрирующими частоту фотонов с определенной скоростью затухания, относящихся к флуоресцентному амилоидсвязывающему соединению Соединение №11 при измерении утром для использования в качестве базовой линии и в конце дня после введения кроликам в рамках исследования в эксперименте в соответствии с вариантом осуществления данного изобретения.
Фиг.11А и 11B являются двумя изображениями времени жизни флуоресценции, полученными при базовой линии и после окончания четвертого дня исследования на животных в эксперимента в соответствии с вариантом осуществления данного изобретения.
Фиг.12 является спектром излучения флуоресцентного амилоидсвязывающего соединения Соединение №11 при возбуждении на уровне 470 нм в соответствии с вариантом осуществления данного изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже приведено описание примерных вариантов осуществления данного изобретения.
в соответствии с вариантом осуществления данного изобретения предлагается система и способ неинвазивного, раннего и надежного обнаружения амилоидного белка, который может формировать агрегат или быть сформирован в виде агрегата. В некоторых вариантах осуществления данного изобретения обнаружение амилоидного белка и/или агрегата указывает на наличие амилоидогенного заболевания. Амилоидогенные заболевания включают AD, семейную AD, спорадическую AD, болезнь Крейтцфельдта-Якоба, вариант болезни Крейтцфельдта-Якоба, спонгиоформные энцефалопатии, прионовые болезни (включая скрепи, спонгиоформные энцефалопатии у коров и другие ветеринарные прионовые заболевания), болезнь Паркинсона, болезнь Хантингтона (и болезни экспансии тринуклеотидных повторов), боковой амиотрофический склероз, синдром Дауна (трисомию по хромосоме 21), болезнь Пика (лобно-височную деменцию), деменцию с тельцами Леви, нейродегенерацию с отложением железа в мозге (болезнь Галлервордена-Шпатца), синуклеинопатии (включая болезнь Паркинсона, множественную системную атрофию, деменцию с тельцами Леви и другие); болезнь, связанную с нейронными внутринуклеарными включениями; таупатии (включая прогрессирующий надъядерный паралич, болезнь Пика, кортикобазальную дегенерацию, наследственную деменцию лобного типа (с/без паркинсонизма), преморбидное нейродегенеративное состояние и боковой амиотрофический склероз О.Гуам/комплекс паркинсонизм-деменция). Данные заболевания могут возникать самостоятельно или в составе различных комбинаций. Анализ амилоидного белка также полезен для обнаружения трансмиссивных спонгиоформных энцефалопатии (TSE), которые являются связанными с прион-опосредованными заболеваниями, характеризующимися смертельной спонгиоформной нейродегенерацией мозга и связанными с тяжелыми и смертельными неврологическими признаками и симптомами. Связанные с TSE прионопатии включают болезнь Крейтцфельдта-Якоба (CJD); новый вариант болезни Крейтцфельдта-Якоба (nv-CJD); синдром Гертсмана-Штройслера-Шайнкера; смертельную семейную бессонницу; Куру; синдром Альперса; губчатую энцефалопатию крупного рогатого скота; скрепи и хроническое истощение (CWD).
Диагностические способы могут осуществляться в отношении глазных тканей млекопитающих, например примата (такого как человек), собак, кошек, овец, коров и т.п.. Отдельные субъекты (например, люди), подлежащие обследованию, включают лиц с подозрением на наличие заболеваний (пациентов) или риска развития данных заболеваний. Например, лица с семейной историей AD или другими факторами риска, такими как пожилой возраст, обследуются с помощью методик, описанных здесь. Также могут быть обследованы лица, в отношении которых неизвестно о наличии или риске развития данных заболеваний.
Диагностические способы осуществляют с помощью нанесения флюорофорного соединения, которое образует связь с амилоидным белком, на ткань глаза млекопитающего (например, человека). «Амилоидный белок» означает белок или пептид, связанный с воспалением вокруг сенильной бляшки при AD, вне зависимости от того, является ли амилоидный б